不同剂量伊达比星联合阿糖胞苷对60岁以下成人急性髓系白血病诱导疗效的临床研究
2023-01-06汪小钰刘丹张旭晗孙光宇陈二玲周紫微薛磊童娟周莉郑昌成
汪小钰 刘丹 张旭晗 孙光宇 陈二玲 周紫微 薛磊 童娟 周莉 郑昌成
蒽环类化疗药物联合阿糖胞苷(3+7方案)是成人急性髓系白血病(AML)的标准诱导治疗方案,特别是对于60岁以下的AML患者,首次诱导完全缓解率(CR)约为60%~80%,但是只有40%~45%的患者能够获得长期无病生存,多数患者仍然死于疾病的复发[1]。多中心前瞻随机临床研究表明在AML诱导治疗期间增加蒽环类药物的剂量有利于患者的生存获益[2-3]。中国成人急性髓系白血病(非急性早幼粒细胞白血病)诊疗指南(2021年版)推荐60岁以下的AML患者使用伊达比星(IDA)12 mg•m-2•d-1×3 d或柔红霉素(DNR)60~90 mg•m-2•d-1×3 d联合阿糖胞苷(Ara-C)100~200 mg•m-2•d-1×7 d为标准方案(IA方案或者DA方案)[4]。然而在国内,不同的临床中心使用IDA剂量波动范围较大(8~12 mg•m-2•d-1),为进一步验证与探讨不同剂量IDA在AML诱导治疗中的作用,探讨高剂量伊达比星是否在国内AML中具有更好的缓解与生存获益,本研究回顾分析了2015年6月~2019年12月在本中心初诊成人AML(14~59岁)的临床资料,比较了伊达比星8 mg/m2和10~12 mg/m2诱导治疗的效果,为进一步提高AML的临床疗效提供参考。
材料与方法
1 病例来源 本文收集了中国科学技术大学附属第一医院(安徽省立医院)2015年6月~2019年12月初次诊断的AML患者进行回顾性研究。纳入标准:(1)符合AML诊断标准;(2)初次确诊治疗者;(3)年龄在14岁或以上、59岁或以下;(4)临床资料完善者。排除标准:(1)急性早幼粒细胞白血病患者;(2)复发型AML患者;(3)患有严重基础疾病不能耐受化疗者。诊断标准参照WHO 2016 造血和淋巴组织肿瘤分类标准[5];预后分层源于2017年ELN关于成人AML诊断和治疗的建议。本研究由安徽省立医院研究伦理委员会根据赫尔辛基宣言进行审查和批准(2022-RE-128)。
2 治疗方案 所有患者均使用IA(3+7)方案诱导治疗,包括伊达比星8 mg•m-2•d-1×3 d+阿糖胞苷100 mg•m-2•d-1×7 d诱导方案(IDA 8 mg/m2组)和伊达比星10~12 mg•m-2•d-1×3d+阿糖胞苷100 mg•m-2•d-1×7 d(IDA 10~12 mg/m2组)诱导方案。高白细胞患者(白细胞≥50×109/L)首先予以阿糖胞苷、羟基脲或依托泊苷降白细胞处理。在诱导过程中,加入右丙亚胺预防蒽环类药物引起的心脏毒性;所有患者均在诱导结束后第8天开始使用粒细胞集落刺激因子,直至中性粒细胞>1.0×109/L。达到完全缓解之后,采用4个疗程大剂量阿糖胞苷(2~3 g•m-2q12h×3 d)或者标准剂量化疗序贯(IA,DA,HA等)进行巩固治疗,中高危患者有条件进一步行造血干细胞移植治疗。
3 统计学分析 本研究的终点是完全缓解(CR)率、疾病累积复发率(CIR)、总生存(OS)、无事件生存(EFS)。所有患者的生存情况是从进入诱导治疗到死于任何原因(OS)或出现复发、死于任何原因(EFS),并在最后一次随访时进行审查。患者自接受诱导治疗的1个月内出现的死亡定义为早期死亡。CIR是所有达到CR的患者从缓解之日到复发之日的时间。使用卡方检验(分类变量)、Mann-Whitney U检验(连续变量)比较患者与疾病特征等的相关变量;考虑到竞争风险,使用累计事件函数法比较复发率;生存分析(OS和EFS)通过 Kaplan-Meier法计算。所有统计学分析均使用R统计软件(R Foundation for Statistical Computing),P<0.05 表示差异有统计学意义。
结 果
1 临床特征 自2015年6月~2019年12月,共有265例初诊AML患者入院,26名患者接受了其他的诱导方案被排除在外,239例患者接受IA(3+7)方案诱导治疗:其中IDA 8 mg/m2组患者93例,IDA 10~12 mg/m2组患者146例。
IDA 8 mg/m2组患者中位年龄为47(17~59)岁,其中男性37例(39.8%),女性56例(60.2%);IDA 10~12 mg/m2组中位年龄为41(14~59)岁,其中男性76例(52.1%),女性70例(47.9%)。根据2017年ELN预后分层,IDA 8 mg/m2组中预后良好组26例(28.0%)、预后中等组47例(50.5%)、预后不良组20例(21.5%);IDA 10~12 mg/m2组预后良好组39例(26.7%),预后中等组75例(51.4%),预后不良组32例(21.9%)。IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有55例(59.1%)和84例(57.5%)患者在初诊时白细胞计数>10×109/L(P=0.893)。两组患者诊断时的中位白细胞计数、血红蛋白计数、血小板计数等具体临床特征见表1。

表1 AML患者的临床特征
2 分子生物学特征 IDA 8 mg/m2组和IDA 10~12 mg/m2组中,分别有11例患者(11.8%)和16例患者(11%)携带有CEBPA双突变;4例患者(4.3%)和12例患者(8.2%)携带有FLT3-ITD突变;1例患者(1.1%)和4例患者(2.7%)携带有FLT3-ITD和NPM1联合突变;10例患者(10.8%)和13例患者(8.9%)携带有NPM1突变(P=0.574)(表1)。
3 诱导缓解情况 在接受首次诱导治疗后,IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有61例(65.6%)和103例(70.6%)患者获得形态CR(P=0.475),32例(34.4%)和43例(29.4%)未获得形态缓解(NR),NR患者中分别有9例(9.7%)和5例(3.4%)出现早期死亡。获得CR的患者采用流式细胞术进行微小残留病灶(MRD)检测,IDA 8 mg/m2组26例(42.6%)患者MRD转阴,IDA 10~12 mg/m2组64例(62.1%)患者MRD转阴(P=0.048)。IDA 8 mg/m2组共有20例患者进行了分子学检查,其中,6例携带有AML1/ETO突变,6例携带有NPM1突变,4例携带CEBPA双突变,3例携带CBFB/MYH11突变,1例携带FLT3突变,10例(50%)患者突变基因转为阴性;IDA 10~12 mg/m2组共有31例患者进行了分子学检查,其中,14例携带有AML1/ETO突变,5例携带FLT3突变,2例携带有NPM1突变,3例携带CEBPA双突变,3例携带CBFB/MYH11突变,1例携带有BCR/ABL突变,1例携带FLT3和NPM1联合突变,1例携带MLL/AF9突变,1例携带NRAS突变,9例(27.3%)患者突变基因转为阴性(P=0.151)。
4 复发与长期生存 IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有31名(31/61,50.8%)和55名(55/103,53.4%)患者在随访过程中复发。IDA 8 mg/m2组3年CIR为45.1%(95%CI:34.1%~57.8%),IDA 10~12 mg/m2组为49.6%(95%CI:40.7%~59.3%)(P=0.469)。
IDA 8 mg/m2组中位随访时间19(0.43~73)个月,IDA10~12 mg/m2组26(0.2~79)个月(P=0.344)。在总体AML患者中,IDA 8 mg/m2组3年OS率为34.6%(95%CI:24.9%~44.4%),IDA 10~12 mg/m2组为46.6%(95%CI:38.2%~54.6%)(P=0.038)(图1A)。预后良好组IDA 8 mg/m2组3年OS率为50.3%(95%CI:28.0%~68.9%),IDA 10~12 mg/m2组的为55.9%(95%CI:38.8%~69.9%)(P=0.901)(图1B)。预后中等组IDA 8 mg/m2组3年OS率为31.5%(95%CI:18.9%~45.0%),IDA 10~12 mg/m2组的为43.7%(95%CI:32.3%~54.6%)(P=0.043)(图1C)。预后不良组3年OS率IDA 8 mg/m2组为20.0%(95%CI:6.2%~39.3%),IDA 10~12 mg/m2组为42.6%(95%CI:25.0%~59.1%)(P=0.206)(图1D)。

图1 总体生存(OS)
总体AML患者中,3年EFS率IDA 8 mg/m2组和IDA 10~12 mg/m2组分别为32%(95%CI:22.7%~41.6%)和37%(95%CI:29.2%~44.8%)(P=0.319)(图2A)。预后良好组IDA 8 mg/m2组和IDA 10~12 mg/m2组3年EFS率分别为53.6%(95%CI:32.9%~70.4%)和43.6%(95%CI:27.9%~58.3%)(P=0.424)(图2B)。预后中等组IDA 8 mg/m2组和IDA 10~12 mg/m2组3年EFS率分别为25.4%(95%CI:14.0%~38.4%)和33.3%(95%CI:23.0%~44.0%)(P=0.107) (图2C)。预后不良组IDA 8 mg/m2组和IDA 10~12 mg/m2组3年EFS率分别为20.0%(95%CI:6.2%~39.3%)和37.5%(95%CI:21.3%~53.7%)(P=0.393)(图2D)。
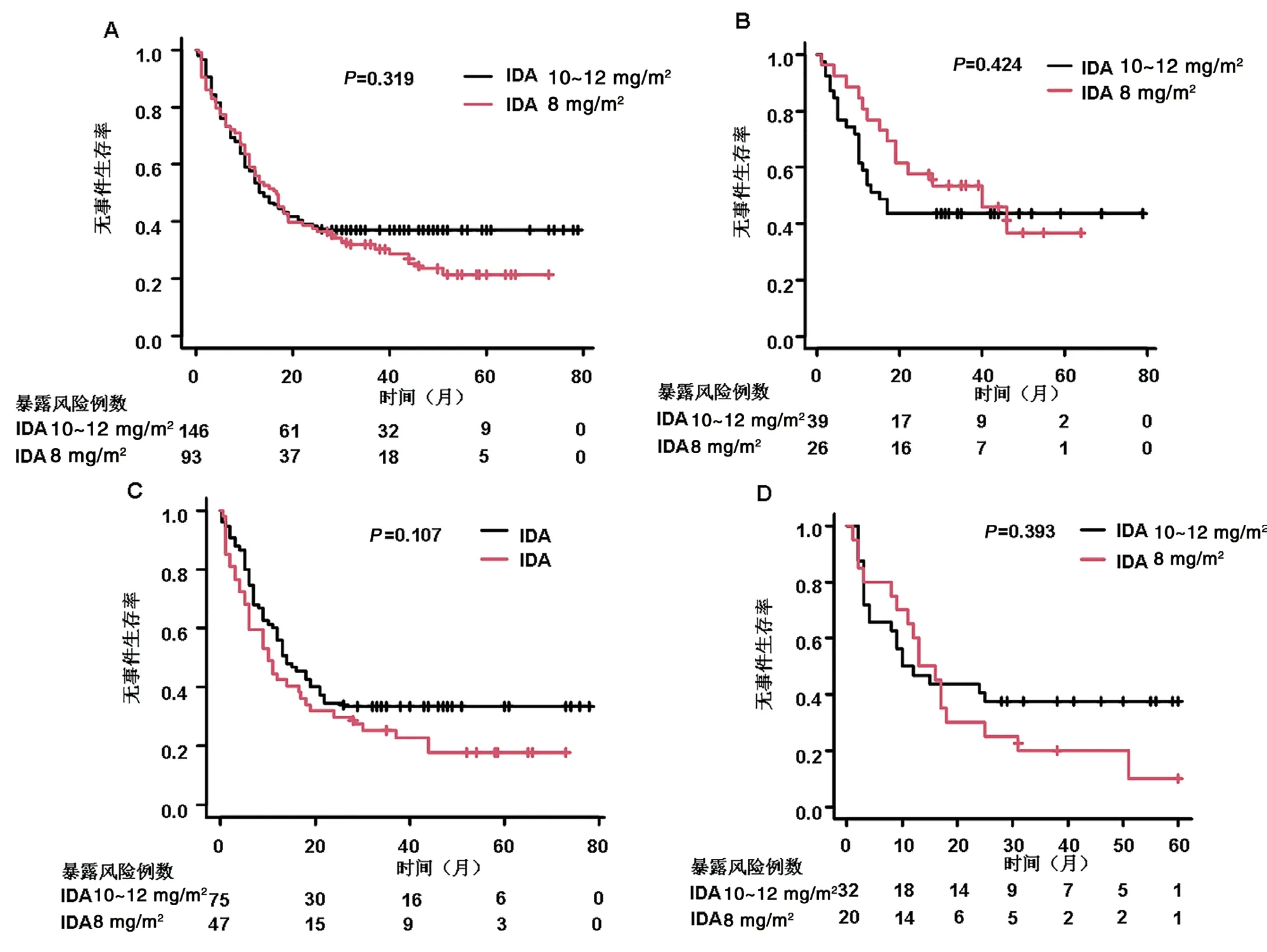
图2 无事件生存(EFS)
5 血液学与非血液学毒性 感染是诱导治疗中最常见的不良事件,IDA 8 mg/m2组和IDA 10~12 mg/m2组中所有患者均并发不同程度的肺部感染,IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有23例(24.7%)和36例(24.7%)患者同时并发其他部位感染:IDA 8 mg/m2组中,并发皮肤软组织感染(肛周感染、中耳炎、面部感染等)12例次,口腔感染4例次,肠道感染伴腹泻4例次,胆囊炎、阑尾炎、泌尿系感染各1例次,败血症3例次;IDA 10~12 mg/m2组中,皮肤软组织感染19例次,口腔感染3例次,肠道感染伴腹泻3例次,口唇疱疹病毒感染2例次,阑尾炎、胸膜炎各1例次,败血症12例次(P=0.432)。IDA 8 mg/m2组和IDA 10~12 mg/m2组中因重症感染合并多器官衰竭而死亡分别为5例和6例(P=0.763)。
几乎所有的患者均发生了≥3级血液学毒性,在血液学恢复期间,IDA 8 mg/m2组中性粒细胞<0.5×109/L的中位天数为15(0~78)天,IDA 10~12 mg/m2组14.5(0~47)天(P=0.766);IDA 8 mg/m2组和IDA 10~12 mg/m2组血小板<20×109/L中位天数分别为10(0~59)天和11(0~36)天(P=0.395);IDA 8 mg/m2组和IDA 10~12 mg/m2组血小板输注中位次数分别为3(0~25)次和4(0~24)次(P=0.625)。IDA 8 mg/m2组有8例(8.6%)患者发生了严重出血事件,其中4例颅内出血(3例死亡),3例眼底出血,1例生殖道出血;IDA 10~12 mg/m2组有12例(8.2%),其中3例颅内出血(2例死亡),3例眼底出血,2例泌尿系出血,4例消化道出血(1例死亡)(P=0.158)。
诱导治疗中,IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有11例(11.8%)和19例(13.0%)患者发生了其他不良事件,IDA 8 mg/m2组中,发生心律失常4例次,胸腔积液4例次,心包积液2例次,皮疹2例次;IDA 10~12 mg/m2组中,心律失常8例次,胸腔积液3例次,心包积液3例次,腹腔积液1例次,皮疹3例次,继发性糖尿病和高尿酸血症各1例次(P=0.854)。
6 移植情况 IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有13例(14.0%)和44例(30.1%)(P=0.005)患者进行了移植;预后良好的患者中,IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有4例(15.4%)和6例(15.4%)患者进行了移植(P=1);预后中等的患者中,IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有8例(17.0%)和22例(29.3%)患者进行了移植(P=0.137);预后不良的患者中,IDA 8 mg/m2组和IDA 10~12 mg/m2组分别有1例(5.0%)和16例(50.0%)患者进行了移植(P<0.001),而预后不良的患者中,IDA 8 mg/m2组和IDA 10~12 mg/m2组的缓解和远期生存无明显差异。
讨 论
蒽环类药物联合阿糖胞苷(3+7方案)是AML患者的标准诱导治疗方案[1]。本研究表明,IDA 10~12 mg/m2组比IDA 8 mg/m2组具有更高的MRD转阴率,提示IDA 10~12 mg/m2组更易达到免疫学缓解。同时生存分析研究发现,IDA 10~12 mg/m2组3年的OS优于IDA 8 mg/m2组,且这种差异在预后中等组尤为明显;此外,IDA 10~12 mg/m2组3年的EFS亦稍高于IDA 8 mg/m2组,提示IDA 10~12 mg/m2诱导治疗能够带来更好的生存获益。
有研究表明在年轻AML患者中柔红霉素90 mg•m-2•d-1×3 d的CR率和生存期均优于柔红霉素45 mg•m-2•d-1×3 d[6],表明柔红霉素剂量的增加有益于提高AML患者缓解与生存。一项针对成人AML患者诱导治疗的随机试验,结果表明柔红霉素 (50 mg•m-2•d-1×5 d)和伊达比星(12 mg•m-2•d-1×3 d)的CR率和生存率相似[7];同样对于年轻成人AML患者伊达比星(12 mg•m-2•d-1×3 d)和高剂量柔红霉素(90 mg•m-2•d-1×3 d)相比,两组在CR率和生存率方面没有差异[8]。这些临床试验表明对于年轻成人AML患者的诱导治疗,柔红霉素60~90 mg•m-2•d-1×3 d与伊达比星 12 mg•m-2•d-1×3 d疗效相当,均纳入指南作为年轻成人AML的标准诱导治疗方案。
然而在国内,不同临床中心使用的IDA剂量波动范围较大(8~12 mg•m-2•d-1×3 d)。苏州大学附属第一医院联合国内36家单位对1 215例成人初发AML患者进行回顾性研究,表明中低危组采用IDA 10 mg、高危组采用IDA 12 mg为最佳诱导治疗剂量[9]。本研究同样证明采用IDA 10~12 mg/m2能够获得更深层次的缓解,从而获得更长的生存率,特别是对于预后中危组的患者,其生存获益更为明显。有研究表明,高白细胞AML患者常伴有不良的细胞遗传学或分子异常是疾病复发和生存率下降的独立危险因素[10-14]。本中心既往临床研究亦表明无论基于细胞遗传学或分子异常的风险分层如何,初诊时白细胞增多是AML患者的独立危险因素[15]。本研究在预后良好组,未能发现IDA 10~12 mg/m2带来的诱导缓解与生存获益,可能与初诊时伴有高白细胞水平的患者较多有关。既往研究同样发现在预后良好的细胞遗传学亚组中,IDA 8 mg/m2和IDA 10~12 mg/m2之间没有发现生存差异[16]。本研究亦发现预后不良组IDA 10~12 mg/m2与IDA 8 mg/m2组相比,增加IDA剂量不会带来生存获益;IDA 8 mg/m2组和IDA 10~12 mg/m2中分别有4例(20.2%)和12例(37.5%)患者携带FLT3-ITD突变(P=0.045),IDA 10~12 mg/m2组具有较高的FLT3-ITD突变率;目前尚未有数据表明增加伊达比星剂量有益于改善FLT3-ITD突变患者的预后。这提示不良分子生物学或者细胞遗传学改变,本身就决定了预后不良组患者具有较差的预后,可能难以通过增加蒽环类药物剂量来达到改善预后的目的。
总之,本研究表明对于年轻成人AML患者,IDA 10~12 mg/m2诱导治疗比IDA 8 mg/m2能够获得更高的免疫学缓解率以及更好地长期生存,特别是对2017 ELN风险评估为预后中等组的患者,其生存获益更为明显。然而,这项研究具有一定的局限性,例如单中心、回顾性研究,且不同预后分层组的病例数相对较少,获得患者细胞遗传学和分子生物学数据不完善等。因此需要前瞻性随机多中心的临床试验来进一步证实本研究的结论。
利益冲突所有作者均声明不存在利益冲突
