改造细菌基因组的双重选择系统的构建
2023-01-05李文静杨桂霞周贤轩陈婷婷石春红
李文静, 杨桂霞, 周贤轩, 陈婷婷, 石春红
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
基因敲除技术目前已广泛应用于动植物、微生物,利用Red同源重组系统可以达到基因敲除、引入、替换等遗传学修饰的目的[1]。Red同源重组系统指λ噬菌体基因组中包含一个Red重组编码区段,可启动外源性DNA和细菌染色体的同源重组[2]。导入细菌的DNA片段与染色体的相应序列发生同源重组,将目的基因置换下来,以达到基因敲除的目的。
反选择标记基因与正选择标记基因相反,含有反选择标记基因的细菌在特定的筛选条件下不能存活,反之则可以存活,从而在不引入抗性基因的情况下达到筛选目的。利用Red同源重组技术,结合正反向选择标记基因的双重选择作用,可以实现细菌基因组中基因的敲除与回补[3-5]。
本文构建的tetA-sacB是一种具有独特优势的两步反选择系统。位于细胞质膜中的tetA基因产物可以阻止四环素在细胞中积累,从而产生四环素抗性,还会使细胞对镰刀菌酸等亲脂性螯合剂敏感[6],因此tetA基因产物对细胞生长具有正反2个方面的选择效应[7]。sacB基因是编码果聚糖蔗糖酶的枯草芽孢杆菌基因,可以将蔗糖转化为果聚糖,果聚糖在周质中积累,会对大肠杆菌的生长起抑制作用[8-9]。tetA-sacB双重选择系统的优势如图1所示。通过基因工程技术将这2个基因构建到一个自杀质粒中,该质粒含有tetA-sacB双基因盒,在细菌基因的敲除与回补过程中可以利用正反选择作用进行筛选。

图1 不同基因敲除方法的比较
由图1a可知,带有抗性基因的DNA片段在同源序列H1和H2的引导下,可以用来进行基因敲除,但无法实现后续基因回补的筛选。由图1b可知,含有tetA-sacB的双基因盒中每个基因产物都发挥独立的作用,可以用于基因敲除的筛选;而且,含有镰刀菌酸和蔗糖的培养基对携带tetA和sacB基因的细菌细胞的生长具有强烈的抑制作用,可以通过这种抑制作用进行反向筛选,该双重选择系统严谨性强。
本文使用遗传背景清楚且易于进行遗传学操作的大肠杆菌MG1655,通过Red同源重组系统结合tetA-sacB双重选择系统,实现细菌基因组基因的敲除与回补,证明了该双重选择系统的可行性与选择的有效性。
1 材料与方法
1.1 实验材料
1.1.1 质粒和菌株
质粒pDNR-LIB、pAH162、pKD46,由本实验室保存;大肠杆菌菌株BW25142和大肠杆菌MG1655均由本实验室保存。
1.1.2 试剂
高保真DNA聚合酶PrimeSTAR购于Takara公司;Taq DNA聚合酶购于北京全式金生物技术有限公司;SanPrep 柱式质粒 DNA 小量抽提试剂盒购于生工生物工程(上海)股份有限公司;凝胶及聚合酶链式反应(polymerase chain reaction,PCR)回收试剂盒购于上海普洛麦格生物产品有限公司;限制性内切酶BamHⅠ、EcoRⅠ购于NEB有限公司;其他试剂均为分析纯;引物设计采用Vector NTI软件,由通用生物(安徽)股份有限公司合成。本实验所用引物见表1所列。

表1 本实验所用引物
表1中带有下划线的表示酶切位点或同源臂序列。
1.2 实验方法
1.2.1 质粒pAH162-sacB的构建
以质粒pDNR-LIB为模板,使用引物P0493、P0494扩增sacB及其启动子,以限制性内切酶BamHⅠ、EcoRⅠ分别双酶切sacB片段和质粒pAH162。将sacB及其启动子连接到pAH162的BamHⅠ和EcoRⅠ位点之间,转化至大肠杆菌BW25142化学感受态。挑取单克隆进行菌落PCR验证,验证引物为P0493和P0028。从保存的阳性菌株中提取质粒并进行测序,构建含有tetA-sacB双基因盒的质粒pAH162-sacB。
1.2.2 大肠杆菌MG1655中lacZ基因的敲除
利用λRed同源重组系统进行基因敲除。从构建的质粒pAH162-sacB中扩增带有lacZ基因上下游同源臂的tetA-sacB片段,扩增引物为P0554、P0555。将tetA-sacB片段通过电击转化至携带温敏性辅助质粒pKD46的大肠杆菌MG1655电感细胞中,该步为正向选择,通过四环素抗性筛选阳性克隆。使用引物P0565、P0566、P0567、P0568进行菌落PCR验证,保存筛选到的阳性菌种MG1655ΔlacZ∶∶tetA-sacB。
1.2.3lacZ基因回补
以大肠杆菌MG1655为模板,使用引物P0565、P0568扩增带有同源臂的lacZ基因。将lacZ基因电击转化至MG1655ΔlacZ∶∶tetA-sacB电感细胞中,通过同源重组替换MG1655ΔlacZ∶∶tetA-sacB中的tetA-sacB片段。在含有镰刀菌酸和蔗糖的反选培养基上筛选阳性克隆,进行菌落PCR验证。
1.2.4tetA-sacB双重选择系统
tetA-sacB双重选择系统使用反选择培养基。100 mL的tetA/sacB反选择固体培养基含有1.5 g琼脂,0.4 g胰蛋白胨,0.4 g酵母提取物,0.8 g氯化钠,0.7 g磷酸二氢钾,11.0 mg氯化锌,2.4 mg镰刀菌酸,6.0 g蔗糖。lacZ基因通过电击转化至MG1655ΔlacZ∶∶tetA-sacB电击感受态中。加入LB复苏后的菌液转接至50 mL上述液体反选培养基中,42 ℃过夜振荡培养[10]。蘸取过夜培养的菌液划线于反选固体培养基,42 ℃培养箱培养1~2 d。挑取单克隆进行PCR验证,利用tetA对镰刀菌酸的敏感性和sacB对蔗糖敏感性的反向选择作用筛选阳性克隆。
1.2.5β-半乳糖苷酶活性分析
将野生型菌株MG1655、敲除菌株MG1655ΔlacZ∶∶tetA-sacB以及回补菌株MG1655ΔlacZ∶∶tetA-sacB(Comp)进行β-半乳糖苷酶活性分析[11]。3种菌株于37 ℃过夜培养,按体积分数1%接入3 mL新鲜LB培养基中培养至对数期。取相应菌液量接入新鲜培养基至总体积为3 mL,37 ℃振荡培养约6 h。取一部分菌液测OD600,一部分菌液做β-半乳糖苷酶活性分析,每种菌株设置3个平行,取300 μL菌液于12 000 r/min离心2 min,弃上清。加入500 μL Z-buffer工作液,30 μL 0.1% 十二烷基硫酸钠(SDS),50 μL氯仿,混匀后于30 ℃水浴5 min。加100 μL 2-硝基苯基-β-D-吡喃半乳糖苷(ONPG),开始计时,当溶液开始变黄色,加入250 μL 1 mol/L Na2CO3,停止计时。12 000 r/min离心10 min,测上清液的OD420,利用公式(1 000×OD420)/(反应时间×菌液体积×OD600),计算β-半乳糖苷酶活性。
2 结果与分析
2.1 质粒pAH162-sacB构建分析
若将反选择标记基因sacB构建到pAH162中,则重组质粒pAH162-sacB含有tetA-sacB双基因盒,该双基因盒可以在细菌基因组的基因敲除与回补实验过程中起双重选择作用。构建质粒pAH162-sacB结果如图2所示。
由图2a可知,质粒pAH162含有tetA基因,质粒pDNR-LIB含有sacB基因,以pDNR-LIB为模板扩增sacB及其启动子片段,通过酶切连接的方法将sacB及其启动子构建到pAH162的BamHⅠ和EcoRⅠ位点之间。
图2b中:M为DNA Marker;泳道1为不加模板的空白对照;泳道2为扩增的sacB基因及其启动子,条带大小为2 071 bp。由图2b可知,将酶切连接的重组质粒转化至大肠杆菌BW25142,对转化板上的单克隆进行PCR检验,结果如图2c所示。图2c中:M为DNA Marker;泳道1为pAH162对照;泳道2~9为转化板上的单克隆PCR验证结果,阳性菌株中引物P0493可以与引物P0028配对,应有2 891 bp的目的条带。由图2c可知,泳道3、4、6 与预期符合,为阳性克隆,泳道5、7、8、9为阴性克隆。提取阳性菌株质粒进行测序,结果表明重组质粒pAH162-sacB构建成功。
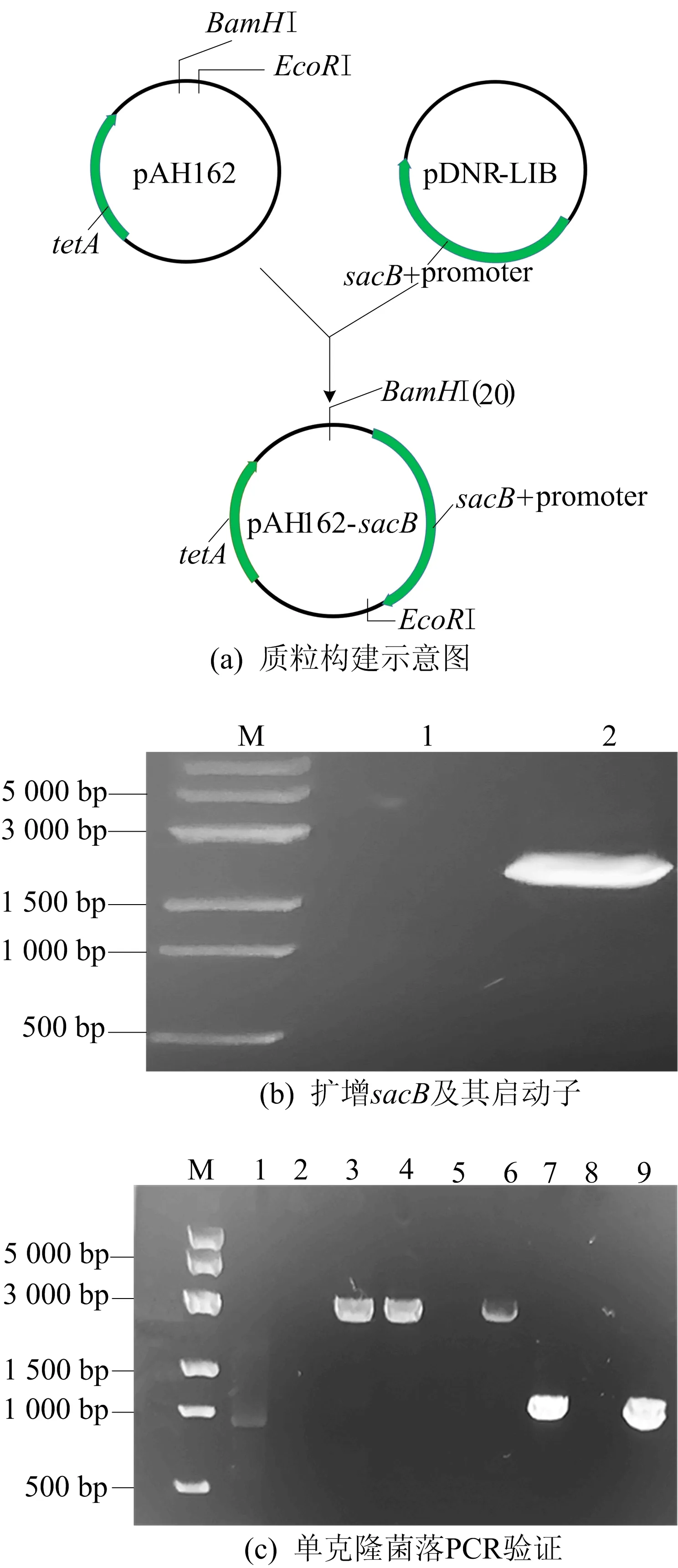
图2 质粒pAH162-sacB构建结果分析
2.2 大肠杆菌MG1655中lacZ基因的敲除分析
利用tetA-sacB片段替换大肠杆菌MG1655中的lacZ基因,通过tetA基因产物表达的四环素抗性筛选阳性克隆。敲除大肠杆菌MG1655中的lacZ基因结果如图3所示。图3b中:M为DNA Marker;泳道1为大肠杆菌MG1655阴性对照,条带大小为3 607 bp;泳道2、3为阳性克隆,分别用引物P0565/P0566、引物P0567/P0568扩增出的目的条带,符合预期。阳性菌株保存于-80 ℃。
由图3a可知,以pAH162-sacB为模板,扩增带有lacZ基因上下游同源臂(H1和H2)的tetA-sacB基因片段,用tetA-sacB替换lacZ基因。敲除成功的阳性克隆基因携带tetA基因,从而具有四环素抗性,可以利用四环素抗性进行正向筛选。由图3b可知,阳性克隆中引物P0565/P0566配对,P0567/P0568配对,可以分别扩增出2条大小为651、2 081 bp的特异性条带。
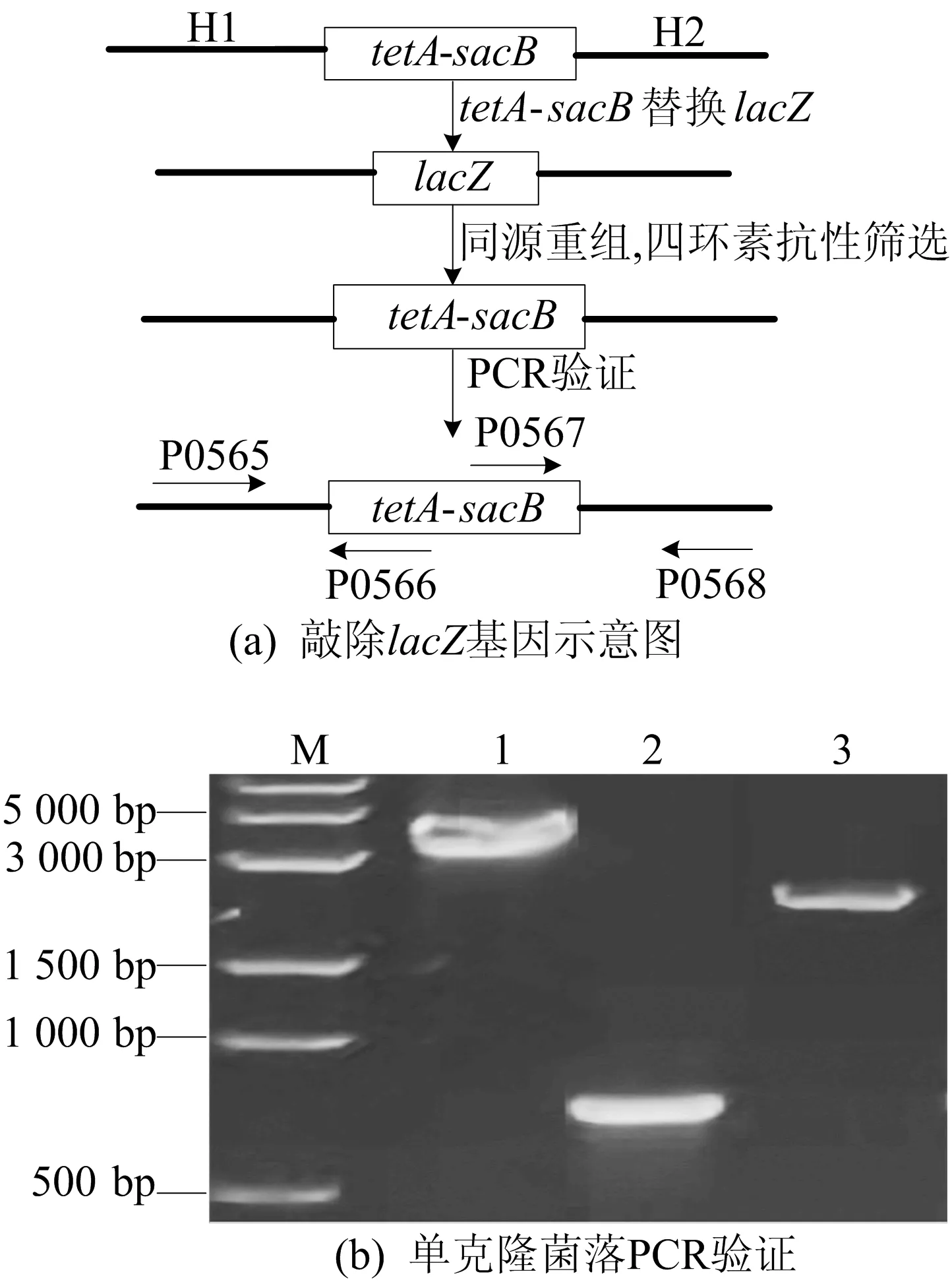
图3 大肠杆菌MG1655中lacZ基因的敲除分析
2.3 lacZ基因回补分析
由于含有镰刀菌酸与蔗糖的培养基对携带有tetA-sacB基因片段的细菌生长有强烈的抑制作用。在回补lacZ基因的实验中,可以利用tetA-sacB双重选择系统的反向选择作用筛选阳性克隆,回补lacZ基因的结果如图4所示。
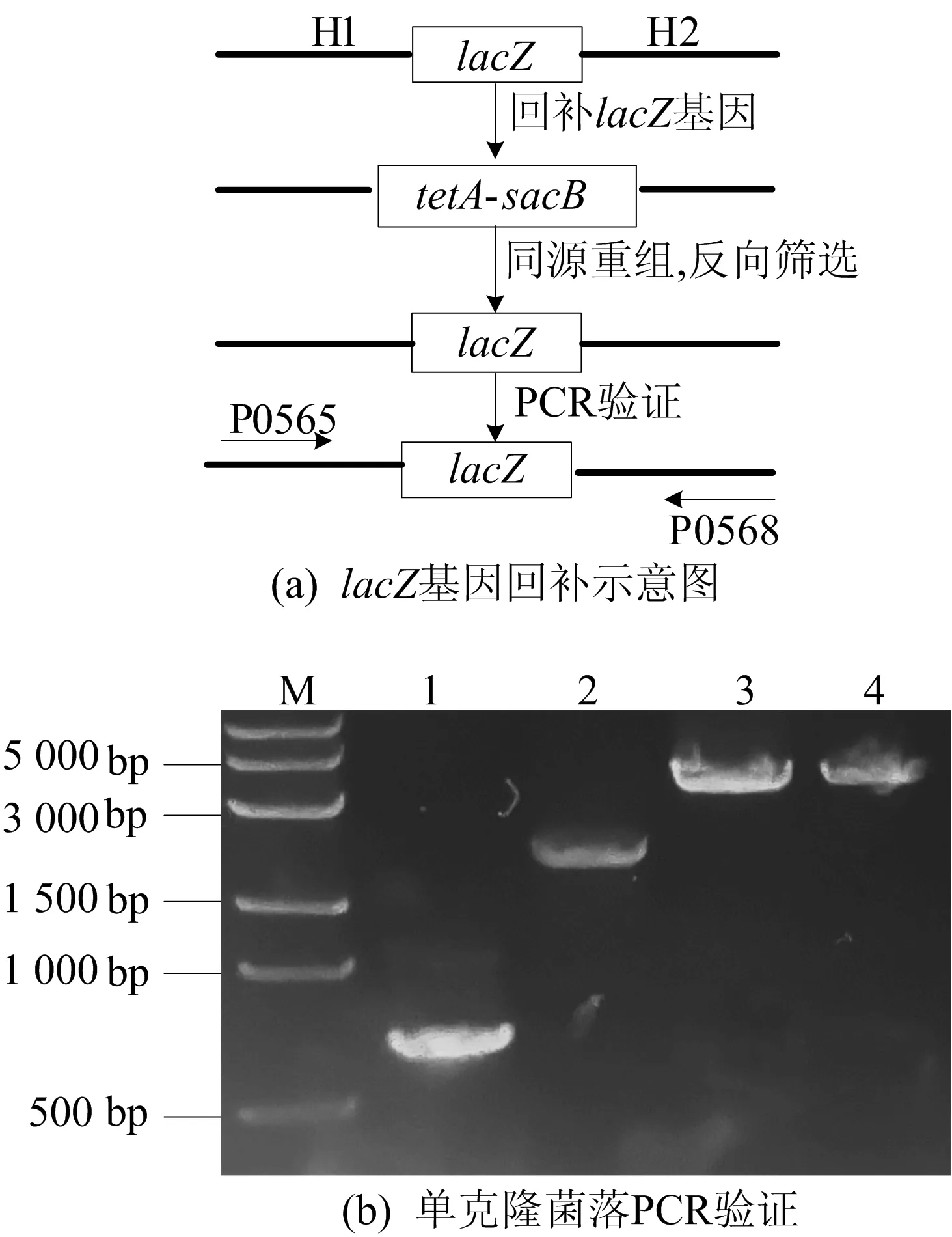
图4 lacZ基因的回补分析
由图4a可知,以大肠杆菌MG1655为模板扩增lacZ基因,替换MG1655ΔlacZ∶∶tetA-sacB中的tetA-sacB基因片段,在含有镰刀菌酸和蔗糖的反选培养基上筛选,实现lacZ基因的回补。
图4b中,M为DNA Marker;泳道1、2分别为阴性对照MG1655ΔlacZ∶∶tetA-sacB通过P0565/P0566和P0567/P0568(图3a)扩增出的条带;泳道3为MG1655阳性对照;泳道4为成功回补lacZ基因的单克隆PCR结果,符合预期。保存阳性菌株于-80 ℃。
2.4 β-半乳糖苷酶活性分析
在大肠杆菌中,lacZ基因编码合成了β-半乳糖苷酶。为了进一步验证敲除菌株及回补菌株结果的可靠性,本文进行了β-半乳糖苷酶活性分析。β-半乳糖苷酶活性分析结果如图5所示,图5中:A为野生型大肠杆菌MG1655;B为敲除菌株MG1655ΔlacZ∶∶tetA-sacB;C为回补菌株MG1655ΔlacZ∶∶tetA-sacB。
由图5可知,MG1655ΔlacZ∶∶tetA-sacB因缺失lacZ基因,因此没有β-半乳糖苷酶活性;野生型MG1655和回补菌株均表达较高的β-半乳糖苷酶活性,且无显著差异。本实验结果表明利用tetA-sacB的双重选择作用,实现了lacZ基因的敲除与回补。
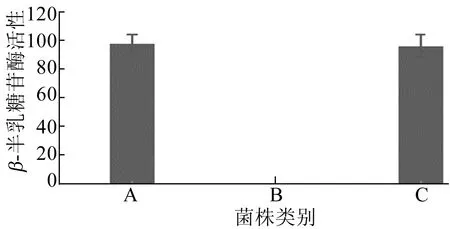
图5 菌株β-半乳糖苷酶活性分析
3 讨 论
Red同源重组系统利用可正向选择的抗生素抗性基因替换目标基因,实现细菌基因组中非致死基因的敲除[12]。抗性基因的正向选择只适合基因敲除,不适合筛选基因组中非必须基因的回补,对验证基因功能的相关研究不利。CRISPR/Cas9系统主要由Cas9蛋白和单链向导RNA(sgRNA)组成,在sgRNA的向导下通过碱基互补配对原则,利用Cas9蛋白对基因组进行剪切,使DNA双链断裂,实现基因敲除[13]。然而sgRNA的设计、脱靶效应、Cas蛋白和sgRNA的递送等在一些情况下限制了CRISPR/Cas9系统的使用[14]。
本文将构建的tetA-sacB双基因盒用于基因敲除,而共同表达2种反选择标记基因tetA和sacB可以实现回补菌株的反向选择。tetA基因可以作为正向标记基因,表达四环素抗性,同时tetA基因还可以用作反向筛选标记,含有镰刀菌酸的培养基对携带tetA基因的细菌有致死作用,但是菌株筛选的阳性率较低[15]。sacB基因不需要抗生素抗性诱导细菌死亡[16],而是通过菌株对蔗糖的敏感性发挥反向筛选作用。sacB基因编码胞外果聚糖蔗糖转移酶,导致果聚糖富集,抑制细菌的生长。本文使用构建的tetA-sacB双基因盒敲除大肠杆菌MG1655中lacZ基因,利用tetA基因产物表达的四环素抗性进行了正向选择;在回补lacZ基因的过程中,利用tetA和sacB的反选择作用进行筛选,阳性率高。
4 结 论
本文通过构建质粒pAH162-sacB,将2种反选择标记基因tetA和sacB构建到一个双基因盒,建立tetA-sacB双重选择系统。扩增tetA-sacB片段敲除大肠杆菌MG1655中的lacZ基因,通过四环素抗性正向选择阳性克隆,成功筛选到阳性菌株MG1655ΔlacZ∶∶tetA-sacB。将lacZ基因原位回补替换MG1655ΔlacZ∶∶tetA-sacB菌株中的tetA-sacB基因片段,利用tetA和sacB的反向选择作用,在含有镰刀菌酸和蔗糖的培养基上成功筛选到回补菌株。β-半乳糖苷酶活性分析结果表明,野生型菌株和回补菌株能够表达β-半乳糖苷酶活性,且彼此间无差异,而敲除菌株因缺失lacZ基因,无β-半乳糖苷酶活性。本文利用tetA-sacB的正反选择作用,成功实现了大肠杆菌MG1655中lacZ基因的敲除与回补,表明该双重选择系统选择的有效性,可以应用到大肠杆菌的基因工程研究中,对细菌基因组进行遗传学修饰。
