介孔CuO-CeO2 复合氧化物负载Au 催化剂催化氧化甘油制备二羟基丙酮
2023-01-04柯义虎余小梅徐换换曹馨怡朱钰卿
柯义虎,余小梅,王 学,徐换换,曹馨怡,朱钰卿,王 非
1.北方民族大学化学与化学工程学院,国家民委化工技术基础重点实验室,宁夏太阳能化学转化技术重点实验室,宁夏 银川 750021;
2.常州大学石油化工学院,江苏省精细石油化工重点实验室,江苏 常州 213164
1,3-二羟基丙酮(DHA)作为一种重要的化工、生化原材料,广泛应用于化妆品、精细化工、医药中间体和食品添加剂等化工生产[1-4]。目前DHA 主要是通过对甘油仲位羟基的生物发酵氧化而来,此方法具有反应底物浓度低、发酵周期长、目标产物产率低、产物分离提纯成本高、酶或菌体对溶液环境的敏感性使其易在反应中失活以及获得困难等缺点[5-6]。因此,开发高效制备DHA 的方法受到越来越多的关注,如光催化氧化法、电催化氧化法和化学催化氧化法等方法。在诸多方法中,以氧气为氧化剂,使用贵金属负载型催化剂催化甘油氧化工艺,被视为一条绿色环保、经济实用、清洁高效的工艺路线,受到了高度关注[7-10]。
近年来,在无碱条件下催化氧化甘油体系中,提高催化剂的催化活性受到研究者的广泛关注,同时。目前研究的负载型催化剂活性组分主要以单金属Pt[11-12],Pd[13],Au[14-15]或双金属Pt-Bi[16-17],Pt-Sb[18],Pt-Sn[19]和Pd-Ag[20]等为主。此外,载体对催化剂的催化性能影响比较明显,以前的研究主要围绕碳展开,而以金属氧化物为载体鲜有报道。在多相催化氧化体系中,负载Au 催化剂的催化活性受载体性质的影响较为显著,Liu 等[21]报道了Au/CuO 催化剂在无碱条件下催化氧化甘油表现出良好的催化活性,研究发现,CuO 作为还原性氧化物载体,可以通过金属与载体的相互作用提高催化活性或改善Au 在载体上的分散性。此外,CeO2作为一种重要的稀土材料,由于Ce4+转换为Ce3+而具有较高的储氧能力,被广泛应用于催化方面,引入其它金属氧化物可有效提高CeO2的储氧能力和稳定性[22-24]。另外,有研究表明CuO-CeO2催化剂中具有萤石结构的CeO2载体,可以对活性组分起到支撑、固定和分散的作用,从而提高其催化性能[25-26]。
鉴于此,为增大Cu 与Ce 的接触面积以增强Cu 与Ce 之间协同作用并提高活性组分的含量及分散度,本工作设计并合成了具有介孔结构的CuO-CeO2复合氧化物材料,以其为载体制备负载Au 催化剂,探讨载体中Cu 和Ce 物质的量之比(Cu/Ce 比)对其孔道的影响,进而有效控制催化剂活性组分的颗粒大小,以提高催化性能及产物的选择性。
1 实验部分
1.1 载体制备
SBA-15 是一种常见的硬模板,其制备方法为:将4.00 g 三嵌段共聚物P123(聚环氧乙烷-聚环氧丙烷-聚环氧乙烷)溶于30.00 g 去离子水中,搅拌均匀后,加入120 mL 浓度为2 mol/L 的盐酸,继续搅拌2 h 后加热至40 ℃,剧烈搅拌下,加入9.00 g 正硅酸四乙酯(TEOS),保持40 ℃继续搅拌24 h,置于100 ℃烘箱中老化48 h 后,冷却、过滤并在65 ℃下干燥,置于马弗炉中以1 ℃/min 升温至550 ℃,焙烧6 h 去除模板,得到SBA-15。
以SBA-15 为硬模板,金属硝酸盐为前驱物,用硬模板法制备介孔CuO-CeO2复合氧化物,制备方法为:称取1.5 g 的SBA-15 置于玛瑙研钵中,并滴加15 mL 正己烷,随后加入一定量的Ce(NO3)3·6H2O 与Cu(NO3)2·3H2O 混合物[固定Ce(NO3)3·6H2O 的量,通过调控Cu(NO3)2·5H2O 的加入量,来控制CuO 的含量],充分研磨30 min 后,将其分散于50 mL 正己烷中,搅拌条件下加热至70 ℃并回流12 h,冷却、离心分离(正己烷洗涤3 次),在70 ℃下干燥12 h,置于马弗炉中以2 ℃/min升温至500 ℃,焙烧5 h 分解硝酸盐前驱体,最后用浓度为2 mol/L 的NaOH 溶液处理上述粉末2 次,每次2 h,去除模板剂,干燥后即得介孔CuO-CeO2-m:n复合氧化物,其中m:n代表Cu 和Ce 物质的量之比。
1.2 催化剂制备
采用均匀沉积沉淀法制备介孔CuO-CeO2复合氧化物负载Au 催化剂。具体操作为:以Au 的理论负载量为3%(质量分数)计,称取1 g 载体、3.655 6 g 尿素(尿素与Au 的物质的量之比为400)分散于50 mL 去离子水中,搅拌条件下快速加入6.268 mL 浓度为0.024 3 mol/L 的氯金酸溶液,搅拌混合后加热至80 ℃保持6 h,冷却至室温后继续搅拌16 h。抽滤,去离子水洗涤至无Cl-(0.1 mol/L AgNO3检测),置于烘箱内110 ℃干燥4 h,经充分研磨至粉末后置于管式炉中,在流动空气气氛下,升温至200 ℃焙烧5 h,得到一系列Au/CuO-CeO2-m:n复合氧化物催化剂。
1.3 催化剂表征
采用美国麦克仪器公司ASAP-2020HD88 型全自动物理吸附仪分析催化剂的比表面积和孔径,通过Brunauer-Emmett-Teller(BET)法计算比表面积;采用利曼公司Prodigy7 型全谱直读等离子体发射光谱仪(ICP-OES)测定催化剂中各金属元素含量;采用日本株式会社理学SmartlabSE 型X 射线衍射仪(XRD,辐射源为Cu-Kα,工作电压为40 kV)测定催化剂物相组成;采用FEI inspect F50 型透射电子显微镜(TEM)测定样品表面信息、Au 纳米颗粒尺寸及分布;采用赛默飞世尔ESCALAB Xi+型多功能成像光电子能谱仪(XPS,辐射源为Al-Kα)测定催化剂表面元素及其价态;采用美国麦克仪器公司AutoChem II 2920 型化学吸附仪,通过H2程序升温还原(H2-TPR)测定催化剂样品表面的还原能力,通过CO2程序升温脱附(CO2-TPD)测定样品的碱含量。
1.4 催化剂评价
在带有温度控制和机械搅拌系统的间歇反应釜中进行催化甘油氧化反应,具体操作步骤如下:取已配制好的0.1 mol/L 甘油水溶液24 mL 和一定量的催化剂,加入反应釜后密封严实,然后通入N2和O2分别置换3 次后,再充入反应所需压力的O2,在500 r/min 搅拌下于20 min 内加热至指定温度,反应2 h,用冰水冷却釜体至室温,排除釜内残余气体并打开反应釜,经过滤后液体待测,催化剂洗涤回收。
转化率和选择性由高效液相色谱仪(HPLC,Sykam S-501)检测分析反应液并采用外标法进行定量计算得到,液相色谱仪配有示差折光(RI,池温为40 ℃)和紫外可见双波长(UV,波长为210 nm)双检测器,以浓度为0.005 mol/L 的H2SO4作为流动相,流速为0.5 mL/min,使用Bio-Rad Aminex HPX-87H 有机糖醇分析柱进行分离,柱箱温度为45 ℃,进样量为20 μL。
2 结果与讨论
2.1 催化剂的组成和结构分析
各Au/CuO-CeO2催化剂的N2吸附-脱附等温线如图1 所示。从图中可以看出,所有催化剂均表现出具有H3 型滞后回线的标准Ⅰ型等温线,说明所有催化剂中出现了介孔结构。

图1 各Au/CuO-CeO2 催化剂的N2 吸附-脱附等温线Fig.1 N2 adsorption-desorption isotherms of Au/CuO-CeO2 catalysts
表1 列出了各催化剂的比表面积(SBET)、孔体积(Vp)和平均孔径(Dp)。不同配比的Au/CuO-CeO2催化剂的比表面积为17.1~158.5 m2/g,孔体积为0.03~0.35 cm3/g。随着CuO 含量的增加,比表面积和孔体积均呈现下降趋势,而平均孔径则变化不大。当Cu/Ce 比由1:5 增加到9:1 时,比表面积由158.5 m2/g 迅速减小至17.1 m2/g,孔体积由0.35 cm3/g 下降至0.03 cm3/g。不同Cu/Ce 比的Au/CuO-CeO2催化剂的比表面积相差很大,说明对于介孔CuO-CeO2复合氧化物载体来说,表面性质受组成影响显著,因此不同Cu/Ce 比对Au/CuO-CeO2催化剂结构性质的影响较为明显。图 2 为各Au/CuO-CeO2催化剂的孔径分布情况。从图中可以看出,不同Cu/Ce 比的Au/CuO-CeO2催化剂均有介孔结构。

图2 各Au/CuO-CeO2 催化剂的孔径分布Fig.2 The pore diameter distributions of Au/CuO-CeO2 catalysts
对不同Cu/Ce 比的Au/CuO-CeO2催化剂中各金属元素进行含量分析,结果见表1。由表中可以看出,催化剂活性组分Au 的实际负载量为1.85%~2.67%。当Cu/Ce 比为7:1 时,活性组分Au 的实际负载量过低,这可能是由于尿素的量过高或分解速率过快,导致溶液pH 值过高,从而在制备过程中使Au 以[Au(OH)4]-和Au(OH)3形式存在导致的[27]。Cu/Ce 比催化剂中Au 实际负载量接近于理论负载量,仅有少部分Au 没有负载在载体上,这可能是由于Cu/Ce 比不同导致载体本身表面性质不同,因此各催化剂的负载量均不一样。从载体中Cu 和Ce 的真实含量分析,发现Cu和Ce 物质的量之比接近理论值,表明在载体制备过程中Cu 和Ce 接近理论含量形成相应的CuO-CeO2复合氧化物。

表1 不同Cu/Ce 比Au/CuO-CeO2 催化剂结构和化学组成分析Table 1 Textural and chemical composition analysis of Au/CuO-CeO2 catalysts with different Cu/Ce ratios
2.2 催化剂XRD 分析
图3 为各催化剂和相应载体的XRD 图谱。由图3 可知,各Au/CuO-CeO2催化剂和相应载体在2θ为28.5º,33.0º,47.4º和56.3º处均出现特征衍射峰,分别归属于CeO2的(111),(200),(220)和(311)晶面,说明各催化剂和其载体中CeO2是立方萤石结构(PDF#89-8436)。而各样品在2θ为35.5º,38.8º,58.4º,61.5º,66.3º,68.1º,72.5º和75.2º处出现的衍射峰,分别归属于CuO 的(002),(111),(202),(-113),(022),(220),(311)和(-222)晶面,说明各催化剂和相应载体中出现了体相CuO(PDF#80-1268)。当Cu/Ce 比低于3:1 时,CuO 在2θ为35.5º和38.8º处的特征衍射峰强度非常弱,随着载体中Cu 含量的增加,CuO 特征衍射峰强度明显加强,说明Cu/Ce 比的增加导致Cu 物种发生团聚。负载Au 后,Au 的负载对载体的晶体形态和峰值强度没有影响。此外,所有催化剂中都未检测到活性组分Au 的特征衍射峰,这可能是由于Au 的特征衍射峰(2θ为38.2º)和CuO 的特征衍射峰(2θ为38.8º)重叠,也可能是由于Au 纳米颗粒在载体上高度分散。

图3 各载体(a)及Au/CuO-CeO2 催化剂(b)的XRD 图谱Fig.3 XRD patterns of different supporters (a) and Au/CuO-CeO2 catalysts (b)
图4 为不同Cu/Ce 比载体的小角XRD 图谱。从图中可以看出,制备的Cu-Ce 混合氧化物载体在2θ为1.2º~2.4º出现一个明显的衍射峰,这表明成功合成了介孔复合氧化物。
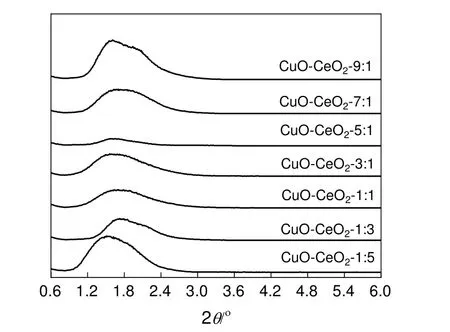
图4 各载体的小角XRD 图谱Fig.4 Low-angle XRD patterns of supporters
2.3 催化剂TEM 分析
各催化剂的TEM 和HRTEM(高分辨率透射电镜)表征结果如图5 所示。从图中可以清晰地看出,Au/CuO 催化剂中Au 颗粒尺寸为(3.03±0.52) nm,Au/CeO2和不同Cu/Ce 比的Au/CuO-CeO2催化剂中Au 颗粒尺寸非常小,粒径分布无法统计,表明Au 完全进入介孔复合氧化物的孔道内部,且未破坏介孔材料的孔道结构。在Au/CuO-CeO2-5:1 的高分辨率透射图像中依据测量到的晶格条纹可以进一步判断催化剂颗粒可能的晶像组成,结合XRD 标准卡片给出的Au,CuO 和CeO2的晶格参数,确定晶面间距为0.23 nm 的衍射条纹对应于Au 的(111)晶面,另外归属于CuO(110)和CeO2(111)晶面的晶格衍射条纹,其晶面间距分别为0.27 nm 和0.32 nm,这表明催化剂中既含有CuO,也存在CeO2,表明形成CuO-CeO2复合氧化物。在电子衍射图中清晰地显示出了Au 和CuO-CeO2的衍射花样,与HRTEM 表征结果相一致。

图5 各催化剂的TEM 和HRTEM 图像Fig.5 TEM and HRTEM images of different catalysts
Au/CuO-CeO2-5:1 催化剂的TEM-Mapping 图像显示了各元素的分布情况,结果见图6。从图中可以看出,催化剂中Cu 和Ce 元素为主要组成,O 元素次之,Au 元素最少,这与制备载体时理论计算的结果相一致。另外,在图中可以清楚地观察到介孔结构,说明成功合成了介孔材料,与XRD 表征结果一致。图6(b)~图6(e)可以清晰地看出Au,Cu,Ce 和O 各元素分散均匀,进一步证明形成了CuO-CeO2介孔复合氧化物,并且Au 颗粒以较小的尺寸均匀地分散在载体上。

图6 Au/CuO-CeO2-5:1 催化剂TEM-Mapping 图像Fig.6 TEM-Mapping images of Au/CuO-CeO2-5:1 catalyst
2.4 催化剂H2-TPR 分析
通过H2-TPR 对不同Cu/Ce 比的CuO-CeO2介孔复合氧化物和催化剂的还原性能进行研究,结果如图7 所示。由图可知,在温度为100~400 ℃,所有载体均出现两个还原峰,较低温度的还原峰可能是高度分散的CuO 以及具有强相互作用的Cu-Ce 固溶体的还原[28],而较高温度下的还原峰可能是结晶CuO 的还原,CeO2在此温度段无法还原。由图7 还可以看出,随着CuO 含量的增加,样品还原温度向低温区移动且两个峰相互重叠形成较大的单峰,这主要是因为CuO 和CeO2之间强相互协同作用,提高了Cu-Ce 混合氧化物的低温还原性,有利于样品的催化氧化活性。此外,随着CuO 含量的增加,还原峰的峰面积和强度都逐渐增大,这意味着总的耗氢量逐渐增加,说明其具有优异的还原性。将Au 负载于载体上后,使得催化剂的还原温度均有所降低,说明Au 与介孔CuO-CeO2载体之间存在相互作用,使得催化剂的低温还原性更好。

图7 各载体(a)及Au/CuO-CeO2 催化剂(b)的H2-TPR 图谱Fig.7 H2-TPR patterns of supporters (a) and Au/CuO-CeO2 catalysts (b)
2.5 催化剂CO2-TPD 分析
图8 为不同Cu/Ce 比的CuO-CeO2介孔复合氧化物负载Au 催化剂的二氧化碳程序升温脱附曲线。各催化剂在50~600 ℃内分别出现3 个或4 个CO2解析峰。一般情况下,在100~250 ℃,250~450 ℃和450~700 ℃温度段的CO2解析峰分别归属于弱、中等和强度碱基位,因此,各催化剂同时具有弱等强度、中等强度和强碱性。相比于其它催化剂,Au/CuO-CeO2-5:1 催化剂脱附峰最少,说明该催化剂的碱性位较少,但是在强碱位上的CO2脱附峰较大,说明其碱性较强,由于催化剂的强碱性是提高甘油催化性能的关键之一,因此该催化剂催化性能也较理想,与实验结果相一致。

图8 各Au/CuO-CeO2 催化剂的CO2-TPD 图谱Fig.8 CO2-TPD patterns of Au/CuO-CeO2 catalysts
2.6 催化剂XPS 分析
图9 为不同Cu/Ce 比的介孔复合氧化物负载Au 催化剂的XPS 表征结果,用C 1s 峰(284.8 eV)进行校正。对催化剂中Ce 的精细谱图分峰拟合后分别用字母μ 和ν 表示Ce 3d3/2和Ce 3d1/2自旋轨道,表明催化剂表面Ce 物种以Ce3+和Ce4+2 种形式存在[29],其中位于885.1 eV 和903 eV 处的峰对应于Ce3+[30-31],其余的均归属于Ce4+。Ce3+的存在是由于CeO2晶格中配位不饱和导致的,同时产生氧空位,而氧空位的存在有利于甘油氧化反应的进行。
对Cu 的精细谱图进行分峰拟合,可以看到所有样品均在结合能为933.1 eV 和934.5 eV 左右出现了明显的Cu 2p3/2的峰,前者归属于Cu+和Cu0的峰,后者归属于Cu2+的峰,此外,所有含Cu 催化剂均出现了较强的卫星峰[32-33]。故所有催化剂中Cu 以3 种电子形态形式存在。随着Cu 含量的增加,Cu2+的含量明显随着增加,其中Au/CuO-CeO2-5:1 中Cu2+的含量最高,同时可以看出,Au/CuOCeO2-1:5 和Au/CuO-CeO2-1:3 催化剂在929.6 eV 出现一个弱峰,可能是Ce 含量较高,通过电子转移使得Cu0或Cu+的结合能降低所致[34]。说明电子从Ce 转移到Cu,两者形成强的相互作用。
从Au 的XPS 精细谱图发现,所有催化剂中Au 的主要结合能在(84.0±0.3) eV 附近出现了Au 4f7/2的峰,说明催化剂中Au 主要以Au0形式存在,而在(85.1±0.5) eV 附近同时出现了Auδ+物种的Au 4f7/2的峰,但含量均较低。随着催化剂中Cu 含量的增加,Au0和Auδ+的结合能逐渐增加,说明催化剂表面缺电子程度增加,并且Au0与Auδ+结合能之间的差距越来越大,说明催化剂中Cu 的加入,与Ce形成强的相互作用,从而影响Auδ+的电子分布。
从图9(d)可以看出,Au/CeO2,Au/CuO-CeO2-1:5,Au/CuO-CeO2-1:3,Au/CuO-CeO2-1:1 和Au/CuO-CeO2-3:1 催化剂中表面O 存在3 种形态,其余催化剂中有2 种形态。529.4~529.8 eV 归属于CuO 和CeO2晶格氧,530.3~530.8 eV 归属于CuO 和CeO2归属于表面吸附氧,531.6 eV 归属于表面羟基或碳酸盐化学吸附的氧种[35]。从图中可以看出,表面晶格氧的含量明显大于其它氧物种,这有利于提高催化活性[36]。
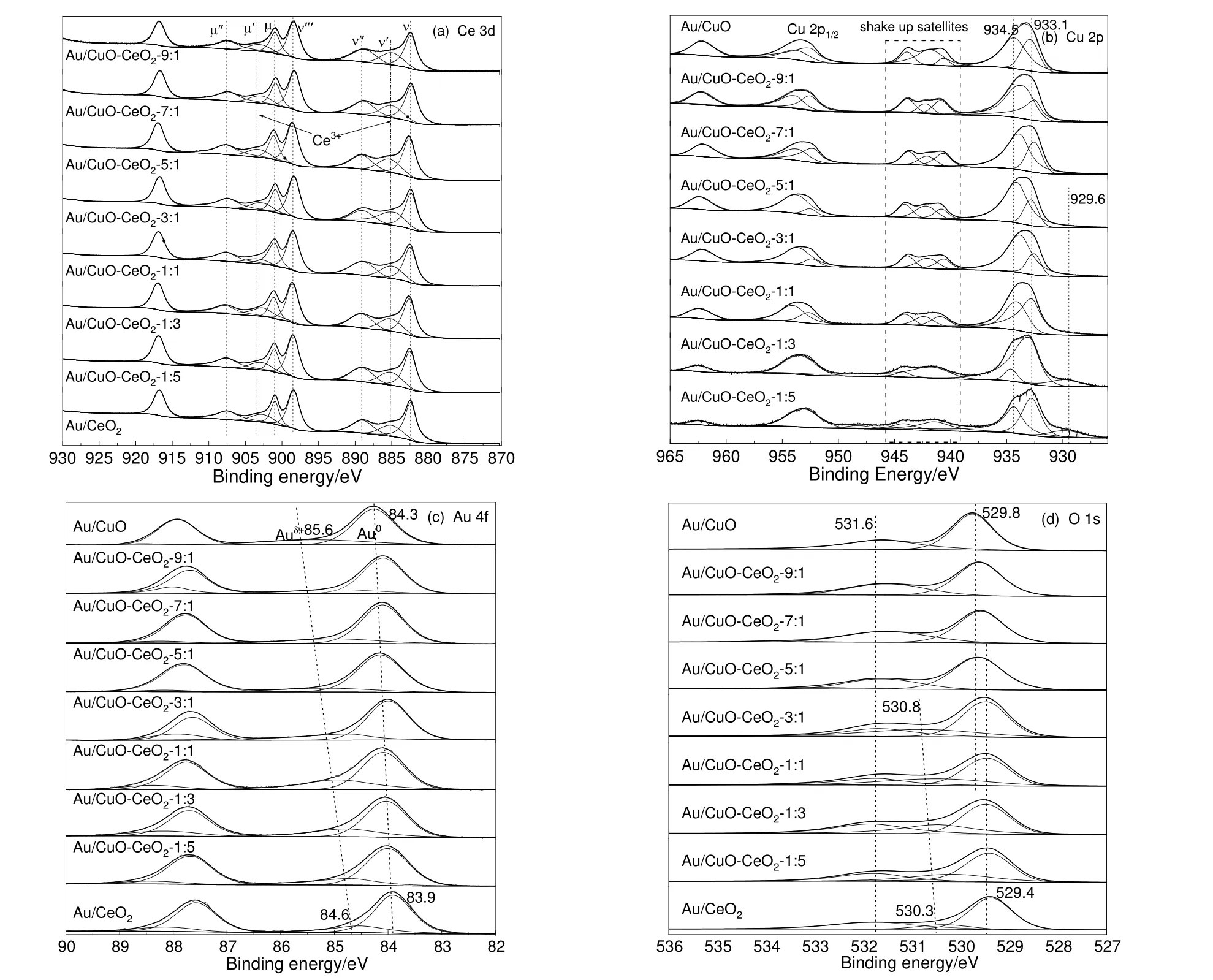
图9 各Au/CuO-CeO2 催化剂的XPS 图谱Fig.9 The XPS spectra of Au/CuO-CeO2 catalysts
2.7 催化剂性能测试
2.7.1 不同Cu/Ce 比对甘油催化性能的影响
将一系列不同Cu/Ce 比的Au/CuO-CeO2催化剂用于催化甘油氧化反应体系中,其反应结果如表2所示。从表2 中可以看出,纯Au/CuO 的催化活性较好,甘油转化率和DHA 选择性分别可达到72.2%和96.3%,而纯Au/CeO2的催化活性较差,甘油转化率只有12.9%,DHA 选择性为61.7%。对于Au/CuO-CeO2催化剂,随Cu/Ce 比的增加,甘油转化率呈“火山型”趋势,DHA 选择性则随Cu/Ce比的增加呈上升趋势。当Cu/Ce 比由1:5 增加至5:1 时,甘油转化率由最初的15.9%增加至80.3%,DHA 选择性由55%增加到89.7%,这表明随着CuO 含量的增加,Cu 与Ce 的协同作用增强,从而增强了催化活性。但随着Cu/Ce 比进一步增大至9:1,甘油的转化率逐渐减小,说明继续增大Cu/Ce 比导致Cu-Ce 的协同作用减弱,从而导致催化活性降低,这与表征结果相一致。此外,结合上述XPS,CO2-TPD 和H2-TPR 表征分析可知,较高的Au0含量、较强的低温还原能力和合适的强碱性位点也是Au/CuO-CeO2-5:1 催化剂具有较高催化活性的原因。
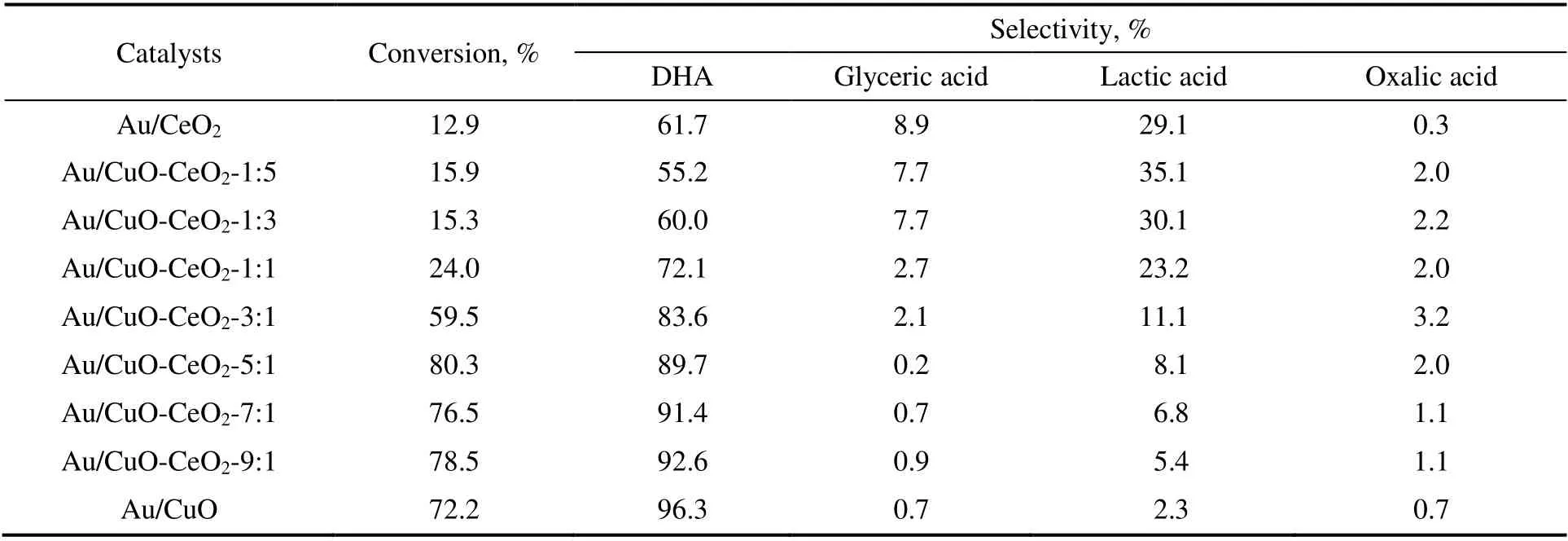
表2 不同Cu/Ce 比的Au/CuO-CeO2 催化剂无碱条件下催化氧化甘油性能Table 2 Catalytic performance of Au/CuO-CeO2 with different Cu/Ce ratios for glycerol to dihydroxyacetoneunder base-free condition
2.7.2 催化剂的循环反应
催化剂寿命是衡量催化剂的一项重要指标,采用Au/CuO-CeO2-5:1 催化剂进行循环反应,对每次反应后的催化剂进行过滤、水洗,于110 ℃鼓风干燥箱中干燥4 h,称量,保持反应温度为80 ℃,反应压力为1 MPa,反应时间为2 h,甘油与Au 物质的量之比为100 来重复上述反应,反应结果如图10 所示。循环前甘油转化率为80.3%,循环1 次后甘油转化率急剧降低至31.3%,随着循环次数继续增加至第5 次,最终甘油的转化率仅有3.1%。而循环次数对DHA 的选择性影响相对较小,从首次的89.7%降到66.7%,并且后3 次基本保持不变。
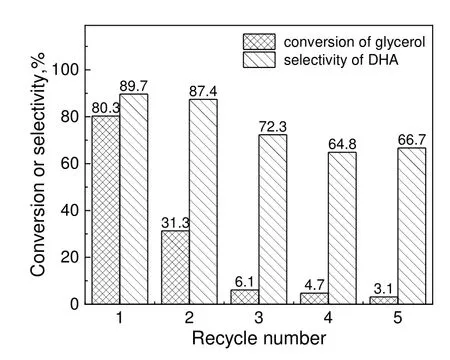
图10 Au/CuO-CeO2-5:1 催化剂循环反应性能Fig.10 Recycling performance of the Au/CuO-CeO2-5:1 catalyst
3 结 论
采用硬模板法,制备了一系列不同Cu/Ce 比的介孔CuO-CeO2复合氧化物,以此为载体,通过沉积沉淀法将Au 纳米颗粒负载到上述载体,采用低温N2-吸脱附、ICP-OES、XRD、TEM、XPS、CO2-TPD和H2-TPR 等表征手段系统地研究了催化剂的结构性质、形貌特征和活性组分化学态,并将其用于甘油催化氧化制备DHA 的反应体系,发现Cu/Ce 比对催化剂活性影响较大,主要是由于在不同Cu/Ce比下,载体结构发生明显的改变,导致催化剂中活性组分Au 与载体间、Cu 与Ce 之间的相互作用以及催化剂的结构存在差异,因此在催化反应中,表现出不同的催化活性。本实验中,当Cu/Ce 比为5:1 时,催化剂性能较好,无碱条件下甘油转化率为80.3%,产物DHA 的选择性为89.7%,但该催化剂的稳定性较差。
