丛枝菌根真菌对垂穗披碱草的生长发育和防御性酶活的影响
2023-01-03耿依仪张万通周华坤邓艳芳康海燕冶文哥邵新庆
耿依仪, 于 露, 张万通, 周华坤, 邓艳芳, 康海燕, 冶文哥, 邵新庆*
(1.中国农业大学草业科学与技术学院, 北京 100193; 2.中国科学院西北高原生物研究所青海省寒区恢复生态学重点实验室,青海 西宁 810001; 3.祁连山国家公园青海服务保障中心, 青海 西宁 810001; 4.青海省海北州祁连县峨堡镇畜牧兽医站,青海 海北 810400; 5.青海省海北州祁连县野牛沟林场边麻管护站, 青海 海北 810499)
近年来,过度放牧、全球变暖等外界因素导致青藏高原地区生态系统极度脆弱,草地资源严重退化,虫鼠灾害频发[1]。其中蝗虫作为影响牧场和农作物产量的主要害虫之一,对青藏高原地区的损害难以忽视[2]。因此,采取有效的措施来防范和治理蝗虫泛滥给青藏高原带来的危害成为了该地区退化草地修复和管理工作的重中之重[3]。目前最为广泛措施仍是化学防治和机械防治,但由于人力物力投资成本较多、防治效果较弱,以及无节制的化学农药施用导致有害生物抗性、再猖獗和农药残留[4],进一步促使人们开始聚焦于“环境友好型”的生物防治。为保证绿色农业的可持续发展及生态环境安全,利用微生物菌肥作为一种农药替代途径的生物防治技术逐渐成为研究热点[4]。
作为地球上较为古老的微生物,丛枝菌根真菌(Arbusculae mycorrhizal fungi,AMF)最先与陆生植物共生的菌群,在土壤中分布较广[5]。与绝大多数陆生植物的根系形成共生体后,AMF可以提高植物对养分的吸收能力,增强宿主植物对逆境的适应[6-7]。真菌通过根外菌丝帮助植物接触并获取土壤中活动性弱、迁移较缓的元素,以满足生长繁殖的需求。作为交换,宿主植物为AMF提供以脂肪酸和糖类物质为主要形式的碳水化合物,从而达到“真菌-植物”互利互惠的目的[4]。
AMF具有增强宿主植物对生物和非生物因素胁迫的抗性[8]。相关研究表明,4种不同AM真菌(球状巨孢囊霉,Gigasporamargarita;幼套球囊霉,Glomusetunicatum;根内球囊霉,Glomusintraradices;稍长无梗囊霉,Acaulosporalongula.)均诱导日本百脉根(Lotusjaponicus)酚类含量增加,抑制了二斑叶螨(Tetranychusurticae)的生长繁殖[9];2种AM真菌(摩西球囊霉,Glomusmosseae;根内球囊霉,Glomusintraradices)均通过诱导银中杨(Populusalba×P.berolinensis)体内产生更多的次生代谢物质,进而促进植物防御反应[10]。异形根孢囊霉(Rhizophagusirregularis)通过激活番茄(Solanumlycopersicum)体内的JA途径来降低棉贪夜蛾(Spodopteralittoralis)的生存率[11]。AM真菌(Glomusmosseae)能够明显增强垂穗披碱草对低温胁迫的耐受性的同时[12],还可显著促进其对有机氮吸收,进一步提高牧草品质和产量[13]。由于AMF的非特异性将同种和异种植物个体根系相连接后,与其他植株的菌根菌丝相互接触后形成菌丝网络结构(Common mycelial network,CMN)[14],从而为防御性物质的传递搭建了防御通路[8]。菌丝直径较细,能够延伸并接触到植物根系无法达到的土壤区域,拓宽植物吸收额外养分的面积,促进其营养吸收[15]。
垂穗披碱草(ElymusnutansGriseb) 作为青藏高原地区的优良牧草,属疏丛型的禾本科牧草,抗寒耐寒性强,营养丰富、适口性好、产量高和耐贫瘠等优点[1,3,16],还可防风固沙、保持水土并加速草地生态恢复进程[17],有效降低自然灾害带来的经济损失。老芒麦(ElymussibiricusLinn.)具备高产优质、抗旱耐寒和较强的适应性等较为优良特性,已经逐渐成为青藏高原地区的主要栽培草种之一[18]。
目前国内外研究多聚焦在丛枝菌根真菌对植物的抗寒抗旱等抗逆性方面[5,14-15],但对于AM真菌-草本植物共生情况下如何防御虫害损伤这一领域仍存在局限性。本研究拟以垂穗披碱草和老芒麦为研究对象,通过室内盆栽试验开展AMF在披碱草属植物间协同抗虫防御机制研究,以分析AMF对两种草本植物的生长发育及化学防御的影响。
1 材料与方法
1.1 试验材料准备
1.1.1基质处理 试验基质土壤取自青海省海北藏族自治州青藏高原高寒草甸,将其过2 mm筛,移除较大石块后,用高温高压蒸汽灭菌锅湿热以消除土壤中的真菌孢子(121℃,2 h)。试验土壤基本理化性质如下:土壤pH值为8.2,总氮含量为4.1 g·kg-1,总碳含量为40 g·kg-1,总磷含量为0.69 g·kg-1。
1.1.2牧草种子 垂穗披碱草和老芒麦种子收集于青海省海北藏族自治州海晏县西海镇的天然高寒草甸。选取健康、无病虫害的垂穗披碱草和老芒麦种子,用8%的过氧化氢溶液消毒10 min后用无菌水冲洗三次后置于培养箱中催芽[19]。
1.1.3供试昆虫 供试昆虫东亚飞蝗(Locustamigratoriamanilensis,Fm)由中国农业大学植保系害虫生防室提供。试验前将蝗虫置于25℃的培养室(温度为28℃~30℃,湿度为65%~70 %,光照条件为16 h/8 h (白天/黑夜)中进行培养,每天早晚以新鲜的小麦叶片进行饲喂至五龄待用。
1.1.4供试菌种 供试菌种为丛枝菌根真菌摩西管柄囊霉(Funneliformismosseae),来源于北京市农林科学院,由贵州农业科学院扩繁。接种剂中含有真菌孢子、菌根侵染根段,且孢子个数约为129个·g-1。
1.2 试验设计
本研究试验装置如下图1所示,共设置5组处理,分别为处理A:供体与受体植物间放置35 μm尼龙网;处理B:供体与受体间用0.5 μm尼龙网阻隔;处理C:供体与受体间用35 μm尼龙网阻隔,虫咬前旋转;处理D:供体与受体间无任何尼龙网阻隔;处理E:供体与受体间无任何阻隔(除E组外,其余各组处理供体植物均接种AMF),具体处理如表1所示。待种子发芽长度至2 cm左右时,将长势一致的垂穗披碱草和老芒麦种苗分别移栽至盛有2.5 kg灭菌过的土壤基质的方形花盆中(长20 cm×宽12 cm×高15 cm)。待移苗30天后,进行接种处理,其中Fm菌土20 g(对照组为已灭菌过的Fm菌土20 g)。垂穗披碱草的种苗移栽至花盆左侧作为供体,并对其接菌,老芒麦的种苗移栽至花盆右侧作为受体。每个花盆内维持供体和受体植株分别50株。将所有花盆随机放置于温室(温度为25℃~28℃,湿度为(25±3)%,光照条件为12 h∶12 h (白天∶黑夜))内培养。

表1 实验分组、处理与目的Table1 Experimental groups,treatments and aims
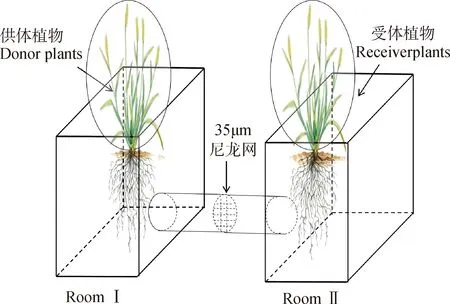
图1 试验装置示意图Fig.1 Schematic diagram of experimental device
每隔3天随机调整花盆摆放位置。同时为避免植物在被昆虫采食后所释放的挥发性物质给实验结果带来的影响,选用聚乙烯袋(110 cm×111 cm,高温高强光下挥发物释放量较低)将供受体植物的地上部分分别严密包裹。
1.2.1虫咬处理 待接菌后30天,在左侧供体室释放5只五龄蝗虫进行24 h的采食实验。昆虫采食前进行饥饿处理2 h。
1.3 测定方法
1.3.1AMF菌丝定殖率的测定 收获垂穗披碱草和老芒麦的根系各1.0 g,并将其剪成1~2 cm长的根段,将根段浸没在10%KOH溶液中沸水浴 30 min后,用蒸馏水冲洗,置于2%的HCI中浸泡20 min。去除HCI后用蒸馏水冲洗后,用0.05%的台盼蓝染液在80℃水浴条件下染色20 min。待染色结束后去除染液,用蒸馏水冲洗干净后置于50%脱色液中甘油∶水=1∶1)脱色。脱色1~2 d后随机挑选根段制作样品片,每个载玻片共压制15个根段,每个处理设置3个重复。在40X显微镜下观察AMF定殖情况[8]。
1.3.2植物地上、地下生物量和碳氮磷含量的测定 将植物地上和地下部分分别收集后,于65℃条件下烘干72 h至恒重后,称量其干重[16]。用球磨仪(德国,Retsch MM400)将植物样品粉碎,取0.1 g样品用元素分析仪(德国,Elementar Vario MICRO CUBE)测定植株全氮、全碳[20]。
1.3.3防御酶活性的测定 待蝗虫采食叶片24 h后,收集植物叶片进行防御性酶活测定。分别采用北京索莱宝科技有限公司的植物多酚氧化酶(Polyphenol oxidase,PPO)、脂氧合酶(Lipoxygenase,LOX)、苯丙氨酸解氨酶(Phenylalnine ammonia-lyase,PAL)和β-1,3葡聚糖酶(β-1,3-Glucanase)活性检测试剂盒测定多酚氧化酶(PPO)、脂氧合酶(LOX)、苯丙氨酸解氨酶(PAL)和β-1,3葡聚糖酶(β-1,3-Glucanase)活性。
1.4 数据统计与处理
用SPSS软件对AMF定殖率、植物碳氮磷含量、四种防御酶等数据进行处理,采用单因素方差分析(ANOVA)进行数据分析,采用Pearson’s analysis进行植物各指标间的相关分析,显著水平为0.05。用Origin 2018 软件作图。
2 结果与分析
2.1 菌根定殖率和地上地下生物量
各处理下的供体植物的菌根定殖率无显著差异(图2),处于10.26%~19.44%;由于A处理设有0.5 μm尼龙网,导致受体植物菌根定殖率大大减少,为1.14%,与各处理组的菌根定殖率有显著差异(P<0.05)。
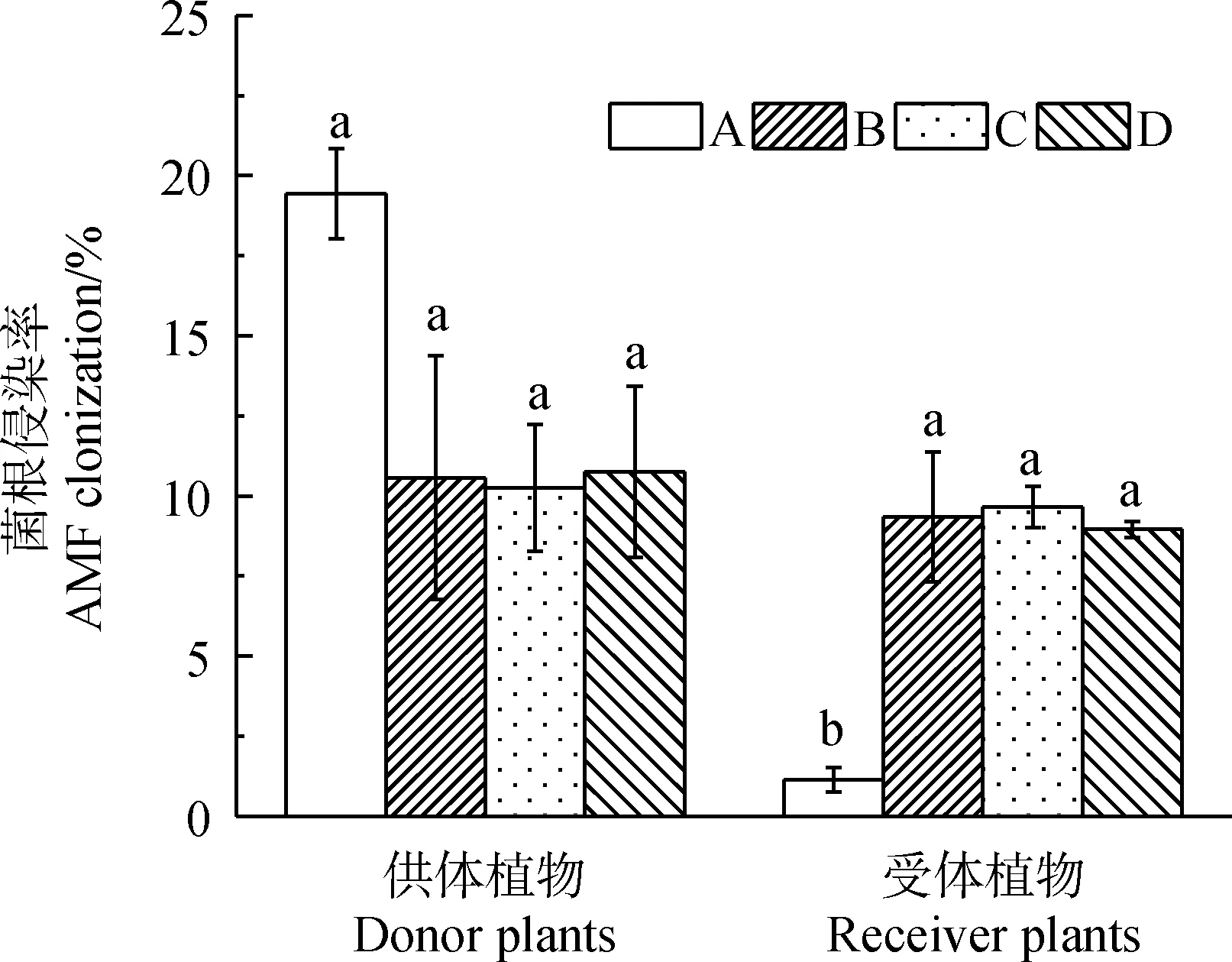
图2 不同处理下供体和受体菌根定殖率情况Fig.2 AMF colonization of donor and receiver plants under different treatments注:平均值±标准误;不同小写字母分别代表在0.05水平差异显著,n=3,下同Note:Mean±SE. Different lowercases letters indicate significant difference at the 0.05 level,n=3,the same as below
各处理的地上生物量无显著差异(图3a)。未接菌的E组下供受体植物的地下生物量均较少,分别为1.88 g和2.39 g;AMF接种处理中,A,C处理下供受体植物的生物量相对较多;其中C处理下的供受体植物的地下生物量最高,分别为3.44 g和0.92 g。
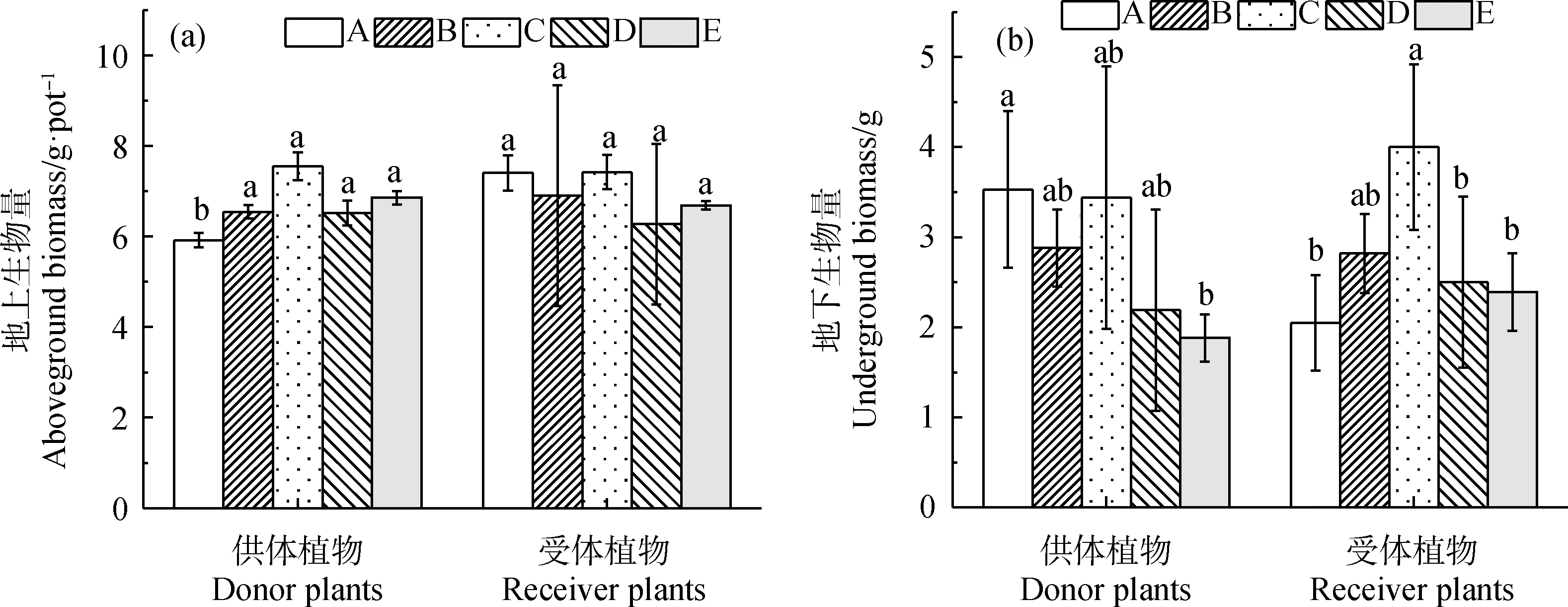
图3 不同处理下供体和受体地上(a)和地下生物量(b)变化情况Fig.3 Aboveground and belowground biomass of donor and receiver plants under different treatments注:平均值±标准误;不同小写字母分别代表在0.05水平差异显著,n=3,下同Note:Mean±SE. Different lowercases letters indicate significant difference at the 0.05 level,n=3,the same as below
2.2 植物碳、氮含量情况
E组供、受体植物的总碳含量分别为40.21%,40.18%,均略高于其他各组(图4a);AMF接种处理下的C,D两组的供、受体植物的总碳含量均无显著差异。
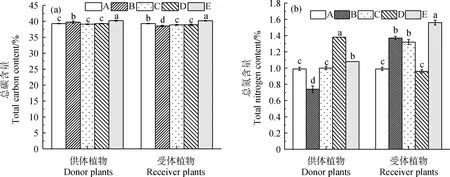
图4 不同处理下供体和受体叶片碳氮含量变化情况Fig.4 Leaf carbon and nitrogen content of donor and receiver plants under different treatments注:平均值±标准误;不同小写字母分别代表在0.05水平差异显著,n=3,下同Note:Mean±SE. Different lowercases letters indicate significant difference at the 0.05 level,n=3,the same as below
不同处理下供、受体植物的总氮含量差异较大(图4b)。对于受体植物,E组总氮含量最高为1.56%;其次是B,C两组,且B组略高于C组,但无显著差异;A,D两组受体植物总氮含量最低且无显著差异。对于供体植物,D组总氮含量最高为1.38%;E组次之;B组总氮含量最低,为0.74%;A,C两组总氮含量无显著差异。
2.3 防御酶活性
由图5可知,菌丝网络是否存在对受体植物防御酶活性高低有重要影响。供体植物的苯丙氨酸解氨酶(PAL)活性均显著高于未接种AMF真菌的E组。有菌丝网络存在的D组供受体植物的多酚氧化酶(PPO)活最高,分别是609.06 U· g-1FW和405.75 U·g-1FW;E组未接种AMF真菌,PPO酶活最低。
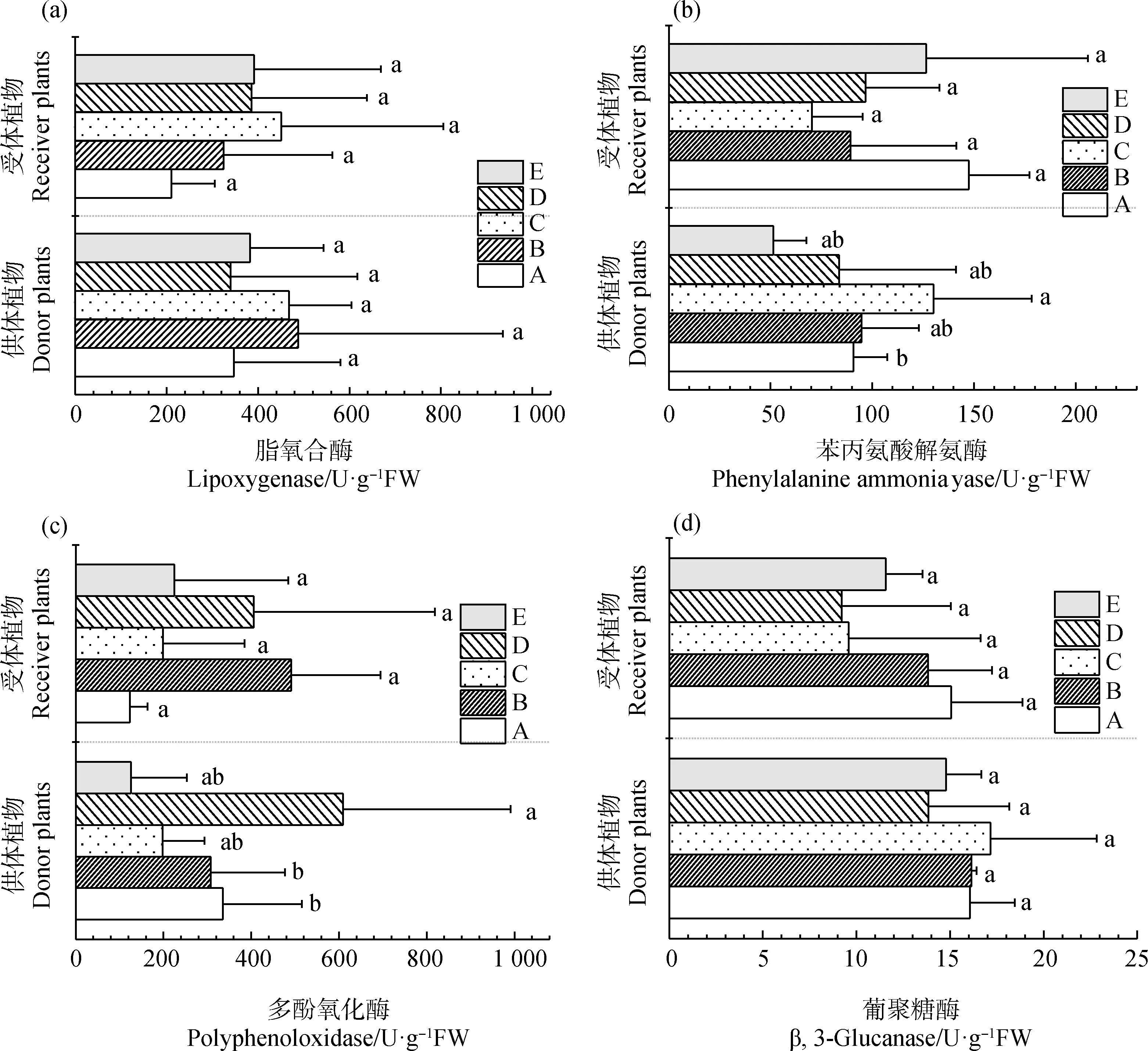
图5 不同处理下防御性酶活性变化Fig.5 The changes of defenses enzymes in donor and receiver plants under different treatments注:平均值±标准误;不同小写字母分别代表在0.05水平差异显著,n=3,下同Note:Mean±SE. Different lowercases letters indicate significant difference at the 0.05 level,n=3,the same as below
2.4 菌根定殖下供体和受体植物各指标间的相关分析
对于供体植物而言(表2),地上生物量和地下生物量呈极显著正相关性(P<0.01);脂氧合酶与地下生物量、地下生物量呈显著负相关性(P<0.05)。对于受体植物而言(表3),地上生物量和地下生物量呈极显著正相关性(P<0.01);苯丙氨酸解氨酶与地上生物量和地下生物量呈极显著正相关性(P<0.01);植物碳含量与菌根定殖率、脂氧合酶呈显著负相关性(P<0.05),与植物总氮含量呈极显著负相关性(P<0.01)。
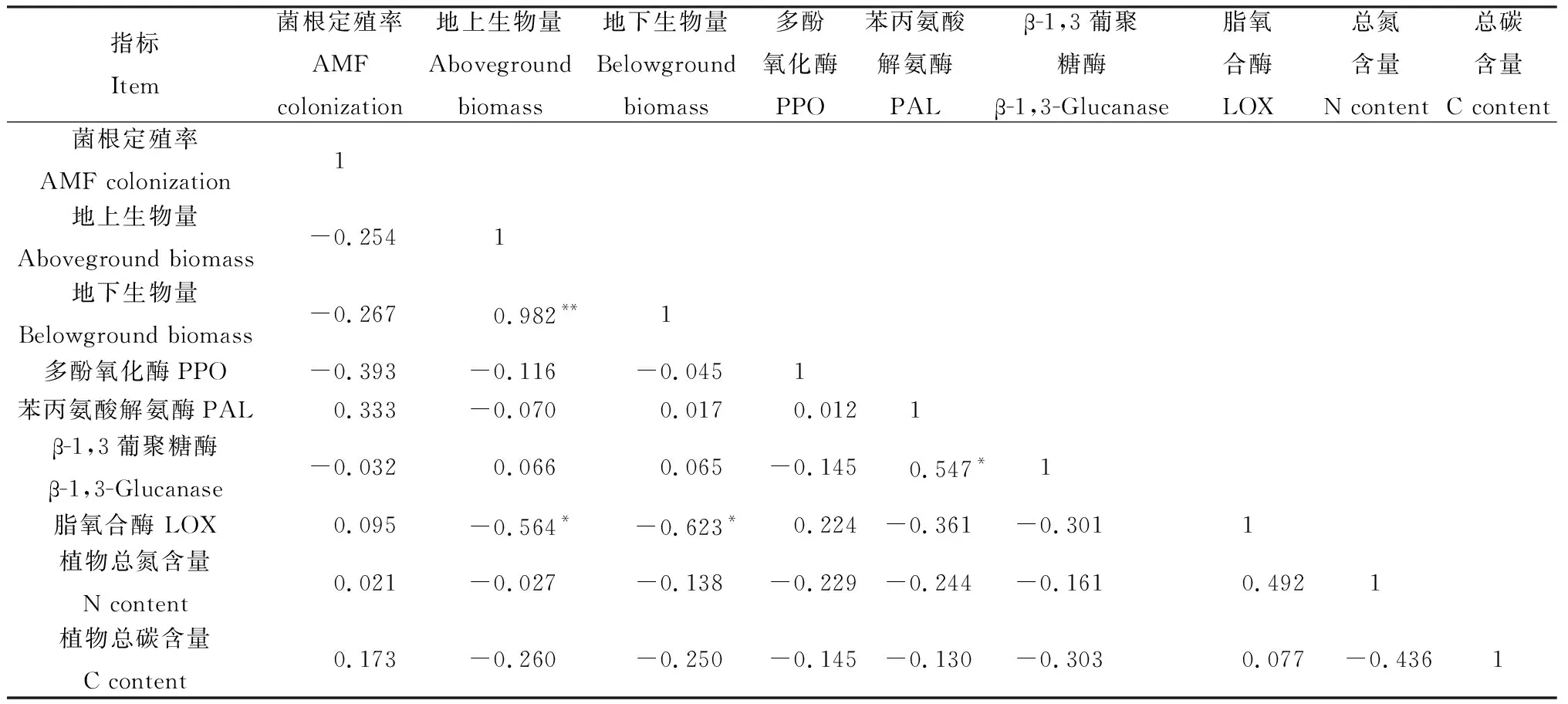
表2 供体植物各指标间的相关性分析Table 2 Correlation between indicators of donor plants
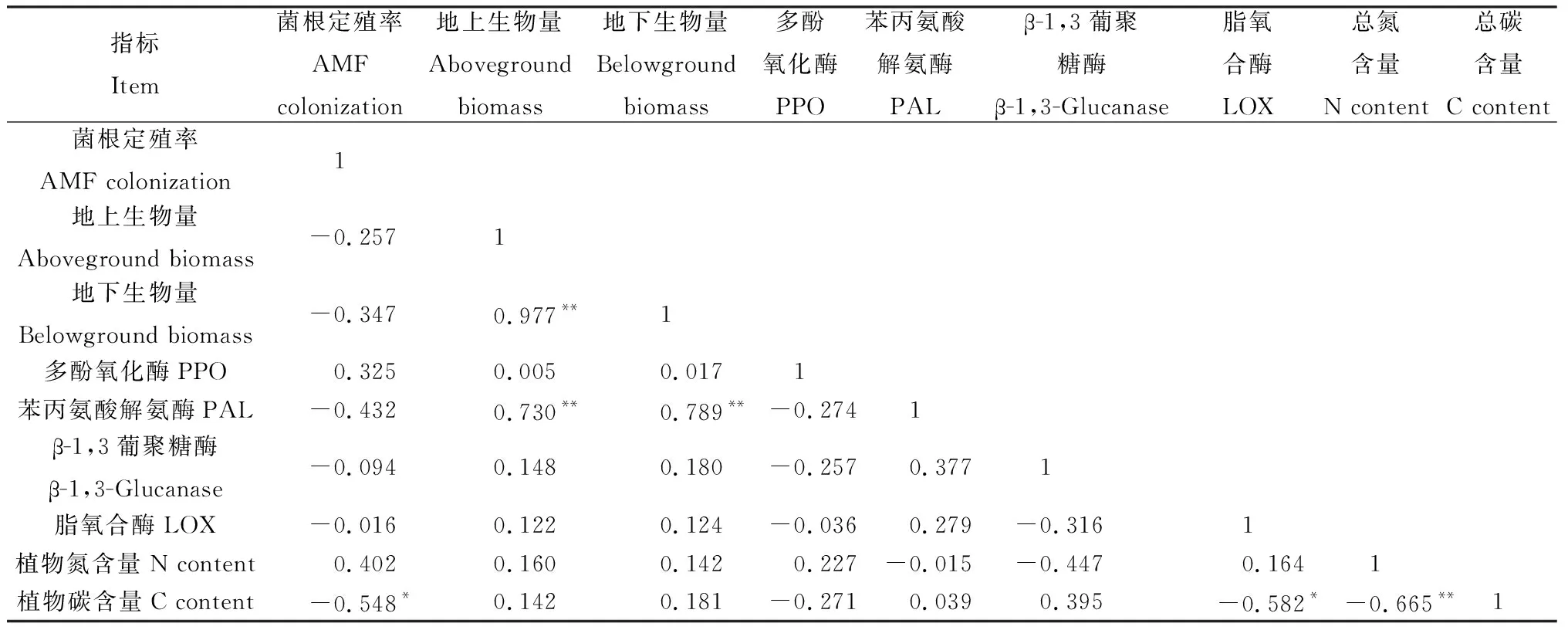
表3 受体植物各指标间的相关性分析Table 3 Correlation between each indicator of receiver plants
3 讨论
3.1 AMF真菌对宿主植物体营养吸收的影响
3.2 AMF真菌对宿主植物体内防御酶活性的影响
AMF不仅可以提高植物对养分和水分的利用效率,而且可以提高植物对非生物和生物环境胁迫的抵抗能力。当植物体遭遇逆境胁迫时,在自身进行防御反应的同时也会向外界释放出一系列的化学信号来提醒周围环境中的其他植物提前做好抵御逆境的准备[28-29]。水杨酸(SA)、茉莉酸(JA)作为参与植物抵抗生物胁迫的两种关键信号物质,在植物免疫反应中起到至关重要的作用[28]。多酚氧化酶、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)、脂氧合酶(LOX)、β-1,3葡聚糖酶(β-1,3-Glucanase)等酶直接参与植物防御保护相关的次生代谢产物的生成过程,其酶活性的升高与宿主植物的防御抗性密不可分[30-31]。苯丙氨酸解氨酶(PAL)作为植物体苯丙烷类代谢的起始酶,与多酚氧化酶(PPO)均是合成SA过程的重要关键酶;脂氧合酶,β-1,3-葡聚糖酶则涉及SA和JA防御途径[32]。相较于未接菌处理,接种AMF的供体植物体内的PPO,LOX,PAL和β-1,3-葡聚糖酶活性显著上升,主要在于AM真菌能够诱导植物脂氧合酶基因表达,启动JA途径、苯丙烷类代谢途径[33-35],说明AMF诱导并增强植物系统防御反应。对于受体植物而言,菌丝网络传递了信号物质,使得受体植物体内酶活性均上升,且程度不同,说明菌丝网络的存在可以加快防御信号的传递,使植物体更快速地做出防御反应。而不同植物间的差异,使得宿主植物对胁迫的响应有所不同。此外,我们发现除了PAL和β-1,3-葡聚糖酶外,B,C处理组受体植物的酶活性高于无菌丝连接组,主要因为菌丝网络被破坏或阻隔后,植物间信号传递受阻,难以为邻近植物传输防御信号物质,这体现了菌丝网络作为植物信号传递的途径的重要性。
4 结论
丛枝菌根真菌不仅能够有效提高植物防御能力,与植物共生后形成的菌丝网络还可促进邻近植物生长及传递防御信号物质。综合来看,丛枝菌根真菌能够有效提高青藏高原地区垂穗披碱草的保护和生产。作为主要的生物防治手段,丛枝菌根真菌在替代化学农药的使用方面具有一定的潜力。
