基于三维斑点追踪成像技术评价高海拔地区心房颤动患者左心房结构和功能的变化
2023-01-03牛小虎王亮邦杨琪杨良瑞
牛小虎,王亮邦,杨琪,杨良瑞
心房颤动(房颤,AF),是临床发病较高的心律失常类型,来自于心肌细胞纤维化引发的左心房重构,可增加患者发生卒中、心源性猝死风险[1]。随着研究进展,对AF发病机制及结构功能变化的认识不断提高,但不同地区间仍存在一定差异[2]。左心房结构和功能评估在AF患者病情监测和预后评估中具有重要意义。超声心动图是临床评价患者左房结构和功能的常用方法,AF发作时左房收缩功能丧失、心动周期长期变异性增大,超声心动图评估此时左房结构和功能受较多因素影响[3,4]。三维斑点追踪成像(3D-STI)技术是研究心脏病变的新技术,能提供多种新的形变参数来对心肌功能行定量评估,有效反映心肌细胞的结构及功能变化[5]。青海省心脑血管病专科医院地处高原地区,研究高海拔地区AF患者左心房结构与功能变化特点对提高本地区AF治疗水平具有重要价值。本文以我院收治的249例AF患者为研究对象,探究3D-STI评价AF患者左心房结构及功能变化特点,以期为临床诊疗提供参考。
1 资料与方法
1.1 研究对象回顾性分析2017年1月至2020年12月于青海省心脑血管病专科医院收治的行AF导管消融手术的高海拔地区AF患者249例,纳入标准:符合2019年美国心脏协会/美国心脏病学学会/心律学会(AHA/ACC/HRS)提供的AF患者管理指南中的诊断标准[6];年龄≥18岁。排除标准:存在先天性心脏病、心脏瓣膜疾病、心肌病等心脏疾病;既往存在射频消融史、植入起搏器或其他心脏手术病史;合并严重肝肾疾病、肺病、甲亢、电解质紊乱等。入选者按AF类型[6]分为阵发组(阵发性AF,n=116)和持续组(持续性AF,n=133)。阵发性AF:发作持续时间低于7 d,为自限性发作或经干预后终止发作;持续性AF:发作时间持续7 d及以上。另选取同期我院健康体检者105例为对照组,经询问病史、生化检测、体格检查、心电图、心脏超声检查证实无心血管或其他系统疾病。
1.2 方法收集受试者临床资料,包括性别、年龄、体质指数(BMI)、合并基础代谢疾病、心率(HR)、常规及三维超声检查结果等。采用彩色多普勒超声仪(飞利浦EPIQ 7C型)检查,受试者取左侧卧位或仰卧位,稳定呼吸后同步连接心电图,采用S5-1探头检测左心房前后径(LAD)、左室射血分数(LVEF)、二尖瓣舒张早期及晚期峰值流速(E及A),二尖瓣环室间隔及侧壁舒张早期峰值速度均值e',计算E/A和E/e'。将探头切换为X5-1,选择实时三维超声全容积模式,采集阵发组和对照组心尖四腔心切面中3个连续心动周期图像,持续组采集3个连续RR间期图像,导入工作站,软件自动描绘心内膜边界,避开左心耳和肺静脉入口,如有异常可人工矫正,在时间-左房容积曲线上测量左房容积,并经体表面积校正为左房容积指数,包括最大容积指数(LAVImax)、最小容积指数(LAVImin)、收缩前容积指数(LAVIp)、左房主动排空容积指数(LAVIa),并计算左房总射血分数(LATEF)=(LAVImax-LAVImin)/ LAVImax;左房扩张指数(LAEI)=(LAVImax-LAVImin)/LAVImin;左房被动射血分数(LAPEF)=(LAVImax-LAVIp)/LAVImax;左房主动射血分数(L A A E F)=(L A V I p-LAVImin)/LAVIp。同时取左房应变曲线(图1)。测得左心房整体径向、纵向、圆周、面积应变(GRS,GLS,GCS,GAS),计算左房僵硬度(LASt)=E/(e'×GLS)。比较各组一般临床资料、常规超声检查及3D-STI参数差异,分析LASt与左房功能、整体应变关系。

图1 各组左心房心肌应变情况
1.3 统计方法采用SPSS 22.0软件包分析数据,符合正态分布计量资料如HR、常规超声指标、3D-STI参数以(±s)表示,组间比较行t检验;计数资料以(n,%)表示,组间比较行χ2检验;相关性分析采用Spearman秩相关性。P<0.05为差异有统计学意义。
2 结果
2.1 各组一般临床资料比较各组性别、年龄、BMI、合并高血压、糖尿病概率比较无显著差异(P>0.05),持续组HR高于阵发组和对照组(P<0.05),而阵发组与对照组HR比较无明显差异(P>0.05),表1。

表1 各组一般临床资料比较
2.2 常规超声指标比较持续组LAD、E、E/e'高于阵发组和对照组,且阵发组高于对照组(P<0.05),各组LVEF、A、E/A、e'比较无明显差异(P>0.05),表2。

表2 各组常规超声指标比较
2.3 各组3D-STI参数及LASt比较持续组LAVI max、LAVImin、LASt高于阵发组和对照组,且阵发组高于对照组(P<0.05),持续组LATEF、LAEI、GLS、GCS、GRS、GAS低于阵发组和对照组,且阵发组低于对照组(P<0.05),持续组、阵发组LAVIa高于对照组,LAVIp、LAAEF、LAPEF低于对照组(P<0.05),表3。
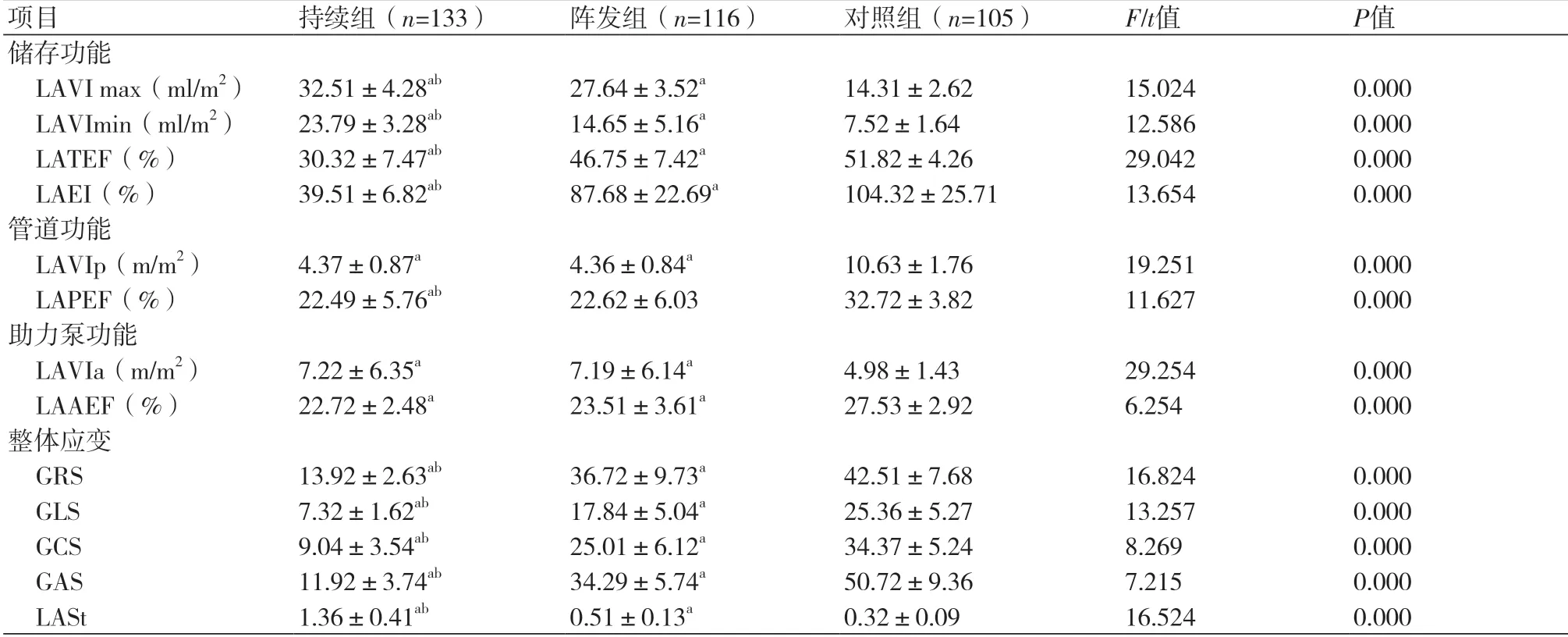
表3 各组3D-STI参数及LASt比较
2.4 LASt与左房结构、功能参数相关性Pearson相关性分析显示:LASt与LAVImax、LAVImin呈正相关(r=0.408、0.534,P<0.001),与LATEF、LAEI、GRS、GLS、GCS、GAS呈负相关(r=-0.416、-0.427、-0.502、-0.379、 -0.420、-0.363,P<0.001),与LAVIp、LAPEF、LAVIa、LAAEF无明显相关性(P>0.05),表4。

表4 LASt与3D-STI参数相关性
3 讨论
AF发作时由于各心动周期变异性大,常需测量10~20个心动周期进行分析,准确度和可重复性差[7]。而心肌纤维独有的走形方式容易使心脏产生较复杂的三维运动,既往使用的二维斑点追踪(2D-STI)受限于二维平面所引发的斑点逃逸,需在不同心动周期、多个切面分别测量,此采集方式易受多种因素影响,结果不可靠[8]。3D-STI是在实时三维超声心动图和2D-STI基础上发展起来的无创超声检测技术,仅需1个心尖四腔切面即可同时分析所有节段,能从整体到局部为心肌结构和功能变化提供更准确的定量参数,目前已应用于多种心血管疾病的诊断和治疗[9,-11]。
本研究采用3D-STI检测高海拔地区AF患者左心房结构和功能变化,结果显示,与正常人群相比,AF患者存在明显左房僵硬度增加,其存储、管道、辅泵功能及应变降低,且持续性AF患者表现较阵发性AF患者更为明显。AF患者常伴随心肌功能异常,其中心房肌的三维整体径向、纵向、圆周、面积应变能有效反映心室舒张末期到收缩末期的结构变化,反映心房储存功能[12,13]。相关研究显示,AF患者较正常人群左房心肌16节段径向、纵向应变降低,且持续性AF患者降低更明显[14]。本研究中AF患者GLS、GCS、GRS、GAS均较对照组减低,且持续性AF更明显,可能与AF发生后患者心肌纤维发生重构、形变能力降低、心房正常功能发生障碍有关。而AF患者LAVImax、LAVIminLATEF、LAEI、LAVIa升高,LAVIp、LAAEF、LAPEF降低提示其出现左房储存、辅泵及管道功能的降低,与Tang等[15]研究一致。左房的心肌纤维化是AF患者发生心房重构的基础,在AF发作和症状维持中起到重要作用[16]。临床主要依靠LASt来评价左房纤维化情况,从而反映AF病变程度[17]。既往研究多采用左房压与舒张晚期左房平均峰值应变的比值来反映LASt变化,但此操作需房间隔穿刺,作为有创性检查部分患者接受度较低[18,19]。本次采用E/(e'×GLS)比值来表示LASt,结果显示,持续性AF患者左房心肌纤维化程度和僵硬度更严重。Pearson相关性分析显示,LASt与LAVImax、LAVImin呈正相关,与LATEF、LAEI、GLS、GCS、GRS、GAS呈负相关,提示AF患者心房肌僵硬度越重,心肌整体应变力越差。可能与持续性AF患者心肌细胞受损更为严重、肌节延长使细胞基质和胶原蛋白产生增加,导致心房扩张、心肌纤维化和重构的发生,造成心房僵硬度的增加[20]。而持续性AF患者LAD、E、E/e'更高也证实了这点。此外,左心室充盈压过高和舒张功能不足也会造成LASt升高,出现心肌功能障碍。
综上所述,高海拔地区AF患者存在左房僵硬度增加及储存、管道、辅泵功能降低特点,且左房僵硬度与其功能变化有关,运用3D-STI技术能有效评价AF患者左心房结构和功能变化,为临床心血管诊断和治疗提供参考。本研究不足之处在于:①三维应变参数的测量可能会受到左心房心肌较薄的影响;②三维超声在时间上分辨力较低,测量上存在一定误差,具体情况有待多次测量从而更准确评价。
