艾叶油治疗慢性支气管炎的实验研究
2023-01-03刘泱泱
刘泱泱
艾叶是菊科艾藁的干燥叶,中医认为其可散寒止痛、温经止血[1]。民间还用其治疗湿疹、出血、痛经及多种慢性病,如骨关节炎、哮喘、胃肠疾病和失眠等。艾叶具有多种药理活性,包括抗炎、抗菌、镇痛、抗病毒、抗氧化、抗肿瘤和免疫调节效果。慢性支气管炎是指气管、支气管黏膜及其周围组织的慢性非特异性炎症,是一种严重危害人类健康的常见病[2]。艾叶是一种传统的草药,最近的研究揭示了该植物提取物中的成分具有抗炎作用[3]。尽管很多科研人员已经深入研究了蒿属植物的抗炎活性,也分离出了几种抗炎化合物,但是没有多少实质性证据支持这种草药的抗炎性能,此外因现阶段对其作用机制仍然不清楚,限制了其在临床实践中的应用[3-6]。因此,本研究旨在评估艾叶油的抗炎潜力,基于艾叶油的体外抑菌、镇咳、祛痰及平喘实验,探究艾叶油对慢性支气管炎的治疗效果,并基于临床数据,分析艾叶油治疗慢性支气管炎的治疗效果作。
1 材料与方法
1.1 实验药品艾叶油。
1.2 菌株 大肠杆菌、金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌、甲型溶血性链球菌、流感杆菌。
1.3 动物 125 只昆明种健康小鼠,雌雄各半,体重16~24 g;80 只健康大鼠,雌雄各半,体重200~250 g。
1.4 主要仪器设备 气相色谱-质谱联用仪(Gas chromatography-mass spectroscopy,GC-MS);超净工作台;细菌培养箱;721 型分光光度仪;402 型超声雾化器;人工呼吸机(DH-140);微压测定仪;二氧化硫(SO2)刺激装置。
1.5 方法
1.5.1 艾叶油GC-MS 分析实验 用Clevenger 仪器按照说明书提取艾草油。随后将得到的油用无水硫酸钠干燥,密封并在制冷下置于黑暗中直至使用。在具有TR-5MS 毛细管柱(30 m×0.2 mm×0.25 μm,Thermo,USA)的GC-MS(Thermo Trace GC Ultra-ISQ 质谱仪)上进行精油的GC/MS 分析,电子冲击模式(电离能量:70 eV),相关数据被记录在全扫描采集模式中,范围为M/Z 40~500。载气为氦,流速1.0 ml/min。以1∶20 的分裂比进行分裂注射(1 μl),注射器温度设定在260℃。质谱仪的离子源温度为200℃。温度程序<60℃开始,在该温度下留在2 min,并在5℃/min 的5℃至170℃下加热2 min,然后将20℃/min 达到250℃并保持2 min。通过将分析物的质谱与NIST 和WIley 图书馆的真实标准进行比较来鉴定艾叶油化合物。
1.5.2 体外抑菌、杀菌实验 选择临床5 种常见菌。采用标准微量肉汤稀释法稀释艾叶油和双黄连口服液,确定最小抑菌浓度(minimal inhibit concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.5.3 艾叶油的镇咳、祛痰、平喘等药理实验
1.5.3.1 枸橼酸喷雾引咳法 预实验:取健康小鼠75 只,雌雄各半,将小鼠放置于5 L 密闭的玻璃实验测试箱内,用超声雾化器喷入17.5%枸橼酸溶液的雾化气体60 s,剔除喷雾后 2 min 不咳的小鼠,休息2 d 后用于正式实验。将小鼠随机分为A 组 (生理盐水对照),B 组(中药急支糖浆阳性对照) 和C1 组(艾叶油低剂量)、C2 阻(艾叶油中剂量)、C3 (艾叶油高剂量),每组15 只。连续灌胃给药,同上法对小鼠进行引咳实验,记录小鼠咳嗽潜伏期时间结果。
1.5.3.2 气道酚红排泄法 另选取50 例健康小鼠,随机分为D 组 (鲜竹沥口服液)、E 组(生理盐水对照) 及F1 组(艾叶油低剂量)、F2 组(艾叶油中剂量)、F3 组(艾叶油高剂量),每组10 只。每组各灌胃给药 1 次,第2 天给药30 min 后,腹腔注射 0.25%苯酚红溶液,用5%碳酸氢钠溶液反复冲洗气管,收集冲洗液,利用721 分光光度计,测量吸光度(波长546 nm),计算酚红浓度。
1.5.3.3 平喘实验 选取80 只大鼠,构造慢性支气管炎大鼠实验模型,测定模型大鼠的支气管平滑肌张力。将组织胺注射入大鼠的颈静脉,收缩支气管,升高溢流压力,致使气喘效果。选择固本平喘片作为对照。将大鼠随机分成慢性支气管炎模型组、艾叶油低剂量组(150 mg/kg)、艾叶油大剂量组 (300 mg/kg)、实验对照固本咳喘片组(160 mg/kg),每组20 只[4]。
1.6 观察指标 分析艾叶油GC-MS 结果、艾叶油体外抑菌试验结果(液体试管法);比较A 组、B 组、C1 组、C2 组、C3 组小鼠咳嗽潜伏期;比较E 组、D 组、F1组、F2 组、F3 组小鼠酚红排泄量;比较慢性支气管炎模型组、艾叶油低剂量组、艾叶油大剂量组、实验对照固本咳喘片组大鼠肺溢流压力及注射组织胺后溢流压力变化。
1.7 统计学方法 采用SPSS19.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示,采用t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 艾叶油GC-MS 结果分析 见表1。
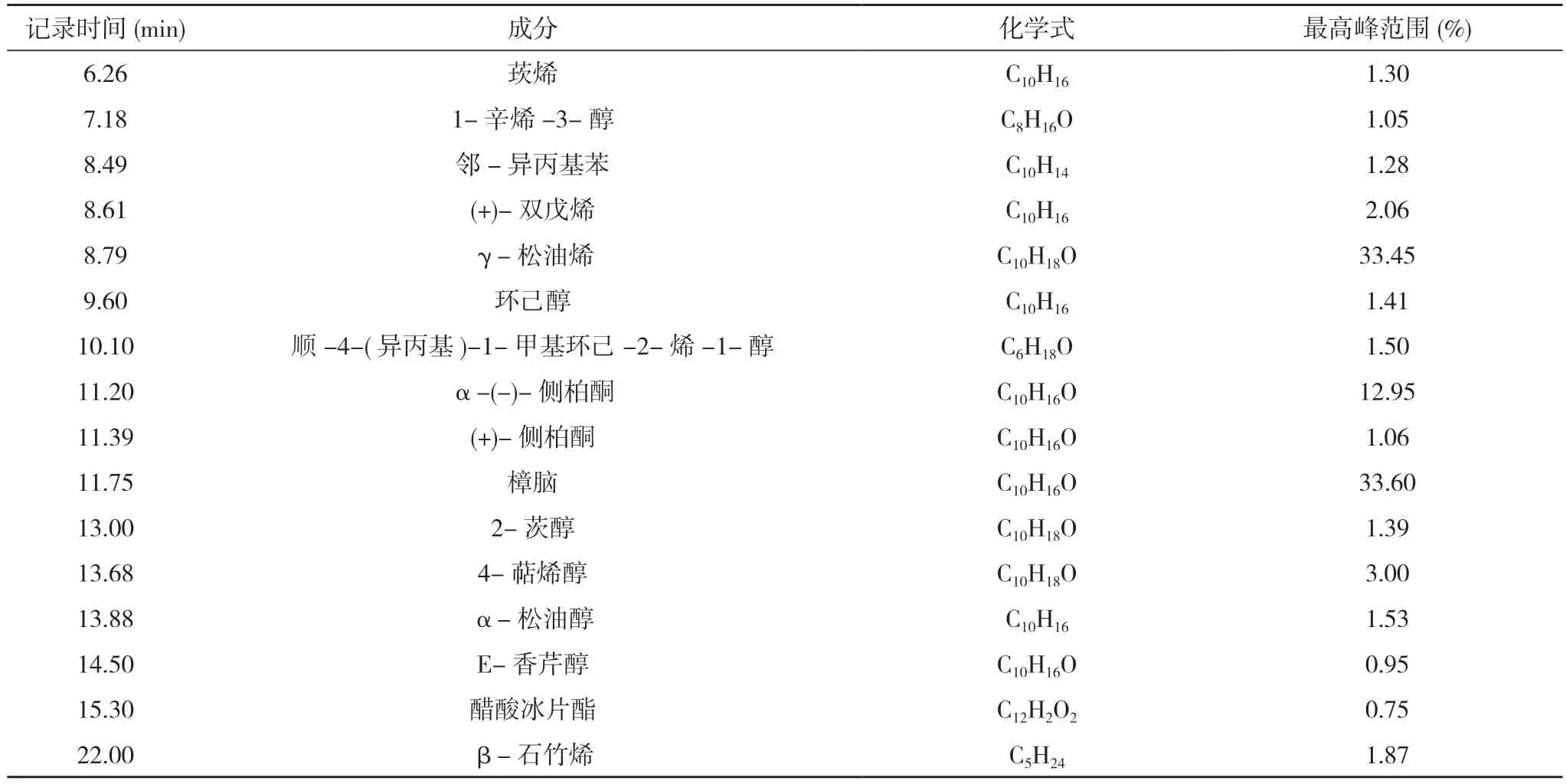
表1 艾叶油GC-MS 结果分析
2.2 艾叶油体外抑菌实验(液体试验法)结果分析见表2。

表2 艾叶油体外抑菌实验(液体试管法)结果分析
2.3 A 组、B 组、C1 组、C2 组、C3 组小鼠咳嗽潜伏期比较 艾叶油的止咳实验结果表明:艾叶油各组咳嗽潜伏期均明显延长,且一定程度上呈剂量依赖性,B 组、C1 组、C2 组、C3 组咳嗽潜伏期分别为(51.79±18.61)、(44.14±7.99)、(57.60±7.82)、(62.98±23.47)min,均长于A 组的(18.79±9.43)min,差异具有统计学意义(P<0.05);B 组与C1 组、C2 组、C3 组咳嗽潜伏期比较,差异均无统计学意义(P>0.05)。见表3。
表3 A 组、B 组、C1 组、C2 组、C3 组小鼠咳嗽潜伏期比较(±s)

表3 A 组、B 组、C1 组、C2 组、C3 组小鼠咳嗽潜伏期比较(±s)
注:与A 组比较,aP<0.05
2.4 E 组、D 组、F1 组、F2 组、F3 组小鼠酚红排泄量比较 艾叶油的祛痰实验结果表明:各组小鼠气道酚红排泄量均增加,且一定程度上呈剂量依赖性。D组、F1 组、F2 组、F3 组酚红排泄量均高于E 组,差异均具有统计学意义(P<0.05);D 组与F1 组、F2 组、F3组酚红排泄量比较,差异无统计学意义(P>0.05)。见表4。
表4 E 组、D 组、F1 组、F2 组、F3 组小鼠酚红排泄量比较(±s)

表4 E 组、D 组、F1 组、F2 组、F3 组小鼠酚红排泄量比较(±s)
注:与E 组比较,aP<0.05
2.5 慢性支气管炎模型组、艾叶油低剂量组、艾叶油大剂量组、实验对照固本咳喘片组大鼠肺溢流压力及注射组织胺后溢流压力变化比较 艾叶油低剂量组、艾叶油大剂量组肺溢流压力均低于慢性支气管炎模型组和实验对照固本咳喘片组,差异均具有统计学意义(P<0.05);慢性支气管炎模型组与实验对照固本咳喘片组肺溢流压力比较及艾叶油低剂量组与艾叶油大剂量组肺溢流压力比较,差异无统计学意义(P>0.05)。注射组织胺后,艾叶油低剂量组、艾叶油大剂量组肺溢流压力升高时间长于慢性支气管炎模型组,差异有统计学意义(P<0.05);慢性支气管炎模型组与实验对照固本咳喘片组肺溢流压力升高时间比较及艾叶油低剂量组与艾叶油大剂量组肺溢流压力升高时间比较,差异无统计学意义(P>0.05)。艾叶油低剂量组、艾叶油大剂量组肺溢流压力升高值均小于慢性支气管炎模型组与实验对照固本咳喘片组,差异有统计学意义(P<0.05);慢性支气管炎模型组与实验对照固本咳喘片组肺溢流压力升高值比较及艾叶油低剂量组与艾叶油大剂量组肺溢流压力升高值比较,差异无统计学意义(P>0.05)。艾叶油低剂量组、艾叶油大剂量组肺溢流压力持续时间均短于慢性支气管炎模型组,差异有统计学意义(P<0.05);艾叶油低剂量组、艾叶油大剂量组、实验对照固本咳喘片组注射组织胺后肺溢流压力变化持续时间比较,差异无统计学意义(P>0.05)。见表5。
表5 慢性支气管炎模型组、艾叶油低剂量组、艾叶油大剂量组、实验对照固本咳喘片组慢性支气管炎大鼠的肺溢流压力及注射组织胺后肺溢流压力变化比较(±s)
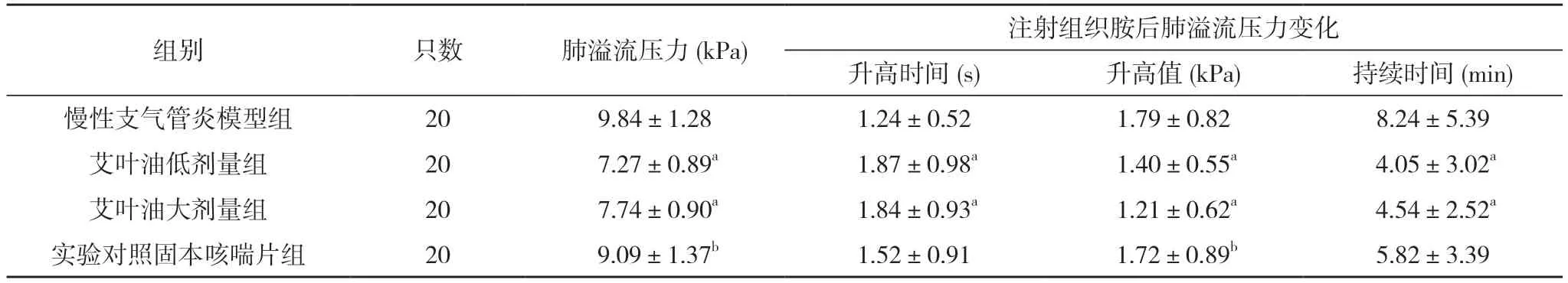
表5 慢性支气管炎模型组、艾叶油低剂量组、艾叶油大剂量组、实验对照固本咳喘片组慢性支气管炎大鼠的肺溢流压力及注射组织胺后肺溢流压力变化比较(±s)
注:与慢性支气管炎模型组比较,aP<0.05;与实验对照固本咳喘片组比较,bP<0.05
3 讨论
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD) 目前被列为第四大死因,全世界每年有3.28 亿患者被确诊[7]。COPD 患者临床上多出现呼吸困难、肺气肿、慢性支气管炎和肺组织的慢性炎症等症状,一旦并发心血管疾病、肺癌,患者生存率将大大下降[2]。目前治疗慢性支气管炎选择的药物主要为支气管扩张剂、皮质类固醇等,但使用后极易出现病情反复发作。皮质类固醇还会给患者带来多种副作用,例如患肺炎和骨质疏松症的风险显著增加,皮肤角质层薄化,皮肤屏障受损等。中医专家认为,慢性支气管炎主要是患者肾、肺、脾等脏器出现器质性或功能性疾病,肺脾肾功能衰退,导致患者气血不足、炎症加剧[8-10]。艾叶作为传统中药材,具有多种药物活性,包括抗炎、抗菌、镇痛、抗病毒、抗氧化、抗肿瘤和免疫调节效果等。艾叶油为艾叶主要的作用成分[11],具有明显抗菌作用,在临床上是主要用于疮疡、皮肤真菌感染、呼吸道感染等的治疗[12]。
本研究中的GC-MS 分析提供艾叶油的详细化学成分,其中发现包括鳞粉、冰片、樟脑和硫静脉的几种主要化学品,根据之前的研究结果其具有抗炎效应。本研究旨在评估艾叶油的抗炎潜力,基于艾叶油的体外抑菌、镇咳、祛痰及平喘实验,探究艾叶油对慢性支气管炎的治疗效果,并基于临床数据,对艾叶油治疗慢性支气管炎的治疗效果作了研究[13-15]。结果发现艾叶油能显著降低临床上多种重要病原菌对抗菌药物的MIC 和MBC,其具有抑菌、杀菌作用;延长咳嗽潜伏期,可促进小鼠气道酚红排泄,肺溢流压力显著下降。艾叶油具体外抑菌效果,并且呈现剂量依赖性。此外,目前艾叶挥发油在临床、化妆品开发、保健品研发、农药等领域中也被广泛应用,但欲开拓中国市场还需解决原料来源、艾叶油生产质量管理规范和提取加工技术规范等一系列问题。
综上所述,艾叶油具有抑菌、杀菌、镇咳、祛痰、平喘作用,且呈剂量依赖性。
