软坚清脉颗粒质量标准研究*
2023-01-02黄雨婷胡鹏跃李国文史秀峰谢燕
黄雨婷,胡鹏跃,李国文,史秀峰,谢燕
(上海中医药大学,上海 201203)
软坚清脉颗粒由垂盆草、蒲黄、豨莶草、海藻、煅牡蛎5味药材配伍,具有软坚散结、祛瘀消肿功效,临床用于治疗肢体动脉粥样硬化斑块形成引起的肢体血管狭窄、闭塞导致下肢慢性缺血的外周动脉疾病等[1]。该制剂现行制备工艺规范性欠佳,且质量标准较低,不能满足临床需求。槲皮素、山柰素、异鼠李素为垂盆草主要成分,香蒲新苷和异鼠李素-3-O-新橙皮苷为蒲黄主要成分,均具有多种药理学活性[2-6]。本研究中采用薄层色谱(TLC)法鉴别该制剂中垂盆草、蒲黄、豨莶草,并建立了同时测定垂盆草中槲皮素、山柰素、异鼠李素及蒲黄中香蒲新苷、异鼠李素-3-O-新橙皮苷含量的高效液相色谱(HPLC)法,以期为软坚清脉颗粒的质量控制提供依据。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1260型高效液相色谱仪(美国Agilent公司);CP225D型十万分之一分析天平(赛多利斯科学仪器<北京>有限公司);ATS4型薄层点样仪、Visalient型薄层成像仪(瑞士CAMAG公司);SK7200LHC型超声波清洗器(上海科导超声仪器有限公司)。
1.2 试药
软坚清脉颗粒(上海练塘药业有限公司,批号分别为210112,211001,211002,211003)。槲皮素对照品(批号为100081-201610,含量98%)、山柰素对照品(批号为110861-201611,含量98%)、异鼠李素对照品(批号为110860-201611,含量98%)、香蒲新苷对照品(批号为111573-201405,含量98%)、异鼠李素-3-O-新橙皮苷对照品(批号为111571-201205,含量98%)、垂盆草对照药材(批号为121434-201203)、蒲黄对照药材(批号为121225-201804)、豨莶草对照药材(批号为121572-201202),均购自中国食品药品检定研究院;奇壬醇对照品(成都曼思特生物科技有限公司,批号为MUST-18051504,含量98%);硅胶G薄层板(烟台市化学工业研究所,批号为20201107);磷酸、乙腈、甲醇均为色谱纯;三氯甲烷、乙酸乙酯、甲苯、甲酸、正丁醇、环己烷、乙醚均为分析纯;水为超纯水。
2 方法与结果
2.1 TLC鉴别
垂盆草:取样品粉末10 g,加甲醇20 mL,超声(功率250 W,频率40 kHz;下同)处理30 min,滤过,蒸干,残渣加2 mL甲醇溶解,即得供试品溶液;取垂盆草对照药材1 g,同法制得对照药材溶液;按软坚清脉颗粒处方及工艺制备缺垂盆草的阴性样品,同法制得阴性对照品溶液。取上述溶液各5μL,分别点于同一硅胶G薄层板,以环己烷-乙酸乙酯(15∶1,V/V)为展开剂,喷以5%磷钼酸乙醇溶液,105℃加热至斑点显色清晰,置日光灯下检视。供试品溶液色谱中,在与对照药材溶液色谱相应位置上显相同斑点,且阴性对照无干扰。详见图1 A。
蒲黄:取样品粉末10 g,加水30 mL,超声处理30 min,滤过,用乙醚萃取,弃去乙醚液,水浴挥去残留乙醚,加水饱和的正丁醇萃取,取正丁醇层蒸干,残渣加2 mL甲醇溶解,即得供试品溶液。取香蒲新苷、异鼠李素-3-O-新橙皮苷对照品适量,精密称定,分别加甲醇溶解制成质量浓度均为1 mg/mL的单一对照品溶液;取蒲黄对照药材1 g,同法制得对照药材溶液;按软坚清脉颗粒处方及工艺制备缺蒲黄的阴性样品,同法制得阴性对照品溶液。取上述溶液各5μL,分别点于同一硅胶G薄层板,以乙酸乙酯-丁酮-甲酸-水(4∶3∶1∶1,V/V/V/V)为展开剂,喷以10%硫酸乙醇溶液,105℃加热至斑点显色清晰,置紫外光灯(365 nm)下检视。供试品溶液色谱中,与对照药材溶液、对照品溶液色谱相应位置上显相同斑点,且阴性对照无干扰。详见图1 B。
豨莶草:取样品粉末10 g,加70%甲醇20 mL,超声处理30 min,滤过,蒸干,残渣加2 mL甲醇溶解,即得供试品溶液。取奇壬醇对照品适量,精密称定,加甲醇溶解制成质量浓度为1 mg/mL的对照品溶液;取豨莶草对照药材1 g,同法制得对照药材溶液;按软坚清脉颗粒处方及工艺制备缺豨莶草的阴性样品,同法制得阴性对照品溶液。取上述溶液各5μL,分别点于同一硅胶G薄层板,以三氯甲烷-甲醇(4∶1,V/V)为展开剂,喷以5%香草醛硫酸溶液,105℃加热至斑点显色清晰,置日光灯下检视。供试品溶液色谱中,在与对照药材溶液、对照品溶液色谱相应位置上显相同斑点,且阴性对照无干扰。详见图1 C。
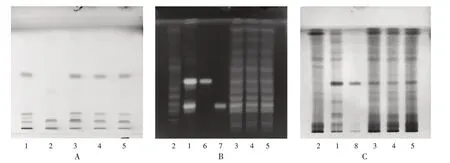
图1 薄层色谱图1.Reference medicinal materials solution 2.Negative reference solution 3-5.Test solution 6.Typhaneoside reference solution 7.Isorhamnetin-3-O-neohesperidoside reference solution 8.Kirenol reference solution A.Sedi Herba B.Typhae Pollen C.Siegesbeckiae HerbaFig.1 TLC chromatograms
2.2 垂盆草有效成分含量测定
2.2.1 色谱条件
色谱柱:Kromasil C18柱(250 mm×4.6 mm,5μm);流动相:甲醇-0.1%磷酸K溶液(44∶56,V/V);流速:1.0 mL/min;检测波长:360 nm;柱温:30℃;进样量:10μL[7]。
2.2.2 溶液制备
取槲皮素、山柰素、异鼠李素对照品各适量,分别加甲醇制成单一对照品溶液;另取3种对照品各适量,精密称定,加甲醇制成质量浓度分别为15,5,5μg/mL的混合对照品溶液。取样品粉末4 g,精密称定,分别精密加入甲醇20 mL及20%盐酸5 mL,精密称定质量,80℃回流45 min,冷却至室温,加甲醇补足减失的质量,摇匀,经0.22μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.2.3 方法学考察
专属性试验:分别吸取2.2.2项下混合对照品溶液、供试品溶液及2.1项下缺垂盆草的阴性对照品溶液各适量,按2.2.1项下色谱条件进样测定,记录色谱图。结果供试品溶液与混合对照品溶液色谱分别于28,55,64 min时出现相应色谱峰,且阴性对照无干扰;二极管阵列检测器纯度分析显示,主峰的纯度因子分别为989,998,999,均大于980,分离度均大于1.5,表明专属性良好。详见图2。
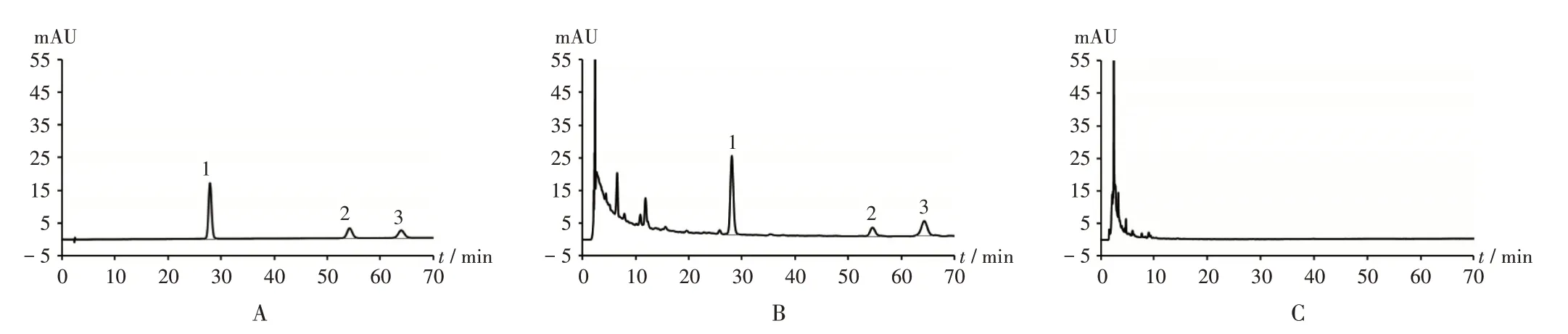
图2 垂盆草高效液相色谱图1.Quercetin 2.Kaempferol 3.IsorhamnetinA.Mixed reference solution B.Test solution C.Negative reference solutionFig.2 HPLC chromatograms of Sedi Herba
线性关系考察:分别取3种对照品各适量,精密称定,加甲醇稀释,制成槲皮素质量浓度分别为83.2,62.4,41.6,20.8,10.0μg/mL,山柰素分别为16.0,12.0,8.0,4.0,2.0μg/mL,异鼠李素分别为44.8,33.6,22.4,11.2,5.6μg/mL的系列单一对照品溶液。取10μL,按2.2.1项下色谱条件进样测定,记录峰面积。分别以待测成分质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y1=4 292.4X1-40.81(r=0.999 6)、Y2=3 835.6X2-11.34(r=0.999 3)、Y3=4 269.1X3-46.36(r=0.999 6)。结果表明,槲皮素、山柰素、异鼠李素质量浓度分别在10.0~83.2μg/mL、2.0~16.0μg/mL、5.6~44.8μg/mL范围内与峰面积线性关系良好。
定量限和检测限考察:取2.2.2项下混合对照品溶液适量,用甲醇倍比稀释,以信噪比(S/N)为10∶1和3∶1时的质量浓度分别记为定量限和检测限。结果槲皮素、山柰素、异鼠李素的定量限分别为9.40,21.36,21.08 ng,检测限分别为2.81,6.41,6.30 ng。
精密度试验:取2.2.2项下混合对照品溶液适量,按2.2.1项下色谱条件连续进样测定6次。结果槲皮素、山柰素、异鼠李素峰面积的RSD分别为0.74%,0.57%,0.88%(n=6),表明仪器精密度良好。
稳定性试验:取2.2.2项下供试品溶液(批号为210112)适量,分别于室温下放置0,2,4,6,8,10,12,24 h时按2.2.1项下色谱条件进样测定。结果槲皮素、山柰素、异鼠李素峰面积的RSD分别为3.29%,4.56%,3.94%(n=8),表明供试品溶液在室温放置24 h内基本稳定。
重复性试验:精密称取样品粉末(批号为210112)适量,各6份,按2.2.2项下方法制备供试品溶液,再按2.2.1项下色谱条件进样测定,记录峰面积并计算含量。结果槲皮素、山柰素、异鼠李素的平均含量分别为269.40,55.48,112.60μg/g,RSD分别为2.59%,1.21%,3.35%(n=6),表明方法重复性良好。
加样回收试验:取已知含量样品粉末(批号为210112)2 g,精密称定,各6份,分别加入2.2.2项下一定质量浓度的单一对照品溶液,按2.2.2项下方法制备供试品溶液,按2.2.1项下色谱条件进样测定,记录峰面积并计算加样回收率。结果见表1。

表1 槲皮素、山柰素、异鼠李素的加样回收试验结果(n=6)Tab.1 Results of the recovery test of quercetin,kaempferol and isorhamnetin(n=6)
2.2.4 样品含量测定
取各批样品适量,分别按2.2.2项下方法制备供试品溶液,再按2.2.1项下色谱条件进样测定,记录峰面积,并计算样品含量,结果见表2。
表2 样品含量测定结果(±s,μg/g,n=3)Tab.2 Results of content determination of five components in the samples(±s,μg/g,n=3)

表2 样品含量测定结果(±s,μg/g,n=3)Tab.2 Results of content determination of five components in the samples(±s,μg/g,n=3)
批号210112 211001 211002 211003槲皮素269.40±2.49 430.36±1.59 419.37±2.36 437.72±15.02山柰素55.48±0.54 87.48±0.68 85.70±0.37 88.10±3.39异鼠李素112.60±0.95 159.31±0.41 155.61±0.36 167.59±8.20香蒲新苷140.89±4.60 179.92±2.03 178.73±2.49 181.91±1.84异鼠李素-3-O-新橙皮苷82.82±4.18 120.53±5.00 121.62±4.80 126.55±3.08
2.3 蒲黄有效成分含量测定
2.3.1 色谱条件
色谱柱:Kromasil C18柱(250 mm×4.6 mm,5μm);流动相:乙腈-0.05%磷酸水溶液(14∶86,V/V);流速:1.0 mL/min;检测波长:254 nm;柱温:30℃;进样量:10μL[2]。
2.3.2 溶液制备
取香蒲新苷、异鼠李素-3-O-新橙皮苷对照品各适量,加甲醇制成质量浓度均为50μg/mL的混合对照品溶液。取样品粉末4 g,加75%甲醇50 mL,精密称定,超声处理45 min,冷却至室温,加75%甲醇补足减失的质量,滤过,经0.22μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.3.3 方法学考察
专属性试验:分别吸取2.3.2项下混合对照品溶液、供试品溶液及2.1项下缺蒲黄的阴性对照品溶液各适量,按2.3.1项下色谱条件进样测定,记录色谱图。结果供试品溶液与混合对照品溶液色谱在28 min及42 min时出现相应色谱峰,且阴性对照无干扰;二极管列阵检测器纯度分析显示,主峰的纯度因子分别为989,992,均大于980,分离度均大于1.5,表明专属性良好。详见图3。

图3 蒲黄高效液相色谱图1.Typhaneoside 2.Isorhamnetin-3-O-neohesperidosideA.Mixed reference solution B.Test solution C.Negative reference solutionFig.3 HPLC chromatograms of Typhae Pollen
线性关系考察:取2种对照品各适量,精密称定,分别用甲醇稀释,制成香蒲新苷质量浓度分别为41.2,33.0,24.7,16.5,8.2,4.1μg/mL,异鼠李素-3-O-新橙皮苷分别为42.4,33.9,25.4,17.0,8.5,4.2μg/mL的系列单一对照品溶液,取适量,按2.3.1项下色谱条件进样测定。以待测成分质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y4=1 455.1X4+16.16(r=0.999 8)、Y5=1 992.0X5+18.85(r=0.999 8)。结果表明,香蒲新苷、异鼠李素-3-O-新橙皮苷质量浓度分别在4.1~41.2μg/mL、4.2~42.4μg/mL范围内与峰面积线性关系良好。
定量限和检测限考察:取2.3.2项下混合对照品溶液适量,用75%甲醇倍比稀释,以S/N为10∶1,3∶1时的质量浓度分别记为定量限和检测限。结果香蒲新苷、异鼠李素-3-O-新橙皮苷的定量限分别为20.24 ng,20.48 ng,检测限分别为6.88 ng,6.96 ng。
精密度试验:取2.3.2项下混合对照品溶液适量,按2.3.1项下色谱条件连续进样测定6次。结果香蒲新苷、异鼠李素-3-O-新橙皮苷峰面积的RSD分别为0.41%,0.36%(n=6),表明仪器精密度良好。
稳定性试验:取2.3.2项下供试品溶液(批号为210112)适量,分别于室温下放置0,2,4,6,8,10,12,24 h时按2.3.1项下色谱条件进样测定。结果香蒲新苷、异鼠李素-3-O-新橙皮苷峰面积的RSD分别为2.11%,4.36%(n=8),表明供试品溶液在室温放置24 h内基本稳定。
重复性试验:精密称取样品粉末(批号为210112)适量,各6份,按2.3.2项下方法制备供试品溶液,再按2.3.1项下色谱条件进样测定,记录峰面积并计算含量。结果香蒲新苷、异鼠李素-3-O-新橙皮苷的平均含量分别为140.89μg/g,82.82μg/g,RSD分别为1.44%,3.16%(n=6),表明方法重复性良好。
加样回收试验:取已知含量样品粉末(批号为210112)2 g,各6份,分别加入一定质量浓度的单一对照品溶液,按2.3.2项下方法制备供试品溶液,按2.3.1项下色谱条件进样测定,记录峰面积并计算加样回收率。结果见表3。

表3 香蒲新苷和异鼠李素-3-O-新橙皮苷的加样回收试验结果(n=6)Tab.3 Results of the recovery test of typhaneoside and isorhamnetin-3-O-neohesperidin(n=6)
2.3.4 样品含量测定
取样品适量,分别按2.3.2项下方法制备供试品溶液,再按2.3.1项下色谱条件进样测定,记录峰面积并计算样品含量。结果见表2。
3 讨论
垂盆草TLC鉴别法建立初期将槲皮素、山柰素、异鼠李素作为鉴别指标,但试验结果显示相似条带较多,且多为假阳性,故最终选用垂盆草对照药材进行鉴别,其特征条带明显且无干扰、方法稳定。蒲黄TLC鉴别方法条件严苛,需多次进行纯化处理。且由于药材中黄酮类物质较多,条带模糊难辨,尝试多种展开体系后仍效果欠佳,故对显色剂进行筛选,最终采用10%硫酸乙醇溶液显色,色谱图清晰美观。豨莶草TLC鉴别方法对样品提取溶剂进行了考察,最终选用70%甲醇为提取溶剂,甲醇复溶处理过程样品中析出大量多糖,避免了展开时的多糖拖尾现象。除上述3味草本药材外,煅牡蛎、海藻两味药材主要成分为碳酸钙和多糖[8-9],鉴于药材特殊性,未建立相关TLC研究内容。
以软坚清脉颗粒方为基础,前期曾选取豨莶草中奇壬醇进行含量测定,但其中奇壬醇含量极低,难以满足质控要求,故舍弃;煅牡蛎作为矿物类药材,其中的钙离子含量可作为质量控制因素[10],但由于颗粒颜色较深导致显色反应中颜色变化不明显,难以确定是否存在阴性干扰,故舍弃;海藻主要成分为多糖,现有检测方法暂无法对其进行准确定量分析。因此,本研究中选用了垂盆草及蒲黄药材中指标成分进行定量分析,且研究发现槲皮素、山柰素、异鼠李素均可通过不同路径降低动脉硬化程度[11-19],香蒲新苷和异鼠李素-3-O-新橙皮苷等黄酮苷类成分有抑制凝血、活血化瘀功效[6]。故本研究中以垂盆草、蒲黄的指标成分作为定量分析成分具有一定的合理性。
与已有研究[20]相比,本研究中确定蒲黄提取时间为45 min,提取方式为超声提取;垂盆草回流水解时间为45 min,盐酸体积分数为20%。本研究中皆选取了提取时间较短,操作简便的提取方式,不仅最大限度地保留了有效成分,还提高了工作效率;将蒲黄、垂盆草的指标成分含量分开测定,分析时间较短,分离度良好,专属性强,符合产业化生产对中药制剂质量分析快速准确的需求。
