低温冷链贮藏对鱼糜凝胶化学作用力和肌原纤维蛋白结构及功能特性的影响
2022-12-30余璐涵蔡茜茜吴金鸿刘永乐黄建联汪少芸
陈 旭,余璐涵,蔡茜茜,吴金鸿,刘永乐,黄建联,汪少芸,*
(1.福州大学生物科学与工程学院,福建 福州 350108;2.福建省冷冻调理水产品加工重点实验室,福建 厦门 361022;3.上海交通大学农业与生物学院,上海 200204;4.长沙理工大学食品与生物工程学院,湖南 长沙 410114;5.安井食品集团股份有限公司,福建 厦门 361022)
鱼糜的凝胶特性是鱼糜最重要的功能特性,与鱼糜中肌原纤维蛋白的结构密切相关。肌原纤维蛋白是一种盐溶性蛋白,由肌球蛋白和肌动蛋白等多种蛋白组成,是鱼糜的主要成分[1]。在鱼糜凝胶化过程中,肌原纤维蛋白相互聚集、交联,形成连续基质并逐渐形成三维网状结构[2]。
低温冷链贮藏是一种被广泛接受的水产保鲜方法,工业生产中通常以冷藏(4 ℃)、冻藏(-18 ℃)和超低温(-35 ℃)速冻进行水产品保鲜。冷冻贮藏通过抑制水产品内源酶活性、微生物的生长和脂质氧化达到延长货架期的作用[3]。为了保持鱼糜的质量和扩大销售范围,鱼糜通常是在低温冷链冻藏条件下贮藏、运输和销售[4],但在实际生产运输过程中,环境温度波动引起的反复冻融严重影响鱼糜的质地和凝胶性能[5],冷冻导致的肌原纤维蛋白冷冻变性以及冷冻诱导冰晶重结晶导致蛋白变性的协同作用,对鱼糜肌原纤维蛋白质量产生负面影响,进而引起鱼糜营养价值、感官特性和安全性降低[6]。此外,冻藏过程中蛋白质的氧化也是影响鱼糜质地品质的重要因素[7],Li Deyang等[8]研究发现,氧化导致蛋白质二级结构中α-螺旋含量减少、β-转角含量增加,过度氧化会降低鱼糜凝胶的力学性能,使鱼糜凝胶网络结构疏松多孔。鱼糜凝胶网络结构主要通过离子键、氢键、疏水相互作用、二硫键等相互作用来维持[9],有研究表明鱼糜中变性的肌原纤维蛋白不能形成凝胶[10]。为进一步探究鱼糜肌原纤维蛋白在低温冷链贮藏温度下的变化以及肌原纤维蛋白与形成鱼糜凝胶化学作用力之间的关系,本研究通过冻融循环的方式模拟了低温冷链贮藏流通过程中的温度变化,旨在探究低温冷链对鱼糜肌原纤维蛋白和凝胶化学作用力的影响,为鱼糜在低温冷链贮藏过程中的品质保持提供基础理论支持。
1 材料与方法
1.1 材料与试剂
鲜活草鱼(Ctenopharyngodon idella)(鱼体质量1.25~1.50 kg、长度40~50 cm)购自福州永辉超市永嘉天地店。超微量ATP酶(Ca2+-ATPase)、羰基检测试剂盒南京建成生物工程研究所有限公司;其他药品与试剂均为分析纯。
1.2 仪器与设备
T18型数码均质机 艾卡(广州)仪器设备有限公司;SpectraMax i3x型多功能酶标仪 美谷分子仪器上海有限公司;Fluoromax-4型荧光光谱仪 法国Horiba Instrument公司;Invia Reflex型激光纤维拉曼光谱仪英国Renishaw公司。
1.3 方法
1.3.1 鱼糜制备
参照文献[11]的方法并稍作修改。新鲜草鱼经前处理后于绞肉机中绞碎;加入5 倍(m/V)超纯水,控制水温2~4 ℃,慢速搅拌10 min,10 000 r/min、4 ℃下离心10 min,取沉淀重复上述操作,然后将沉淀加入5 倍体积0.15 g/100 mL NaCl溶液慢速搅拌10 min,10 000 r/min、4 ℃下离心15 min,所得沉淀即为鱼糜样品,将制得的鱼糜样品分装后置于4 ℃(冷藏)、-18 ℃(冷冻)、-35 ℃(速冻)冰箱中贮藏备用。
1.3.2 鱼糜凝胶制备
将1.3.1节鱼糜样品放入研钵中空斩2 min,然后按照添加鱼糜质量3%的NaCl斩拌3 min,即为鱼糜溶胶。将鱼糜溶胶注入圆柱形模具中,并用保鲜膜封紧,采用二段加热法,先在40 ℃水浴锅中凝胶化30 min,然后迅速转移入90 ℃水浴锅中凝胶化30 min,最后立即置于冰水中冷却20 min备用,即为鱼糜凝胶。
1.3.3 鱼糜凝胶低温贮藏
参照文献[11]的方法并稍作修改。第0天鱼糜凝胶样品不做冷冻处理直接进行后续指标测定。其余鱼糜凝胶样品分别在4、-18、-35 ℃下贮藏3、6、9、12、15、18 d取样解冻(25 ℃保温2 h)。以温度-贮藏时间形式命名样品(例:4-3为4 ℃下贮藏3 d)。
1.3.4 鱼糜肌原纤维蛋白的提取
参考文献[12]的方法并稍作修改。取2 g鱼糜样品,按照料液比1∶10(m/V)加入4 ℃、20 mmol/L Tris-HCl缓冲液(含50 mmol/L KC1、pH 7),充分匀浆,然后在10 000 r/min、4 ℃下离心10 min,洗去残留在鱼糜样品中的水溶性蛋白。弃去上清液后,按照料液比1∶10(m/V)在沉淀中加入20 mmol/L Tris-HCl缓冲液(含0.6 mol/L KC1、pH 7),充分匀浆,并在4 ℃提取1 h,然后在10 000 r/min、4 ℃下离心10 min,所得上清液为肌原纤维蛋白溶液。
1.3.5 盐溶性蛋白含量测定
参考文献[12]的方法并稍作修改。将1.3.4节肌原纤维蛋白溶液用20 mmol/L Tris-HCl缓冲液(含50 mmol/L KCl、pH 7)稀释10 倍。吸取0.5 mL后采用双缩脲法测定蛋白质含量即盐溶性蛋白含量,以牛血清蛋白为标准品绘制标准曲线。每个样品测定3 次,结果取平均值。
1.3.6 Ca2+-ATPase活力测定
参照超微量ATP酶(Ca2+-ATPase)试剂盒说明书测定不同低温冷链贮藏条件下肌原纤维蛋白的Ca2+-ATPase活力。
1.3.7 总巯基含量测定
参照文献[13]的方法并稍作修改。取0.5 mL 1.3.4节肌原纤维蛋白溶液加入到4.5 mL 0.2 mol/L Tris-HCl缓冲液(pH 6.8,含8 mol/L尿素、2%十二烷基硫酸钠和10 mmol/L乙二胺四乙酸)中。向上述混合液加入0.5 mL质量分数0.1%的5,5’-二硫代双(2-硝基苯甲酸)溶液,涡旋振荡混匀,40 ℃下精确保温25 min,用酶标仪测定412 nm波长处吸光度。空白组不加样品溶液,加入等体积20 mmol/L Tris-HCl缓冲液(含0.6 mol/L KCl、pH 7)。总巯基含量以蛋白质量计,单位为mol/g。
1.3.8 羰基含量测定
参照羰基检测试剂盒说明书测定不同低温冷链贮藏条件下肌原纤维蛋白的羰基含量,结果以蛋白质量计,单位为nmol/mg。
1.3.9 鱼糜肌原纤维蛋白二级结构的拉曼光谱分析
参考文献[14]的方法并稍作修改,采用激光显微拉曼光谱仪测定,设置参数为:激发波长785 nm,扫描范围400~3 200 cm-1。每个样品重复测定3 次。
1.3.10 鱼糜肌原纤维蛋白的荧光光谱分析
参考文献[15]的方法并稍作修改。取1.3.4节肌原纤维蛋白溶液用20 mmol/L Tris-HCl缓冲液(含0.6 mol/L KCl、pH 7)稀释至质量浓度为1 mg/mL,以20 mmol/L Tris-HCl缓冲液(含0.6 mol/L KCl、pH 7)作为空白,采用Fluoromax-4荧光光谱仪测定荧光强度。设定参数为:激发波长295 nm,狭缝宽度5 nm,扫描波长310~380 nm,扫描速率10 nm/s,响应时间0.5 s。每个样品重复扫描3 次。
1.3.11 鱼糜凝胶化学作用力分析
参考文献[16]的方法并稍作修改。取2 g鱼糜凝胶分别与20 mL 0.05 mol/L NaCl溶液(SA反应液)、0.6 mol/L NaCl溶液(SB反应液)、0.6 mol/L NaCl+1.5 mol/L尿素溶液(SC反应液)和0.6 mol/L NaCl+8 mol/L尿素溶液(SD反应液)混合,均质90 s后,4 ℃放置1 h,然后10 000 r/min、4 ℃离心15 min,收集上清液。采用双缩脲法测定上述上清液和1.3.4节肌原纤维蛋白溶液的蛋白质含量(以540 nm处的吸光度表示),凝胶中蛋白质分子间的非特异性相互作用(除氢键、静电相互作用、疏水相互作用和二硫键等的其他作用力)相对含量以SA溶液与肌原纤维蛋白溶液中蛋白质含量的比值表示;鱼糜凝胶中离子键、氢键和疏水相互作用相对含量分别以SB溶液与SA溶液中蛋白质含量的差值、SC溶液与SB溶液蛋白质含量差值、SD溶液与SC溶液蛋白质含量的差值与肌原纤维蛋白溶液中蛋白质含量的比值表示。
1.4 数据处理与分析
实验设置3个平行,结果以平均值±标准差表示。采用Origin 9.0软件作图,采用SPSS 26.0软件进行单因素方差分析,采用Duncan检验进行显著性分析,P<0.05表示差异显著。利用SIMCA 14.1软件进行主成分分析,利用Peakfit 4.12软件进行拉曼光谱分析。
2 结果与分析
2.1 鱼糜盐溶性蛋白含量的变化
肌原纤维蛋白是鱼糜在低温冷链贮藏过程中变性的主要成分。冻藏过程中,冰晶的生长促使肌原纤维蛋白分子之间形成非共价键,导致蛋白质链大量聚集,形成不溶性大分子凝集体,使其盐溶性下降[17]。而蛋白质的功能性如凝胶特性、流变学特性等加工特性只有在高溶解度状态下才能表现出[18]。如图1所示,不同低温冷链贮藏温度下的盐溶性蛋白含量均随贮藏时间的延长而下降,且在4、-18、-35 ℃贮藏前3 d盐溶性蛋白含量下降较为迅速,第3天时由初始的194.90 mg/g分别下降至144.15、63.82、43.36 mg/g,随后则基本趋于平缓,这是由于贮藏过程中冰晶的形成以及重结晶导致蛋白质脱水,从而降低了蛋白质的可提取性[19]。此外,-18、-35 ℃贮藏条件下盐溶性蛋白含量没有明显差别。Coombs等[20]认为蛋白溶解度降低是由于在贮藏过程中肌原纤维蛋白间氢键、盐键、二硫键、疏水相互作用发生改变,导致内部分子间规则空间结构发生改变。盐溶性蛋白含量的变化可以看作冷冻变性的初级指标,不能准确得知蛋白质的变性程度。
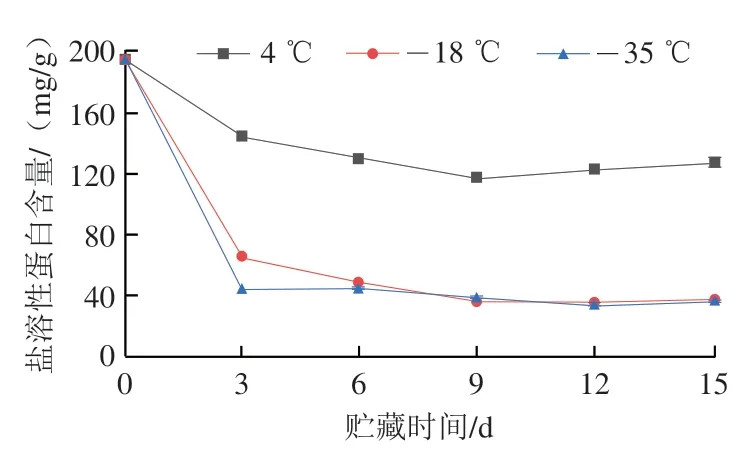
图1 不同低温冷链温度贮藏期间鱼糜盐溶性蛋白含量的变化Fig. 1 Changes in salt-soluble protein content in surimi during cold chain storage at different temperatures
2.2 鱼糜肌原纤维蛋白Ca2+-ATPase活力的变化
肌球蛋白球状头部的Ca2+-ATPase活力对冷冻贮藏过程中蛋白质完整性的变化十分敏感,其活力越低表示肌球蛋白完整性受到破坏的程度越严重[21]。如图2所示,不同低温冷链贮藏温度下的Ca2+-ATPase活力均随贮藏时间的延长而下降,且在前3 d Ca2+-ATPase活力下降较快,而后逐渐趋于平缓,与Jiang Longfa等[22]研究结果相似。在4、-18、-35 ℃冷冻贮藏15 d后,Ca2+-ATPase活力分别由最初的0.956 U/mg下降至0.586、0.615、0.628 U/mg,且贮藏温度越低,Ca2+-ATPase活力越高,蛋白质保留越完整,这是因为在低温冷链贮藏过程中冰晶的形成、生长以及重结晶引起肌球蛋白头部构象变化[17],蛋白质之间通过相互作用发生重排形成不溶性大分子聚集体,导致Ca2+-ATPase失活,而-35 ℃冻藏过程中形成的冰晶较小,从而保护了蛋白质构象。
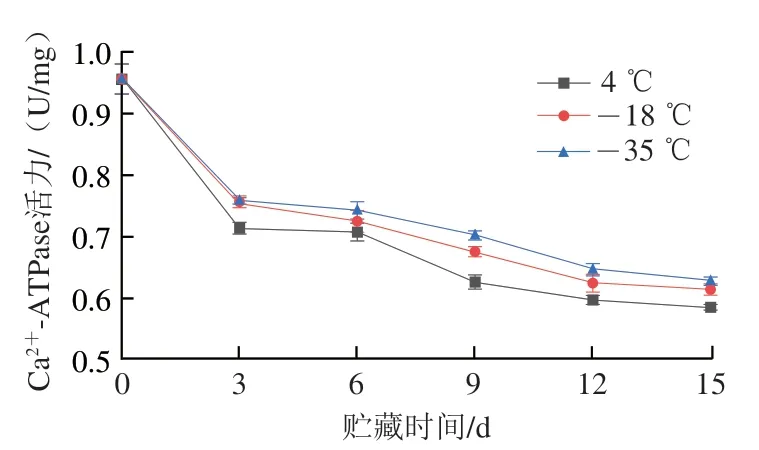
图2 不同温度贮藏期间肌原纤维蛋白Ca2+-ATPase活力的变化Fig. 2 Changes in Ca2+-ATPase activity of myofibrillar protein during cold chain storage at different temperatures
2.3 鱼糜肌原纤维蛋白总巯基含量的变化
半胱氨酸中的巯基对鱼糜冷冻贮藏过程中肌原纤维蛋白活性氧氧化修饰十分敏感,巯基作为重要的功能性基团对于维持蛋白质的空间结构稳定以及功能性质具有重要意义[17],而巯基的氧化通常被认为是蛋白质氧化的最初反应之一,因此巯基含量变化可用于检测蛋白质初期结构的变化。总巯基包括活性巯基和包埋在蛋白质分子内部的巯基[23],活性巯基易在冻藏过程中被氧化形成二硫键。如图3所示,在低温冷链贮藏过程中,随着贮藏时间的延长,总巯基含量呈现下降趋势,贮藏前6 d,总巯基含量下降较为迅速而后则逐渐趋于平缓,在4、-18、-35 ℃贮藏15 d后,总巯基含量分别由最初的9.768×10-5mol/ g明显下降至5.635×10-5、6.086×10-5、6.741×10-5mol/g,这是因为游离的活性巯基发生氧化反应生成二硫键,造成总巯基含量的减少[24],而后期下降速率趋于平缓是因为低温冷链贮藏过程中蛋白质氧化导致蛋白质构象变化而引起蛋白质分子的聚集,巯基被包埋在分子内部,较难被氧化[25]。
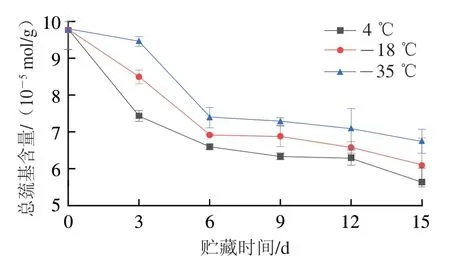
图3 不同温度贮藏期间肌原纤维蛋白总巯基含量的变化Fig. 3 Changes in total sulfhydryl content in myofibrillar protein during storage at different temperatures
2.4 鱼糜肌原纤维蛋白羰基含量的变化
鱼糜冷冻贮藏过程中,常常伴随着蛋白质的氧化变性,蛋白质氧化会导致必需氨基酸的损失,进而降低了鱼糜的营养品质和风味特性。羰基含量是反映蛋白质氧化程度的有效指标[26],在金属离子和活性氧存在下,赖氨酸、脯氨酸、精氨酸等氨基酸容易被氧化成半醛,半醛约占总羰基含量的70%[27]。羰基含量与蛋白质的氧化变性呈正相关,其含量越高蛋白质的变性程度越严重。如图4所示,在贮藏前新鲜的鱼糜肌原纤维蛋白中的羰基含量仅为0.001 6 nmol/mg,随着贮藏时间的延长,羰基含量呈现明显上升趋势,在4、-18、-35 ℃贮藏15 d后,其羰基含量分别增加至0.021 6、0.016 4、0.012 7 nmol/mg。羰基含量增加是由于氨基酸侧链—NH—或—NH2等活性基团被氧化,蛋白质构象改变,蛋白质间发生交联聚集,部分氨基酸残基转化为羰基,-18、-35 ℃冷冻贮藏下羰基含量明显低于4 ℃,说明较低的贮藏温度可以有效抑制蛋白质氧化,这与崔旭海等[28]研究结果一致。
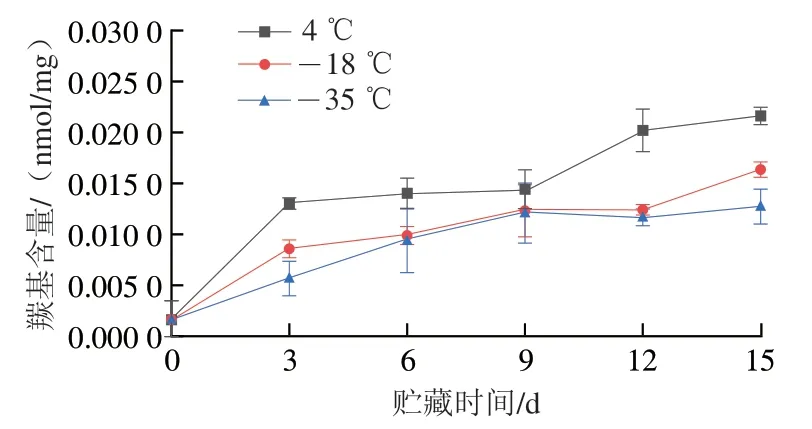
图4 不同温度贮藏期间肌原纤维蛋白羰基含量的变化Fig. 4 Changes in carbonyl content in myofibrillar protein during storage at different temperatures
2.5 鱼糜肌原纤维蛋白二级结构的变化
蛋白质二级结构是维持蛋白质空间构象的基础,它与蛋白质的功能特性有密切关系[29],根据不同的空间构型可将其分为α-螺旋、β-折叠、β-转角和无规卷曲4种结构[30],蛋白质的冷冻及氧化都会引起蛋白质二级结构的变化。拉曼光谱是测定蛋白质二级结构的重要手段,酰胺I带(1 600~1 700 cm-1)主要由C=O振动引起,与蛋白质肽链的骨架有序程度紧密相关,常用于分析蛋白质4种二级结构的相对含量变化[31]。如图5所示,随着贮藏时间的延长,α-螺旋相对含量下降,β-折叠和无规卷曲相对含量增加。在4、-18、-35 ℃贮藏15 d后,α-螺旋相对含量由24.24%分别下降至14.12%、13.02%、12.83%,β-折叠相对含量由33.38%上升至39.30%、35.01%、43.72%,无规卷曲相对含量由15.45%上升至16.35%、19.70%、15.78%,其不同结构相对含量的变化与蛋白质螺旋结构的伸展有关。通常认为α-螺旋与β-折叠属于相对有序的二级结构,而β-转角和无规卷曲属于相对无序的二级结构,薛勇[32]研究表明鱼肉冻藏过程中,蛋白中氢键、疏水相互作用、二硫键和离子键的改变导致了蛋白结构的变化。总地来说,冷冻贮藏会导致蛋白质二级结构由有序向无序转变。
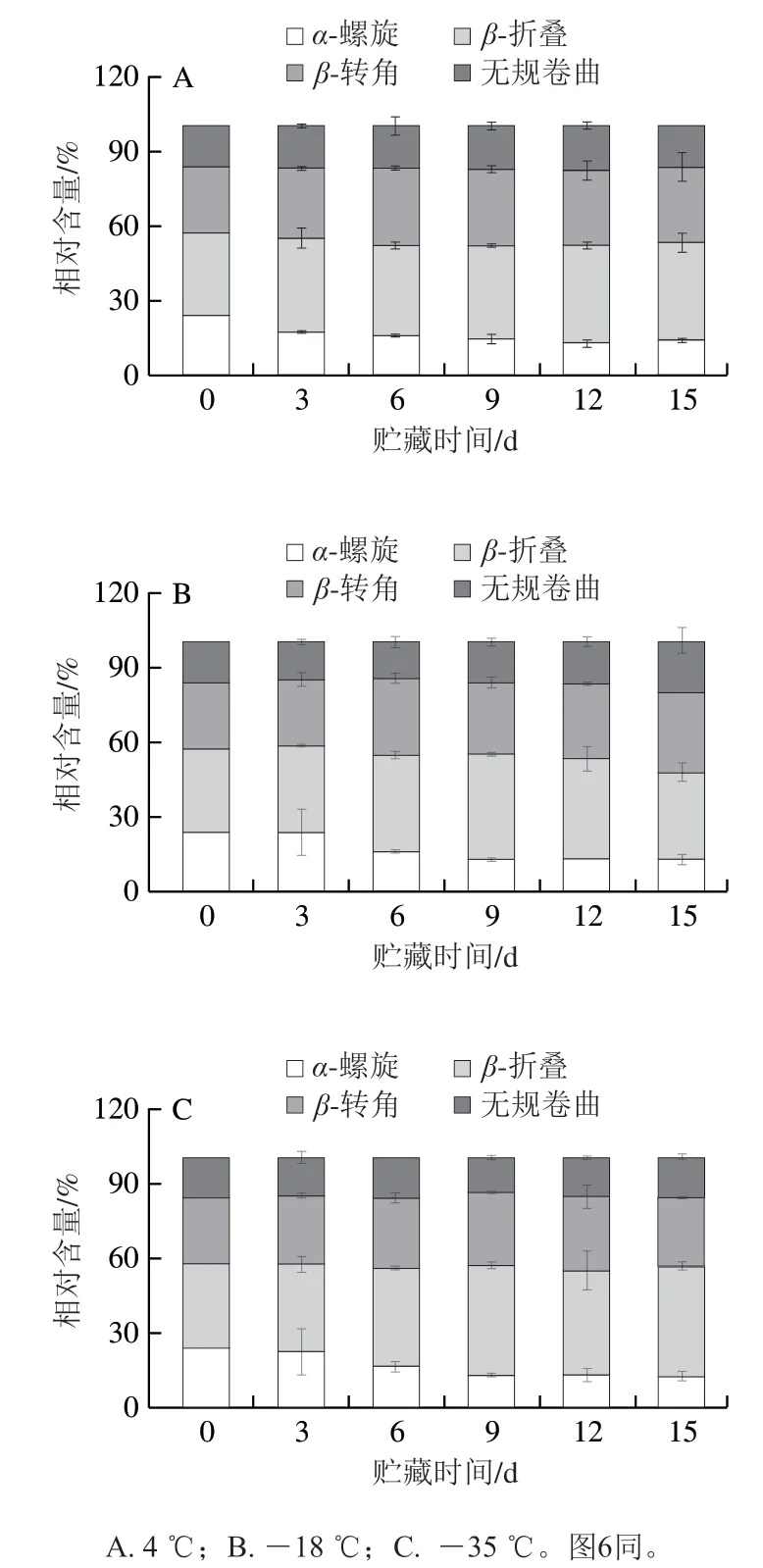
图5 不同温度贮藏期间鱼糜肌原纤维蛋白二级结构的变化Fig. 5 Changes in secondary structures of myofibrillar protein during storage at different temperatures
2.6 鱼糜肌原纤维蛋白内源性荧光强度的变化
内源性荧光光谱可以表征贮藏和加工过程中蛋白质三级结构的变化[33],常被用于芳香族氨基酸暴露指数分析。色氨酸残基的内源性荧光对蛋白质微环境的极性十分敏感,当其位于蛋白质内部时,荧光强度较高;当蛋白质变性,蛋白质构象展开,位于蛋白质内部的色氨酸残基暴露于溶剂中加速猝灭现象[34]。如图6所示,随贮藏时间的延长,不同贮藏温度下肌原纤维蛋白荧光强度均呈下降趋势,与4 ℃冷藏条件相比,-18、-35 ℃冻藏条件下荧光强度的下降幅度较大,这说明冻藏对蛋白质极性环境的影响较大,在贮藏9 d后,荧光强度随贮藏时间的延长下降较为缓慢,这可能是由于大量色氨酸残基的暴露增大了其周围环境的极性而产生了屏蔽效应。贮藏15 d后,4、-18、-35 ℃下最大吸收波长均出现了红移,最大吸收波长处的荧光强度较0 d时分别下降了31.76%、71.41%、43.60%,这说明随着贮藏时间的延长,肌原纤维蛋白微环境发生变化,但相对较低的冻藏温度又可以在一定程度上减缓蛋白质的变性和结构变化。
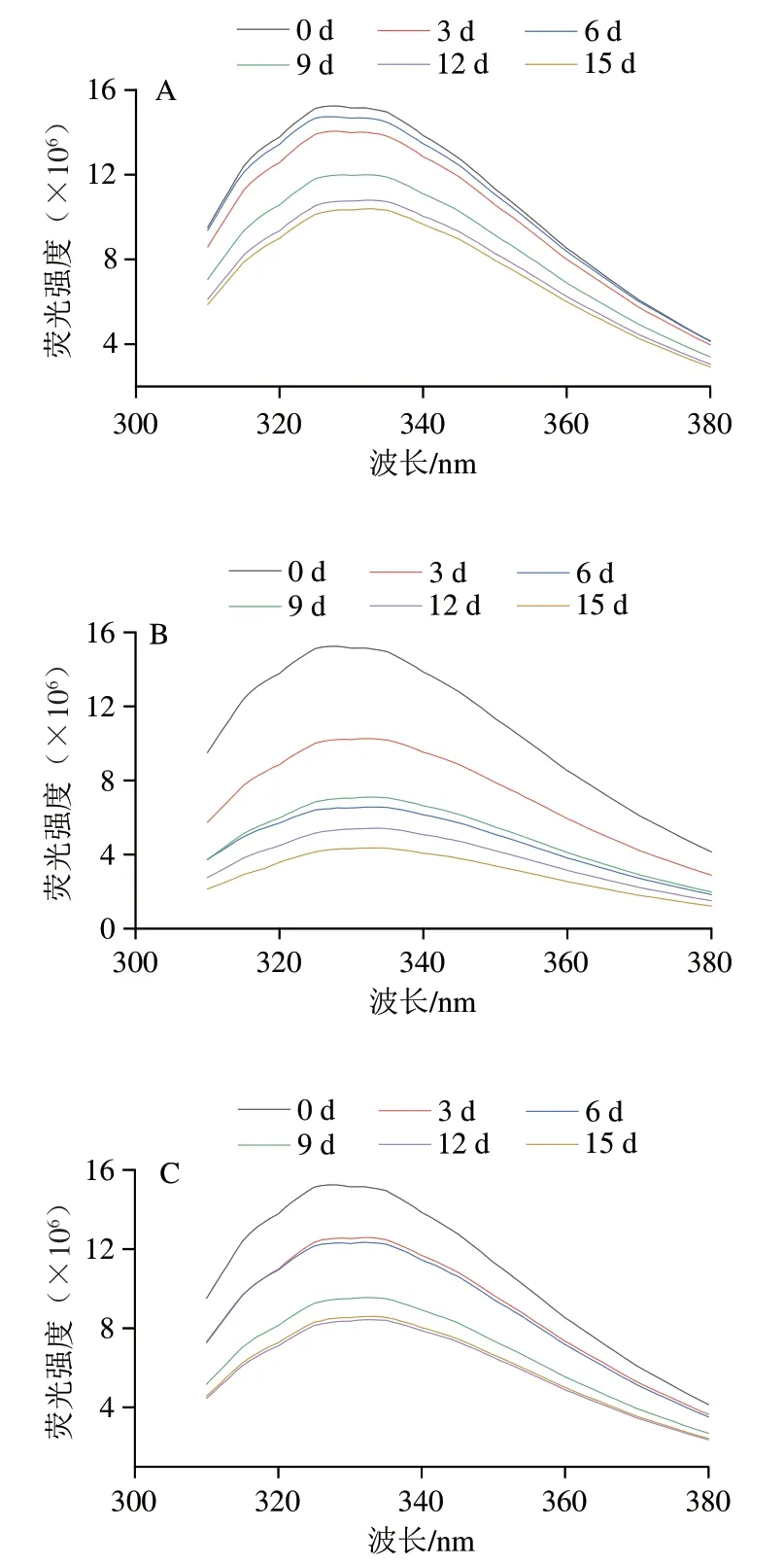
图6 不同温度贮藏期间肌原纤维蛋白内源性荧光强度的变化Fig. 6 Changes in intrinsic fluorescence spectrum of myofibrillar protein during storage at different temperatures
2.7 鱼糜凝胶化学作用力的变化
鱼糜通过加热促使蛋白质发生变性进而形成空间网状结构,该网络结构的稳定离不开化学作用力的维持。维持鱼糜凝胶网络结构的化学作用力主要由离子键、氢键、疏水相互作用等[35],其中,离子键和疏水相互作用是维持鱼糜凝胶构象稳定的主要作用力[36],氢键主要维持蛋白质的二级结构,它可以起到稳定结合水的作用[37]。
如图7所示,在低温冷链贮藏初期,鱼糜凝胶中离子键和疏水相互作用含量相对较高,这说明它们是维持鱼糜凝胶结构的主要作用力,与米红波等[38]研究结果相似。随着贮藏时间的延长,非特异性相互作用相对含量增加,离子键和疏水相互作用相对含量减少,氢键相对含量呈现先增加后减少的趋势。在低温冷链贮藏15 d后,4 ℃贮藏样品非特异性相互作用相对含量显著高于-18、-35 ℃贮藏样品,离子键、氢键和疏水相互作用含量显著低于-18、-35 ℃贮藏样品。这说明较低的贮藏温度可以有效保护鱼糜中有助于形成凝胶网络结构的活性基团,从而保持鱼糜凝胶网络结构形成能力。
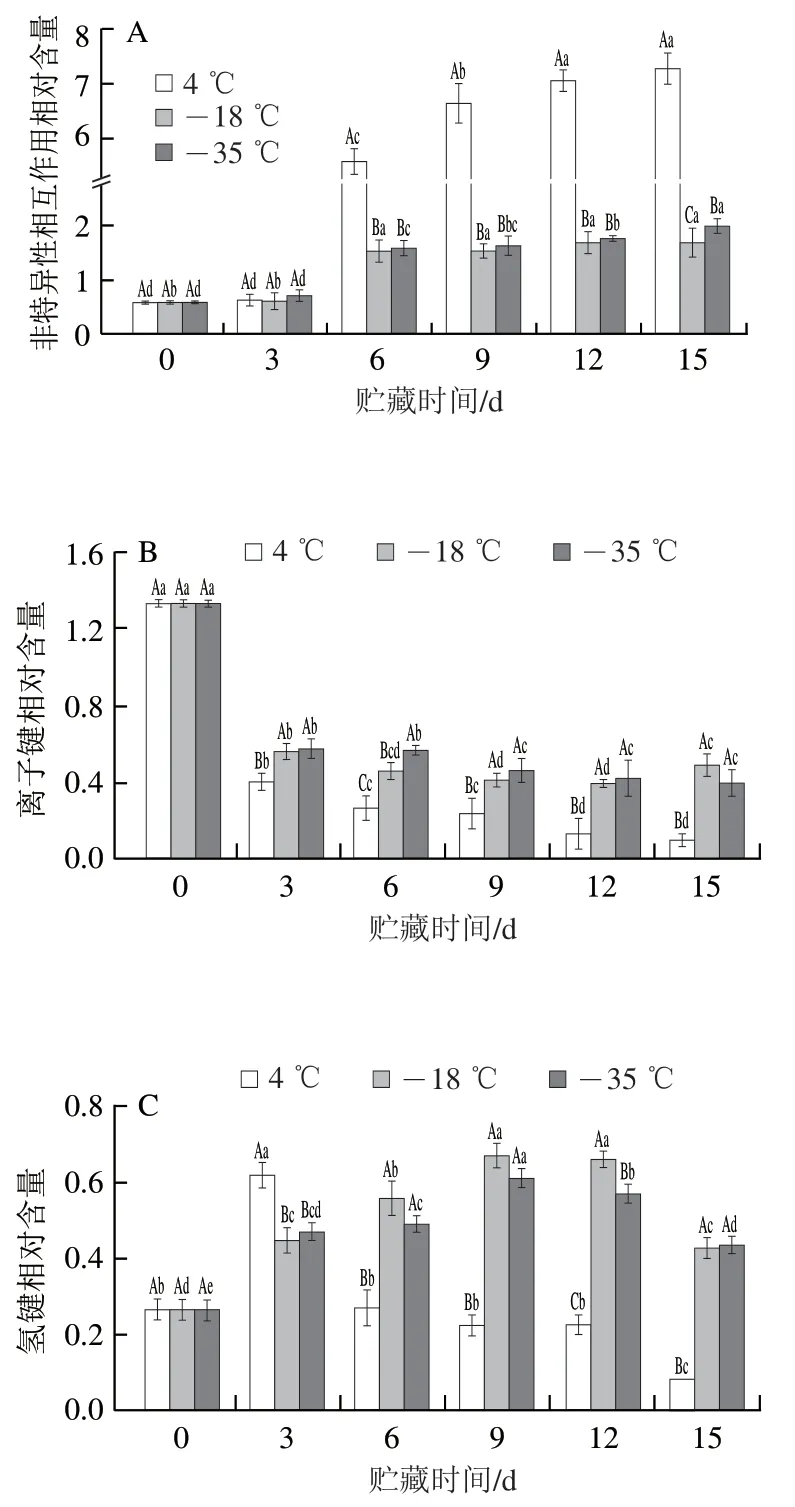
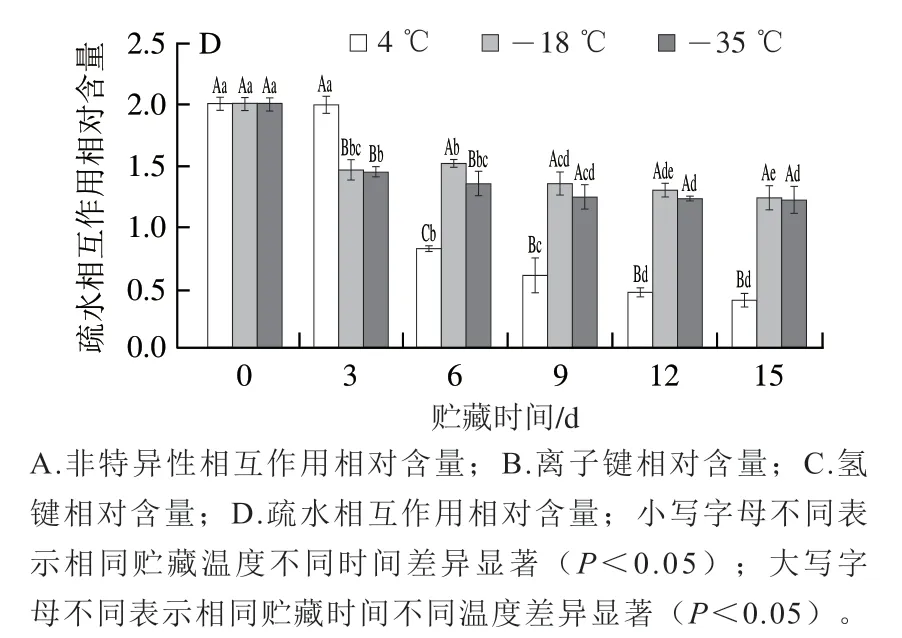
图7 不同温度贮藏期间鱼糜凝胶化学作用力的变化Fig. 7 Changes in chemical interactions of surimi gels during storage at different temperatures
2.8 基于肌原纤维蛋白变化与凝胶化学作用力的主成分分析结果
肌原纤维蛋白是鱼糜中的主要成分,本实验进一步分析在低温冷链温度贮藏过程中凝胶化学作用力与肌原纤维蛋白变化之间的关系,探究低温冷链贮藏对鱼糜凝胶特性的影响。对不同温度和贮藏时间样品的肌原纤维蛋白相关指标及鱼糜凝胶化学作用力进行主成分分析,PC1(51.9%)和PC2(24.3%)的累计方差贡献率为76.2%,肌原纤维蛋白总巯基含量、Ca2+-ATPase活力、α-螺旋相对含量和离子键相对含量的位置接近,具有较高的相关性(图8A);不同贮藏时间和贮藏温度的鱼糜之间存在的差异,4 ℃及各温度下贮藏时间较长的样品主要分布在第二、三象限(图8B),这些样品具有较多的无规卷曲、β-折叠结构以及较高的羰基含量和非特异性相互作用水平;不同温度下贮藏时间较短的样品主要分布在第一、四象限(图8B),这些样品具有较高的Ca2+-ATPase活力、总巯基含量、α-螺旋相对含量、离子键和疏水相互作用相对含量。

图8 不同温度贮藏期间鱼糜凝胶特性和肌原纤维蛋白的主成分分析结果Fig. 8 PCA plots for gel properties and myofibrillar protein of surimi during storage at different temperatures
2.9 肌原纤维蛋白变化与凝胶特性的相关性分析结果
为了进一步揭示低温冷链贮藏导致的鱼糜肌原纤维蛋白变性与鱼糜凝胶化学作用力之间的关系,对肌原纤维蛋白相关指标及鱼糜凝胶化学作用力相对含量进行相关性分析。如图9所示,Ca2+-ATPase活力、总巯基含量、α-螺旋结构相对含量与离子键、疏水相互作用相对含量之间呈正相关,羰基含量、β-转角相对含量、无规卷曲相对含量与离子键、疏水相互作用相对含量呈负相关,与非特异性相互作用相对含量呈正相关,这说明低温冷链贮藏导致的肌原纤维蛋白的活性基团变性与鱼糜凝胶化学作用力的形成有密切联系。其中,离子键相对含量与Ca2+-ATPase活力(r>0.9)、总巯基含量(r>0.8)呈较强的相关性,进一步说明Ca2+-ATPase活力和总巯基含量与鱼糜凝胶离子键的形成有关。Chen Yanting等[39]研究发现无规卷曲含量与凝胶强度和持水性呈负相关,蛋白质结构的变化会破坏凝胶网络结构。
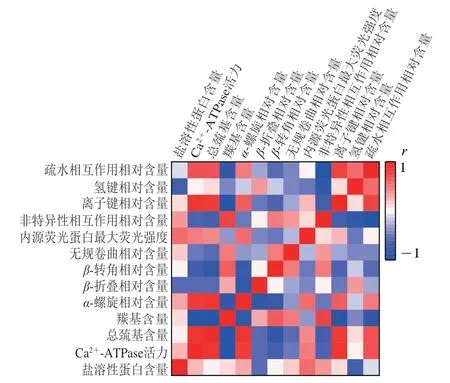
图9 不同温度贮藏期间鱼糜凝胶特性和肌原纤维蛋白的相关性分析结果Fig. 9 Correlation analysis between gel properties and myofibrillar protein of surimi during storage at different temperatures
3 结 论
本研究探讨了低温冷链贮藏对鱼糜凝胶化学作用力与肌原纤维蛋白相关特性的影响。结果表明,低温贮藏过程中鱼糜盐溶性蛋白含量和肌原纤维蛋白Ca2+-ATPase活力随贮藏时间的延长而下降,且在前3 d下降较快,而后逐渐趋于平缓。总巯基含量在冻藏前6 d下降较为迅速,而羰基含量呈现显著上升的趋势,较低的贮藏温度可以有效抑制蛋白质的氧化。贮藏过程中,肌原纤维蛋白α-螺旋相对含量下降,β-折叠和无规卷曲相对含量增加,说明蛋白质二级结构由有序向无序转变,蛋白微环境发生变化。鱼糜凝胶中离子键和疏水相互作用相对含量减少,氢键相对含量呈现先增加后减少。通过建立鱼糜肌原纤维蛋白与凝胶化学作用力之间的关系,阐明了肌原纤维蛋白中活性基团与凝胶化学作用力的形成密切相关,揭示了低温冷链贮藏引起的肌原纤维蛋白活性基团变性和凝胶化学作用力改变是鱼糜凝胶品质劣变的主要原因。因此,在贮藏初期防止蛋白氧化和冷冻变性是维持鱼糜凝胶特性的有效途径,而较低的冻藏温度可以有效缓解蛋白的氧化和冷冻变性。
