魔芋葡甘露聚糖通过肠道菌群-胆汁酸途径发挥降脂作用
2022-12-30邹晓莹何方晴孙远明李美英
邹晓莹,邓 婕,钟 静,王 倩,何方晴,孙远明,李美英
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642)
长期高脂饮食会导致血液和肝脏中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)含量上升,这些物质与载体蛋白结合后被输送至其他组织,从而诱导高脂血症、糖尿病等代谢性疾病发生,同时伴随肠道菌群失调和代谢紊乱[1-4]。近年来,多糖因其突出的降脂作用及天然安全的特性而成为最具研究价值的天然降脂食品之一,研究发现肠道菌群在多糖调节血脂和代谢紊乱中发挥关键作用[5-7],其中胆汁酸作为肠道微生物源性代谢物之一,与肠道菌群共同参与肠肝循环,是肠道菌群调节血脂代谢中的重要桥梁[8-9]。因此,调节肠道微生物组成及胆汁酸代谢可能是多糖改善血脂紊乱的新机制。
魔芋葡甘露聚糖(konjac glucomannan,KGM)是一种水溶性多糖,其主链由D-葡萄糖和D-甘露糖组成,并通过β-1,4糖苷键连接,平均每19个单元存在1个以酯键结合的乙酰基[10]。研究表明,KGM具有良好的减肥降脂作用[11-12],可通过减少游离脂肪酸、神经酰胺和氧化三酰甘油的生物合成以改善脂质代谢紊乱[13]。KGM难以被人体消化酶催化水解,但可被肠道菌群发酵利用,引起肠道微生物结构及肠道微生物源性代谢物发生变化[14-15]。Kang Yongbo等[16]发现KGM可促进埃氏巨球型菌(Megasphaera elsdenii)等有益菌的增殖,降低与肥胖相关的有害菌泽泻菌属(Alistipes)和金氏副杆菌菌属(Parabacteroides goldsteinii)等相对丰度,并下调脂肪合成相关基因表达来预防肥胖。因此调节肠道菌群已成为KGM功能研究的重要切入点,而KGM对肠道菌群及其代谢物(如短链脂肪酸)的影响、肠道胆汁酸代谢与血脂代谢的关系鲜见报道。据此,本研究拟从肠道微生物和胆汁酸代谢角度分析KGM的降脂作用机制。
1 材料与方法
1.1 动物、材料与试剂
5 周龄SPF级(无特定病原体)雄性金黄地鼠,体质量(92.76±0.40)g,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2019-0009;实验方案经华南农业大学实验动物中心伦理委员会批准,实验伦理审查编号:2020B052。
基础饲料(含11%(质量分数,下同)脂肪、21%蛋白质、68%碳水化合物)、高脂饲料(含35%脂肪、21%蛋白质,44%碳水化合物)及含2%(质量分数,下同)、6%、10% KGM的高脂饲料 南通特洛菲饲料科技有限公司。
KGM(纯度>90%) 湖北花仙子魔芋制品公司;无水乙醚、氯化钠、浓硫酸(分析纯) 天津百世化工有限公司;甲酸(质谱级) 美国Thermo Fisher公司;甲醇、乙腈(质谱级) 德国默克公司;TC、TG、低密度脂蛋白胆固醇(low density lipoproteincholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)试剂盒、脂质校准品 深圳迈瑞生物医疗电子股份有限公司;乙酸、丙酸、丁酸、异戊酸(色谱纯) 美国Sigma-Aldrich公司;戊酸(色谱纯) 上海麦克林生化科技有限公司;异丁酸(色谱纯) 德国DRE公司;胆酸(cholic acid,CA)、甘氨胆酸(glycocholic acid,GCA)、熊去氧胆酸(ursodeoxycholic acid,UDCA)、甘氨熊去氧胆酸(glycoursodeoxycholic acid,GUDCA)、鹅去氧胆酸(chenodeoxycholic acid,CDCA)、脱氧胆酸(deoxycholic acid,DCA)、石胆酸(lithocholic acid,LCA)(均为色谱纯) 上海源叶生物科技有限公司;总RNA提取试剂盒 广州捷倍斯生物科技有限公司;Hifair III 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)、Heiff qPCR SYBR Green Master Mix(Low Rox) 翌圣生物科技(上海)股份有限公司。
1.2 仪器与设备
BS-380全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司;7890B气相色谱仪 美国Agilent公司;Axio Imager D2正置荧光显微镜 德国Zeiss公司;Illumina MiSeq PE300测序平台、Ultimate 3000超高效液相色谱串联四极杆静电场轨道阱质谱(ultra performance liquid chromatography-quadrupole-exactive orbitrap mass spectroscopy,UPLC-Q-Exactive Orbitrap-MS)仪 赛默飞世尔科技(中国)有限公司;QuantityStudio 3实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国Applied Biosystems公司、DNA Engine PCR扩增仪美国Bio-Rad公司。
1.3 方法
1.3.1 动物分组与干预
以基础饲料适应性喂养1 周后,根据体质量将地鼠随机分为Control组、高脂模型组(high fat diet,HFD)组、2% KGM(低剂量)组、6% KGM(中剂量)组和10% KGM(高剂量)组,每组6 只。Control组饲喂基础饲料;HFD组饲喂高脂饲料;2%、6%和10% KGM组分别饲喂含20、60、100 g/kg KGM的高脂饲料。地鼠在SPF环境饲养干预5 周,实验期间自由摄食、饮水,相对湿度控制在40%~60%,室温(22±2)℃,12 h明暗交替。每周称量体质量并计算体质量增长量(每周体质量/g-初始体质量/g);每天定时记录地鼠摄食量,结果取平均值,单位为g/d。
1.3.2 样品采集
实验结束后,地鼠禁食不禁水7 h后,用无水乙醚麻醉,眼球取血,室温放置2 h后,以4 ℃、3 000 r/min离心10 min,收集上清液保存于-80 ℃冰箱。解剖收集肝脏、附睾脂肪和肾周脂肪并称质量,计算肝脏指数(肝脏质量/体质量×100%)。取接近回肠一侧的盲肠内容物用于胆汁酸含量测定,取接近结肠一侧盲肠内容物用于短链脂肪酸浓度测定及菌群分析。取左上肝叶、左侧附睾脂肪以及距离盲肠1~2 cm处结肠用4%(质量分数)多聚甲醛溶液固定,用于病理组织切片观察。
1.3.3 血清和肝脏脂质浓度测定
取0.1 g肝脏组织加入0.9 mL预冷生理盐水,采用冷冻研磨机制备组织匀浆。采用全自动生化分析仪测定血清TC、TG、LDL-C、HDL-C浓度和肝脏匀浆TC、TG浓度。
1.3.4 组织切片病理学分析
将收集的左上肝叶、左侧附睾脂肪以及结肠固定,经脱水、石蜡包埋制备成切片,经苏木精-伊红(hematoxylin-eosin,HE)染色后,置于显微镜下观察。
1.3.5 盲肠内容物菌群分析
取盲肠内容物委托上海美吉生物医药科技有限公司提取16S DNA,按照16S DNA V3~V4区域设计引物:338F(5’-ACTCCTACGGGAGGCAGCAG-3’)、806R(5’-GGACTACHVGGGTWTCTAAT-3’),采用Illumina MiSeq PE300平台进行测序。按照操作分类单元(operational taxonomic unit,OTU)划分进行物种丰度组成和多样性分析,采用非参数检验进行显著性分析。
1.3.6 短链脂肪酸浓度测定
参考文献[17-18]的方法提取短链脂肪酸,测定盲肠内容物中乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸6种短链脂肪酸浓度及其总浓度。
1.3.7 盲肠内容物代谢谱分析
参考文献[19]的方法对样本进行前处理,采用UPLCQ-Exactive Orbitrap-MS测定盲肠内容物中代谢物变化。色谱条件为:采用ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温40 ℃;流动相A为含体积分数(下同)0.1%甲酸的乙腈溶液,流动相B为含0.1%甲酸的10 mmol/L乙酸铵溶液;流速0.15 mL/min;进样量5 μL。洗脱程序:0~1.5 min,5% A;1.5~2.0 min,25% A;2.1~4.0 min,50% A;4.1~6.0 min,70% A;6.1~9.0 min,80% A;9.1~15.5 min,95% A;15.6~16.0 min,5% A;16.1~17.0 min,5% A。参考文献[15]的方法进行质谱参数设置和分析。采用Compound Discover 4.2软件处理盲肠内容物代谢质谱数据,参考mz Cloud数据库(http://www.mzCloud.org)对代谢物的保留时间和一级片段m/z进行定性分析。利用SIMCA-P 14.0软件对各组代谢物峰面积(去除空白样峰面积)进行主成分分析(principal component analysis,PCA)和偏最小二乘判别分析以及差异代谢物筛选,并在Metaboanalyst 5.0数据库(https://www.metaboanalyst.ca/)中进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析以及类别富集分析。
1.3.8 盲肠内容物胆汁酸质量浓度测定
为进一步分析盲肠内容物代谢物中胆汁酸质量浓度变化,对上述盲肠内容物代谢谱分析方法进行优化,高分辨质谱采用电喷雾电离离子源,采用负离子模式,参照表1优化碰撞能,同时根据保留时间、一级片段、二级碎片离子信息进行定性,根据不同胆汁酸化合物峰面积采用外标法计算其质量浓度。
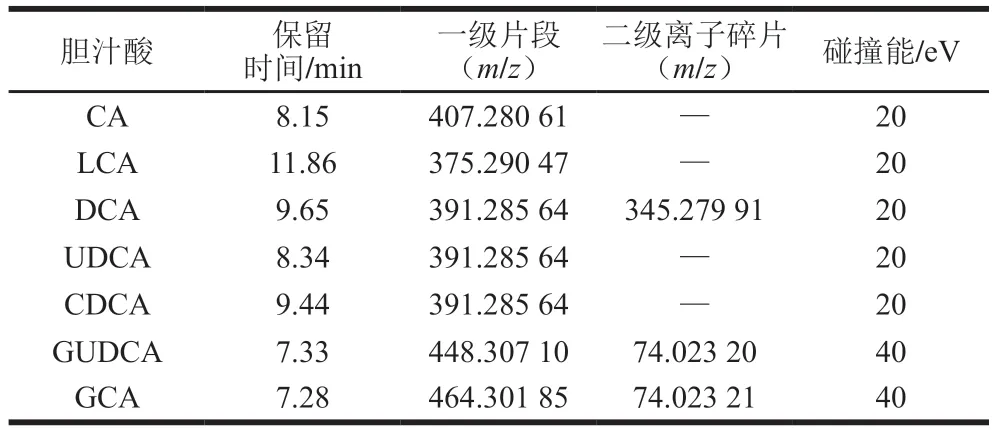
表1 胆汁酸质谱分析条件Table 1 Mass spectrometric parameters for analysis of bile acids
1.3.9 实时荧光定量PCR测定
参考总RNA提取试剂盒说明书提取地鼠肝脏组织RNA,反转录得到cDNA,-20 ℃保存。根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库和文献[20]设计引物(表2)。参照Heiff qPCR SYBR Green Master Mix(Low Rox)试剂盒说明书进行实时荧光定量PCR,反应条件为:95 ℃、5 min;95 ℃、10 s;60 ℃、34 s;40个循环。以GAPDH为内参基因,采用2-ΔΔCt法计算肝脏组织中各基因表达水平。
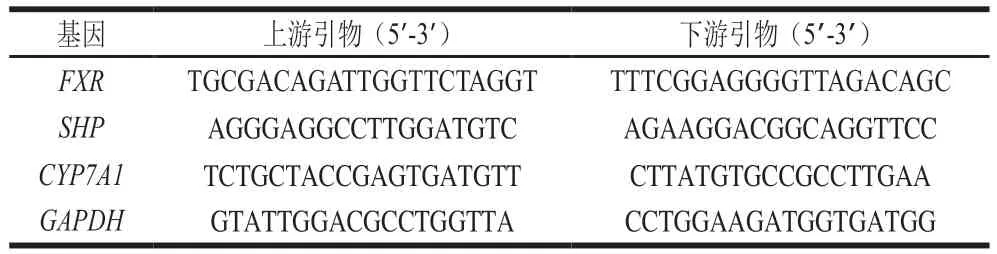
表2 金黄地鼠肝脏胆汁酸合成相关基因PCR引物Table 2 Primer sequences used for PCR amplification of genes related to bile acid synthesis in liver tissues of golden hamsters
1.4 数据统计与分析
实验设置两次平行,结果以平均值±标准差表示。利用Excel软件处理数据,采用SPSS Statistic 21软件进行单因素方差分析,若方差齐性时采用最小显著差异法进行显著性分析,若不具备方差齐性,采用非参数检验-Tamhane检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 KGM对高脂血症金黄地鼠体质量增长与摄食量的影响
如表3所示,6%和10% KGM干预组地鼠体质量增长量显著低于HFD组(P<0.05),表明6%和10% KGM可抑制高脂饮食导致的体质量增长,而2% KGM组体质量增长量在第4、5周相较HFD组无显著差异(P>0.0.5)。各组地鼠干预期间摄食量无明显差异(图1)。
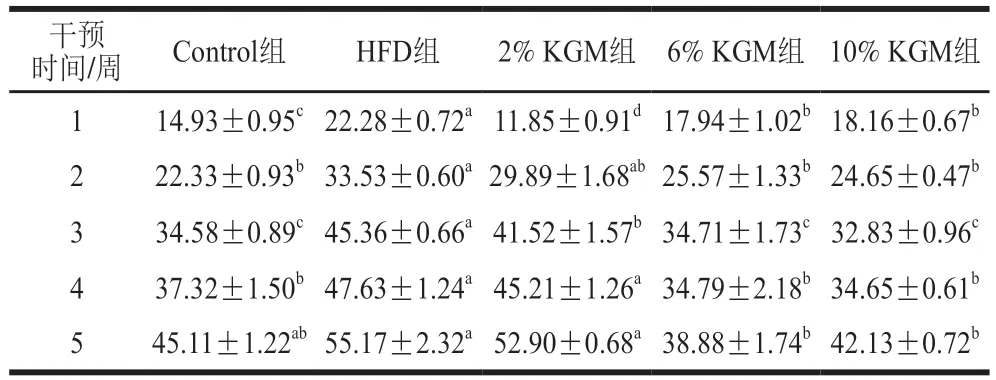
表3 KGM对高脂血症金黄地鼠体质量增长量的影响Table 3 Effect of KGM on body mass gain in hyperlipidemic hamsters g
图1 KGM干预期间各组金黄地鼠摄食量Fig. 1 Effect of KGM on food intake in hyperlipidemic hamsters
2.2 KGM对高脂血症金黄地鼠肝脏与组织脂肪质量的影响
如表4所示,与HFD组相比,3个KGM干预组中6%、10% KGM干预后肝脏质量分别显著下降16.00%(P<0.05)和14.64%(P<0.05),附睾脂肪和肾周脂肪质量干预前后无显著变化(P>0.0.5)。同时,Control组肝脏指数与HFD组相比存在显著差异(P<0.05),但KGM干预组较HFD组无显著差异(P>0.0.5)。
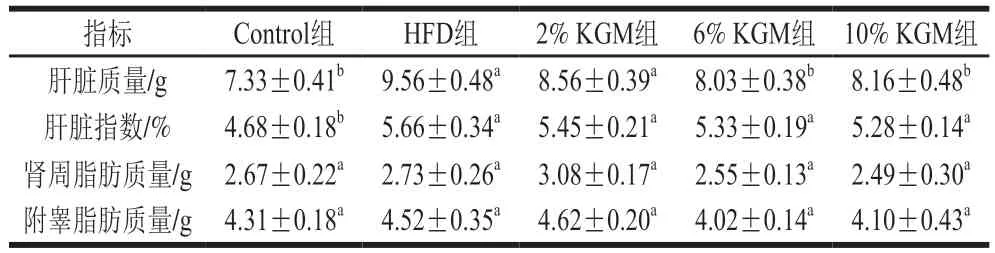
表4 KGM对高脂血症金黄地鼠肝脏、肾周脂肪和附睾脂肪质量的影响Table 4 Effect of KGM on liver, perirenal fat and epididymal fat mass in hyperlipidemic hamsters
如图2所示,肝脏及附睾脂肪组织切片显示,相较HFD组,6%和10% KGM组肝细胞排列趋于整齐,脂质空泡数量减少(黑色箭头)且附睾细胞脂肪细胞体积较小。
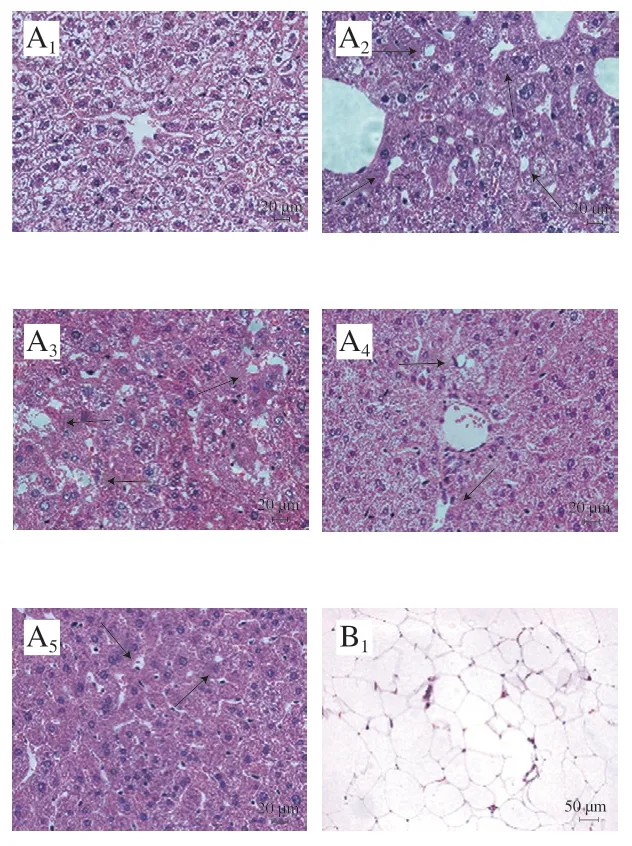
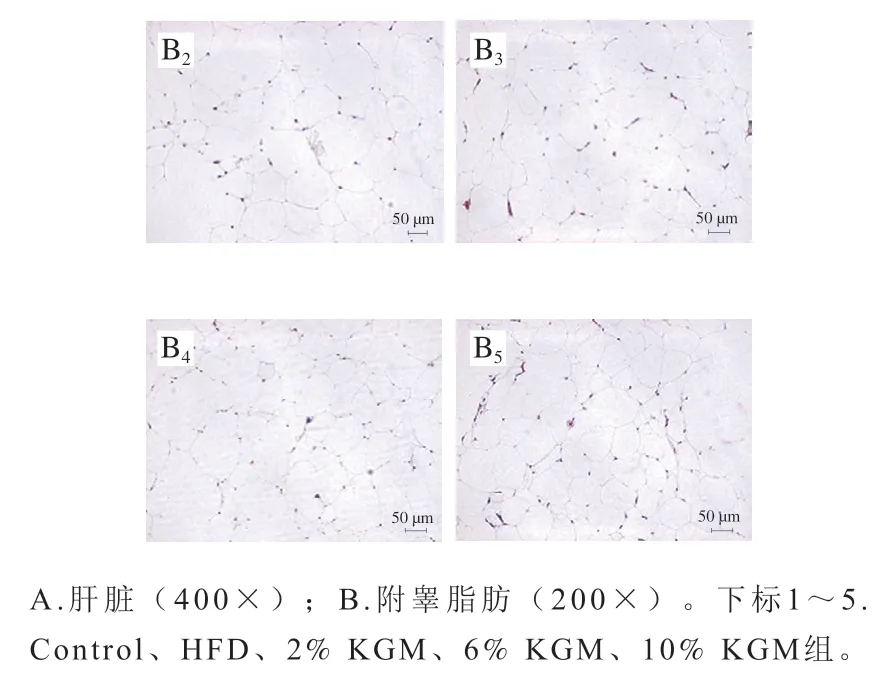
图2 KGM对高脂血症金黄地鼠肝脏和附睾脂肪组织形态的影响Fig. 2 Effect of KGM on histomorphology of liver and epididymal fat in hyperlipidemic hamsters
2.3 KGM对高脂血症金黄地鼠血清与肝脏脂质水平的影响
如表5所示,与HFD组相比,6%和10% KGM干预后血清中TC浓度分别显著下降33.85%和28.17%(P<0.05),TG浓度分别显著下降32.04%和32.21%(P<0.05),LDL-C浓度分别显著下降46.57%和39.26%(P<0.05),HDL-C浓度分别显著下降19.78%和15.40%(P<0.05),表明6%和10% KGM可显著抑制高脂饮食导致的血清脂质浓度升高。此外,6% KGM组肝脏TC、TG浓度显著低于HFD组,2% KGM组TC浓度和10%KGM组TG浓度相较HFD组显著降低(P<0.05)。
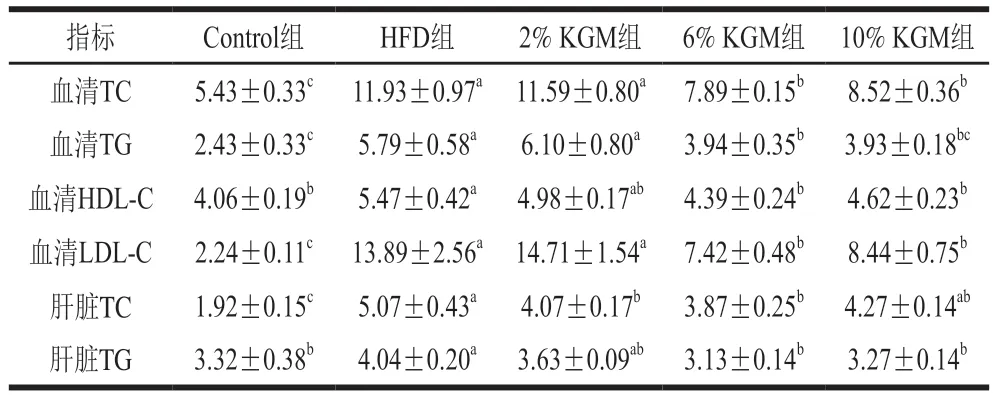
表5 KGM对高脂血症金黄地鼠血清和肝脏脂质浓度的影响Table 5 Effect of KGM on serum and hepatic lipid levels in hyperlipidemic hamsters mmol/L
2.4 KGM对高脂血症金黄地鼠短链脂肪酸和结肠组织结构的影响
与HFD组相比,2%和10% KGM组乙酸浓度显著上升(P<0.05),6% KGM组有上升趋势(P>0.05)。2%、6%和10% KGM组丁酸浓度分别较HFD组显著上升22.09%、31.40%和23.26%(P<0.05),丙酸和戊酸浓度同样存在上升趋势,但均差异不显著(表6)。各KGM干预组总短链脂肪酸浓度均显著上升(P<0.05),表明KGM在一定程度具有调节短链脂肪酸的能力。病理切片(图3)显示HFD组结肠组织杯状细胞(黑色圆圈)生长异常,固有层受损,绒毛萎缩,黏膜下层结构(黑色箭头)受损,2%、6%和10% KGM均具有缓解杯状细胞生长异常的作用。
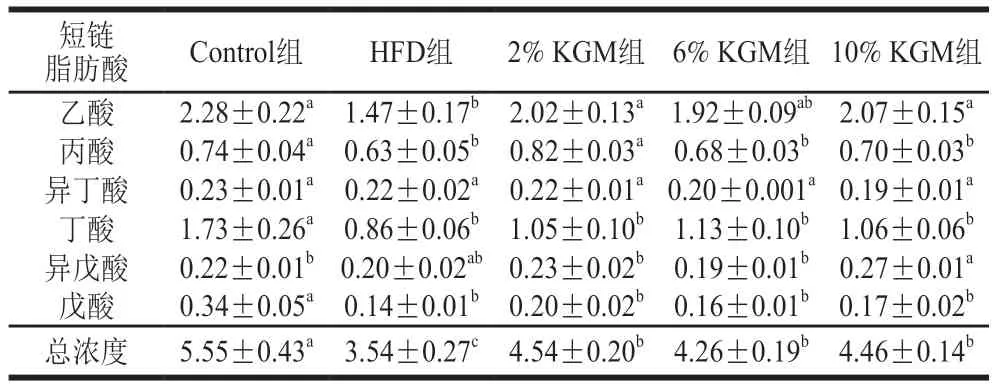
表6 KGM对高脂血症金黄地鼠短链脂肪酸浓度的影响Table 6 Effect of KGM on short fatty acid levels in hyperlipidemic hamsters mmol/L
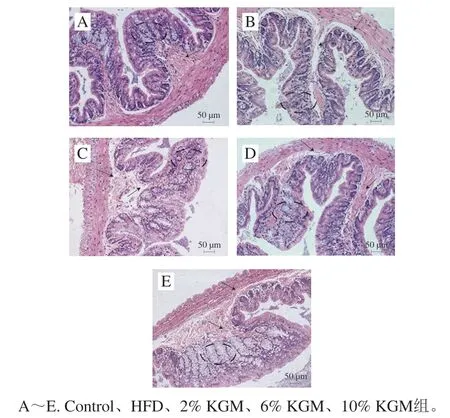
图3 KGM对高脂血症金黄地鼠结肠组织结构的影响(200×)Fig. 3 Effect of KGM on the structure of colon tissues in hyperlipidemic hamsters (200 ×)
2.5 KGM对高脂血症金黄地鼠肠道菌群多样性的影响
图4A显示,HFD组、2%、6%和10% KGM组Shannon指数均显著高于Control组(P<0.05),表明HFD组、2%、6%和10% KGM组肠道菌群alpha多样性相较Control组显著升高。主坐标分析(principal co-ordinates analysis,PCoA)结果如图4B所示,PC1、PC2贡献率分别为34.35%和17.19%,Control组与HFD组区别明显,随着KGM干预剂量的增加,KGM干预组样本点逐渐远离HFD组,说明随着KGM干预剂量的增加,金黄地鼠肠道菌群组成与HFD组区别逐渐明显。
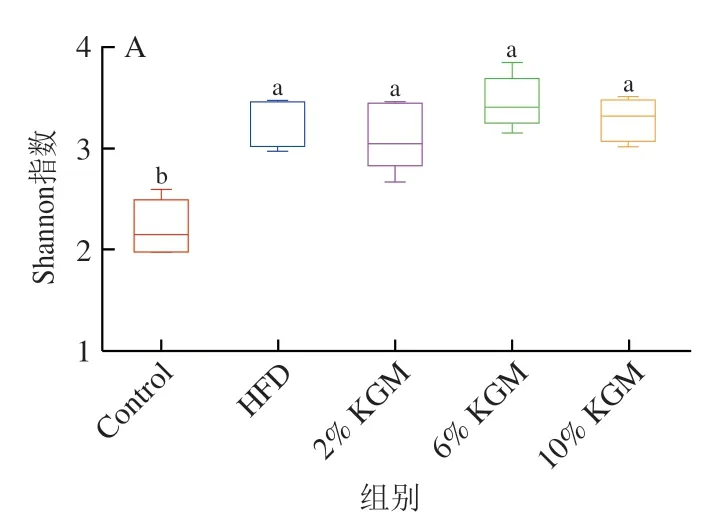
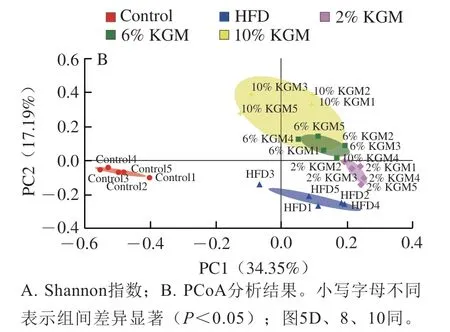
图4 KGM对高脂血症金黄地鼠肠道菌群多样性的影响Fig. 4 Effect of KGM on the diversity of gut microbiota in hyperlipidemic hamsters
2.6 KGM对金黄地鼠肠道菌群物种组成和差异物种的影响
基于门水平分类,各组肠道菌群组成如图5所示。高脂饮食可导致厚壁菌门(Firmicutes)与拟杆菌门(Bateroidota)相对丰度比值(F/B)发生显著变化(P<0.05),10% KGM干预后F/B较HFD组显著降低。同时,HFD组厚壁菌门、拟杆菌门、脱硫菌门(Desulfobacterota)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteriota)在肠道菌群中相对丰度分别为86.16%、1.16%、8.77%、1.33%和2.28%。与HFD组相比,2% KGM组脱硫菌门相对丰度(2.58%)明显减少,6% KGM组放线菌门相对丰度(0.43%)明显减少,10% KGM组拟杆菌门相对丰度(18.49%)明显上升,脱硫菌门相对丰度(1.77%)和放线菌门相对丰度(0.42%)明显下降。
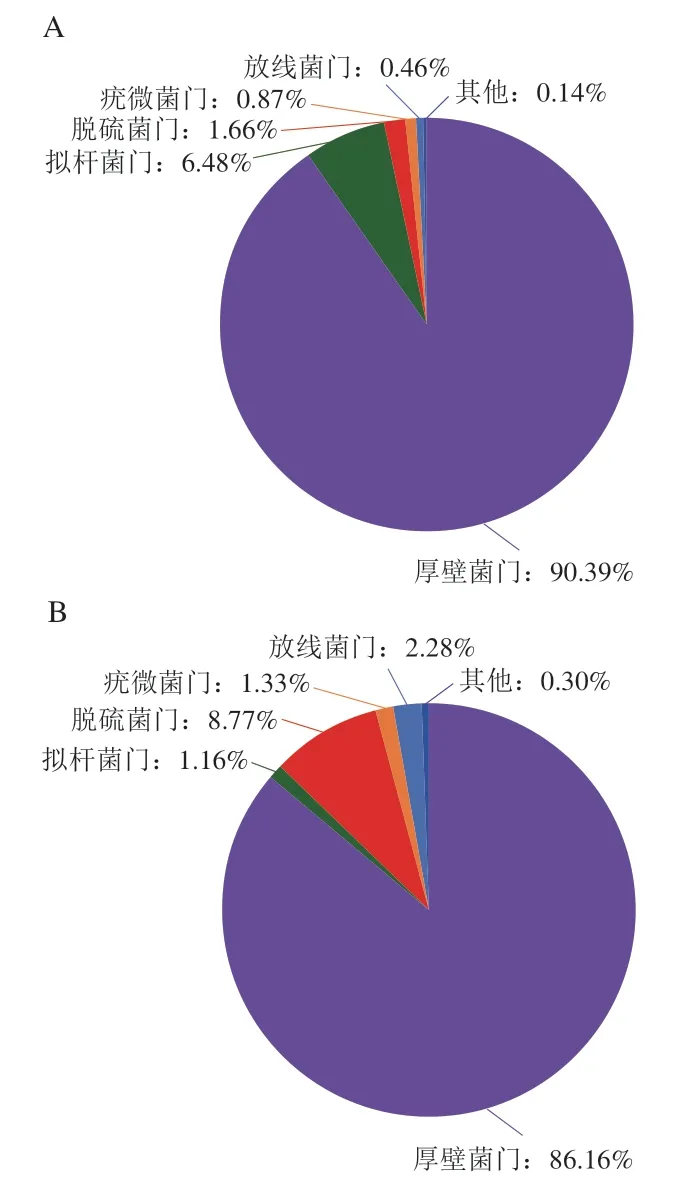
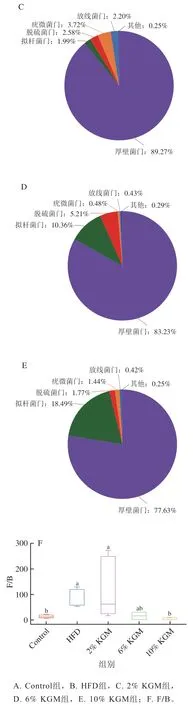
图5 KGM对高脂血症金黄地鼠肠道菌群门分类水平物种组成的影响Fig. 5 Effect of KGM on the composition of gut microbiota at the phylum level in hyperlipidemic hamsters
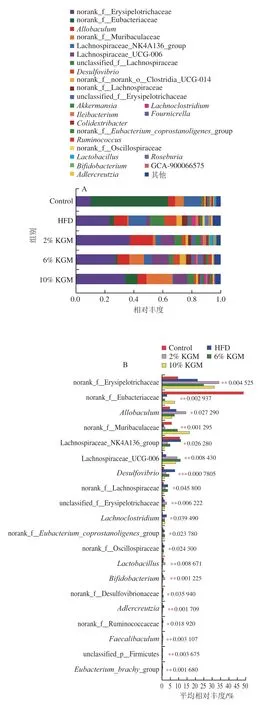
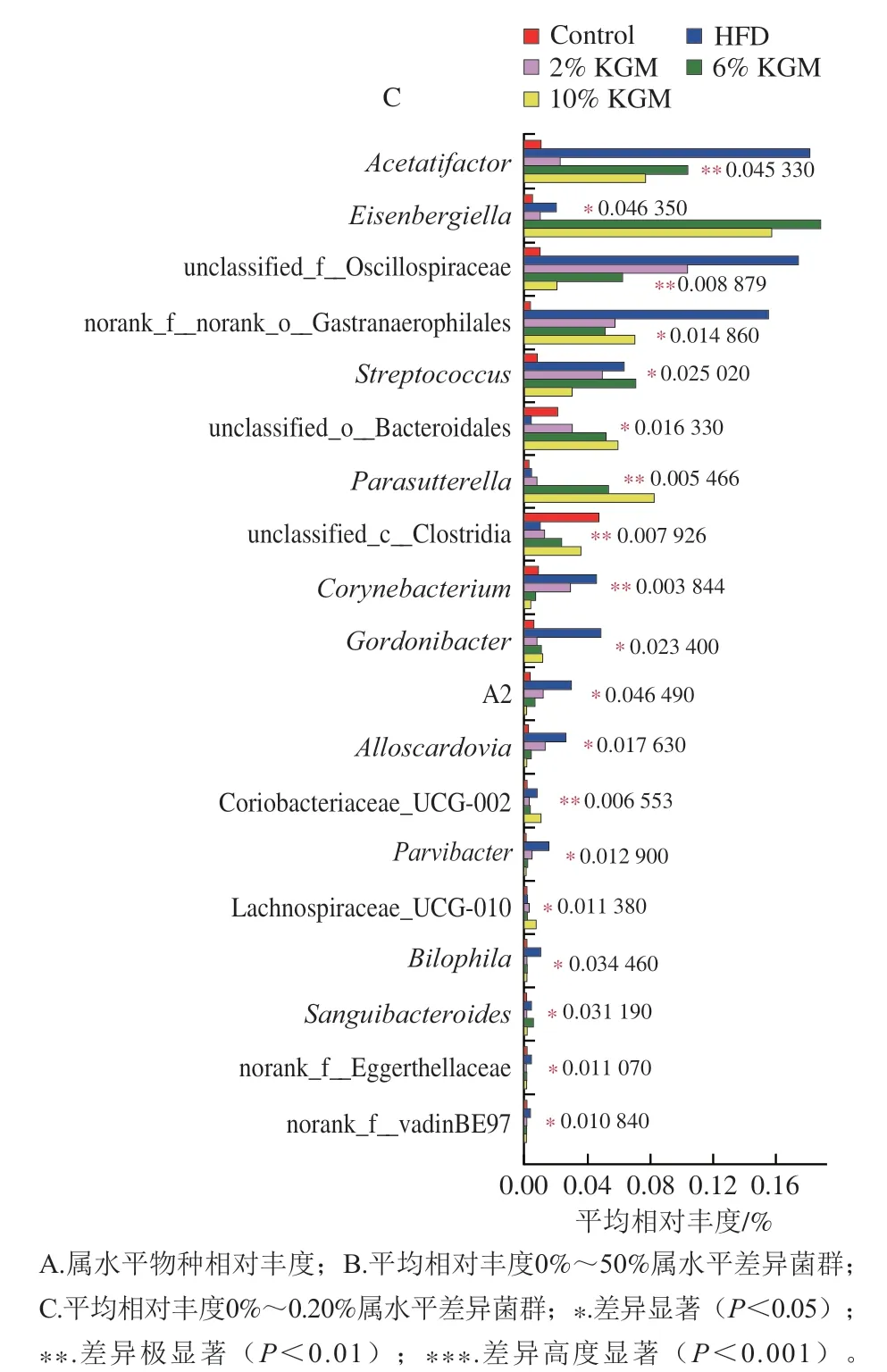
图6 KGM对高脂血症金黄地鼠肠道菌群属分类水平物种组成的影响Fig. 6 Effect of KGM on the composition of gut microbiota at the genus level in hyperlipidemic hamsters
基于属水平分类,各组肠道微生物物种构成和优势菌属分布情况如图6A所示。进一步分析各组间的差异菌属,5 组共有39个差异菌属,其中6%和10% KGM干预后棒状杆菌(Corynebacterium)、嗜胆菌属(Bilophila)、双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)、安德克氏菌属(Adlercreutzia)和戈登氏杆菌属(Gordonibacter)等相对丰度显著下降(图6B、C)。
2.7 KGM对高脂血症金黄地鼠盲肠内容物代谢物的影响
如图7A所示,对各样本中的代谢物峰面积进行PCA,结果显示HFD组样本点与Control组明显分离,6%和10% KGM组与HFD组代谢轮廓存在显著差异,2% KGM组样本点与HFD组距离更近。将HFD组分别与Control组、不同剂量KGM组比较,以变量投影重要性(variable important in projection,VIP)值>1且P<0.05为条件筛选出51种差异代谢物(图7B),经代谢物类别富集分析后,将代谢物归类为胆汁酸和脂肪酸等12个类别,其中胆汁酸类化合物数量占比(24%)最高(图7C)。进一步对代谢物进行KEGG通路富集分析,与KGM影响高脂血症金黄地鼠盲肠内容物代谢物相关的通路主要涉及嘌呤代谢、初级胆汁酸生物合成和脂肪酸生物合成等8 条通路(图7D)。
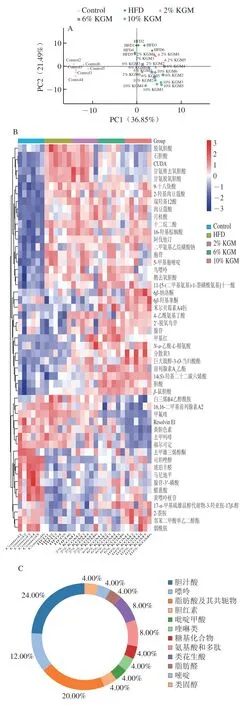
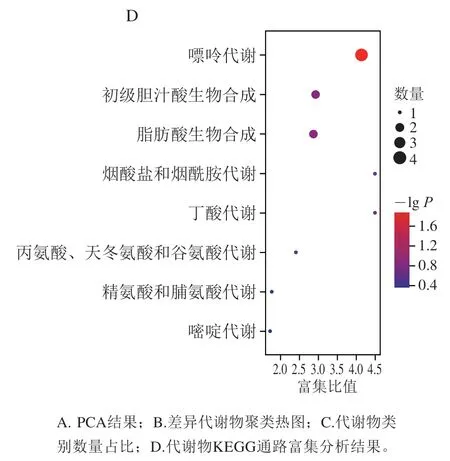
图7 KGM对高脂血症金黄地鼠盲肠内容物代谢物的影响Fig. 7 Effect of KGM on metabolites in cecal contents from hyperlipidemic hamsters
2.8 KGM对高脂血症金黄地鼠盲肠内容物胆汁酸的影响
如图8所示,与HFD组相比,6%、10% KGM干预后DCA和LCA质量浓度显著降低(P<0.05),并使GCA质量浓度显著升高(P<0.05)。同时,与HFD组相比,6% KGM组UDCA显著升高,6%和10% KGM组CA质量浓度与HFD组相比分别升高4.65 倍和8.35 倍,但无显著差异。
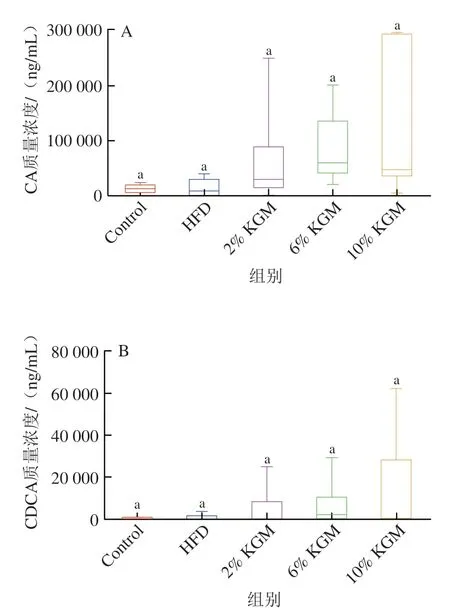
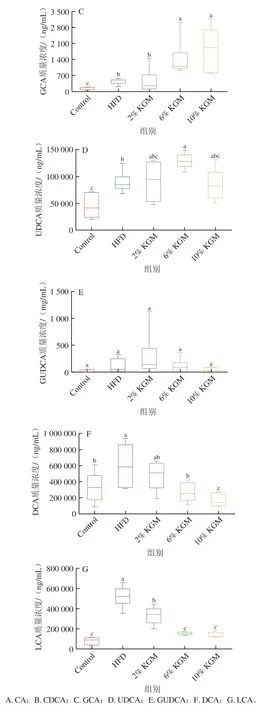
图8 KGM对高脂血症金黄地鼠盲肠内容物胆汁酸质量浓度的影响Fig. 8 Effect of KGM on bile acid levels of cecal contents from hyperlipidemic hamsters
2.9 显著变化菌属相对丰度与胆汁酸、血脂水平Spearman相关性分析结果
对差异菌属的相对丰度和胆汁酸、血脂水平进行Spearman相关性分析(图9),结果表明,UDCA质量浓度与Lachnoclostridium、Acetatifactor和链球菌属(Streptococcus)等9个菌属相对丰度呈显著正相关;CA质量浓度与Parasutterella等3个菌属相对丰度呈显著正相关,与乳杆菌属、嗜胆菌属相对丰度呈显著负相关;DCA质量浓度与双歧杆菌属、棒状杆菌属、Parvibacter、Lachnospiraceae_UCG-010等7个菌属相对丰度呈正相关,与Lachnospiraceae_NK4A136_group和副杆菌属等5个菌属相对丰度呈现负相关;LCA质量浓度与脱硫弧菌属(Desulfovibrio)、Lachnoclostridium、双歧杆菌属、链球菌属、棒状杆菌属、戈登氏杆菌属和嗜胆菌属等22个菌属相对丰度呈显著正相关,与Lachnospiraceae_NK4A136_group等6个菌属相对丰度呈负相关;GCA质量浓度与Acetatifactor、Eisenbergiella和Parasutterella等9个菌属相对丰度呈显著正相关,与norank_f__Lachnospiraceae和乳杆菌属相对丰度呈现负相关。TC、TG、HDL-C、LDL-C浓度主要与双歧杆菌属、戈登氏杆菌属、粪杆菌(Faecalibacterium)和Enbacterium_brachy_group等12个菌属菌呈现显著相关。此外,TC浓度与脱硫弧菌属、Lachnoclostridium等8个菌属相对丰度呈现显著正相关;TG浓度与脱硫弧菌属、棒状杆菌属和嗜胆菌属等6个菌属相对丰度呈显著正相关;HDL-C浓度与嗜胆菌属、脱硫弧菌属及Lachnoclostridium等8个菌属相对丰度呈显著正相关;LDL-C浓度与链球菌属及Lachnospiraceae_UCG-006等7个菌属相对丰度呈显著正相关。
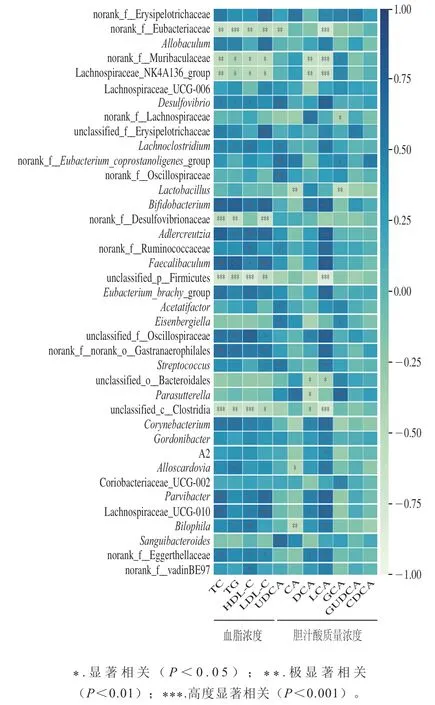
图9 金黄地鼠肠道菌群显著变化菌属与胆汁酸、血脂水平Spearman相关性分析结果Fig. 9 Spearman’s correlation analysis of significantly changing gut bacterial genera and bile acids from hyperlipidemic hamsters
2.10 KGM对高脂血症金黄地鼠胆汁酸代谢基因调控的影响
KGM对高脂血症金黄地鼠肝脏为法尼醇X受体(farnesoid X receptor,FXR)、小异二聚体伴侣受体(small heterodimer partner,SHP)和胆汁酸合成关键酶胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)基因表达的影响如图10所示。与HFD相比,2%、6%和10% KGM干预后肝脏FXRmRNA相对表达水平显著下降。6% KGM组肝脏CYP7A1mRNA相对表达水平与其他组相比显著上升,10% KGM组肝脏CYP7A1基因表达较HFD组显著上调43.27%(P<0.05)。同时6%、10% KGM组金黄地鼠的SHPmRNA表达水平高于Control、HFD以及2% KGM组,但差异不显著(P>0.05)。
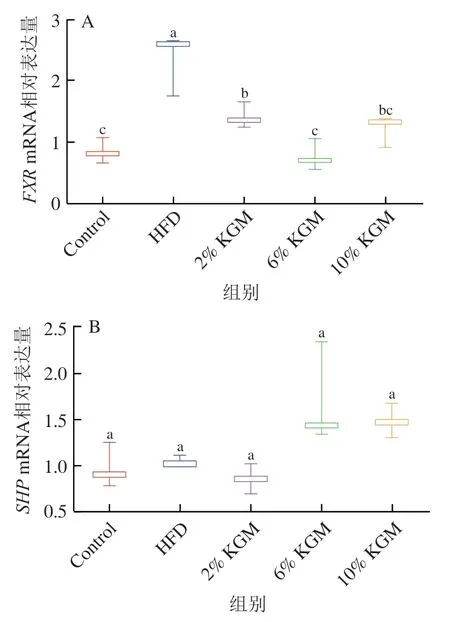
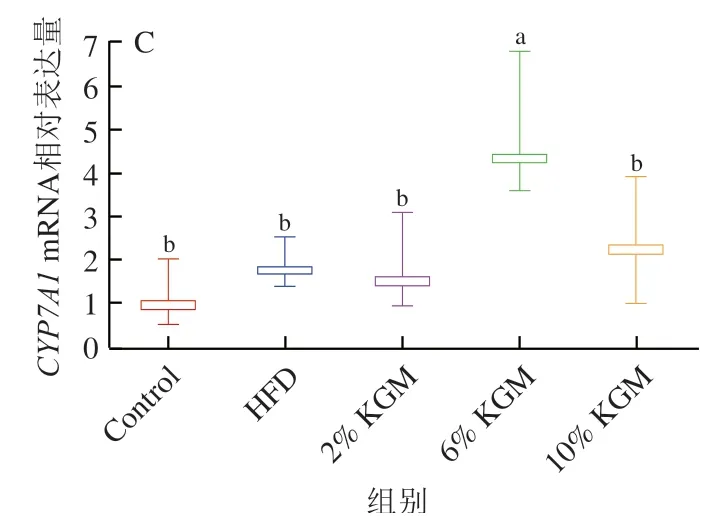
图10 KGM对高脂血症金黄地鼠肝脏FXR(A)、SHP(B)和CYP7A1(C)mRNA表达的影响Fig. 10 Effect of KGM on relative mRNA expression of FXR (A),SHP (B) and CYP7A1 (C) in liver from hyperlipidemic hamsters
3 讨 论
高脂饮食导致机体血液中TG和TC含量升高,二者与载体蛋白结合后被输送到组织中,从而诱导糖尿病、动脉粥样硬化等相关代谢疾病的发生[1,21]。本研究中HFD组可显著提高血清TC、TG和LDL-C以及肝脏TC、TG浓度,说明高脂动物模型构建成功。补充5 周6%、10% KGM后,地鼠血清和肝脏脂质水平显著下降,与HFD组相比,脂肪细胞体积变小,肝脏脂质空泡数量减少,这与以往研究结果[13,16]一致。
具有胆盐水解酶(bile salt hydrolase,BSH)活力的肠道菌群是调节机体胆汁酸代谢的重要菌群,主要包括双歧杆菌属、乳杆菌属、拟杆菌属(Bacteroides)和李斯特菌属(Listeria)等[9,22]。它们在回肠中发挥去结合作用将结合胆汁酸转化为非结合胆汁酸,随后非结合胆汁酸在羟基化和差向异构化作用下转化为DCA、LCA和UDCA等次级胆汁酸[22-24]。Wan Yi等[25]对307 名健康人群开展为期6个月不同脂肪含量的膳食干预研究,发现高脂饮食会促进具有BSH活力的双歧杆菌属和乳杆菌属等菌群增殖,同时显著增加DCA含量。本研究中,具有BSH活力的菌群在各干预组呈现了不同的变化趋势,HFD组双歧杆菌属和乳杆菌属等菌群相对丰度显著增加,与Wan Yi等[25]研究结果一致[25]。与HFD组相比,6%、10% KGM干预组双歧杆菌属和乳杆菌属相对丰度显著下降,DCA、LCA质量浓度显著降低。同时相关性分析结果显示DCA、LCA及血清TC、TG、LDL-C、HDL-C水平均与双歧杆菌属相对丰度呈显著正相关。以上结果表明KGM可能通过降低具有BSH活力菌属相对丰度来减少次级胆汁酸DCA和LCA质量浓度,调节脂质紊乱和改善肠道健康。嗜胆菌属作为一种胆汁酸耐受菌属,可将牛磺胆酸转化为DCA,因此嗜胆菌属数量增多同样会导致DCA含量显著升高[26],本研究中6%和10% KGM干预后,与TG、HDL-C浓度显著正相关的嗜胆菌属相对丰度显著下降,表明KGM可抑制嗜胆菌属增殖从而降低DCA质量浓度,并与血脂水平存在显著相关性。此外,本研究以VIP值>1、P<0.05为条件筛选出51种盲肠内容物差异代谢物,主要参与初级胆汁酸合成和脂肪酸生物合成等8 条代谢通路,其类别富集分析结果显示胆汁酸类代谢物数量占比24%,在所有代谢物类别中最高,进一步表明胆汁酸在KGM调节血脂紊乱中发挥重要作用。
胆汁酸是胆固醇从体内排出的主要途径,胆固醇通过CYP7A1和CYP8B1等胆汁酸合成关键酶生成CA和CDCA,并与肝细胞中甘氨酸和牛磺酸结合,以结合胆汁酸的形式被释放到胆囊和小肠中[27-28]。经过回肠中肠道菌群的修饰作用转化的胆汁酸,对肝脏FXR有调节作用[29-30]。在肥胖小鼠中,FXR可诱导肝脏中FXR和成纤维细胞生长因子15(fibroblast growth factor,FGF15)信号通过门静脉与肝细胞表面受体结合,抑制CYP7A1表达,从而抑制胆汁酸合成[31-32]。本研究结果显示6% KGM可抑制肝脏中FXR基因表达,从而上调CYP7A1基因表达,促进肝脏中胆固醇合成胆汁酸以减少肝脏中TC浓度,在Shi Linlin等[33]的麦冬多糖对高脂血症小鼠胆汁酸影响的研究中也发现类似的调控途径。
综上,KGM或通过降低具有BSH活力的肠道菌群双歧杆菌属、乳杆菌属和嗜胆菌属相对丰度,抑制结合型初级胆汁酸转化为次级胆汁酸DCA和LCA,同时上调CYP7A1的mRNA表达促进CA生成,从而发挥调节脂质紊乱及改善肠道黏膜损伤的作用。
