副干酪乳杆菌Z17-壳聚糖复配对大肠杆菌O157:H7的抑菌效果及作用机制
2022-12-30谷恒梅马鑫敏杨卫星康艳萍
谷恒梅,马鑫敏,赵 宇,杨卫星,孟 锋,康艳萍,陈 萍
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
大肠杆菌O157:H7是造成人类食源性疾病的主要病原体[1]。美国疾病预防与控制中心报告显示,2006年美国每10万 人中就有3.4万 人感染大肠杆菌O157:H7[2];2012年在德国因食用被大肠杆菌O157:H7污染的冷冻草莓引起该国最大的食源性疾病爆发,约11 000 人感染[3]。
乳酸菌具有抑制致病菌和延长食品保质期的作用,其主要通过代谢产物有机酸、细菌素来抑制细菌的生长繁殖[4-5]。Wang Ni等[6]研究发现通过添加植物乳杆菌无细胞发酵上清液和控制培养基pH值能有效抑制地衣芽孢杆菌形成生物膜,并延缓细菌生物膜的形成;孙悦等[7]筛选的乳酸菌XCT1-1无细胞发酵上清液的粗提物能够破坏耐药性大肠杆菌细胞壁和细胞膜。研究发现,副干酪乳杆菌作为天然生物抑菌剂被广泛应用于食品安全生产中,其代谢产物副干酪乳杆菌无细胞发酵上清液是能够对宿主产生积极影响的可溶性物质[8]。
壳聚糖是天然的抑菌剂,其相容性较好且安全无毒[9]。王月慧等[10]研究发现壳聚糖可与细菌细胞内物质反应,阻止细菌细胞生长代谢从而达到抑菌作用。本课题组前期研究发现,将具有协同抑菌作用的壳聚糖与副干酪乳杆菌无细胞发酵上清液粗提物复配使用可提高抑菌活性,降低单一抑菌剂的使用量,但两者复配的抑菌机理仍有待深入探索。因此,本研究以副干酪乳杆菌无细胞发酵上清液粗提物与壳聚糖复配作为抑菌剂,对草莓中大肠杆菌O157:H7进行处理,并对抑菌效果进行评价,同时通过流式细胞术、傅里叶变换红外光谱、拉曼光谱及扫描电子显微镜技术进行分析以揭示其抑菌机制。
1 材料与方法
1.1 菌株、材料与试剂
大肠杆菌O157:H7(CICC21530)、副干酪乳杆菌Z17保藏于吉林农业大学食品安全实验室。
丹东‘九九’草莓购于长春欧亚超市。
碘化丙啶 美国Beckman Coulter公司;壳聚糖(脱乙酰度大于90%) 深圳市富晟生物科技有限公司。
1.2 仪器与设备
DXR3显微共聚焦激光拉曼光谱仪 美国赛默飞世尔公司;SU8010扫描电子显微镜 日本日立公司;BDLSRFortessa流式细胞仪 美国BD公司;UV-1800紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 副干酪乳杆菌Z17-壳聚糖复配最佳抑菌条件的确定
1.3.1.1 大肠杆菌O157:H7菌悬液制备
参照王子元等[11]的方法,将大肠杆菌O157:H7菌液以1%的接种量接种于无菌胰酪大豆胨(tryptic soy broth,TSB)液体培养基,置于摇床中,在37 ℃、180 r/min条件下培养24 h,所得菌液10 000 r/min离心15 min,用无菌生理盐水洗涤菌体3 次,加入去离子水稀释,使菌液浓度达到108CFU/mL。
1.3.1.2 草莓样品人工污染
参照Eunice等[12]的方法,草莓用自来水清洗后再用体积分数2%次氯酸钠水溶液浸泡2 min,放入大肠杆菌O157:H7菌悬液中浸泡10 min,自然干燥。
1.3.1.3 副干酪乳杆菌Z17粗提物制备和最小抑菌质量浓度的测定
参照胡诚[13]的方法稍作修改,将副干酪乳杆菌Z17菌液以1%的接种量在无菌MRS液体培养基中连续活化2 代,10 000 r/min离心15 min,使用0.45 μm无菌滤菌器过滤上清液,将无细胞上清液真空冷冻干燥成粉末,制备成副干酪乳杆菌Z17粗提物备用。
用TSB液体培养基将副干酪乳杆菌粗提物溶解并定容至5 mL,使其终质量浓度分别为16.0、8.0、6.0、4.0、2.0、1.0、0.5、0.25、0 mg/mL,分别加入至100 mL 108CFU/mL的大肠杆菌O157:H7悬浮液中,置于摇床中37 ℃、180 r/min培养24 h,用分光光度法和平板涂布法确定副干酪乳杆菌Z17粗提物对菌株的最小抑菌质量浓度。
1.3.1.4 副干酪乳杆菌Z17-壳聚糖复配液制备和抑菌效果的确定
称取一定量的壳聚糖粉末溶解于体积分数1%冰醋酸溶液中,加入副干酪乳杆菌Z17发酵上清液固体粉末使其达到最小抑菌浓度,得到副干酪乳杆菌Z17-壳聚糖复配液。取1.3.1.2节中草莓样品随机分为7 组,分别静置于等体积无菌生理盐水,质量分数1%壳聚糖溶液,壳聚糖质量分数分别为0、0.5%、1.0%、1.5%、2.0%的副干酪乳杆菌-壳聚糖复配液中,对应记为CK、H、CH0、CH0.5、CH1、CH1.5、CH2组。
将上述处理后的草莓样品每25 g装入含有225 mL TSB液体培养基的无菌均质袋内,均质3 min。用TSB液体培养基稀释均质后的样品,以平板计数法测定活菌数,按下式计算减菌率。

1.3.2 副干酪乳杆菌Z17-壳聚糖复配抑菌机制分析
1.3.2.1 大肠杆菌O157:H7 DNA胞外释放量的测定
参照宁亚维等[14]的方法,将大肠杆菌O157:H7培养至对数期,加入等体积副干酪乳杆菌Z17-壳聚糖复配液,分别以生理盐水和体积分数0.1%的Triton X-100为阴性对照和阳性对照。37 ℃条件下培养3 h,每小时用超微量分光光度计检测上清液中DNA质量浓度。
1.3.2.2 大肠杆菌O157:H7细胞膜完整性的测定
参照Hossain等[15]的方法,取1 mL培养至对数期菌悬液经过10 000×g离心30 s后,弃去上清液,用磷酸盐缓冲液(0.2 mol/L、pH 7.4,下同)重悬菌体使其浓度达到1×106CFU/mL,加入等体积副干酪乳杆菌Z17-壳聚糖复配液,以生理盐水处理作为对照,混匀静置10 min后10 000 r/min离心15 min收集菌体,菌体用磷酸盐缓冲液冲洗并重悬,用质量浓度为1 mg/mL碘化丙啶在4 ℃黑暗条件下染色,采用流式细胞仪检测,激发波长为488 nm,在650 nm波长处对染色细胞进行计数并记录荧光强度。
1.3.2.3 大肠杆菌O157:H7细胞膜成分分析
参照Wang Hongsu等[16]的方法,取1.3.2.2节中加入副干酪乳杆菌Z17-壳聚糖复配液的菌悬液并进行相同处理,以生理盐水作对照,10 000 r/min离心15 min后收集菌体。用体积分数2.5%戊二醛溶液在4 ℃下固定菌体。以体积分数分别为50%、70%、80%、90%、100%的乙醇溶液依次逐级脱水,再用乙酸异戊酯置换2 次,冷冻干燥样品。傅里叶变换红外光谱扫描分析条件:波数4 000~400 cm-1,最高分辨率4 cm-1,扫描32 次。
1.3.2.4 大肠杆菌O157:H7细胞结构分析
参照Lü Xinran等[17]的方法,取1.3.2.2节中加入副干酪乳杆菌Z17-壳聚糖复配液的菌悬液并进行相同处理,以生理盐水作对照,10 000 r/min离心15 min后收集菌体。采用785 nm激发光收集500~1 750 cm-1范围内的表面增强拉曼光谱信号,激光功率约为30 mW,曝光时间为5 s。每个样品测定3 次。取4 μL细菌样品溶液进行表面增强拉曼光谱检测。
1.3.2.5 大肠杆菌O157:H7细胞形态的观察
取1.3.2.3节中乙酸异戊酯置换后冷冻干燥后的样品粉末,进行喷金和扫描电子显微镜观察,电压1.5 kV、放大倍数10 000。
1.4 数据统计与分析
所有实验重复3 次取平均值,采用SPSS Statistics 19软件与Origin 2018软件行统计分析和作图。使用Duncan法进行显著差异性比较,以P<0.05表示差异显著。
2 结果与分析
2.1 副干酪乳杆菌Z17与壳聚糖复配对大肠杆菌O157:H7的减除效果
如图1所示,副干酪乳杆菌粗提物质量浓度为6.0 mg/mL时即可完全抑制大肠杆菌O157:H7的生长,同时用平板涂布法也无活菌检出,故确定副干酪乳杆菌Z17发酵上清液粗提物对大肠杆菌O157:H7的最小抑菌质量浓度为6.0 mg/mL。
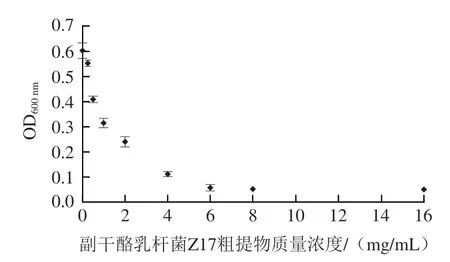
图1 副干酪乳杆菌Z17粗提物对大肠杆菌O157:H7最小抑菌质量浓度Fig. 1 Minimum inhibitory concentration of culture supernatant of L. paracei Z17 against E. coli O157:H7
如图2所示,对照组鲜食草莓上大肠杆菌O157:H7菌落总数为4.7(lg(CFU/g)),0、0.5%、1%、1.5%、2%(质量分数,后同)壳聚糖和副干酪乳杆菌Z17复配处理组菌落总数分别为4.131、4.69、2.69、2.74、2.77(lg(CFU/g))。最小抑菌浓度副干酪乳杆菌Z17发酵上清液粗提物与1%壳聚糖复配时,减菌率已达到了99%,副干酪乳杆菌Z17(CH0)和壳聚糖(H)单独处理组减菌率分别为73%和85%。以上结果表明,壳聚糖和副干酪乳杆菌Z17复配有协同抑菌作用,能有效提高减菌率。选择1%壳聚糖与最小抑菌质量浓度副干酪乳杆菌复配进行后续抑菌机制的研究。
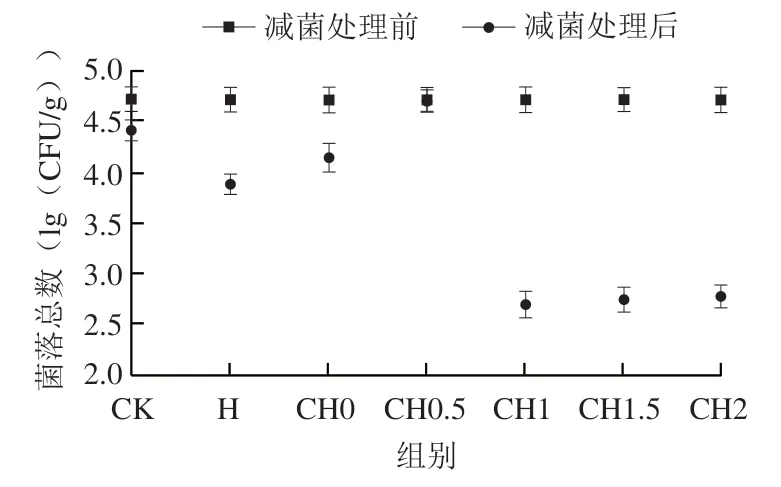
图2 不同浓度副干酪乳杆菌Z17-壳聚糖复配对大肠杆菌O157:H7的减除效果Fig. 2 Bacteriostatic effect of mixture of different concentrations of chitosan solution with L. paracei Z17 on E. coli O157:H7
2.2 副干酪乳杆菌Z17与壳聚糖复配对大肠杆菌O157:H7 DNA胞外释放的影响
DNA的释放情况是判断其细胞膜是否被破坏的依据[18]。由表1可以看出,副干酪乳杆菌Z17与壳聚糖溶液复配液处理组大肠杆菌O157:H7 DNA的胞外释放量远高于阴性对照组,在3 h时内DNA的释放量不断增加,在第3小时DNA释放量达(381.00±3.53)ng/μL。因此推断植物乳杆菌Z17与壳聚糖复合溶液是通过破坏细胞膜导致大肠杆菌O157:H7死亡。郭行[19]从鼠李糖乳杆菌中分离纯化的新型细菌素也通过破坏大肠杆菌细胞膜的方式导致DNA胞外泄漏,在4 h内DNA泄漏量可达187.57 ng/μL,与之相比本实验中副干酪乳杆菌Z17与壳聚糖溶液复配液对大肠杆菌O157:H7细胞膜的破坏作用更剧烈。
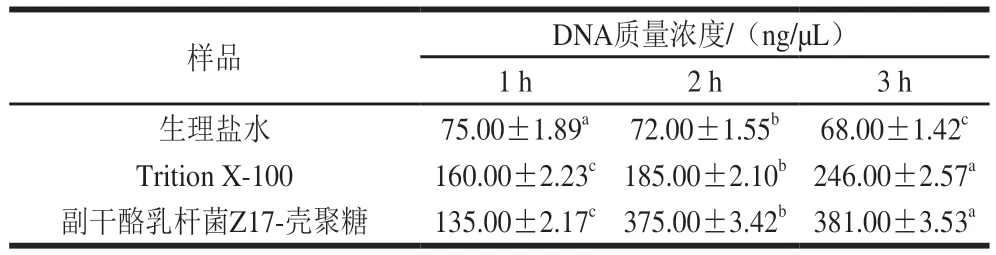
表1 副干酪乳杆菌Z17与壳聚糖复配对大肠杆菌O157:H7 DNA胞外释放的影响Table 1 Effect of chitosan-L. paracei Z17 mixture on extracellular DNA release from E. coli O157:H7
2.3 副干酪乳杆菌Z17与壳聚糖复配对大肠杆菌O157:H7细胞膜完整性的影响
碘化丙啶是用于检验细胞膜完整性的荧光染色剂,只有在细菌细胞膜受到破坏或细胞已经死亡时,碘化丙啶才能够进入到细胞内部与DNA或RNA嵌合,从而产生荧光,荧光强度可表示实验中所收集的大肠杆菌O157:H7细胞中受损细胞所占百分比,即细胞膜破损率[20]。
由图3A可知,经生理盐水处理的对照组,大肠杆菌O157:H7细胞膜破损率为0.9%。由图3B可知,副干酪乳杆菌Z17与壳聚糖溶液复配处理组大肠杆菌O157:H7细胞膜破损率为58.3%,处理组的大肠杆菌O157:H7细胞膜破损率远高于对照组。杨昆等[21]研究发现大肠杆菌O157:H7菌悬液加入抗菌肽BCp12培养6 h后,细胞膜的破坏率可以达到25.1%。本实验中副干酪乳杆菌Z17与壳聚糖溶液复配处理对大肠杆菌O157:H7细胞膜的破坏作用比其更强。
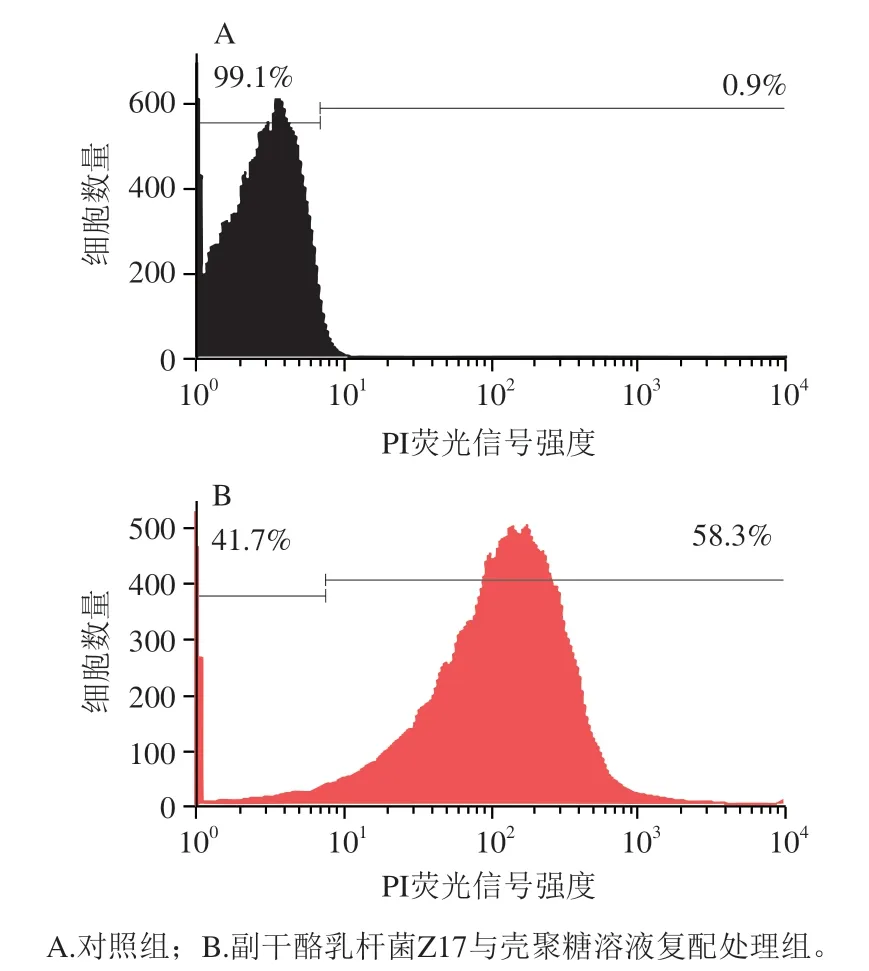
图3 副干酪乳杆菌Z17-壳聚糖复配对大肠杆菌O157:H7细胞膜完整性的影响Fig. 3 Effect of L. paracei Z17- chitosan mixture on cell membrane integrity in E. coli O157:H7
由此可知,经副干酪乳杆菌Z17与壳聚糖复配溶液处理组后,菌体细胞膜受到损伤,通透性增强,导致细胞死亡。初步推测副干酪乳杆菌Z17发酵上清液粗提物中的酶类、蛋白或多肽类抗菌物质通过连接嵌入作用破坏了细菌细胞膜。
2.4 副干酪乳杆菌Z17与壳聚糖复配对大肠杆菌O157:H7细胞膜成分的影响
傅里叶变换红外光谱技术可以分析微生物细胞质膜和细胞壁的组成和成分变化情况。大肠杆菌O157:H7细胞的红外光谱图呈现出革兰氏阴性菌的特征振动峰,它由几个重要的峰组成,一般可分为4个部分用以区分不同的微生物细胞成分[22-23]:1)指纹信息区:900~500 cm-1;2)细胞壁多糖信息区:1 200~900 cm-1;3)蛋白和多肽酰胺信息区:1 800~1 500 cm-1;4)脂肪酸信息区:3 000~2 800 cm-1。
如图4所示,1 450~1 230 cm-1附近的吸收峰增强,此吸收峰归因于肽聚糖中氨基酸和脂肪酸链羧酸酯基团(—COO—)中C=O键的对称拉伸振动;1 650 cm-1和1 450 cm-1周围的特征峰对应大肠杆菌O157:H7细胞膜、细胞质、鞭毛、菌毛和核糖体中酰胺I带和酰胺II带;其中,1 650 cm-1处吸收峰归因于C=O的振动,1 450 cm-1处吸收峰归因于肽基基团N—H键和C—N键的弯曲和拉伸;图4中副干酪乳杆菌Z17与壳聚糖复配处理组1 650 cm-1和1 450 cm-1附近峰强度相对于对照组明显下降,表明副干酪乳杆菌Z17-壳聚糖复配处理对大肠杆菌O157:H7细胞膜或壁上的蛋白质造成破坏;2 930 cm-1附近的吸收峰归因于脂肪酸和脂类中的甲基(—CH3)和亚甲基(—CH2)官能团的C—H对称拉伸谱带拉伸振动;1 080 cm-1附近吸收峰主要对应糖苷链多糖中的醚和许多细胞的构成成分肽聚糖,此外还对应磷脂、核酸、脂肪糖中的含磷基团,此处峰强度的降低主要是由于磷脂中官能团P—O以及PO2的不对称拉伸振动;副干酪乳杆菌Z17-壳聚糖复配液处理组在以上5个区间的吸收峰强度明显高于对照组,由此可知细胞膜和细胞壁中蛋白质、肽聚糖成分被破坏,使大肠杆菌O157:H7失去活性。傅里叶变换红外光谱分析结果进一步证明了副干酪乳杆菌Z17-壳聚糖复配液对大肠杆菌O157:H7第一作用靶点是细胞膜,可能是副干酪乳杆菌Z17发酵液和壳聚糖中的基团与细菌细胞膜脂质基团相互作用,其大量聚集使膜局部位移变薄,最后形成孔洞,大分子物质进入细胞,使细菌内容物泄漏,导致细胞死亡[24]。
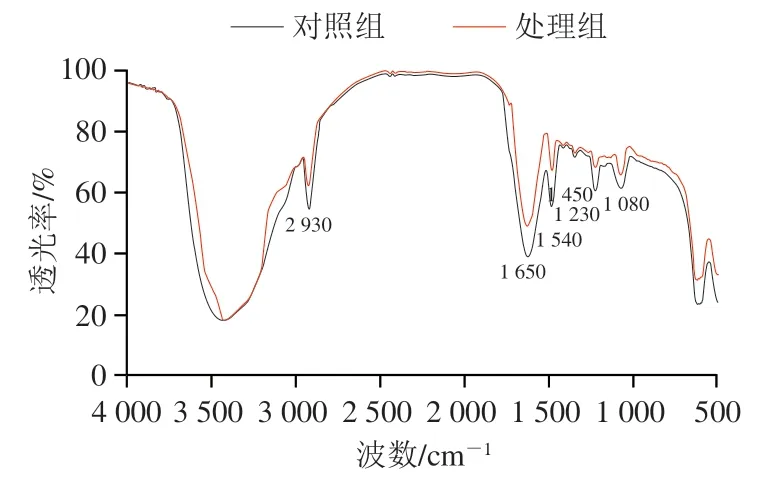
图4 副干酪乳杆菌Z17-壳聚糖复配对大肠杆菌O157:H7细胞膜成分的影响Fig. 4 Effect of L. paracei Z17-chitosan mixture on cell membrane composition of E. coli O157:H7
2.5 副干酪乳杆菌Z17与壳聚糖复配对大肠杆菌O157:H7细胞结构的影响
拉曼光谱是一种灵敏的成像工具,大肠杆菌O157:H7细胞壁的结构差异可通过拉曼光谱表征。如图5所示,大肠杆菌O157:H7在827~840、845~880、1 095~1 100、1 494 cm-1和1 590 cm-1处有明显的特征峰,对照组峰强度明显高于处理组。827~840 cm-1处特征峰能够表征酪氨酸含量;845~880 cm-1和1 590 cm-1特征峰能够表征细胞壁中肽聚糖含量[25-26];1 494 cm-1处特征峰归因于C=C、C—H伸缩振动;拉曼光谱分析再次证实副干酪乳杆菌Z17-壳聚糖复配能够破坏大肠杆菌O157:H7细胞壁中肽聚糖、糖苷环、多糖结构。
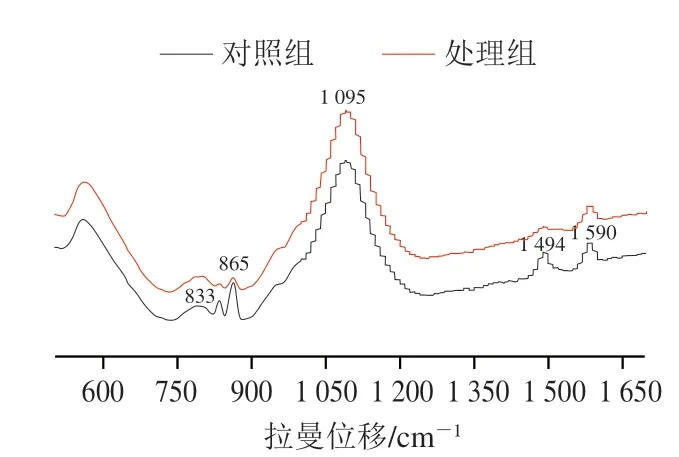
图5 副干酪乳杆菌Z17-壳聚糖复配处理大肠杆菌O157:H7拉曼光谱图Fig. 5 Raman spectra of E. coli O157:H7 treated with L. paracei Z17-chitosan mixture
2.6 副干酪乳杆菌Z17与壳聚糖复配对大肠杆菌O157:H7细胞形态的影响
由图6A可知,对照组样品饱满完整、形态均匀。由图6B可知,经副干酪乳杆菌Z17-壳聚糖复配液处理后,菌体细胞表面塌陷、出现孔洞、局部破裂,菌体细胞壁失去刚性,发生质壁分离、细胞膨胀,最后裂解死亡。由此可知,副干酪乳杆菌Z17-壳聚糖复配液处理可破坏大肠杆菌O157:H7的细胞完整性。

图6 副干酪乳杆菌Z17-壳聚糖复配对大肠杆菌O157:H7细胞表面形态的影响Fig. 6 Effect of L. paracei Z17-chitosan mixture on cell surface morphology of E. coli O157:H7
3 讨 论
本实验研究了副干酪乳杆菌Z17发酵上清液粗提物对大肠杆菌O157:H7的抑菌作用,确定其最小抑菌浓度为6.0 mg/mL,其与壳聚糖溶液复配处理对草莓中的大肠杆菌O157:H7有协同抑菌作用,且抑菌效果强于单独使用。从大肠杆菌O157:H7细胞形态与结构、细胞膜的完整性、细胞壁膜成分3个方面分别探讨了副干酪乳杆菌Z17发酵上清液粗提物与壳聚糖复配对大肠杆菌O157:H7作用机制。结果表明,其主要作用点在细胞膜上,副干酪乳杆菌Z17发酵上清液粗提物通过破坏大肠杆菌O157:H7细胞壁中肽聚糖、糖苷环、多糖结构成分,引起菌体形态结构的变化,从而导致DNA胞外泄漏,细胞内核酸和蛋白质的流失,细胞正常生理代谢活动被扰乱,这与Smaoui[27]和Kamal[28]等的研究结果相似。Hoda等[29]研究发现,壳聚糖能形成薄膜吸附在细胞膜上,影响营养物质进入,从而达到抑菌的作用。李小芳[30]研究发现,壳聚糖通过渗透作用进入细菌细胞内,与细胞中蛋白质和核酸物质结合,影响DNA的复制和蛋白质的合成,从而阻碍mRNA的合成,抑制细菌的繁殖,导致细菌死亡。副干酪乳杆菌Z17发酵上清液粗提物与壳聚糖复配有协同抑菌效果,推测可能是副干酪乳杆菌Z17发酵上清液破坏细胞膜后,壳聚糖大分子物质部分黏附在细胞壁膜表面,部分随之进入细胞中,加快了细胞中内容物的泄漏,同时菌体死亡速度也随之提升。
