水分活度对花生仁贮存过程中的品质影响及防霉措施的研究
2022-12-30刘明月李学锋
刘明月,李学锋,李 静
(深圳市瑞利来实业有限公司,广东深圳 518000)
花生仁、玉米、小麦仁、芝麻和花生油等粮油产品,尤其是高油脂果仁,在贮存期间极易受到外部的影响,如在湿度大、温度高的情况下,产品表皮发霉、口感酸败,失去了原有的新鲜光泽和纯正香气,从而影响产品的食用价值。同时,因发霉产生的黄曲霉毒素B1污染对人的身体具有危害性,可能引发人的原发性肝癌。因此,解决花生仁等粮油产品贮存中的发霉问题显得尤为重要。
花生在种植、采摘、贮存和加工中受黄曲霉毒素B1污染的程度,主要与花生品种、种植土壤、成熟度、采摘技术、贮存温度和水分活度等因素有关。此外,其本身的水分含量、水分活度的高低对黄曲霉毒素B1的含量也会造成影响。本文通过研究水分含量、水分活度与黄曲霉毒素B1之间的关系,找出花生仁在贮存过程中黄曲霉毒素B1污染的主要影响因素,进而重点分析其影响机理和变异规律,为制定花生仁贮存过程中的有效防霉措施提供技术支撑,为生产出合格的食品提供安全保障。
1 材料与方法
1.1 材料与试剂
花生仁;1×106个·mL-1黄曲霉孢子液;无菌水;麦芽糖琼脂培养箱(MEA);氯化钠;甲醇(分析纯);甲醇(色谱纯);蒸馏水;棉签;定性滤纸;微纤维滤纸;黄曲霉总量免疫亲和柱。
1.2 仪器与设备
分析天平(FA1204C);紫外线消毒灯(UVC20 WT6L 型);具塞磨口锥形瓶(1L);振荡器(Genius 3 型);恒温恒湿培养箱(ELB-HW-80B20);立式压力蒸汽灭菌锅(DGL-75B 型);万能粉碎机;小型离心机(Sigma1-14 型);三角瓶(250 mL);漏斗(60 mm);0.22 μm 微孔滤器;光化学(柱后)衍生器;高效液相色谱2690 型。
1.3 实验方法
1.3.1 建立花生仁水分活度-水分含量曲线
依据第三方实验室的花生仁水分、水分活度检测数据建立花生仁水分活度-水分含量曲线,以花生仁水分含量数值为纵坐标,样本序号为横坐标,样本序号按水分含量从低到高排序,形成水分活度-水分含量的关系曲线,进而了解它们之间的关联。
1.3.2 花生仁水分活度对黄曲霉生长和产毒的影响
(1)花生仁样品的准备。取500 g 花生仁样品调整至目标水分活度,经紫外线消毒灯杀菌30 min 以上后,放置于1 L 具塞磨口锥形瓶中。接种1 mL 孢子浓度为1×106个·mL-1的黄曲霉孢子液,接种完封口后采用振荡器进行振荡摇匀,确保每颗花生仁都能被黄曲霉孢子液包裹,实验样品制备完毕。共设置3 个平行实验样,且实验重复3 次。
(2)花生仁带菌培养。将以上花生仁样品置于恒温恒湿的培养箱中培养,培养周期设置为7 d。7 d后取出进行带菌量的检测。
(3)花生仁带菌量的检测。培养完成后每个样品取5 g 花生仁样品,加50 mL 无菌水,在振荡器上振荡1 min,得到0.1 g·mL-1的花生仁菌悬液,再取1 mL 用无菌水稀释10 倍后装入已灭菌的离心管中,使用振荡器充分摇匀,得到已稀释10 倍的均匀稀释液。按此操作制备各个梯度的样品稀释液。取各梯度的样品稀释液悬液100 μL 在MEA 平板(Cotty,1994)上均匀涂布,置于恒温恒湿的培养箱中,在(28±1)℃的恒温恒湿条件下培养5 d。
(4)花生仁中黄曲霉毒素B1含量的检测。培养完成后,将花生仁置于压力蒸汽灭菌锅内进行灭菌,在121 ℃的恒温条件下灭菌30 min,再用高速粉碎机将花生仁进行粉碎。待充分粉碎后,准确称取25 g 粉碎样品置入250 mL 的三角瓶中,加入5 g 氯化钠和125 mL 甲醇/水(70∶30,v/v)萃取溶液,密封三角瓶,高速振荡30 min 后静置[1]。取干净的锥形瓶、漏斗用滤纸对其进行过滤,并收集滤液。吸取10 mL 滤液加入20 mL 蒸馏水中进行稀释,充分摇匀后,得到已稀释3 倍的均匀稀释液,再用微纤维滤纸过滤,收集滤液。取15 mL 滤液上柱,依据黄曲霉毒素总量免疫亲和柱操作方法过柱,使其保持以2~3 mL·min-1的速度流出[1]。待滤液全部流完后,采用10 mL 蒸馏水或去离子水进行洗涤,共洗涤2 次,保持以3~4 mL·min-1的速度流出,用1 mL 甲醇(色谱纯)进行洗脱,洗脱液用0.22 μm 微孔滤器过滤后转移至进样瓶,用于高效液相色谱分析,测定不同水分活度的花生仁中黄曲霉毒素B1的含量[1]。
2 结果与分析
2.1 花生仁水分活度-水分含量曲线的建立
由表1可知,当水分含量在5%~10%时,水分活度随着水分含量的升高而升高。一般情况下,生干花生仁的水分含量在8%左右。由图1知,水分含量与水分活度之间呈正相关,相关系数较高,为R2=0.975 4。
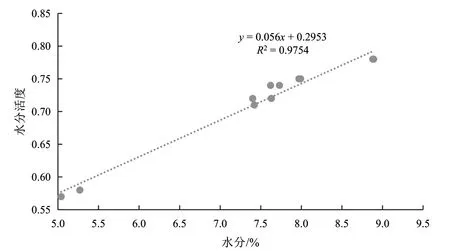
图1 花生仁水分活度-水分含量的关系曲线图

表1 有机花生仁水分、水分活度检测数据统计表
2.2 花生仁水分活度对黄曲霉生长和产毒的影响
不同水分活度的花生仁中黄曲霉毒素B1的含量测定结果见表2。为了更加直观地体现出花生仁水分活度与黄曲霉毒素B1含量的关系,将以上数据做了变化趋势图,见图2。由图2可知,当花生仁水分活度值处于较低水平时,黄曲霉毒素B1含量也处在较低的水平,当水分活度值低于0.65 时,其变化不会造成黄曲霉毒素B1含量太大的变化,当水分活度值高于0.65 时,黄曲霉毒素B1含量有了显著的变化,会随着水分活度值的增加而显著上升。由此可见,水分活度值0.65 是一个分界线,是决定黄曲霉毒素B1含量的关键参考值。

图2 花生仁水分活度值与AFT B1 的关系
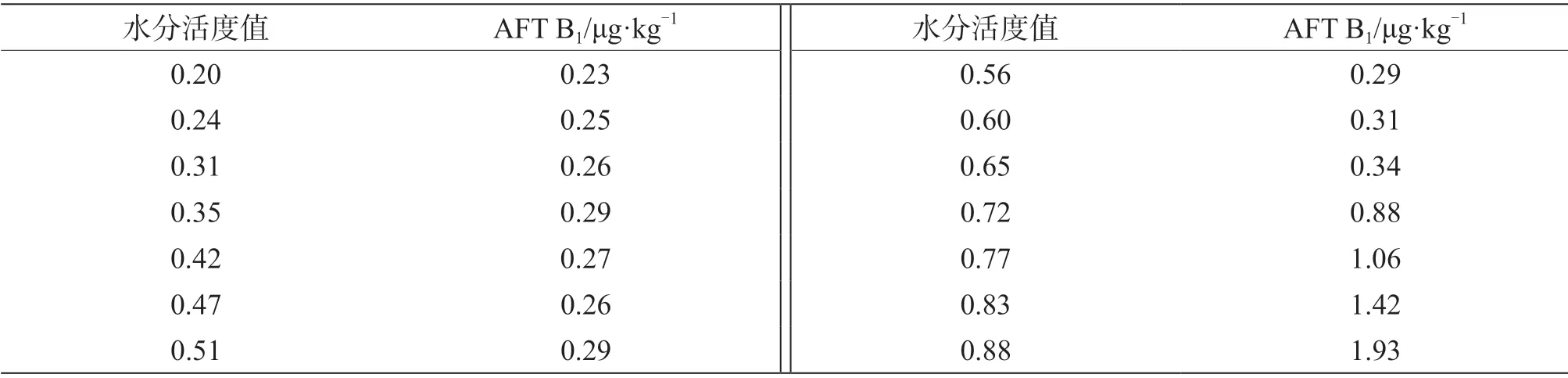
表2 不同水分活度值与黄曲霉毒素B1 含量统计表
综上,花生仁的水分活度与黄曲霉毒素B1含量之间存在着极强正相关关系,而花生仁的水分含量与水分活度之间也存在着极强正相关关系。花生仁水分的高低影响其口感和性状,水分高极易造成霉变,生成黄曲霉毒素;水分低极易造成口感干涩和表皮脱落,导致损耗大,成本上升。结合实际情况,经综合考虑,当花生仁水分活度为0.65 时,黄曲霉毒素B1含量处于较低且稳定水平,根据工厂生产实际情况,其水分值在保证安全的情况下实现的最大值为6.3%。因此,当花生仁水分活度为0.65,水分含量为6.3%时,是控制黄曲霉毒素B1污染的最佳参数。
3 花生仁的防霉措施
花生是最容易感染黄曲霉的农作物之一,黄曲霉毒素对花生具有极高的亲和性。花生中黄曲霉毒素主要有B1、B2、G1和G2,其中B1的毒性最强、产毒量最大。为确保花生的食品安全,各国制定了严格的黄曲霉毒素限量标准,如欧盟规定直接用于食用和直接用于食品原料的花生黄曲霉毒素B1的最高限量为2 μg·kg-1,B1+B2+G1+G2的最高限量为4 μg·kg-1。日本规定花生黄曲霉毒素B1的最高限量为10 μg·kg-1[2]。我国《食品安全国家标准 食品中真菌毒素限量》(GB 2761—2017)中关于花生及其制品的黄曲霉毒素B1的最高限量为20 μg·kg-1。要减少花生仁被黄曲霉侵染和产毒,可从以下几点进行控制。
(1)品种筛选。筛选出对黄曲霉毒素具有品种抗性[3]的栽培品种进行种植,从源头减少被黄曲霉侵染和产毒的风险。
(2)改善土壤。土壤是黄曲霉菌赖以生存的重要环境,研究表明,花生黄曲霉感染与土壤的类型有关,变性土壤比淋溶性土壤的感染少[3]。可通过逐步改善种植土壤类型,削弱黄曲霉菌的生存能力,减少被黄曲霉菌感染。
(3)及时采收。在花生收获前,如果接连遇到高温干旱或大雨,就会为黄曲霉侵染创造良好的时机,极易被黄曲霉感染,因此,要准确把握合适的采收时间及时采收。
(4)避免损伤。在花生种植、采收、加工和运输过程中,极易受到外部力量的损伤,破壳、破皮、破半、碾压等损伤为黄曲霉菌的侵入和生长创造了条件,因此避免损伤也能极大地减少黄曲霉侵染的可能。
(5)储藏技术。花生在储藏期间,仓储的相对湿度、储藏温度、仓储时间、仓储害虫等因素会引起花生霉变,造成黄曲霉的侵染。依据《粮油储藏技术规范》(GB/T 29890—2013)中的花生储藏技术要点:花生宜以花生果形式储藏;宜采用机械通风、低温或气调储藏;水分含量应符合当地安全水分标准;重点防治印度谷娥的危害。因此,花生的储藏可参照现有的技术规范执行,以减少在储藏环节受到黄曲霉的侵染。
(6)剔除霉变粒。黄曲霉毒素一般在花生表面上,表现为黄绿色霉菌,可在花生仁贮存前进行人工剔除,避免交叉污染[4-5]。
4 结语
花生仁的水分含量、水分活度、黄曲霉毒素B1三者之间存在着密切的关联,有效控制其水分含量,就能影响其水分活度,进而能有效防止其发霉造成黄曲霉毒素B1污染。当花生仁水分含量控制在6.3%或水分活度控制在0.65 以下时,是控制黄曲霉毒素B1污染的最佳参数,对产品品质能够得到有效的保障。但控制花生仁的水分含量或水分活度不是保证产品不受黄曲霉污染、保障产品品质的唯一手段,防霉措施的深入研究,从品种筛选、改善土壤、及时采收、避免损伤和储藏技术等方面加以控制,也能有效防止黄曲霉毒素B1的污染,对产品的品质控制具有重要的意义。
