NaCl浸泡处理对牛肝风味的影响
2022-12-29刘子琪董丽琴杨大维张丽余群力
刘子琪,董丽琴,杨大维,张丽,余群力
(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)
牛肝是一种完全优质蛋白食品,高蛋白、低脂肪,含有L-肉碱、牛磺酸等多种活性物质[1]。研究证实,牛肝中的这些微量元素及活性物质对人体健康大有裨益[2],可以将其直接烹饪或加工成各种特色食品[3],如咖喱肝粒、速冻肝片、牛肝酱及牛肝肠等[4]。然而,由于肝脏的不良风味影响了其作为食品加工利用。因此,为提高牛肝类产品的可接受度,牛肝脱腥是一个关键问题。目前脱腥技术主要包括化学脱腥法、生物脱腥法和物理脱腥法。化学脱腥法易产生化学物质残留,因此不宜在食品上使用[5]。生物脱腥法是利用微生物发酵技术去除腥味成分和异味的方法[6],目前常用的方法是酵母发酵法,例如于学萍等[7]对猪肝进行酵母发酵浸泡处理,结果表明,酵母的添加量为1.2%,发酵温度为35 ℃,发酵时间为45 min时,能较好改善猪肝风味;但由于其需要控制酵母发酵生长的最适环境条件,所以操作相对繁琐。在物理脱腥法中,盐溶法较为普遍,它是利用盐析和晶体渗透作用,采用食盐去除腥味,且操作相对简单。例如陈军等[8]对带鱼进行脱腥处理,确定食盐溶液浸泡法的最佳脱腥浓度为0.6%~1.2%,浸泡时间为60~90 min时,感官效果最好。因此在后续研究中,牛肝脱腥采用NaCl脱腥法相对可行。此外,大量学者围绕着动物肝脏挥发性风味物质方面开展了一定研究,例如徐欢等[9]在腊牛肝加工过程中共检出71种挥发性风味物质,发现醇类、醛类和酯类物质为腊牛肝的特征性风味物质;党欣等[10]针对犊牦牛肝和成年牦牛肝,分析了不同年龄牦牛肝中挥发性化合物的差异,发现相比成年牦牛肝,犊牦牛肝中的醛类物质含量高出43.81%,酮类高出11.52%,而烃类低44.94%,芳香族化合物成年牦牛肝中的含量是犊牦牛的17倍。但是,对于探究牛肝腥味是由哪些物质引起,以及在脱腥过程中哪些关键物质的含量变化会引起牛肝腥味减弱的报道较少。
本研究基于NaCl的脱腥效果,采用气相离子迁移谱(gas chromatography ion mobility spectroscopy,GC-IMS)技术结合主成分分析(principal component analysis,PCA)法,探析不同浸泡条件下牛肝中的挥发性物质的差异信息,以期为脱腥后牛肝制品的风味物质的调控提供依据,同时为基于GC-IMS技术检测到的牛肝风味信息指纹图谱数据库提供参考。
1 材料与方法
1.1 材料
牛肝(实验用牛肝采自康美现代农牧产业集团有限公司);蒸馏水;食盐。
1.2 仪器与设备
HX-202型电子天平,慈溪市天乐衡器厂;BCD-249 CF型冰箱,合肥芙蓉股份有限公司;FlavourSpec顶空气相-离子迁移谱仪,德国G.A.S.公司;配备CTC CombiPAL顶空自动进样器,瑞士CTC Analytics AG公司;MXT-5金属色谱柱(15 m×0.53 mm×1 μm),美国Restek公司;氚电离源。
1.3 实验方法
1.3.1 原料预处理
采集3头1岁半岁龄生长发育良好、体况相近、健康无病的肉牛,宰前禁食24 h,停水2 h后,宰后立即取出牛肝,除去牛肝内容物,用水清洗干净牛肝表面,然后去除牛肝表面筋膜,将牛肝切分成统一重量的块状并在-18 ℃下冷冻保存。
1.3.2 实验设计
1.3.2.1 浸泡设计
对牛肝进行浸泡处理,蒸馏水浸泡30、60、90 min,标记为L-Z-30、L-Z-60、L-Z-90;1.0%(质量分数,下同)NaCl浸泡30、60、90 min,标记为L-N-1.0-30、L-N-1.0-60、L-N-1.0-90;0.6% NaCl浸泡30、60、90 min,标记为L-N-0.6-30、L-N-0.6-60、L-N-0.6-90;1.8% NaCl浸泡30、60、90 min,标记为L-N-1.8-30,L-N-1.8-60,L-N-1.8-90;以不做处理的牛肝作为对照组,标记为L-Y。每组样品3个平行。
1.3.3 脱腥值评价
参照于学萍等[7]的方法略作修改。因脱腥效果无法作定量测定,实验中以10位感官评价员的感官评定的结果表示脱腥效果,并将腥味程度分成6个等级,以双蒸水作为参照(分值为0分),分类级别及对应分值为:0-无腥味;1-略有腥味;2-腥味较弱;3-腥味一般;4-腥味偏重;5-腥味很重。分值越大,则腥味越重。感官评价值为10人评定小组的平均得分。具体评价标准见表1。
1.3.4 GC-IMS分析
顶空进样条件:称取3 g牛肝碎,置于20 mL顶空样品瓶中,密闭封口后进行检测。顶空孵育温度60 ℃;采用振荡加热;孵育转速500 r/min;孵育时间15 min;顶空进样针温度65 ℃;进样量500 μL;清洗时间30 s。
GC条件:色谱柱MXT-5(弱极性,15 m×0.53 mm,1 μm);色谱柱温度60 ℃;运行时间20 min;载气为高纯N2,纯度≥99.999%;流速:初始2.0 mL/min,保持2 min后在20 min内线性增至100 mL/min。
IMS条件:漂移管长度9.8 cm;管内线性电压500 V/cm;漂移管温度45 ℃;漂移气为高纯N2(纯度≥99.999%);流速150 mL/min;IMS探测器温度45 ℃。
1.4 数据分析与处理
采用配套VOCal分析软件,利用内置NIST数据库和IMS数据库等对样品中挥发性风味物质进行定性定量分析。结合Reporter插件、Gallery Plot插件、Dynamic PCA插件,对数据进行多角度分析处理,获得二维、三维谱图,根据指纹图谱对比,直观且定量地比较不同浸泡条件下的牛肝样品之间的挥发性有机物差异。采用MATLAB.R 2017b对数据进行PCA。
2 结果与分析
2.1 不同处理方式下牛肝腥味值测定
不同处理方式下牛肝腥味值测定如图1所示。由图1可知,NaCl和蒸馏水浸泡处理均可显著降低牛肝腥味值(P<0.05)。其中,0.6% NaCl浸泡60、90 min处理和1.0% NaCl浸泡30、60、90 min处理的效果都优于蒸馏水浸泡和1.8% NaCl浸泡处理的效果。并且,1.0% NaCl分别浸泡60 min和90 min处理下牛肝的腥味值最低,为1.0左右。
2.2 牛肝挥发性有机成分定性分析
牛肝挥发性有机成分定性分析如图2~3所示。由图2可知,不同处理方式下牛肝样本的特征挥发性组分可通过GC-IMS分离,且具有各自不同的GC-IMS特征谱图信息。不同处理方式下牛肝样本的差异谱图中的颜色深浅程度不同(颜色越深则说明挥发性成分的含量较高,反之则较低),说明部分挥发性成分含量出现升高或降低,显示出了较明显的差异(图2中红色框A~I中所示);与对照组相比,其他浸泡方式下的含量有所增加或减少,如图中红色虚线框A与红色框B~I相比所示。此外,可观察到,经1.0% NaCl浸泡60 min后牛肝中的风味物质与对照组相比差异最为明显,如图2中红色实线框F与A所示,这可能是1.0% NaCl浸泡60 min处理后发生了风味物质迁移,造成部分风味物质含量大大增加[11]。
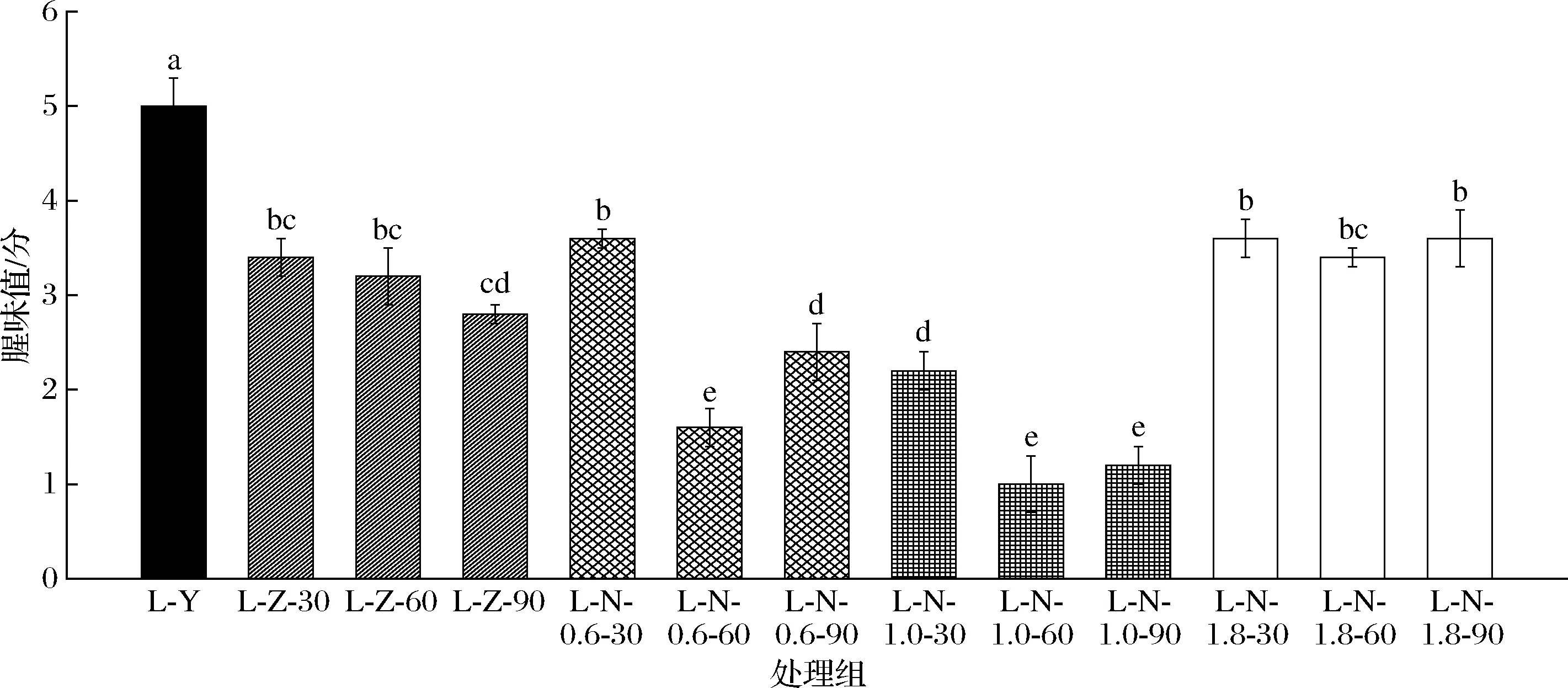
图1 不同处理方式下牛肝腥味值变化Fig.1 Changes of beef liver smell value under different treatment methods注:不同字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)
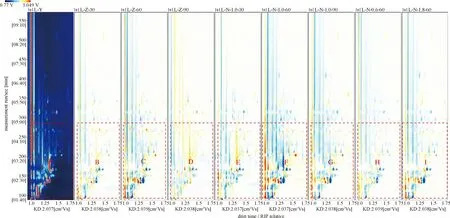
图2 不同处理方式下牛肝中挥发性物质成分对比差异谱图Fig.2 Comparison and difference spectrum of volatile components in bovine liver under different treatment methods
图3为不同处理方式下的牛肝指纹图谱。由图3可知,9种不同处理方式下的牛肝具有共同的挥发性有机物,但挥发性组分的浓度不同(颜色深浅表示物质的浓度高低,白色表示浓度较低,红色表示浓度较高,红色越深表示浓度越高)[12-14];与对照组与蒸馏水浸泡处理相比,NaCl浸泡处理后一部分风味物质浓度增加,如与红色框A1和A2相比,A3颜色明显变深,以及与红色框C1和C2相比,C3也变深,对应的物质有2,3-己二酮、3-羟基-2-丁酮、2-己酮、3-戊酮二聚体、3-戊酮、E-2己烯醇、3-甲基丁醇、2-甲基丁醛和E-2-戊烯醛;一部分浓度则降低,如与红色框B1和B2相比,B3颜色明显变浅,对应的物质有乙酸乙酯二聚体、乙酸乙酯和3-甲基丁酸乙酯。综上所述,牛肝用NaCl浸泡和蒸馏水浸泡后的效果存在差异。
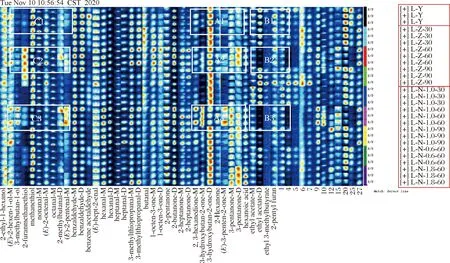
图3 不同处理方式下牛肝指纹谱图Fig.3 Fingerprint spectra of bovine liver under different treatment methods
2.3 挥发性物质的鉴定
不同处理方式下牛肝部分特征峰对应的化合物如表2所示。由表2可知,牛肝样品中识别出的挥发性物质主要为醛类、酮类、醇类、酯类物质。其中醛类物质27种,酮类物质16种、醇类物质14种、酯类8种、烃类1种、苯环1种、呋喃类1种、酸类1种。
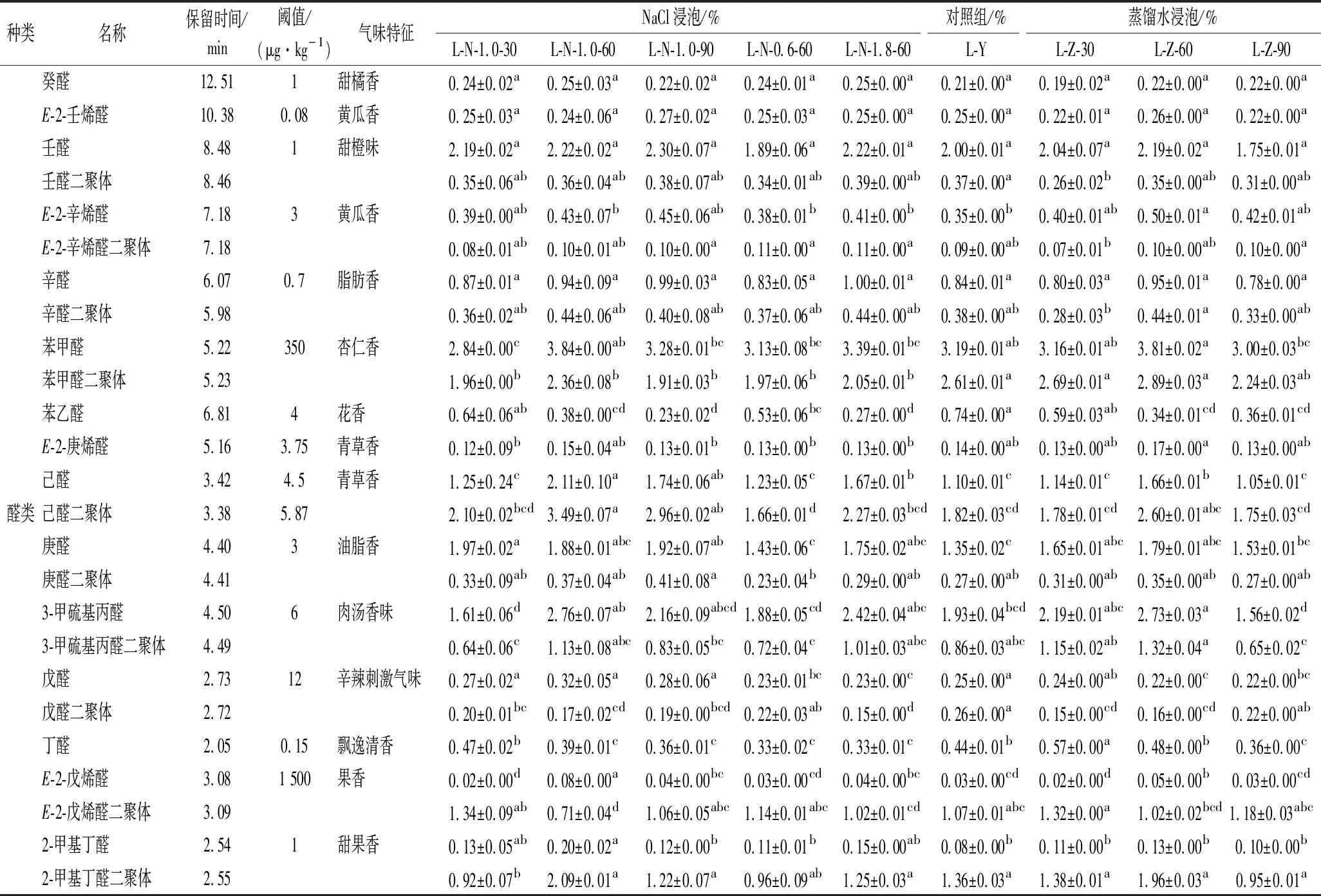
表2 不同处理方式下牛肝部分特征峰对应的化合物Table 2 Compounds corresponding to partial characteristic peaks of bovine liver under different treatment methods
续表3
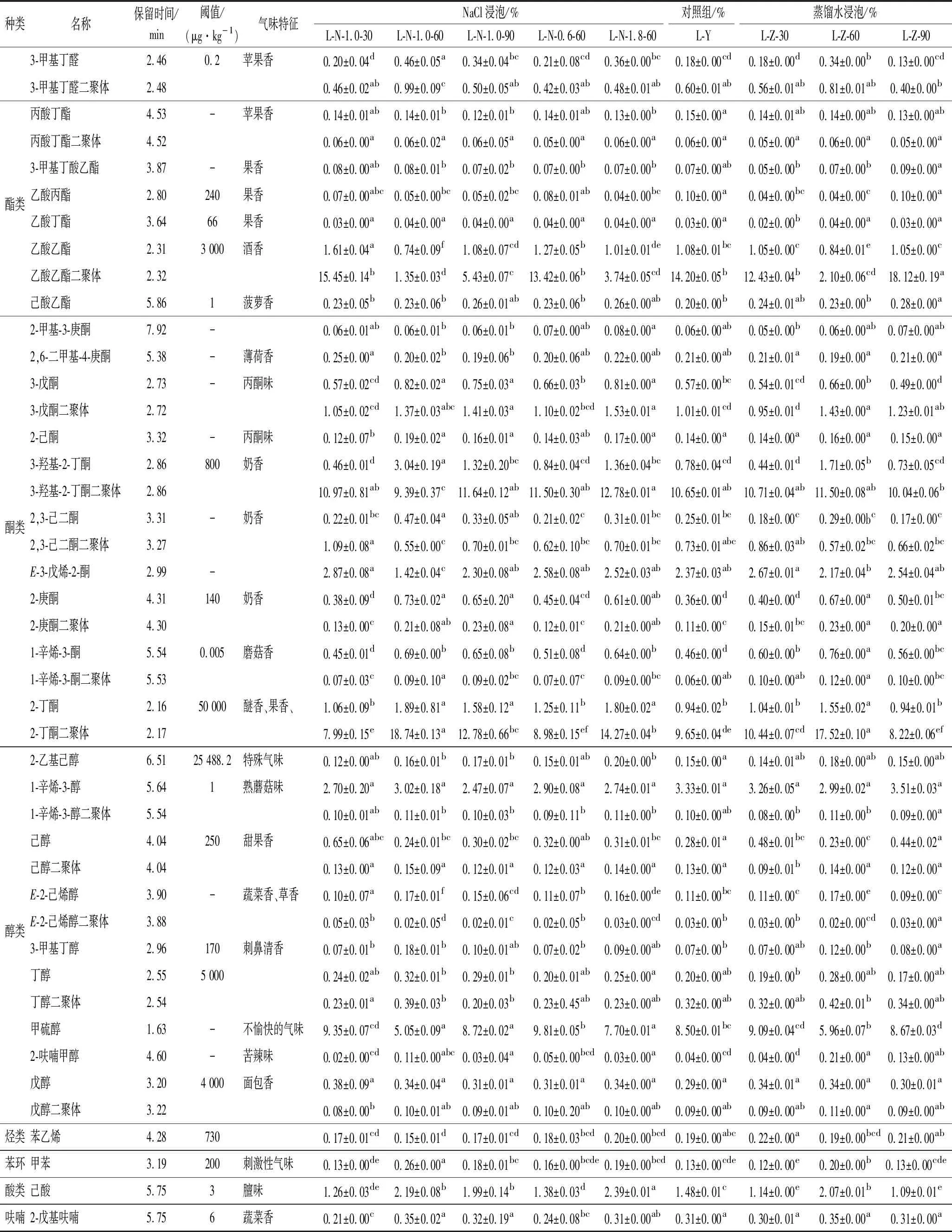
由图4可知,各处理组间存在显著差异的醛类物质为己醛二聚体、己醛、E-2-戊烯醛二聚体、3-甲基丁醛二聚体、3-甲基丁醛、2-甲基丁醛和E-2-戊烯醛(P<0.05)。醛类物质主要来源于脂质氧化[15],挥发性强,是牛肝中重要的风味物质。在检测到的这7种物质中,3-甲基丁醛二聚体、3-甲基丁醛和2-甲基丁醛这3种醛类物质在1.0% NaCl浸泡60 min处理后的相对含量均显著高于其他处理组(P<0.05),其中阈值非常低的有3-甲基丁醛(0.2 μg/kg)、3-甲基丁醛二聚体(0.2 μg/kg)和2-甲基丁醛(1 μg/kg),它们都具有苹果香,故3-甲基丁醛二聚体、3-甲基丁醛和2-甲基丁醛均对牛肝风味改善有重要影响。己醛二聚体经1.0% NaCl浸泡60 min处理后,其相对含量显著高于以下处理组:对照组、蒸馏水浸泡处理组、0.6% NaCl浸泡60 min处理和1.8% NaCl浸泡60 min处理(P<0.05);己醛经1.0% NaCl浸泡60 min处理后的相对含量显著高于其他处理组(P<0.05),己醛和己醛二聚体的阈值均较低(4.5 μg/kg),都具有青草香,所以己醛和己醛二聚体对1.0% NaCl浸泡60 min处理下的牛肝的风味改善有重要影响[16-17]。E-2-戊烯醛二聚体经1.0% NaCl浸泡60 min后的相对含量显著低于其他处理组(P<0.05),而E-2-戊烯醛的相对含量在这7种醛类物质中最低,但E-2-戊烯醛二聚体和E-2-戊烯醛阈值都很高(1 500 μg/kg),且都具有果香,故E-2-戊烯醛和E-2-戊烯醛二聚体对牛肝风味改善的影响较小。综上所述,牛肝在不同处理方式下,除了E-2-戊烯醛和E-2-戊烯醛二聚体外,其余5种醛类物质的阈值低,且牛肝在1.0% NaCl浸泡60 min时这5种醛类物质的相对含量均显著增加(P<0.05),故对牛肝的风味改善可能有重要影响;且E-2-戊烯醛二聚体可能是引起牛肝腥味的成分之一,在1.0% NaCl浸泡60 min后其相对含量下降。

图4 不同处理方式下牛肝中醛类化合物相对含量的变化Fig.4 Changes of relative contents of aldehydes in bovine liver under different treatments
由图5可知,2-丁酮二聚体、3-羟基-2-丁酮二聚体、E-3-戊烯-2-酮、3-羟基-2-丁酮、2-丁酮、3-戊酮、2-庚酮、2,3-己二酮这8种酮类物质的相对含量在各处理组间均存在显著差异(P<0.05)。经1.0% NaCl浸泡60 min处理后,尽管2-丁酮二聚体和2-丁酮的相对含量与其他处理组相比均显著增加(P<0.05),但因其阈值都很高(50 000 μg/kg),故对牛肝风味改善无较大影响。经1.0% NaCl浸泡60 min处理后,3-羟基-2-丁酮二聚体、E-3-戊烯-2-酮和2,3-己二酮二聚体的相对含量与其他处理组相比均显著降低(P<0.05),3-羟基-2-丁酮二聚体和2,3-己二酮都具有奶香味,因3-羟基-2-丁酮二聚体阈值高(800 μg/kg)[18],故对牛肝风味改善影响小。2-庚酮和3-戊酮,尽管这2种酮类物质在1.0%NaCl浸泡60 min处理后的相对含量均显著高于对照组(P<0.05),但因其在1.0% NaCl浸泡60 min处理下的相对含量均较低,且阈值都较高,故3-戊酮和2-庚酮可能会对牛肝风味改善的影响都很小。综上所述,酮类物质对牛肝风味改善可能有一定影响,但因酮类物质相对含量通常较低,阈值较高,故对牛肝的风味改善的影响不及醛类物质大;且因E-3-戊烯-2-酮经1.0% NaCl浸泡60 min处理后相对含量降低,其可能是引起牛肝腥味的物质之一。
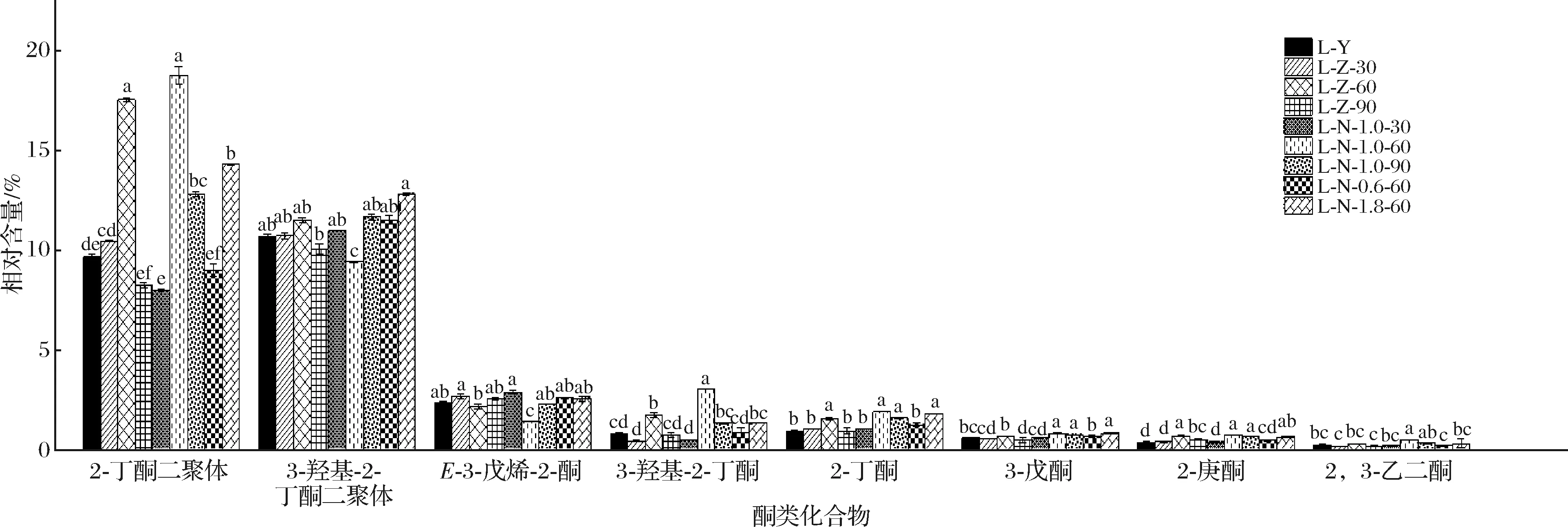
图5 不同处理方式下牛肝中酮类化合物相对含量的变化Fig.5 Changes of relative contents of ketones in bovine liver under different treatments
如图6所示,在酯类物质中,乙酸乙酯二聚体和乙酸乙酯的相对含量在各处理组间存在显著差异(P<0.05)。尽管在1.0% NaCl浸泡60 min处理后,乙酸乙酯二聚体和乙酸乙酯的相对含量与其他处理组相比均显著降低(P<0.05),其都具有酒香,但因乙酸乙酯和乙酸乙酯二聚体在1.0% NaCl浸泡60 min处理下相对含量均较低,且其阈值都很高(3 000 μg/kg),故乙酸乙酯和乙酸乙酯二聚体对牛肝风味改善的影响都很小;且乙酸乙酯和乙酸乙酯二聚体可能是构成牛肝腥味的物质之一,经1.0% NaCl浸泡60 min处理后其相对含量均下降。
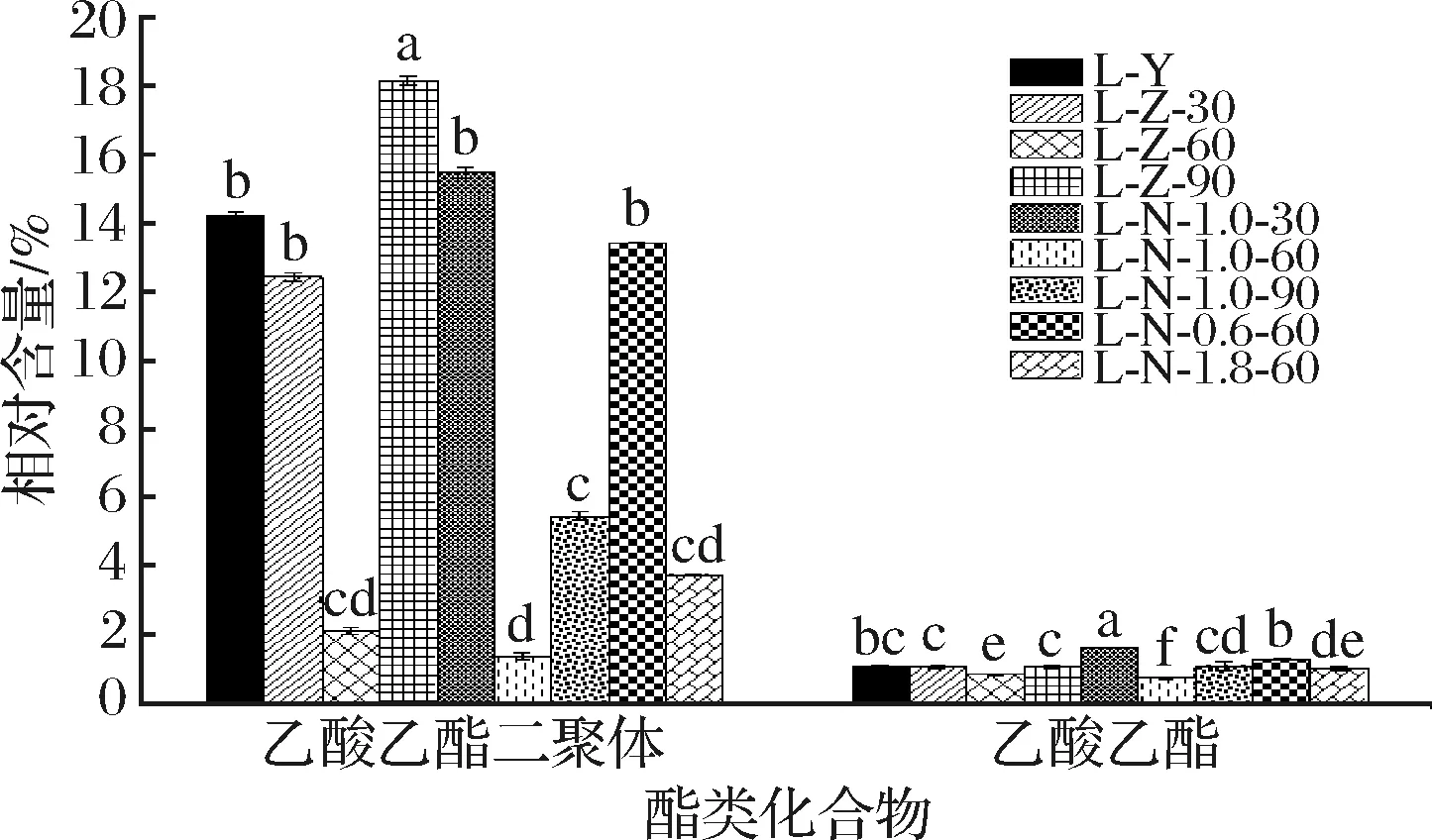
图6 不同处理方式下牛肝中酯类化合物相对含量的变化Fig.6 Changes of relative contents of ester compounds in bovine liver under different treatments
图7为对甲硫醇、己酸、丁醇、2-呋喃甲醇、E-2-己烯醇、甲苯、3-甲基丁醇进行分析的结果。其中,甲硫醇经1.0% NaCl浸泡60 min处理后相对含量显著低于其他处理组(P<0.05),在1.0% NaCl浸泡60 min处理下其相对含量较高,阈值极低,但因具有不愉快气味,故对牛肝的腥味脱除无重要作用。丁醇、甲苯和3-甲基丁醇这3种挥发性物质经1.0% NaCl浸泡60 min处理后相对含量均显著高于其他处理组(P<0.05),因其在1.0% NaCl浸泡60 min处理下的相对含量都很低,且阈值都很高,其中丁醇(5 000 μg/kg)、甲苯(200 μg/kg)、3-甲基丁醇(170 μg/kg)阈值都很高,故它们对牛肝风味改善的影响都很小。己酸、2-呋喃甲醇和E-2-己烯醇经1.0% NaCl浸泡60 min处理后相对含量均显著高于对照组、蒸馏水处理组和0.6% NaCl浸泡60 min处理组(P<0.05),己酸在1.0% NaCl浸泡60 min处理下的相对含量较高,其阈值低(3 μg/kg),但因具有膻味,故对牛肝的风味改善无较大影响。而2-呋喃甲醇和E-2-己烯醇的相对含量在1.0% NaCl浸泡60 min处理下均很低,且因醇类物质阈值均较高,故2-呋喃甲醇和E-2-己烯醇对牛肝的风味改善的影响均较小;且甲硫醇可能是引起牛肝腥味的主要物质之一,经1.0% NaCl浸泡60 min处理后其相对含量降低。
此外,由表2可知,烃类物质中主要是苯乙烯,苯乙烯可能是通过烷基自由基的脂质自氧化过程或类胡萝卜素分解生成,相对含量低,阈值高(730 μg/kg),且在各处理组间差异不显著(P<0.05),因此对牛肝的风味改善无显著影响[19-22]。2-戊基呋喃是典型的脂肪氧化产物,在各处理组间差异不显著(P<0.05),具有蔬菜香,相对含量低,阈值为6 μg/kg,故对牛肝的风味改善无较大影响。
2.4 PCA
利用SPSS对不同浸泡处理后的牛肝中挥发性风味物质的组成进行PCA,得到主成分的特征值和特征向量、主成分载荷矩阵,分别见表3、表4。
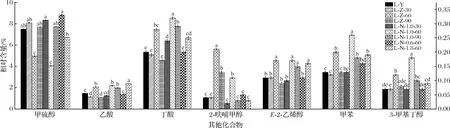
图7 不同处理方式下牛肝中其他化合物相对含量的变化Fig.7 Changes of relative contents of other compounds in bovine liver under different treatments注:甲硫醇和己酸相对含量较高,参照左纵坐标;后5种物质相对含量较低,参照右纵坐标
由表4可知,第一成分的贡献率为38.183%,第2成分的贡献率为12.671%,2个主成分的累积贡献率达到50.854%,说明前2个主成分代表了50.854%的综合信息[23]。由表5可知,代表第一主成分的是乙酸乙酯二聚体、己醛、E-2-戊烯醛二聚体、3-羟基-2-丁酮、甲硫醇、己醛二聚体、己酸等;代表第二主成分的是丁醛、2-戊基呋喃、E-2-辛烯醛、2-丁酮二聚体等。

表3 主成分因子的特征值及其方差贡献率Table 3 Characteristic values and variance contribution rates of principal component factors
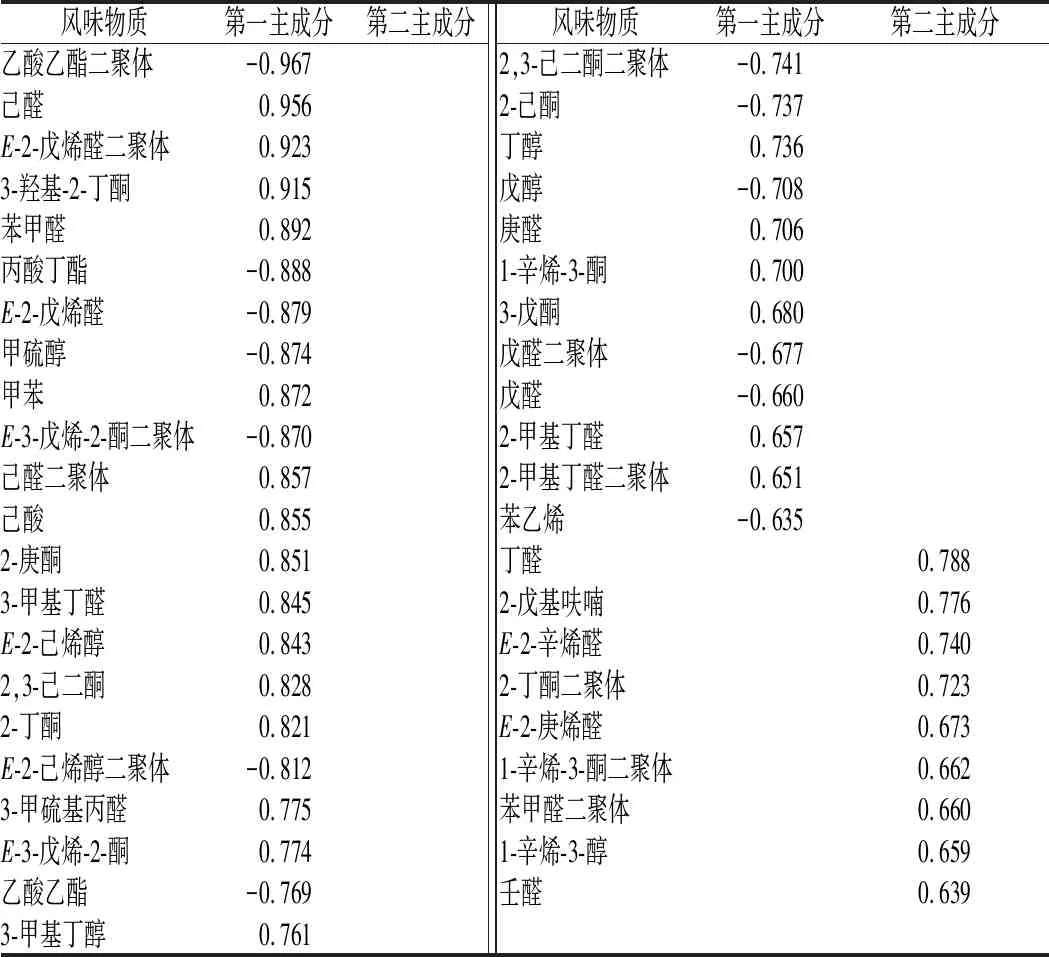
表4 GC-IMS特征向量矩阵Table 5 GC-IMS feature vector matrix
图8为牛肝不同处理方式下PCA图。由图8可知,牛肝在不同处理下的PCA以风味不同区分开,沿着第一主成分方向,蒸馏水浸泡60 min、1.0% NaCl浸泡60 min、1.0% NaCl浸泡90 min和1.8% NaCl浸泡60 min较为靠近,而对照组、1.0% NaCl浸泡30 min、0.6% NaCl浸泡60 min、蒸馏水浸泡30 min和蒸馏水浸泡90 min距前面所述这4种处理组较远,说明PC1为时间因子的表征。沿着第二主成分方向,蒸馏水浸泡60 min、1.0% NaCl浸泡60 min、蒸馏水浸泡30 min和蒸馏水浸泡90 min距离较近,而与1.0% NaCl浸泡90 min、1.8% NaCl浸泡60 min、0.6% NaCl浸泡60 min和1.0% NaCl浸泡30 min距离较远,说明PC2代表处理因子。

图8 牛肝不同处理方式下PCA图Fig.8 PCA of bovine liver under different treatment methods
图9为牛肝在不同处理方式下的挥发性风味物质因子载荷图,PC1左半轴酯类聚集,右半轴酮醛类聚集。PC2将醛醇和酯酮区分开来,上半轴醛醇聚集较多,下半轴酯酮多,说明PC2表征挥发性化合物结构特征。综合图8和图9可知,图8右上半轴处理中蒸馏水浸泡60 min、1.0% NaCl浸泡60 min和1.0% NaCl浸泡90 min对应图9中己醛二聚体、3-甲基丁醛二聚体、2-甲基丁醛、2,3-己二酮、2-丁酮二聚体、E-2-己烯醇、2-呋喃甲醇和3-甲基丁醇。图8右下半轴处理中1.0% NaCl浸泡60 min、1.0% NaCl浸泡90 min和1.8% NaCl浸泡60 min对应图9中3-戊酮、3-戊酮二聚体、3-羟基-2-丁酮、E-3-戊烯-2-酮、E-2-戊烯醛二聚体、2-丁酮、己醛、2-庚酮、3-甲基丁醛、己酸、丁醇、甲苯。图8左上半轴处理组中蒸馏水30 min、蒸馏水90 min和对照组对应图9中E-2-戊烯醛和乙酸乙酯二聚体。图8左下半轴处理组中0.6% NaCl浸泡60 min、蒸馏水90 min和1.0% NaCl浸泡30 min对应图9中甲硫醇、乙酸乙酯和3-羟基-2-丁酮二聚体。综合图4~图9可知,经1.0% NaCl浸泡60 min处理后,尽管己醛二聚体、己醛、E-2-戊烯醛二聚体、3-羟基-2-丁酮、2-丁酮二聚体、乙酸乙酯,甲硫醇和己酸与对照组均有显著差异(P<0.05),但由于E-2-戊烯醛二聚体、3-羟基-2-丁酮,2-丁酮二聚体和乙酸乙酯的阈值均很高,故这4种物质对牛肝的风味改善的影响均较小,且说明在不同处理方式下对牛肝风味影响最大的是己醛、己醛二聚体,甲硫醇和己酸,但因甲硫醇和己酸会带来不愉快气味,故己醛和己醛二聚体会对牛肝的风味改善有重要作用。
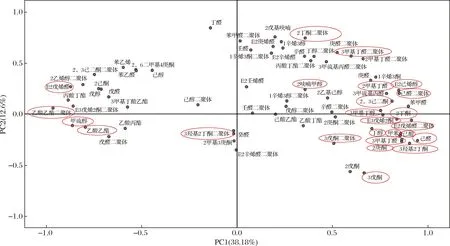
图9 牛肝不同处理方式下挥发性风味物质因子载荷图Fig.9 Factor loading diagram of volatile flavor substances in beef liver under different treatments
3 结论
牛肝用1.0% NaCl浸泡60 min时,脱腥效果达到最佳。基于NaCl脱腥效果,采用GC-IMS技术,检出了牛肝中含有醛类物质27种,酮类物质16种、醇类物质14种、酯类8种、烃类1种、苯环1种、呋喃类1种、酸类物质1种,且明确醛类、酮类、酯类为牛肝的主要风味物质。结合感官评价、GC-IMS和主成分分析证实,1.0% NaCl浸泡60 min处理下,己醛和己醛二聚体被认为是与牛肝风味特征改善密切相关的关键因素;而E-2-戊烯醛二聚体、E-3-戊烯-2-酮、乙酸乙酯、乙酸乙酯二聚体以及甲硫醇可能是引起牛肝腥味的主要物质。综上所述,1.0% NaCl浸泡60 min后牛肝腥味值显著降低(P<0.05),可能是因为以上醛类物质的相对含量显著增加(P<0.05),而其他物质的相对含量均显著降低(P<0.05),以此改善牛肝不良风味。
