淋巴瘤临床研究—2022 年ASCO 会议报告*
2022-12-29陈馨蕊石远凯
陈馨蕊 石远凯
淋巴瘤是中国常见恶性肿瘤之一,包括霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)。国内每10 万人HL和NHL 的发病率分别为0.46% 和4.29%,死亡率分别为0.19%和2.45%[1]。传统的化疗药物已不能满足临床需要,近年来肿瘤免疫治疗药物、细胞治疗和靶向药物的良好疗效及安全性为淋巴瘤患者带来新的希望。2022 年6 月召开的第58 届美国临床肿瘤学会(ASCO)年会报道了全球肿瘤领域研究的最新进展。本文将根据淋巴瘤不同组织分型对2022 年ASCO 年会中淋巴瘤临床研究领域最新成果进行综述。
1 HL
HL 患者在接受一线放化疗后有较高的缓解率和较长的生存期,但仍有10%~15% 的患者出现复发,这部分患者通常对传统化疗不敏感[2]。近年,抗体偶联药物(antibody-drug conjugate,ADC)及免疫检查点抑制剂的出现为这类患者提供了新的选择。
维布妥昔单抗(brentuximab vedotin,Bv)是由抗CD30 单克隆抗体和MMAE 组成的ADC 药物。多项研究结果表明,Bv 单药或联合化疗方案在初治及复发/难治(relapse/ refractory,r/r)经典型霍奇金淋巴瘤(classic Hodgkin’s lymphoma,cHL)患者的治疗中显示出较高的缓解率[3-6]。2022 年ASCO 年会公布了应用Bv 联合化疗方案治疗初治Ⅲ/Ⅳ期cHL 患者的ECHELON-1 研究的最新随访结果(摘要编号7503)。中位随访时间为73 个月,A+AVD(Bv,多柔比星,长春新碱,达卡巴嗪)组与ABVD(多柔比星,博来霉素,长春新碱,达卡巴嗪)组6 年总生存(overall survival,OS)率分别为93.9%与89.4%(P=0.009),6 年无进展生存(progression-free survival,PFS)率分别为82.3%和74.5%(P=0.002)。与ABVD 组患者相比,A+AVD 组患者的治疗方案中无博来霉素,因此这组患者第二次恶性肿瘤发生率更低,在随访期间有更多的女性患者怀孕或生产。
淋巴细胞活化基因3(lymphocyte activation gene-3,LAG-3)为T 细胞表面抑制性受体。体内、外研究结果显示,同时拮抗LAG-3 和程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-1)可增强T 细胞抗肿瘤作用[7-9]。2022 年ASCO 年会公布了IgG4 LAG-3 抑制剂favezelimab 联合帕博利珠单抗(pembrolizumab)治疗r/r cHL 的Ⅰ/Ⅱ期临床研究结果(摘要编号7516)。30例入组患者客观缓解率(objective response rate,ORR)为73%,其中7 例患者为完全缓解,中位PFS(median PFS,mPFS)为19 个月。最常见的不良事件(adverse event,AE)是甲状腺功能减退、疲劳、输液相关反应、头痛、关节痛、甲状腺功能亢进、肌痛和恶心。3 级以上治疗相关AE 发生率为20%。LAG-3 抑制剂联合PD-1 抑制剂与既往PD-1 抑制剂单药治疗r/r cHL 结果相似[10-11]。因此,LAG-3 抑制剂能否使r/r cHL 患者获益有待进一步探究。
2 NHL
2.1 弥漫性大B 细胞性淋巴瘤
弥漫性大B 细胞性淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是NHL 最常见的病理类型,一线治疗后有30%~50% 患者出现复发或难治[12]。2022年ASCO 年会上公布了多项DLBCL 免疫治疗和细胞治疗的研究结果(表1)。

表1 2022 年ASCO 会议中免疫疗法治疗DLBCL 相关研究汇总
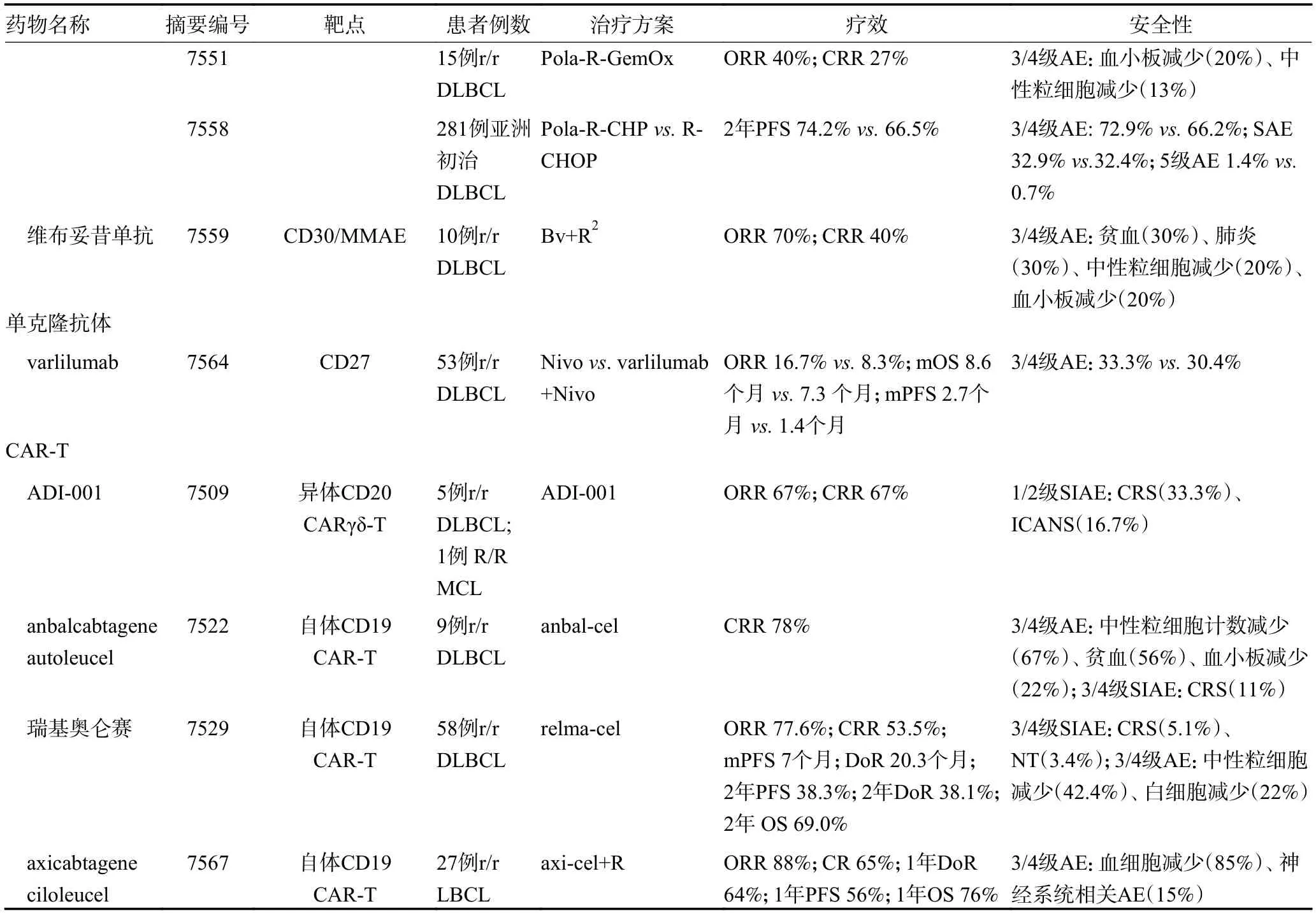
表1 2022 年ASCO 会议中免疫疗法治疗DLBCL 相关研究汇总 (续表1)
2.1.1 双特异性抗体 双特异性抗体(bispecific antibody )具有同时靶向细胞毒性T 细胞表面CD3 和肿瘤细胞表面特异性抗原的特性,通过这一机制激活T细胞杀伤肿瘤[13]。在2022 年ASCO 年会上,澳大利亚学者口头汇报了glofitamab 单药治疗r/r DLBCL患者的关键Ⅱ期扩展研究结果(摘要编号7500)。Glofitamab 是一种新型双特异性抗体药物,以2∶1结构同时与B 细胞表面CD20 双价和细胞毒性T 细胞表面CD3 单价结合发挥抗肿瘤作用。本研究纳入155 例先前至少接受过2 线治疗的DLBCL 患者,ORR 和完全缓解率(complete response rate,CRR)分别为51.6% 和39.4%,mPFS 为4.9 个月。虽然63%的患者发生了细胞因子释放综合征(cytokine release syndrome,CRS),但仅有3.9%为3 级以上。目前,glofitamab 在中国的注册临床研究正进行中(NCT0465 7302)。此外,另一种靶向CD3/CD20 的双特异性抗体药物epcoritamab,单药治疗r/r DLBCL 时ORR 为68%,CRR 为45%[14]。在联合传统方案治疗初治及r/r DLBCL 的研究中均表现出较好的疗效和安全性(表1)。靶向CD3/CD20 的双特异性抗体在一线应用CD20 单抗治疗后复发、不适合接受移植或接受嵌合抗原受体 T 细胞(chimeric antigen receptor T-cell,CAR-T)治疗后复发的患者中表现出较好的疗效。
2.1.2 抗体偶联药物 波妥珠单抗维多丁(polatuzumab vedotin,Pola)是首款CD79b 抗体偶联甲基澳瑞他汀E(monomethyl auristatin E,MMAE)的ADC 类药物,通过破坏B 细胞分裂发挥作用。在2022 年ASCO 年会公布的Pola-DA-EPCH-R 方案治疗初治侵袭性B 细胞淋巴瘤的初步结果(摘要编号7546)显示,纳入的18 例患者ORR和CRR 分别为88%和24%。但严重AE 发生较多,包括1 例5 级败血症/肠炎,3 例发热性中性粒细胞减少症,1 例3 级结肠憩室穿孔。这与年会其他Pola 联合治疗方案(表1)及既往Pola 相关研究报道相似,尽管包含Pola 的治疗方案在初治及r/r DLBCL 患者中显示出较好疗效,但治疗相关AE 的增加可能会限制其临床应用[15-16]。
2.1.3 嵌合抗原受体 T 细胞 近年来,基于JULIET、ZUMA-1 和TRANSCEND 的研究数据,靶向CD19的自体CAR-T 细胞产品axicabtagene ciloleucel、tisagenlecleucel、lisocabtagene maraleucel 已被美国食品药物监督管理局(FDA)批准上市,用于复发或≥2 线方案无效的DLBCL 患者的治疗[17]。但应用过程中的脱靶效应和肿瘤细胞免疫逃逸等问题仍待解决[18]。本次年会中,美国学者公布的ADI-001 的Ⅰ期研究报道异体CD20 靶向CARγδ-T 细胞疗法用于治疗成人r/rB细胞淋巴瘤(摘要编号7509)。利用γδ-T 细胞不需要与主要组织相容性复合物分子结合的特点,直接识别并结合肿瘤细胞表面抗原,补充CAR 的靶向作用,同时减少移植物抗宿主反应的发生。在可评价的6 例患者中,用药第28 天ORR 为67%,且全部患者达到完全缓解。特别关注的AE(special interest AE,SIAR)中2 例患者出现1/2 级CRS,1 例患者出现1 级免疫效应细胞相关神经毒性综合征(immune effector cellassociated neurotoxicity syndrome,ICANS)[19]。
RELIANCE 研究是应用国产瑞基奥仑赛(relmacabtagene autoleucel,relma-cel)靶向CD19 的自体CAR-T 细胞治疗r/r 大B 细胞淋巴瘤(large B-cell lymphoma,LBCL)的临床研究。在2022 年ASCO 年会上中国学者公布了RELIANCE 研究的2 年随访结果(摘要编号7529)。在可评价的58 例患者中,2 年最佳ORR 和CRR 分别为77.6%和53.5%。2 年OS率为69.0%。但3 级以上的AE 发生率是72.9%。
目前,自体CAR-T 细胞疗法显著改善了不可接受造血干细胞移植和多线治疗后进展的B 细胞淋巴瘤患者的预后,异体CAR-T 细胞疗法也显示出广阔的应用前景。但临床研究样本量较小且随访时间有限,有效性及安全性有待进一步探究。
2.2 滤泡淋巴瘤
滤泡淋巴瘤(follicular lymphoma,FL)是最常见的惰性NHL,多数患者对治疗反应较好,但初始治疗后24 个月内复发及多线治疗后耐药的患者预后较差[20]。
2.2.1 磷脂酰肌醇3-激酶抑制剂 近年来,靶向药物磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抑制剂idelalisib、copanlisib 和duvelisib 单药已尝试用于r/r FL 的治疗,但仅展现出中等程度的活性(ORR 为43.8%~57.0%,CRR 为1.6%~15.0%)。且除血液学相关AE 外,感染及免疫相关AE 发生率较高[20]。在2022 年ASCO 年会上公布了两项PI3K抑制剂的研究结果(摘要编号7511、7574)。两种新型PI3Kδ 抑制剂zandelisib 及parsaclisib 单药在治疗r/r FL 中均表现出较好的疗效,ORR 分别达到70.3%和86.9%,CRR 分别为35.2% 和31.1%。Zandelisib的研究结果显示3 级SIAE(腹泻,结肠炎,皮疹,口腔炎,转氨酶升高)的发生率均≤5%。
2.2.2 Bruton 酪氨酸激酶抑制剂 泽布替尼(zanubrutinib,Z)为中国自主研发的Bruton 酪氨酸激酶(Bruton's tyrosine kinase,BTK)抑制剂,被批准用于套细胞淋巴瘤、成人慢性淋巴细胞白血病/小淋巴细胞淋巴瘤和华氏巨球蛋白血症的治疗。有研究显示,单药泽布替尼治疗r/r FL 的ORR 仅为36.4%,CRR 为18.2%,mPFS 为10.4 个月[21]。意大利学者在本次年会上公布了ROSEWOOD 研究主要结果,比较Z 联合奥比妥珠单抗(obinutuzumab,O)对比O 单药治疗r/r FL 患者的疗效和安全性(摘要编号7510)。纳入的217 例患者随机分配到ZO 组(n=145)和O 组(n=72)。结果显示,ZO 组的ORR 显著高于O 组(68.3%vs.45.8%,P=0.002)。ZO 组mPFS 显著长于O 组患者,分别为27.4 个月和11.2 个月(HR=0.51,95% CI:0.32~0.81,P=0.004)。18 个月的OS 率为85.4%(ZO 组)vs.72.6%(O 组,HR=0.37,95% CI:0.23~0.60,P<0.001)。常见≥3 级AE 是血液学相关AE。r/r FL 对ZO 联合方案的疗效优于Z 或O 单药,且AE 无明显增加[21]。
2.2.3 组蛋白去乙酰化酶抑制剂 在2022 年ASCO年会上公布了由中国医学科学院肿瘤医院牵头开展的新型泛靶点口服组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)艾贝司他(abexinostat)治疗r/r FL 的疗效及安全性的Ⅱ期临床研究结果(摘要编号7513)。在研究中艾贝司他采用“服用1 周,停止1 周”的方式用药。在37 例可评价疗效的患者中,ORR 为70%,CRR 为16%。其中≥60 岁的16 例患者ORR 为88%,CRR 为31%。常见3 级及以上治疗相关AE 为血小板减少(41%)、中性粒细胞减少(27%)、白细胞减少(7%)、淋巴细胞减少(7%)、Q-T间期延长(7%)和贫血(5%)。
2.2.4 果蝇zeste 基因增强子人类同源物2 抑制剂2022 年ASCO 年会上还公布了组蛋白甲基转移酶果蝇zeste 基因增强子人类同源物2(enhancer of zeste homolog 2,EZH2)抑制剂SHR2554 治疗r/r 成熟细胞淋巴瘤的Ⅰ期研究结果(摘要编号7525),在纳入的84 例r/r 成熟细胞淋巴瘤患者中(41 例FL,22 例外周T 细胞淋巴瘤和21 例cHL),FL 患者ORR 为58.5%,EZH2 突变型FL 患者的ORR 比野生型患者略高(62.5%vs.55.2%)。所有患者中位持续反应时间(duration of response,DoR)为9.3 个月。
2.3 套细胞淋巴瘤
套细胞淋巴瘤(mantle cell lymphoma,MCL)是一种罕见的NHL 亚型,免疫化疗和造血干细胞移植是标准的一线治疗策略。但是对于不可耐受高剂量化疗的老年患者或进入r/r 阶段的MCL 患者需要更有效且耐受性更好的治疗方案[22]。伊布替尼(ibrutinib)联合利妥昔单抗(rituximab)方案在初治老年MCL 患者中表现出较好的疗效及较低的骨髓毒性。ORR 达到96%,CRR 为71%,3 年PFS 和OS 分别为87%和94%。3/4 级骨髓抑制发生率<5%[23]。2022 年ASCO年会Michael Wang 口头报告在初治老年MCL 患者中应用伊布替尼联合苯达莫司汀(bendamustine)和利妥昔单抗(Ibr+BR),后续利妥昔单抗维持治疗的SHINE 研究结果引起了广泛关注(摘要编号7 502)。将纳入的523 例患者随机分配至Ibr+BR 组(n=261)或安慰剂(Pbo)+BR 组(n=262),并在治疗后采用利妥昔单抗维持治疗。入组患者中位年龄为71 岁,Ibr+BR 组 的ORR 为89.7%,CRR 为65.5%,pbo+BR组ORR 为88.5%,CRR 为57.6% 。Ibr+BR 组与pbo+BR 组相比mPFS 显著延长2.3 年(80.6 个月vs.52.9 个月,P=0.011)。虽然Ibr+BR 组房颤发生率较Pbo+BR 组稍高(13.9%vs.6.5%),但大出血、高血压、关节痛和继发性恶性肿瘤等其他AE 发生率两组相似。目前,BTK 抑制剂仍是r/r MCL 有效率较高的靶向药物,未来该药联合方案可能成为初治老年MCL 及r/r MCL 患者的新选择。
2.4 外周T 细胞淋巴瘤
外周T 细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)是起源于胸腺成熟T 细胞或NK/T 细胞的一组具有高度异质性的NHL,占我国淋巴瘤患者的23.3%[24]。
2.4.1 免疫检查点抑制剂 结外自然杀伤/T 细胞淋巴瘤(extranodal natural killer/T-cell lymphoma,ENKTL)为PTCL 亚型,在亚洲国家发病率显著高于西方国家[24-26]。对于晚期和复发的ENKTL 患者以化疗为主的治疗方法5 年生存率仅为40%[25]。2022 年ASCO 年会上中国学者口头报告的GEMSTONE-201 研究旨在评价PD-L1 抑制剂舒格利单抗(sugemalimab)单药治疗成人r/r ENKTL 的有效性和安全性(摘要编号7501)。结果显示在78 例可评价的患者中,ORR 为46.2%,CRR 为37.2%,1 年DoR 为86%,2 年OS 率为54.6%。39%的患者出现了3 级以上AE。2020 年Kim 等[27]发表的应用PD-L1 单抗avelumab治疗r/r ENKTL 的Ⅱ期临床研究结果显示,ORR 为38%,CRR 为24%,mPFS 仅为2.7 个月,结果并不理想。而舒格利单抗在r/r ENKTL 患者中表现出相对持久的抗肿瘤活性,与其他PD-L1 单抗相比,具有更高的CRR 和良好的OS 获益趋势。
2.4.2 造血干细胞移植 造血干细胞移植治疗PTCL的相关研究较少[28-29]。2019 年ASCO 年会德国学者公布了AATT 研究结果,该研究前瞻性地比较了初治PTCL 患者常规治疗后接受异基因造血干细胞移植(allogeneic transplantation,alloSCT)与自体造血干细胞移植(autologous transplantation,autoSCT)作为巩固治疗的疗效和安全性。结果显示,初治PTCL 患者接受alloSCT 或autoSCT 巩固均有较高的缓解率,且3 年PFS 和OS 均无统计学差异[30]。2022 年ASCO年会该团队公布了7 年随访结果(摘要编号7534)。在AATT 研究中实际参与移植的患者(n=67)中,虽然两组之间患者的生存仍无显著差异(autoSCT 组vs.alloSCT 组:7 年无事件生存率为50%vs.61%,P=0.403,7 年OS 为72%vs.61%,P=0.349)。但autSCT组患者复发率较alloSCT 组患者高(42%vs.5%)。AutoSCT 后复发的15 例患者中,10 例患者接受allo-SCT 作为后线治疗,其中8 例患者生存时间为39~94 个月;未接受alloSCT 的患者的5 年生存率仅为17%。因此,对较年轻符合SCT 条件的PTCL 患者,SCT 仍是首选的巩固治疗方案,接受autoSCT 后复发的患者行alloSCT 挽救治疗方案可延长生存期。
3 结语
淋巴瘤的治疗模式正在发生改变,靶向治疗、免疫治疗和细胞治疗的进展十分迅速,基础研究成果不断向临床转化。新靶点和新作用机制的药物、新疗法和新方案在淋巴瘤患者中表现出较好疗效和安全性,期待更多的研究成果问世,为初治及复发/难治的淋巴瘤患者带来新的希望。
