国人卵巢癌DNA 损伤修复基因突变图谱分析*
2022-12-29叶英楠王珂董莉程亚楠韩雷张蕊于津浦
叶英楠 王珂 董莉 程亚楠 韩雷 张蕊 于津浦
卵巢癌是全球范围内最常见的恶性肿瘤之一,也是妇科肿瘤的第二大死因。由于筛查方法受限,早期发现困难,5 年生存率仅为 46%[1-2]。在我国,卵巢癌也是高发病率和高致死率的癌症之一,严重威胁着女性的健康[2]。卵巢癌中90%为上皮性卵巢癌,其中最多见的是高级别浆液性卵巢癌(high-grade serous ovarian cancer,HGSOC)。在卵巢癌的发生和发展过程中,基因突变发挥了重要作用。其中,乳腺癌易感基因(breast cancer susceptibility genes,BRCA)作为重要的同源重组修复(homologous recombination repair,HRR)基因,其变异与卵巢癌的发生发展和临床治疗密切相关。
DNA 损伤修复(DNA damage repair,DDR)基因除同源重组(homologous recombination,HR)通路外,还包括错配修复(mismatch repair,MMR)通路、核苷酸切除修复(nucleotide excision repair,NER)通路、碱基切除修复(base excision repair,BER)通路等[3]。其中HR 通路和MMR 通路是双链DNA 和单链DNA修复的关键通路,在多种肿瘤发生和发展过程中发挥重要作用,是备受关注的DNA 损伤修复通路[4]。有报道显示,ATM、BRIP1、PALB2、RAD51C、RAD51D等HRR 基因与卵巢癌的发生和发展相关[5-6]。也有报道认为,MLH1、MSH2、MSH6 等MMR 基因增加卵巢癌的发病风险[7]。因此,本研究参照NCCN 指南的推荐,利用高通量测序技术分析122 例卵巢癌中ATM、BARD1、BRCA1、BRCA2、BRIP1、PALB2、RAD51C、RAD51D 等HRR 基因,EPCAM、MLH1、MSH2、MSH6、PMS2 等MMR 基因,PTEN、STK11和TP53 等卵巢癌易感基因的胚系和体细胞变异图谱,以明确DDR 基因突变在中国卵巢癌人群中的分布及其与临床病理特征的相关性。
1 材料与方法
1.1 材料
1.1.1 样本收集 本研究纳入2019 年6 月至2020年6 月在天津医科大学肿瘤医院接受手术治疗的卵巢癌患者122 例。收集全部患者的血液白细胞样本及其中67 例患者的肿瘤组织标本。同时收集122 例患者的临床特征,包括发病年龄、既往史、家族史、病理类型、FIGO 分期、铂类药物的治疗反应以及复发情况。122 例病例中,患者中位年龄为56(30~77)岁。10 例既往患其他恶性肿瘤,其中7 例为乳腺癌。47例有肿瘤家族史,其中15 例有乳腺癌卵巢癌家族史。FIGO 分期:Ⅰ期12 例,Ⅱ期15 例,Ⅲ期46 例,Ⅳ期49 例。病理类型:浆液性腺癌111 例,透明细胞癌9 例,子宫内膜癌2 例,未纳入其他病理类型。患者接受了满意的卵巢细胞减灭术或新辅助化疗联合中间性肿瘤细胞减灭术,且两种治疗方式的入组患者均接受铂类药物化疗,化疗疗程共6~8 个周期,随访时间12~24 个月。本研究获得天津医科大学肿瘤医院伦理委员会批准,所有纳入受试者均签署知情同意书。
1.1.2 二代测序检测试剂盒 本研究采用基于Ion Torrent S5TM平台的针对19 个卵巢癌易感基因二代测序检测试剂盒GO prep kits(安智因公司,中国北京),用于外周血白细胞样本和肿瘤组织DNA 突变情况检测。检测覆盖ATM、BARD1、BRCA1、BRCA2、BRIP1、CDH1、CHEK2、EPCAM、MLH1、MSH2、MSH6、NBN、PALB2、PMS2、PTEN、RAD51C、RAD51D、STK11、TP53 基因的编码序列和剪接区域(外显子边界±10 bp)。目标区域大小为258 kb,99%的目标区域被1 452 个扩增子覆盖。
1.2 方法
使用QIAamp DNA Blood Mini Kit(凯杰公司,德国)提取白细胞和肿瘤组织样本的基因组DNA。使用GO prep kits 构建目标区域DNA 文库。制备的文库通过Ion Torrent S5TM平台进行测序。通过TMAP(v5.10)将合格的读数与人类参考基因组hg19 进行比对。白细胞样本目标区域的测序深度不低于200×,肿瘤样本的测序深度不低于1 000×。使用TVC软件(v5.10)进行变异检测(SNV/small InDel<22 bp)。使用Ensembl Variant Effect Predictor 软件(http://grch37.ensembl.org/info/docs/tools/vep/index.html)进行变异注释,例如 HGVS 表示法、来自GnomAD 的人口等位基因频率(http://gnomad.broadinstitute.org/)和1K 基因组计划(http://www.1000genomes.org),临床意义状态由HGMD(http://www.hgmd.cf.ac.uk/)、ClinVar(http://www.ncbi.nlm.nih.gov/clinvar/)、BRCAexchange(https://brcaexchange.org/)和BIC(https://research.nhgri.nih.gov/bic/)数据库信息进行判读。根据《ACMG 遗传变异分类标准与指南》,所有突变被分为致病性(pathogenic,P)、可能致病性(likely pathogenic,LP)、临床意义未明(variant of uncertain significance,VUS)、可能良性(likely benign,LB)和良性(benign,B)。
1.3 统计分析
采用SPSS 19.0 软件对数据进行分析。计量资料用中位数(四分位数间距)表示,计数资料用表示。计量资料的比较采用χ2检验,计数资料的比较采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 卵巢癌患者胚系突变特征
122 例卵巢癌患者中共检出胚系突变位点107 个,其中致病性位点36 个(33.64%),可能致病性位点2个(1.87%),临床意义不明位点69 个(64.49%)(图1A)。在全部的突变位点中主要的突变类型为错义突变(61.68%),但在致病和可能致病性位点中,主要的突变类型为移码突变(63.16%,图1B)。这些位点中80.37%为HRR 基因,包括ATM、BARD1、BRCA1、BRCA2、BRIP1、CDH1、CHEK2、NBN、PALB2、RAD51D;其余19.63%为MMR 基因,包括EPCAM、MLH1、MSH2、MSH6、PMS2(图1C,1D)。检出的38 个致病和可能致病性位点主要集中于BRCA1、BRCA2、ATM、RAD51D。MMR 通路基因未检出致病或可能致病性突变,这表明卵巢癌患者胚系突变致病基因主要为HRR 基因。

图1 卵巢癌患者胚系突变特征
2.2 卵巢癌患者胚系BRCA 基因突变与临床病理特征相关性
122 例卵巢癌患者中共检出BRCA 致病或可能致病胚系突变阳性(BRCA+)29 例(23.77%),其中22例为BRCA1 突变,7 例为BRCA2 突变。对比BRCA+和BRCA-患者的临床特征(表1),发现BRCA+患者有肿瘤家族史和乳腺癌卵巢癌家族史的比例均显著高于BRCA-患者(55.17%vs.33.33%,P=0.035;27.59%vs.7.53%,P=0.008),说明BRCA 基因胚系突变与家族聚集有关。BRCA+患者病理类型为浆液性腺癌的比例显著高于阴性患者(100%vs.88.17%,P=0.043),并且BRCA+患者的病理类型全部为HGSOC。表明BRCA 基因胚系突变与HGSOC 病理类型有关,BRCA+患者对铂类药物治疗敏感的比例增高(82.76%vs.72.04%),但无统计学差异。

表1 122 例卵巢癌患者胚系BRCA 基因突变与临床病理特征相关性
2.3 卵巢癌患者HRR 基因胚系突变与临床病理特征的相关性
122 例卵巢癌患者中共检出38 例(31.15%)携带HRR 致病或可能致病胚系突变患者(gHRR+),其中22 例为BRCA1 突变,7 例为BRCA2 突变,8 例为RAD51D 突变,1 例ATM 突变。对比gHRR+和gHRR-患者的临床特征(表2),结果发现gHRR+患者55 岁前发病的比例高于gHRR-患者(57.89%vs.36.90%,P=0.030)。gHRR+患者中有家族史和有乳腺癌卵巢癌家族史的比例均高于gHRR-患者(55.26%vs.30.95%,P=0.011;26.31%vs.5.95%,P=0.003),说明gHRR+发病较早,与家族聚集有关。gHRR+患者病理类型为浆液性腺癌的比例显著高于阴性患者(100%vs.86.90%,P=0.013),且gHRR+患者的病理类型均为HGSOC。gHRR+患者对铂类化疗药物治疗敏感性更高(86.84%vs.69.05%,P=0.037),提示HRR 基因胚系突变与卵巢癌的病理分型和治疗效果有关。

表2 122 例卵巢癌患者HRR 基因胚系突变与临床特征相关性
2.4 卵巢癌患者肿瘤组织突变特征
122 例卵巢癌患者中有67 例同时检测了肿瘤组织样本,共检出突变位点119 个,其中致病性位点40 个(33.61%),可能致病性位点26 个(21.85%),临床意义不明位点53 个(44.54%)(图2A)。在全部的突变位点中,主要的突变类型为错义突变(63.87%);在致病和可能致病性位点中,主要的突变类型为错义突变(40.91%),其次是移码突变(30.30%,图2B)。这些位点致病和可能致病性位点主要集中于TP53、BRCA1、BRCA2、ATM、RAD51D、PALB2 和PMS2(图2C)。致病和可能致病性DDR基因变异位点与胚系变异位点的分布不同,胚系致病性突变主要集中在以BRCA1/2 为主的HRR 基因;而组织层面检出的致病性突变主要集中在TP53(59.09%),其次是HRR基因(39.39%),仅有1.52%为MMR 基因(图2D)。

图2 卵巢癌患者体细胞突变特征
2.5 卵巢癌患者HRR 基因体细胞突变与临床病理特征的相关性
上述67 例患者中,46 例组织层面检出致病或可能致病性突变,其中20 例患者检出2 个突变。26 例患者肿瘤组织层面检出HRR 基因突变(tHRR),39 例患者检出TP53 基因突变,1 例患者检出PMS2 突变。在肿瘤组织tHRR 突变的患者中有22 例在胚系层面检出了HRR 基因突变(84.66%),4 例患者未检出胚系HRR 突变,仅检出体细胞HRR 突变,说明组织层面tHRR 检测可以提高检出率,使更多患者受益。比较tHRR+和tHRR-患者的临床特征(表3),结果发现tHRR+患者55 岁之前发病的比例显著高于tHRR-患者(53.85%vs.34.14%),并且,tHRR+患者中有家族史和有乳腺癌卵巢癌家族史的比例均高于tHRR-患者(53.85%vs.14.63%,P=0.001;19.23%vs.2.44%,P=0.029)。结果还发现,tHRR+患者对铂类化疗药物治疗敏感性更高(88.46%vs.56.10%,P=0.005),且复发比例更低(19.23%vs.51.22%,P=0.009),提示HRR基因体细胞突变与卵巢癌的治疗效果和预后有关。MMR 基因致病性或可能致病性突变检出较少,仅1例患者检出了PMS2 突变。39 例患者检出TP53突变,通过对比tTP53+和tTP53-患者的临床病理指标,结果发现tTP53+患者有乳腺癌卵巢癌家族史的比例较高,其余指标均无显著差异。说明目前针对卵巢癌患者肿瘤组织的DDR 的基因检测中,HRR 基因检测的价值较高。

表3 67 例卵巢癌患者体细胞HRR 基因突变与临床病理特征的相关性
进一步分析发现,67 例患者中22 例携带胚系突变(gMut+),24 例未检出胚系突变但检出体细胞致病或可能致病性突变(gMut-tMut+),21 例患者两个层面均未检出突变(WT)。对比三组患者的临床特征(表4),结果发现,gMut+患者在这三组中,有肿瘤家族史和有乳腺癌卵巢癌家族史的比例最高(54.54%vs.29.17%vs.4.76%,P=0.001;22.72%vs.4.17%vs.0,P=0.014),说明携带胚系突变的患者家族聚集性最明显,gMut+患者铂类化疗药物治疗敏感性更高(90.90%vs.52.38%vs.61.90%,P=0.012),也正因对铂类药物的响应,其复发比例在三组中最低(13.64%vs.50.00%vs.52.38%,P=0.008)。
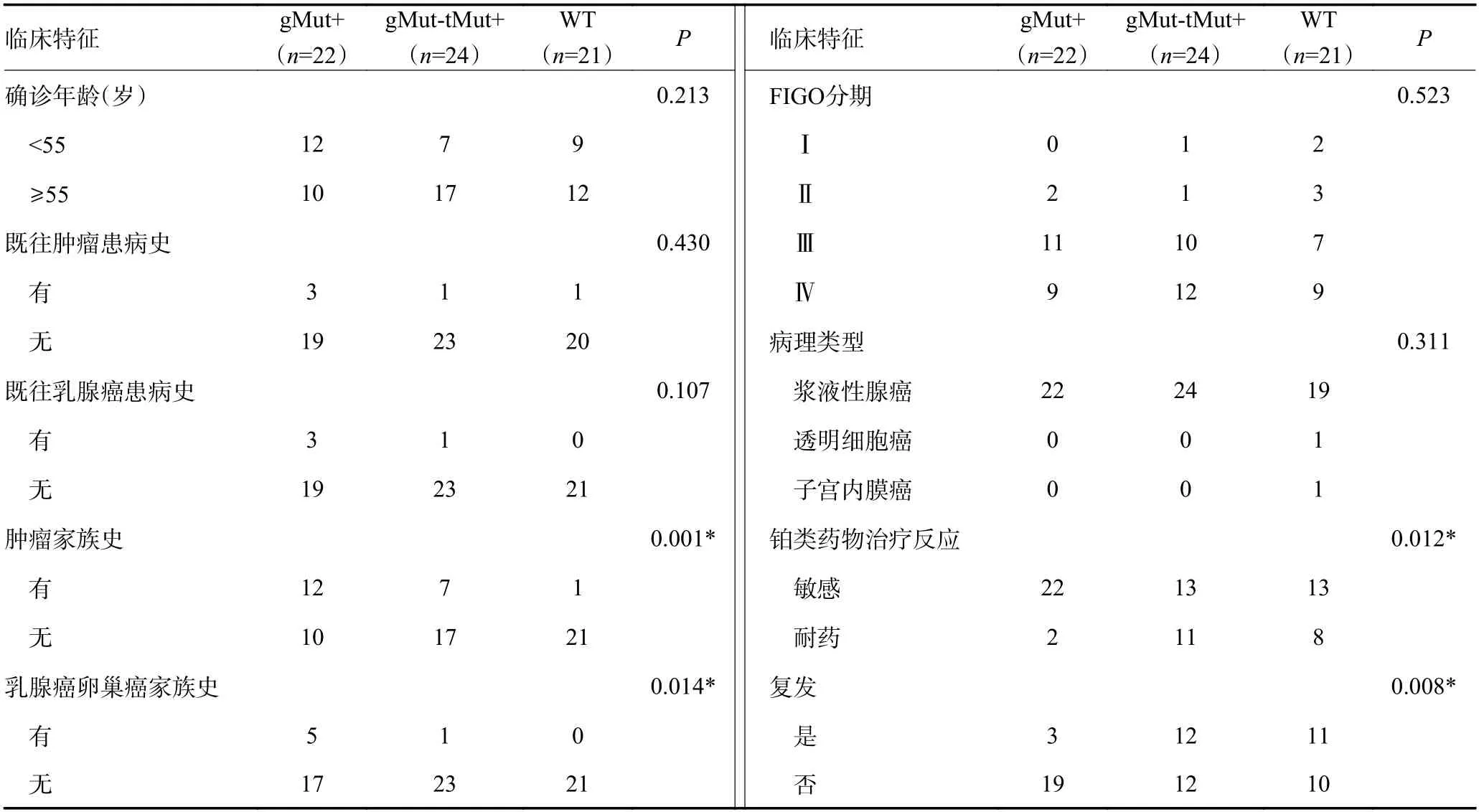
表4 67 例卵巢癌患者基因突变与临床病理特征相关性
3 讨论
DDR 基因与卵巢癌的发生发展密切相关,本研究中纳入19 个DDR 基因,涵盖HR 通路、MMR 通路以及与卵巢癌发病相关的易感基因。众多DDR 基因中,HRR 基因发挥了重要的作用[8],《NCCN 遗传性/家族性高风险评估指南:乳腺和卵巢》中指出,HRR 基因中的ATM、BARD1、BRCA1、BRCA2、BRIP1、PALB2、RAD51C、RAD51D 等基因明确或可能增加卵巢癌的发病风险[9]。同时,MMR 基因EPCAM、MLH1、MSH2、MSH6、PMS2 明确增加卵巢癌的发病风险。MMR基因的胚系突变可导致林奇综合征,使罹患卵巢癌的风险增加9%~14%[10]。本研究纳入的卵巢癌易感基因PTEN、STK11 和TP53 分别被认为是Cowden 综合征、Peutz-Jeghers 综合征、Li-Fraumeni 综合征的致病基因,可增加卵巢癌的发病风险。本文研究在BRCA 胚系突变阴性的患者中检出ATM 和RAD51D的胚系突变,占整体的7.38%,提示BRCA 阴性的患者中仍有部分存在HR 通路缺陷,但是本研究未检出胚系MMR 基因或易感基因的致病或可能致病性突变。
BRCA 基因与卵巢癌的发病年龄、家族性、遗传性相关[11-12]。本文研究发现不仅是BRCA,HRR 基因胚系突变的患者也具有明显的遗传发病特征,呈现典型的家族聚集现象,并且HRR 基因突变的患者55 岁之前发病比例较高。有研究表明BRCA1/2 基因突变与HGSOC 有关[13],本文研究发现不仅BRCA1/2 基因,HRR 基因突变也与HGSOC 相关。但是,本研究发现HRR 基因突变与铂类药物治疗敏感性相关,HRR 基因突变患者对铂类药物治疗更敏感[14-15],提示开展HRR 多基因检测对于指导卵巢癌患者精准治疗有重要价值。
除了胚系突变,体细胞突变也具有重要的检测价值,其能更加直观地反映肿瘤组织的突变情况。体细胞层面检测出致病性突变最多的基因是TP53,多数肿瘤组织携带TP53 突变,卵巢癌组织中TP53 也是最主要的突变基因,然而目前卵巢癌中并无针对TP53 有效的治疗方法[16-18]。本文也分析了TP53 与卵巢癌患者临床病理指标的相关性,结果发现TP53 与卵巢癌患者治疗和预后无显著相关。本文仅检出1 例患者携带MMR 基因致病突变,提示携带MMR 基因突变的患者比例可能较低,组织层面检出的HRR 突变大部分来源于胚系,这与肿瘤的“二次打击”学说一致,携带胚系突变的人群罹患肿瘤的风险更高。但是仍有4例患者为gHRR-、tHRR+(这些位点发生于ATM、BRCA1 和PLAB2 基因),其中2 例胚系中检出NBN基因VUS 突变。现阶段对于BRCA 以外的其他HRR 基因VUS 突变认识仍有不足,提示某些HRR基因的VUS 突变可能具有致病性,仍有待进一步研究。另外2 例患者除了携带tHRR,还检出tTP53 突变,这提示肿瘤组织的驱动基因突变可能在卵巢癌发病过程中发挥作用。组织层面检出tHRR 的患者与gHRR 的患者在发病年龄和家族史方面具有相同的特征,并且对铂类药物治疗敏感。本研究还发现,tHRR突变有利于降低患者的复发风险。有文献报道携带以BRCA 为主的HRR 突变的患者短期生存优势明显[19-22],这与本文研究结果一致,说明肿瘤组织的HRR 基因检测有助于增加铂类获益人群的检出,并辅助评估卵巢癌患者的远期预后。
聚ADP-核糖聚合酶(poly-ADP ribose polymerase,PARP)抑制剂已经获批应用于BRCA 突变和同源重组修复缺陷(homologous recombination repair deficiency,HRD)患者的治疗[23-26]。因此,可以预见,开展基于二代测序的DDR 多基因检测可使更多的卵巢癌患者从中受益,指导卵巢癌精准诊疗,并辅助远期预后的评估。
