禾谷镰刀菌对苯基吡咯类杀菌剂咯菌腈的抗性机制
2022-12-27周焕焕崔叶贤胡海燕刘起丽刘润强吴艳兵李成伟
周 锋, 周焕焕, 崔叶贤, 胡海燕, 刘起丽,刘润强, 吴艳兵*,, 李成伟
(1. 河南科技学院 资源与环境学院,河南 新乡 453003;2. 河南科技学院 生命科技学院,河南 新乡 453003;3. 河南工业大学 粮油食品学院,郑州 450001)
小麦是世界上最重要的粮食作物之一,在其生产过程中,由禾谷镰刀菌Fusarium graminearum引起的小麦赤霉病在各主产区广泛流行,不仅造成小麦产量下降,还因其在侵染过程中产生脱氧雪腐镰刀菌烯醇 (deoxynivalenol,DON) 毒素等次生代谢物质而威胁人畜健康[1-7]。已有研究表明,以黄河和长江流域为代表的我国主要小麦产区赤霉病发病率和严重程度大幅上升,引起了人们对小麦生产可持续性的担忧[8-10]。在缺乏稳定的小麦赤霉病抗病品种的情况下,当前对该病害的防控主要以施用杀菌剂多菌灵 (carbandazim)、戊唑醇(tebuconazole) 和氰烯菌酯 (phenamacril) 等为主[1-2,11-17]。然而,因化学杀菌剂的广泛和不科学施用,易导致病原菌产生抗药性[18],且已证实多菌灵及戊唑醇等杀菌剂在防控我国小麦赤霉病过程中存在较大的抗性风险[2,15,17,19]。
苯基吡咯类杀菌剂咯菌腈 (fludioxonil) 对多种病原真菌均具有较高的抑制活性,从而为防治小麦赤霉病提供了新的途径[20-22]。近年来,咯菌腈在我国已广泛用于小麦、水稻、棉花和花生等作物上病害的防治[7,23-24]。然而,因前期咯菌腈的大量及不科学使用,现已导致多种病原菌对其敏感性下降,在玉米和大豆病害样品中均已检测到禾谷镰刀菌抗咯菌腈的突变体[25],并已从我国小麦田中分离到亚洲镰刀菌Fusarium asiaticum对咯菌腈的抗性菌株[7]。此外,在其他包括灰葡萄孢Botrytis cinerea、玉蜀黍平脐蠕孢Bipolaris maydis及链格孢Alternate alternaria在内的多种植物病原真菌中,也检测到了低水平的抗咯菌腈突变体[26-36]。本课题组前期研究表明,于2018 年至2019 年采自我国主要小麦产区的53 株禾谷镰刀菌均对咯菌腈表现敏感,尚未检测到其抗性突变体,并据此建立了禾谷镰刀菌对咯菌腈的敏感性基线[37],研究结果为小麦赤霉病的有效防控及后续明确抗禾谷镰刀菌突变体的抗药性水平提供依据。
目前,有关咯菌腈的具体作用机制尚不完全清楚,但人们普遍认为其作用于与III 型杂合组氨酸激酶 (group III hybrid histidine kinases,HHKs)高渗透压应激反应 (high-osmolarity glycerol,HOG1) 相关的促分裂原活化蛋白激酶 (mitogenactivated protein kinase,MAPK) 信号传导通路[20-22]。因这一信号通路在许多植物病原真菌中广泛存在,所以咯菌腈对多种病原菌都表现出很高的抑制活性[20,22,38]。此外,尽管已有研究表明其抗性机理可能与某些基因的突变或表达量变化有一定关联,但其潜在的抗性机制仍没有完全被揭示。有研究表明,灰葡萄孢对咯菌腈的实验室诱导高水平抗性突变体其上游HHKs 的C-端ATM 酶结构域序列发生了改变,而野生型菌株主要分布在组氨酸激酶、腺苷酸环化酶、甲基结合蛋白以及HKSN-末端的磷酸酶 (histidine kinases, adenylyl cyclases, methy binding proteins, phosphatases,HAMP) 结构域,该结构域为识别化合物刺激性所必需的基序[24,34,36]。同时,因植物病原真菌可能具有多个HHKs 基因,如禾谷镰刀菌的HOG1-MAPK信号通路中至少有4 个Os系列基因存在 (FgOs1、FgOs2、FgOs4和FgOs5)[7,9],且已有研究表明,Os系列基因的突变可能是导致病原菌对咯菌腈产生抗性的主要原因[7,39]。相关研究表明,抗咯菌腈突变体通常表现出适合度降低,特别是对渗透胁迫的高度敏感等表现型,这和病原菌对咯菌腈的抗性机制与HOG1-MAPK 信号通路之间存在关联的结果是一致的[7,24,36-37,40]。此外,本课题组新近的研究结果表明,在实验室诱变得到的禾谷镰刀菌对咯菌腈高水平抗性突变体中,仅发现FgOs1和FgOs5 存在氨基酸突变,而FgOs2 和FgOs4 均不存在氨基酸突变位点,但FgOs2和FgOs4的基因表达量存在显著下调 (P<0.05) 现象[37],推测禾谷镰刀菌HOG1-MAPK信号通路中相关氨基酸的突变或基因表达量的变化可能参与了其对咯菌腈抗性的形成过程,但关于FgOs1和FgOs5的基因表达量是否发生了变化、其是否参与了禾谷镰刀菌对咯菌腈抗性的形成过程等尚不清楚。目前,尽管已有一些关于咯菌腈作用机制和抗性方面的研究报道,但因其作用机制及抗性机制的复杂性,具体仍有待深入研究,因此,本课题组进一步开展了禾谷镰刀菌对咯菌腈抗性机制的探究,以期为咯菌腈在小麦赤霉病防控中的科学使用及更好地指导生产实践提供参考。
1 材料与方法
1.1 供试材料
菌株:4 株禾谷镰刀菌F.graminearum对咯菌腈的敏感菌株2XZ-4 (EC50值为0.06 μg/mL)、HBXT2 (0.01 μg/mL)、CM2 (0.05 μg/mL) 和SQ1-2(0.04 μg/mL),2018 年于本实验室保存至今;4 株通过室内药剂驯化获得的禾谷镰刀菌对咯菌腈的抗性突变体2XZ-4R (EC50值为41.36 μg/mL)、HBXT2R (48.75 μg/mL)、CM2R (68.45 μg/mL) 和SQ1-2R (101.78 μg/mL),抗性倍数分别为318.2、375.0、526.5 和782.9,2019 年于实验室保存至今[37]。
杀菌剂:96.0%咯菌腈原药 (湖北健源化工有限公司)。称取适量原药溶于丙酮中,配制成质量浓度为10 000 μg/mL 母液,根据试验需要进行梯度稀释后置于4 ℃冰箱中保存,备用。
培养基:供试菌株在马铃薯葡萄糖琼脂培养基 (PDA,200 g/L 马铃薯、20 g/L 琼脂和20 g/L葡萄糖) 中于23 ℃条件下培养,备用;于绿豆肉汤 (MBB,55 g/L 绿豆) 培养基中摇培孢子,用于开展供试菌株的致病性分析;于马铃薯葡萄糖(PDB,北京奥博星生物科技有限公司) 培养基中培养收集菌丝,用于菌体内酶活性分析以及RNA提取试验,相关试验均参照前期本课题组的研究方案[37]实施。
试剂盒:苯丙氨酸解氨酶 (phenylalanineammonialyase,PAL) (货号:A137-1-1)、过氧化物酶(peroxidase,POD) (货号:A084-3-1) 和多酚氧化酶 (polyphenol oxidase,PPO) (货号:A136-1-1) 活性测定试剂盒购自南京建城生物工程研究所;RNA提取试剂盒 (货号:R6840-01) 购自OMEGA 公司;PrimeScript RT 试剂盒 (货号:RR047A) 购自Takara 公司。
供试仪器:荧光定量PCR 仪 (QuantStudio 6 Flex PCR) 购自Applied biosystems 公司;酶标仪(Tecan Infinite200 Pro) 购自Tecan 公司;血球计数板 (XB-K-25) 购自上海市求精生化试剂仪器有限公司。
1.2 抗咯菌腈禾谷镰刀菌突变体的生物学特性测定
1.2.1 对小麦的致病性测定 按照已报道的研究方案[37]评估供试菌株的产孢量:将在PDA 中培养48 h 的3 块直径5 mm 的新鲜菌丝块转移到装有30 mL 已灭菌绿豆肉汤 (MBB) 培养基的三角瓶中,于23 ℃、130 r/min 的恒温摇床上振荡培养3 d 后收集孢子,经无菌水连续重悬与稀释后,用血球计数板计数,统计供试菌株产生孢子的数量。
同时,按照周明国课题组报道[13,41]的孢子人工接种小麦幼穗法,在温室条件 (25 ℃左右) 下开展供试菌株对扬花初期小麦穗的致病性评估,每个菌株至少重复8 个小麦穗。于小麦抽穗扬花初期,用10 μL 孢子悬浮液 (1.0 × 105孢子/mL) 进行接种,以接种清水作为空白对照,并在接种后17 d评估发病率及病害严重程度。
1.2.2 对渗透胁迫的敏感性测定 将在PDA 平板上培养48 h、直径5 mm 的供试新鲜菌丝块分别转接到含0.5 mol/L NaCl、1.0 mol/L MgCl2、1.0 mol/L 葡萄糖或1.0 mol/L 甘露醇的PDA 平板上,以接种到空白PDA 培养基的处理作为对照,每个处理设6 次重复。在23 ℃培养箱中培养48 h 后,用十字交叉法测量菌落直径,并按照前期报道的优化后的方法[37]计算菌丝生长抑制率。
1.2.3 酶活性 (PAL、POD 及PPO) 测定 酶的提取、活性测定和分析使用商业检测试剂盒,根据商品说明书和前期已报道[36,42-43]的研究方法开展试验,并稍作改进。首先将新鲜菌丝块接种至200 mL 已灭菌的PDB 中,于23 ℃、150 r/min 下振荡培养3 d,并于菌丝收集前8 h 在每个处理瓶中加入0.1 μg/mL 的咯菌腈,以相同培养条件下不加咯菌腈的样品作为对照。进一步孵育后,收集新鲜菌丝样品 (0.1 g),经液氮研磨后转到1 mL 浓度为100 mmol/L 的磷酸盐缓冲液 (pH 7.4) 中充分混匀,4 ℃条件下于3 500 r/min 离心10 min,取上清液即为供试样品总酶源,4 ℃保存、备用。
PAL 活性测定根据商品说明书和Duan 等[42]的报道并稍作改进。取样品总酶源20 μL,与试剂盒中的试剂I 780 μL 和试剂II 200 μL 充分混合,置于40 ℃水浴锅中反应30 min,再加入40 μL 试剂III 并充分混合,终止反应。样品在3 500 r/min下离心10 min,转移到直径1 cm 的比色皿中,在酶标仪中测量290 nm 处的吸光度,以仅含有蒸馏水的比色皿作为空白对照,计算吸光度变化,以1 mL 反应体系中、1 g 供试菌丝样品在1 min 内使290 nm 处吸光度值变化0.1 为1 个酶活力单位(U/g 鲜重),具体计算公式见说明书。
采用与已有研究报道[36,42]相似的方法测定POD 和 PPO 活性,其中,酶源样品分别为100和150 μL,按照相应试剂盒说明书中的操作规程操作,测定420 nm 处的吸光度,分别以加入100 μL双蒸水和150 μL 煮沸处理的粗酶上清液作为空白对照,每个供试样品设3 次重复。以37 ℃条件下、1 g 供试菌丝样品在1 min 内催化1 μg 底物的酶量定义为一个POD 酶活力单位 (U/g 鲜重); 以1 mL 反应体系中、1 g 供试菌丝样品在 1 min 内使420 nm 处吸光度值变化0.01 为一个PPO 酶活力单位 (U/g 鲜重);具体计算公式见说明书。
1.3 FgOs1 及FgOs5 基因表达量分析
按照真菌RNA 提取试剂盒说明书提取菌丝中的总RNA,再用PrimeScript RT 试剂盒合成第一链cDNA,并以此作为反应模板,结合表1 中的引物对供试菌株中FgOs1和FgOs5的基因片段(约400 bp) 进行扩增。按试剂盒说明书配制好RTPCR 反应体系后,参照以下程序在QuantStudio 6 Flex PCR 检测系统中进行扩增反应:95 ℃预变性10 s;95 ℃ 5 s,60 ℃ 34 s,循环40 次;95 ℃15 s,60 ℃ 60 s;95 ℃ 15 s。然后按照已报道[16,37]的方法计算候选基因的相对表达水平,以β-微管蛋白 (β-tubulin) 为内参基因。每个样品重复3 次,计算平均值和标准误差 (SE)。
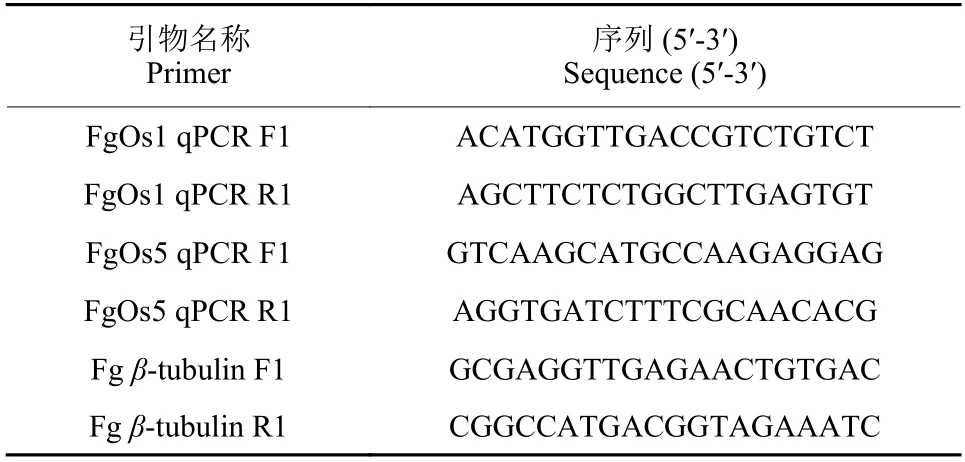
表1 本研究中所用到的引物Table 1 Primers used in this study
1.4 数据分析
试验结果数据均采用SPSS (17.0) 软件处理,运用Fisher 最小显著差异法进行分析。
2 结果与分析
2.1 抗咯菌腈禾谷镰刀菌突变体的致病性及对渗透压的敏感性
本研究通过孢子人工接种小麦幼穗法评价供试禾谷镰刀菌对小麦的致病性。结果 (图1) 表明:与敏感菌株相比,所有供试抗咯菌腈突变体对小麦的致病性均显著降低 (P<0.05),发病植株的病害严重程度也显著下降,降低了约50%;其中,突变体2XZ-4R 甚至已完全丧失对小麦幼穗的侵染能力。
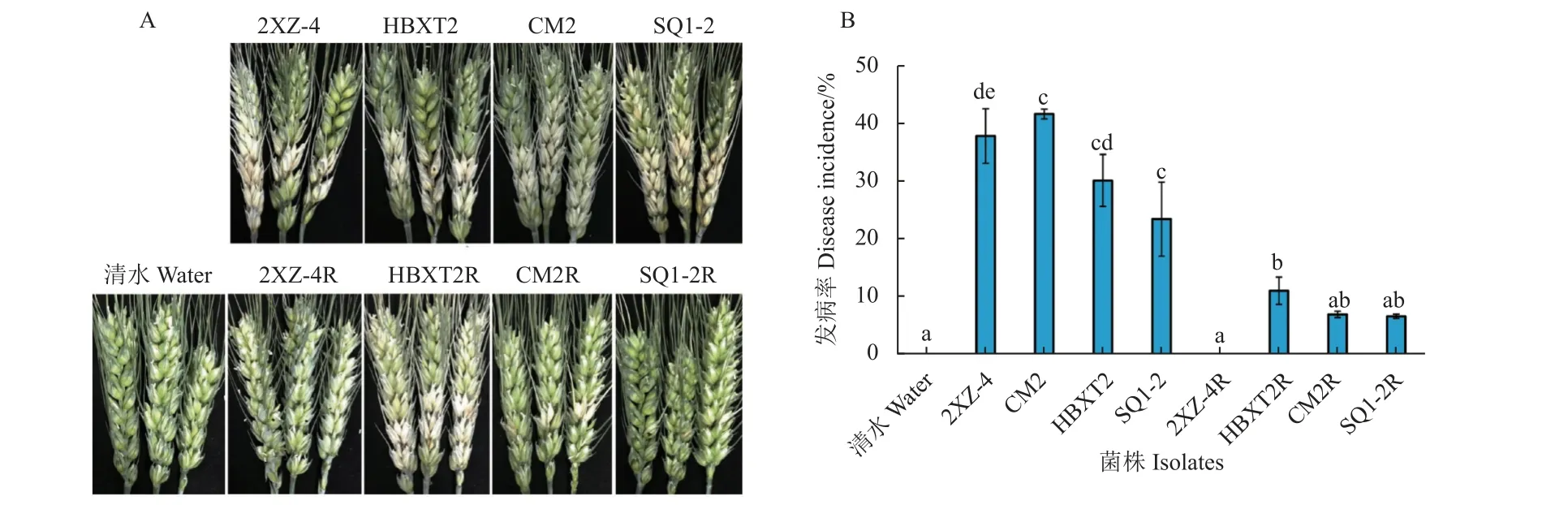
图1 抗咯菌腈禾谷镰刀菌突变体与敏感菌株对小麦幼穗的致病力Fig.1 Pathogenicity of fludioxonil-resistant mutants and -sensitive isolates of F. graminearum on wheat ears
渗透压敏感性分析结果表明:在PDA 培养基中分别添加0.5 mol/L 氯化钠 (图2A)、1.0 mol/L氯化镁 (图2B)、1.0 mol/L 葡萄糖 (图2C) 和1.0 mol/L 甘露醇 (图2D) 后,与敏感菌株相比,所有供试抗咯菌腈禾谷镰刀菌突变体菌丝的抑制率均表现出显著降低趋势,降低约50%以上 (P<0.05)。
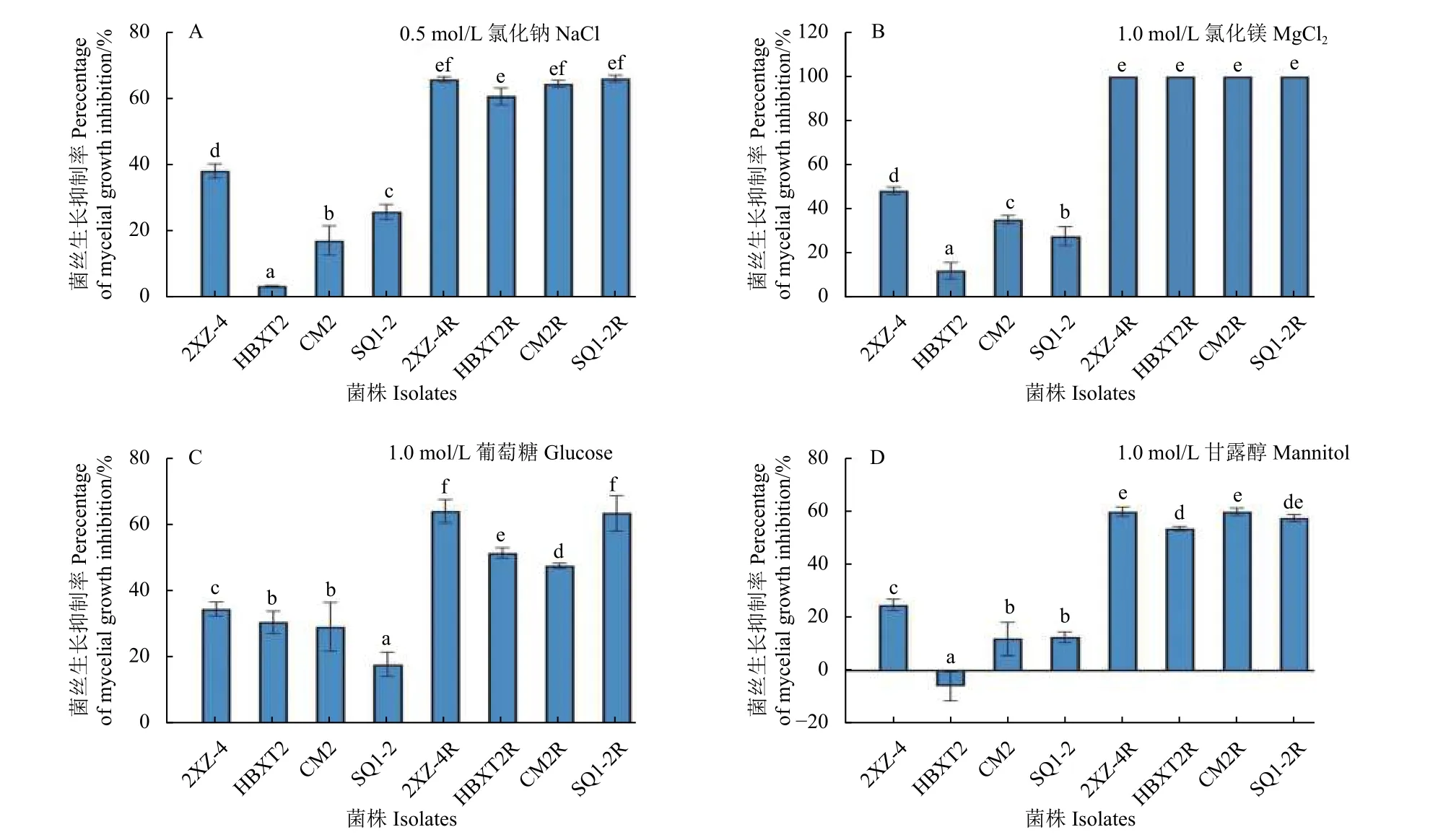
图2 供试抗咯菌腈禾谷镰刀菌突变体与敏感菌株对渗透胁迫的敏感性Fig.2 Four fludioxonil-resistant mutants and four sensitive isolates of F. graminearum in response to osmotic stresses
综上,研究表明,抗咯菌腈禾谷镰刀菌突变体在致病性和渗透胁迫反应方面的适合度均显著降低。
2.2 抗咯菌腈禾谷镰刀菌突变体PAL、POD 和PPO 酶活性
PAL、POD 和PPO 等抗氧化反应酶在植物病原真菌的成功定殖中起着重要作用[36,42-44]。本研究发现,抗咯菌腈禾谷镰刀菌突变体中这3 种酶的活性均显著升高 (P<0.05),尤其是在没有咯菌腈处理的情况下,突变体的PAL 和POD 活性几乎为敏感菌株酶活性的2 倍 (图3A 和3B)。其中,突变体2XZ-4R、HBXT2R、CM2R 和SQ1-2R 的PAL 活性分别比敏感菌株的酶活性平均值升高了2.46、2.38、2.04 和2.24 倍,POD 活性分别升高了2.40、1.78、2.76 和1.60 倍。在咯菌腈存在的情况下,尽管咯菌腈敏感菌株中这两种酶的活性也显著增加,但从未达到突变体菌株中观察到的活性水平。类似的模式在PPO 活性中也被发现,虽然趋势更加明显,但抗咯菌腈禾谷镰刀菌突变体的活性明显高于缺乏咯菌腈刺激时的活性,且PPO 活性与敏感菌株酶活性平均值相比分别提高了1.53、1.42、1.57 和1.36 倍。
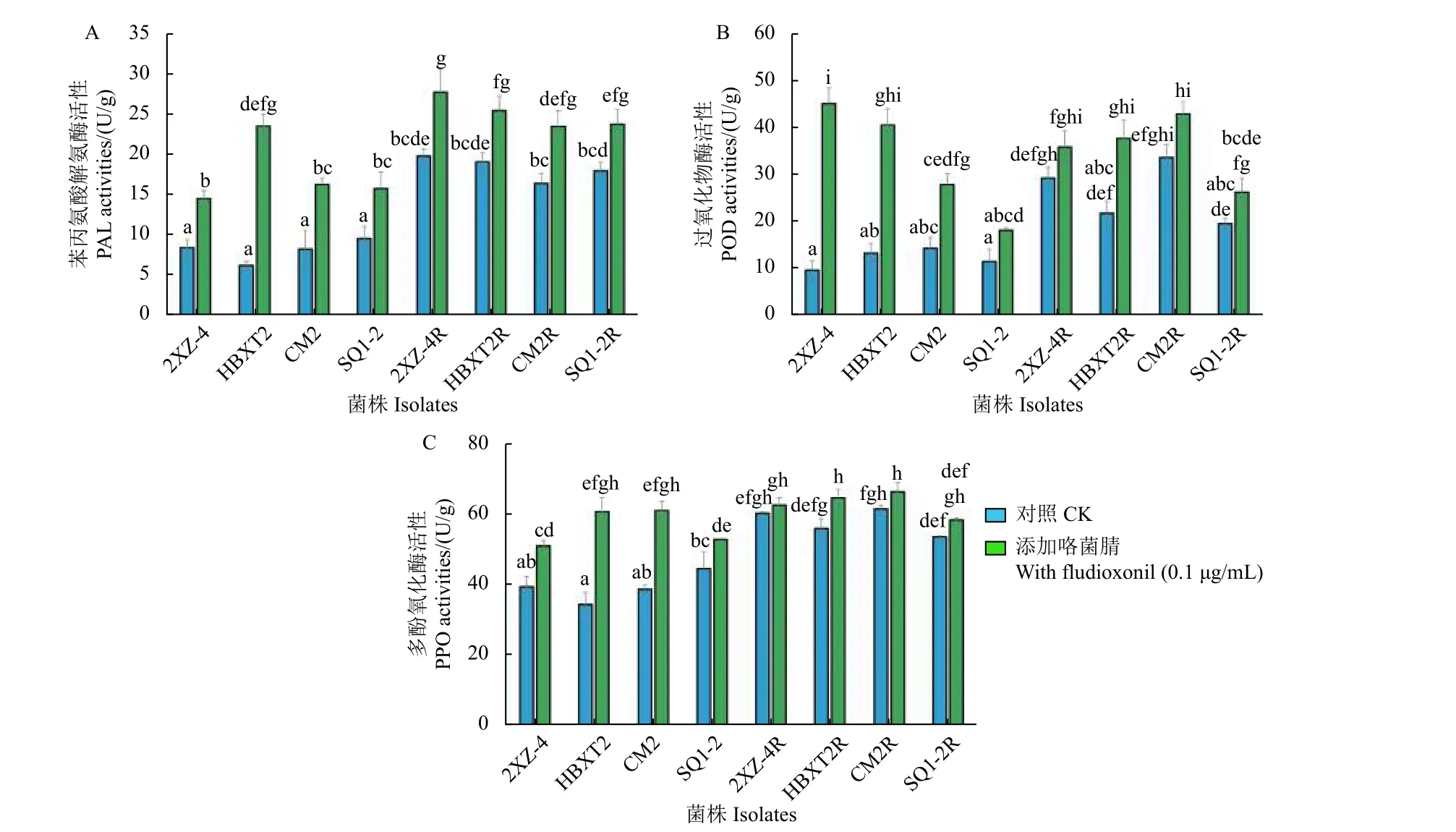
图3 供试抗咯菌腈禾谷镰刀菌突变体与敏感菌株中抗氧化酶的活性分析Fig.3 Activities of antioxidant reactive enzymes in four four fludioxonil-resistant mutants and four sensitive isolates of F. graminearum
2.3 抗咯菌腈禾谷镰刀菌突变体FgOs1 及FgOs5基因表达量
本课题组前期研究[37]表明,FgOs1及FgOs5也可能是咯菌腈在禾谷镰刀菌中的作用靶标,并参与了禾谷镰刀菌对咯菌腈抗性的形成过程。本研究通过分析供试菌株中FgOs1及FgOs5的基因表达量变化发现:与敏感菌株 (2XZ-4、HBXT2和CM2) 相比,其对应抗性突变体的基因表达量均显著下调 (P<0.05),但菌株SQ1-2 与其对应抗性突变体SQ1-2R 在FgOs5基因表达量上无显著性差异 (图4);经0.1 μg/mL 咯菌腈处理后,各敏感菌株及其抗性突变体FgOs1和FgOs5的表达量均显著上调 (图4A 和4B),但抗性突变体的上调幅度更为明显,与敏感菌株的平均值相比,菌株2XZ-4、HBXT2、CM2 和SQ1-2 中FgOs1的表达量分别增加了2.20、2.40、2.10 和1.05 倍。在没有咯菌腈刺激的情况下,供试抗性突变体仍然没有上升到敏感菌株的基因表达水平 (图4B)。其中,敏感性菌株SQ1-2 在没有咯菌腈刺激的情况下FgOs1和FgOs5表达水平均较低,基因表达量与其突变体SQ1-2R 之间无显著性差异 (P>0.05),而其他抗性突变体 (2XZ-4R、HBXT2R和CM2R)相较于其亲本菌株的FgOs1和FgOs5表达量均显著下降。上述结果进一步证实了FgOs1和FgOs5在禾谷镰刀菌对咯菌腈的抗性中发挥着重要作用,同时表明了禾谷镰刀菌对咯菌腈的抗性分子机制可能比之前认为的更加复杂。
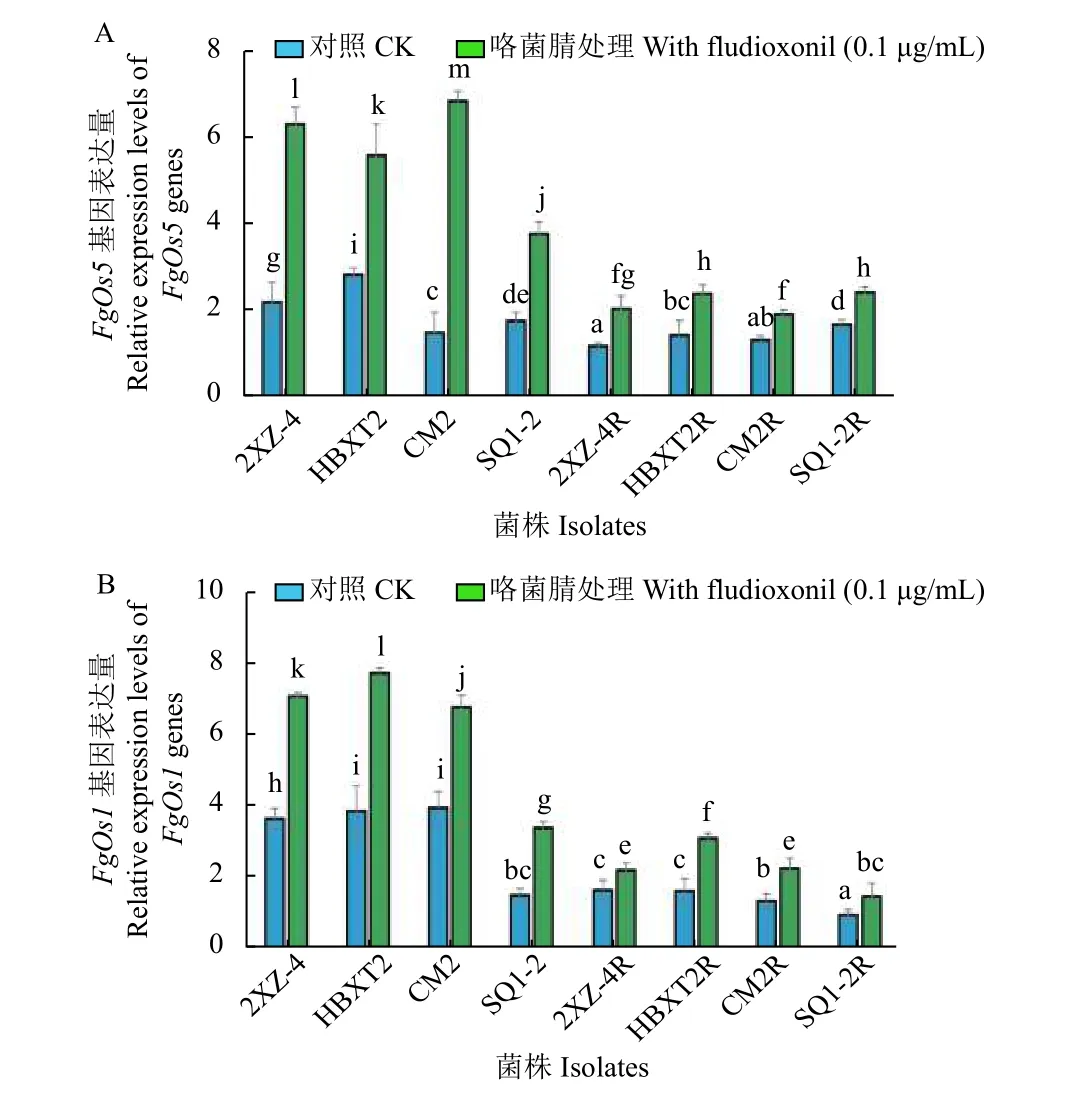
图4 供试抗咯菌腈禾谷镰刀菌突变体与敏感菌株的基因表达量分析Fig.4 Expression analysis of genes in four fludioxonilresistant mutants and four sensitive isolates in F. graminearum
3 结论与讨论
本课题组前期研究表明,从2018-2019 年于我国主要小麦产区分离到的53 株禾谷镰刀菌中,尚未检测到对咯菌腈抗性突变体的存在[37],这为继续使用咯菌腈来防控小麦赤霉病提供了数据支撑。现有研究表明,咯菌腈的作用靶标可能是与HOG1-MAPK 信号通路相关的III 型组氨酸蛋白激酶[7,22,34,36-37],但目前对于其准确的抗性分子机制尚不清楚。我们最近的研究表明,抗咯菌腈突变体对渗透胁迫表现出很高的敏感性[37],这与前期的靶蛋白质假说一致。同时,还有不少关于咯菌腈抗性突变体存在菌丝生长速率、产孢量和致病力降低等适合度下降现象的报道[7,22,34,37]。本研究发现,抗咯菌腈禾谷镰刀菌突变体在小麦抽穗扬花期对麦穗的致病性也存在显著降低现象 (P<0.05),这与前人关于抗咯菌腈禾谷镰刀菌突变体对小麦幼苗致病力降低的研究结果一致[7,37],同时也表明本研究所用的孢子人工接种小麦幼穗法和前期报道的孢子人工接种小麦幼苗法均适用于评价禾谷镰刀菌对小麦的致病性。此外,本研究还发现,所有供试抗咯菌腈禾谷镰刀菌突变体对渗透胁迫较敏感菌株均更加敏感,这也与前人的研究结果[7,22,34,37]相一致。总之,结合前期的研究报道和本研究结果可以得到,尽管在禾谷镰刀菌中可能会出现高水平的咯菌腈抗性菌株,但因抗性突变体对环境的适合度较低,在实践中可能降低了禾谷镰刀菌对咯菌腈的抗性风险[7,34,45]。
一般认为,抗氧化反应酶PAL、POD 和PPO 在植物病原菌与寄主植物之间的相互作用中起着关键作用,并为寄主植物的抗氧化损伤提供保护[36,42-44,46-47]。本研究中,抗咯菌腈禾谷镰刀菌突变体的PAL、POD 和PPO 酶活性较敏感菌株均显著升高 (P<0.05),这与前期研究结果和文献报道一致[36,42-43],进一步表明PAL、POD 和PPO 参与了禾谷镰刀菌对咯菌腈抗性的形成过程。综上所述,苯基吡咯类杀菌剂咯菌腈可通过诱导氧化应激,并通过PAL、POD 和PPO 酶活性变化启动防御反应,而这些酶活性的升高可能是禾谷镰刀菌对咯菌腈产生抗性的一个重要因素。
众多研究表明,与HOG1-MAPK 信号通路相关的III 型组氨酸蛋白激酶蛋白质序列的突变或其基因表达量的变化 (上调或下调),可导致植物病原真菌对咯菌腈产生抗性[7,24,34,37],如Os1基因中位于N 端部分的HAMP 结构域突变,可以促进链格孢菌Alternaria alternata和灰葡萄孢Botrytis cinerea对咯菌腈的抗性[33-34]。据不完全统计,到目前为止已在不同的植物病原菌中至少发现了24 种氨基酸突变类型 (附图1)[24,34,37,45],但目前尚不清楚哪些突变位点的改变与对咯菌腈的抗性直接相关,还需要进一步验证。在禾谷镰刀菌的HOG1-MAPK 信号通路中,虽然至少有4 个Os系列基因 (FgOs1、FgOs2、FgOs4和FgOs5) 存在[7,9],但目前在抗咯菌腈的禾谷镰刀菌突变体中只发现了FgOs1 和FgOs5 存在氨基酸突变,而FgOs2和FgOs4基因的表达量发生了显著下调(P<0.05)[37]。本研究表明,与敏感菌株相比,咯菌腈抗性突变体中FgOs1和FgOs5基因的表达量也存在显著下调 (P<0.05) 现象,但在低浓度咯菌腈(0.1 μg/mL) 的作用下,敏感菌株比抗性突变体的基因表达量上调更加显著。这些结果表明,抗咯菌腈禾谷镰刀菌突变体的FgOs1 和FgOs5 不仅存在氨基酸突变,而且抗性突变体中这两个基因的表达量也发生了显著变化。
综上所述,目前的研究表明,植物病原真菌对苯基吡咯类杀菌剂咯菌腈的抗性机制远比之前认为的要复杂,可能涉及多个基因及其相关基因的相互作用。因此,需要进一步利用转录组学、代谢组学及蛋白质组学技术,找到与抗性表型有关的关键基因,并通过反向遗传学方法进一步验证与咯菌腈抗性直接相关的候选基因,进而全面揭示植物病原真菌对咯菌腈的抗性分子机制。此外,深入揭示植物病原真菌对咯菌腈的抗性分子机制,不仅可为评估重要植物病原真菌对咯菌腈的抗性风险提供理论指导,同时也可为开发新型苯吡咯类杀菌剂提供分子靶标,因而对植物真菌病害的有效防控具有重要意义。
