三种基质中15 种农药及其代谢物的不确定度评估
2022-12-27杨晓云刘江情卢潇婷王立芳周文忠胡建西李璐芸
杨晓云, 姜 亮, 刘江情, 卢潇婷, 王立芳,周文忠, 胡建西, 李璐芸, 刘 静*,
(1. 云南同创检测技术股份有限公司,昆明 650106;2. 云南大学 化学科学与工程学院,昆明 650091)
自1963 年美国数理专家Churchill Eisenhart首次提出测量不确定度的概念以来,测量不确定度就受到国内外的广泛关注[1]。1993 年国际标准化组织 (ISO)、国际计量局 (BIPM)、国际电工委员会 (IEC)、国际临床化学联合会 (IFCC)、国际实验室认可合作组织 (ILAC)、国际理论和应用物理联合会 (IUPAP)和国际法制计量组织 (OIML) 联合建立并发布了测量不确定度评定和表示的通用规则——Guide to the Expression of Uncertainty in Measurement (简称GUM),为检验检测结果的不确定度评定和表示奠定了基础[2-3]。为了满足测量不确定度在国内的需求,我国也紧随GUM 的步伐,发布了一系列标准和指南,例如国家质检总局先后发布的JJF 1135—2005《化学分析测量不确定度评定》[4]、JJF 1059.1—2012《测量不确定度评定与表示》[5]和JJF 1059.2—2012《用蒙特卡洛法评定测量不确定度》[6],中国实验室国家认可委员会制定的CNAS-GL006—2019《化学分析中不确定度的评估指南》[7]等。
其中CNAS-GL006—2019[7]将不确定度定义为与测量结果相关联的参数,它表征了可以合理地赋予被测量的量值分散程度。因此,测量不确定度是对检验检测结果合格判定的重要因素,同时也是衡量实验室检验检测质量的重要指标[8]。为了控制测量不确定度在合格判定中引起的误判风险,CNAS-CL01—2018《检测和校准实验室能力认可准则》[9]和RB/T 214—2017《检验检测机构资质认定能力评价 检验检测机构通用要求》[10]均规定需提供测量不确定度的信息。
近年来,农药残留检测结果对测量不确定度的需求日益增长[11-12]。洪泽淳等[13]对气相色谱法(GC) 测定白菜中16 种有机磷农药残留的不确定度进行了评估。汪志威等[14]对气-质联用法 (GCMS) 测定草莓中丙溴磷、亚胺硫磷、五氯硝基苯、氯氟氰菊酯4 种农药残留的不确定度进行了评估。Pano-Farias 等[15]对GC-MS 法测定木瓜和鳄梨中5 种农药残留的不确定度进行了评估。张磊等[16]对气相色谱-串联质谱法 (GC-MS/MS) 法测定香菇中联苯菊酯残留量的不确定度进行了评估。乔海霞等[17]对GC-MS/MS 法测定黄瓜中嘧霉胺残留量的不确定度进行了评估。阳曦等[18]对GCMS/MS 法测定结球甘蓝中甲基毒死蜱的不确定度进行了评估。Harischandra 等[19]对GC-MS/MS 和液相色谱-串联质谱法 (LC-MS/MS) 同时测定树豆中79 种农药残留的不确定度进行了评估。但不同食用农产品基质对引入不确定度的影响却未见报道,因此本研究选择茶叶、普通白菜和苹果3 种基质来考察不确定度。
自GB 23200.113—2018《食品安全国家标准植物源性食品中208 种农药及其代谢物残留量的测定 气相色谱-质谱联用法》[20]实施以来,《食品安全监督抽检实施细则》采用GB 23200.113—2018 检测茶叶、蔬菜和水果等食用农产品中有机磷、有机氯和拟除虫菊酯类农药及其代谢物呈现逐年递增的趋势。2022 年版《食品安全监督抽检实施细则》中茶叶、普通白菜和苹果共有15 项农药及其代谢物可用GB 23200.113—2018 检验。因此,本研究对采用GB 23200.113—2018 QuEChERS前处理测定茶叶、普通白菜和苹果3 种不同基质中15 种农药及其代谢物的不确定度进行评估,并对如何降低不确定度进行了探讨,以期为茶叶和果蔬中农药残留合格性判定提供依据。
1 材料与方法
1.1 材料与试剂
TG-5SILMS 色谱柱 (30 m × 0.25 mm,0.25 μm,美国赛默飞公司),陶瓷均质子 (2 cm × 1 cm,美国Agilent 公司);微孔滤膜 (天津津腾实验设备有限公司)。Pesticides-Mix54、Pesticides-Mix55、Pesticides-Mix56 和Pesticides-Mix57 标准品(50 μg/mL,坛墨质检科技股份有限公司);环氧七氯B (100 μg/mL,坛墨质检科技股份有限公司);乙腈 (色谱纯,DiKMA);乙酸乙酯 (色谱纯, 美国Fisher 公司);醋酸 (色谱纯,天津市科密欧化学试剂有限公司);无水乙酸钠 (分析纯,天津市风船化学试剂科技有限公司);氯化钠、无水硫酸镁和柠檬酸钠 (分析纯,西陇科学股份有限公司);柠檬酸氢二钠 (分析纯,阿拉丁试剂 (上海) 有限公司);乙二胺-N-丙基硅烷化硅胶 (PSA,40~60 μm)、十八烷基硅烷键合硅胶 (C18,50 μm) 和石墨化炭黑(GCB,40~120 μm) (青云实验耗材有限公司)。
1.2 仪器与设备
TRACE 1300/TSQ 9000 气相色谱-串联质谱仪(美国赛默飞世尔科技公司);AUW220 分析天平 (日本岛津公司);N-EVAP-111 氮吹仪 (美国Organomation公司);瓶口分液器 (德国Eppendorf 公司)。
1.3 试验方法
1.3.1 样品制备 按照GB 23200.113—2018 中茶叶及蔬菜水果对应的QuEChERS 前处理方法进行[20]。
1.3.2 标准溶液配制
标准储备液:分别准确量取1 mL Pesticides-Mix54、Pesticides-Mix55、Pesticides-Mix56 和Pesticides-Mix57 标准品,用乙酸乙酯定容至10 mL,配成质量浓度为5 μg/mL 的农药及其代谢物的标准储备液, 于 -18 ℃避光保存。
标准工作溶液:精确吸取一定量上述标准储备液,用乙酸乙酯逐级稀释成质量浓度为0.01、0.02、0.05、0.10、0.20 和0.40 μg/mL 的标准工作溶液。
内标溶液:准确量取0.5 mL 环氧七氯B,用乙酸乙酯定容至10 mL,配成质量浓度为5 μg/mL的内标溶液。
基质混合标准工作溶液:将空白基质溶液用氮气吹干后加入20 μL 内标溶液,加入1 mL 相应质量浓度的标准工作溶液,混匀后过微孔滤膜。
1.3.3 检测条件 TG-5SILMS 色谱柱 (30 m ×0.25 mm,0.25 μm)。升温程序:初始温度40 ℃,保持1.5 min,以25 ℃/min 的速率升至90 ℃,保持1.5 min,再以25 ℃/min 的速率升至180 ℃,再以5 ℃/min 的速率升至280 ℃,再以10 ℃/min的速率升至300 ℃,保持5 min。载气为氦气 (纯度≥99.999%),流速为1 mL/min。进样口温度280 ℃。进样量1 μL,不分流进样。电子轰击源电压70 eV。离子源温度300 ℃。传输线温度280 ℃。多反应监测模式,保留时间及定量定性离子对见表1。
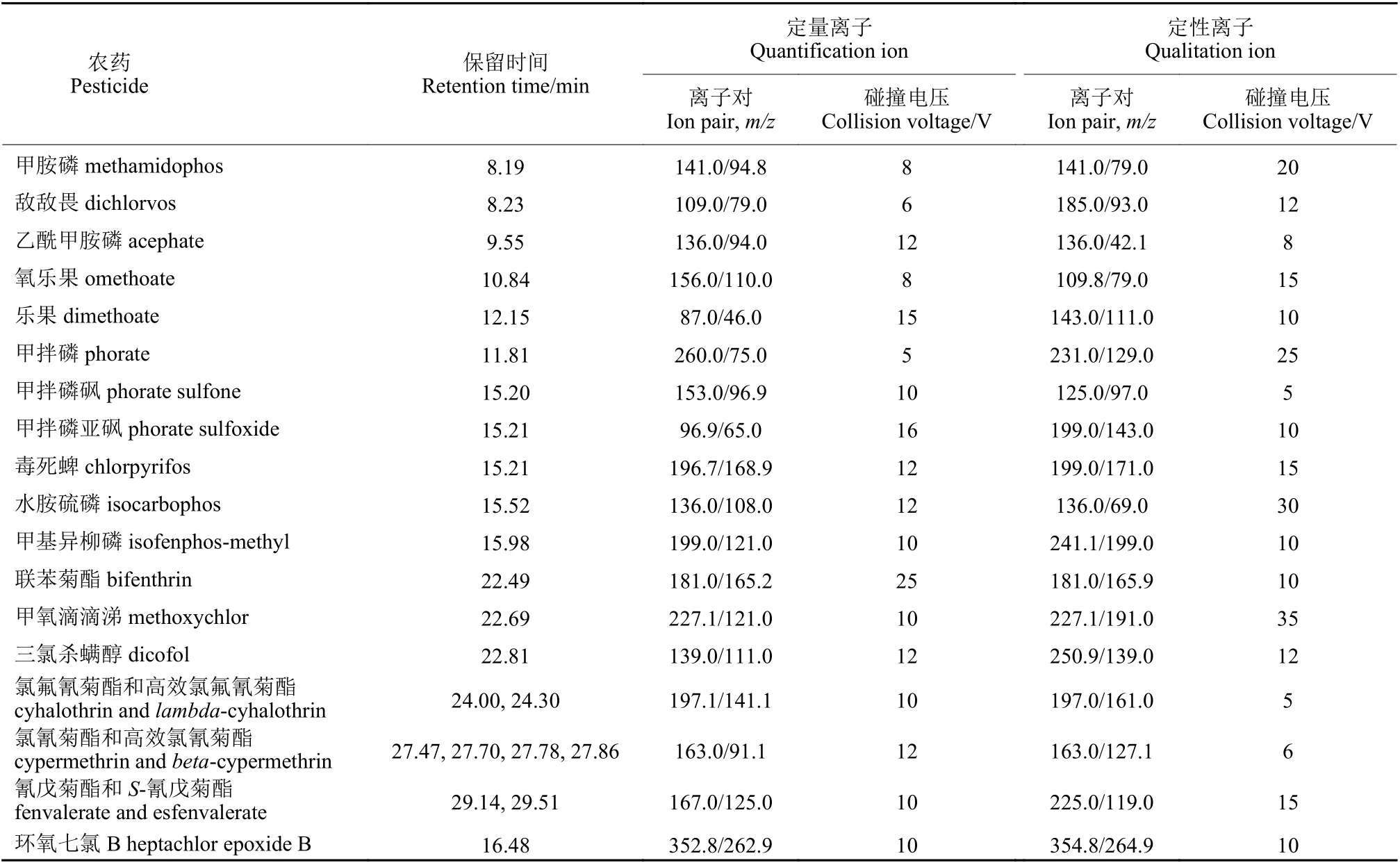
表1 15 种农药及其代谢物的保留时间和质谱参数Table 1 Retention time, mass spectrometric parameters for 15 pesticides and their metabolites
2 结果与分析
2.1 数学模型的建立
依据GB 23200.113—2018[20]进行测定,内标法定量,按公式 (1) 计算样品中被测农药残留量。
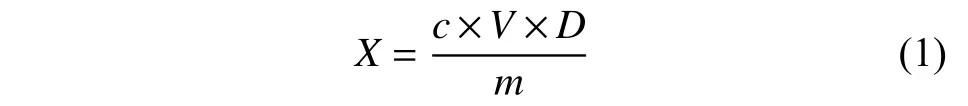
式中,X—试样中被测物含量,mg/kg;c—试样中被测物质量浓度,μg/mL;V—试样最终定容体积,mL;m—试样质量,g;D—稀释因子。
2.2 不确定度来源分析
根据数学模型及测量过程,各农药残留测定结果的不确定度分量主要来自3 个A 类评定分量:测量重复性、工作曲线拟合、回收率,以及3 个B 类评定分量:标准溶液配制、样品制备、仪器。详见图1。
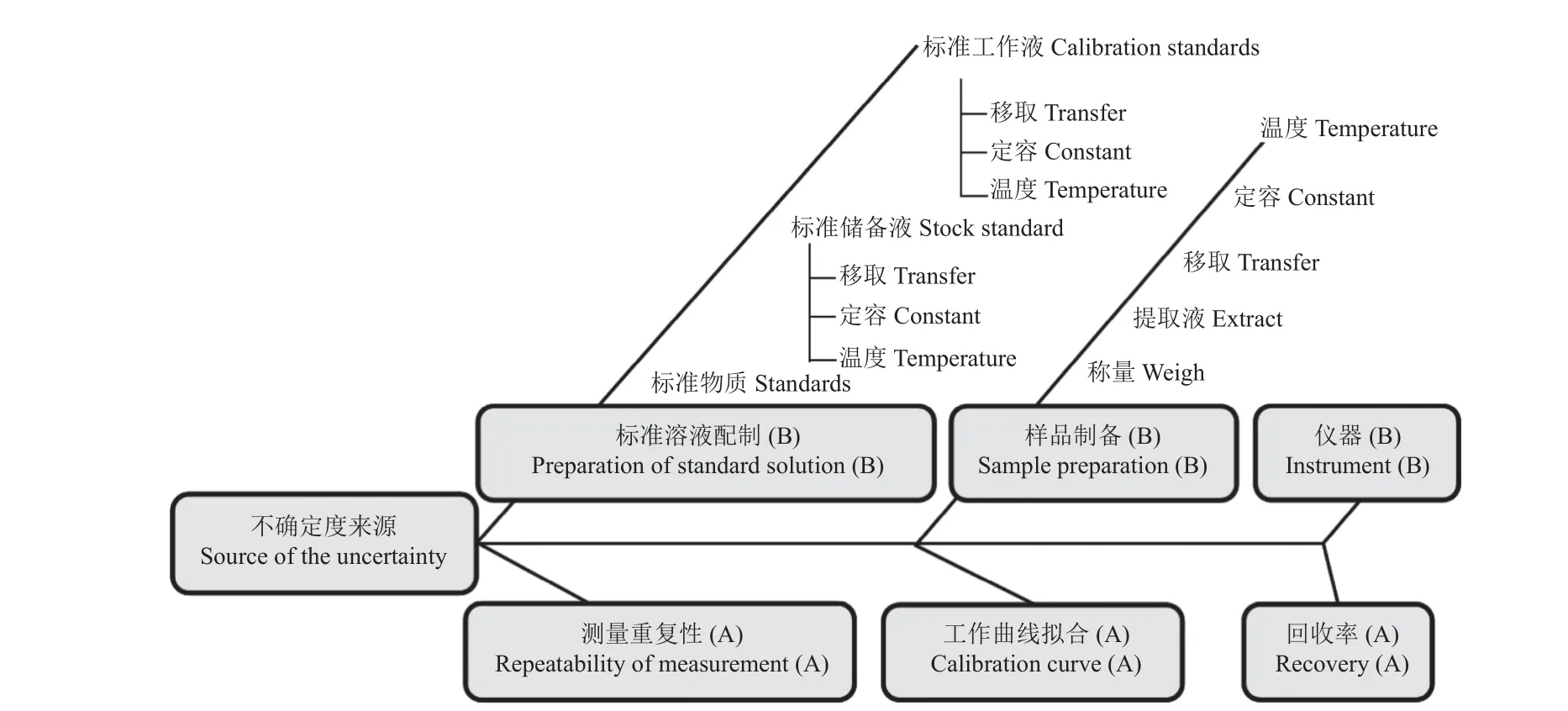
图1 不确定度分量来源图 (A:A 类评定分量;B:B 类评定分量)Fig.1 Source of the uncertainty (A: A-type evaluation component; B: B-type evaluation component )
CAC/GL 59《国际食品法典 结果不确定度评估导则》将测量不确定度的评估方法分为自下向上 (bottom up) 法和自上向下 (top down) 法[21]。其中bottom up 指的是,通过分析识別出每个可能的不确定度来源,评定每一来源对不确定度贡献大小,从而得到测量过程的合成不确定度的值;top down 指的是基于分析方法的建立及从实验室检测样本、已发表的文献数据以及实验室间的协作试验等得到的长期的精确的数据来进行不确定度评定。由于本文是依据GB 23200.113—2018[20]测定不同基质中15 种农药残留及其代谢物的不确定度,因此,采用的是bottom up 的评估方法。
2.3 B 类不确定度评定
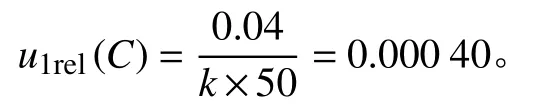
2.3.1.2 由标准储备液引入的不确定度u2rel(C)
使用1 mL 移液管分别移取Pesticides-Mix54、Pesticides-Mix55、Pesticides-Mix56 和Pesticides-Mix57 标准溶液各1 mL,合并于10 mL 容量瓶中,用乙酸乙酯定容得到5 μg/mL 的农药及其代谢物标准储备液。
根据JJG 196—2006《常用玻璃量器检定规程》[22]:A 级单标线1 mL 移液管容量允差为± 0.007 mL,A 级单标线10 mL 容量瓶的容量允差为 ± 0.020 mL,按矩形分布计算k=;环境温度为 (20 ± 5) ℃,有机液体的膨胀系数为1 ×10-3/k,按均匀分布取k=。
各分量的不确定度为:
(1) 1 mL 移液管的相对标准不确定度为:
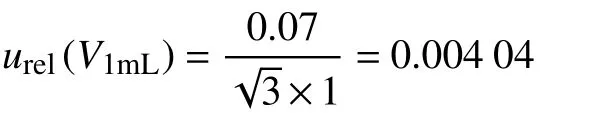
(2) 10 mL 容量瓶的相对标准不确定度为:
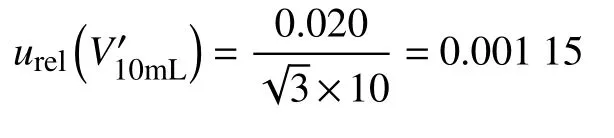
(3) 环境温度变化的相对标准不确定度为:
由以上不确定度分量可得,标准储备液引入的相对标准不确定度为:
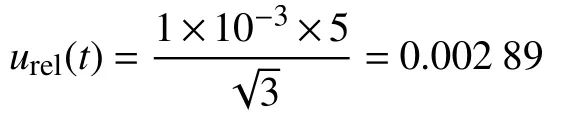

2.3.1.3 由标准工作溶液配制引入的不确定度u3rel(C)
配制标准溶液过程中用到1 次1 mL 移液管,5 次5 mL 移液管,6 次10 mL 容量瓶。
根据JJG 196—2006 《常用玻璃量器检定规程》[22]:A 级1mL 分度移液管的容量允差为 ± 0.008 mL,A 级5 mL 分度移液管的容量允差为 ± 0.025 mL,按矩形分布计算k=;A 级单标线10 mL容量瓶的容量允差为 ± 0.020 mL,按矩形分布计算k=。
各分量的不确定度为:
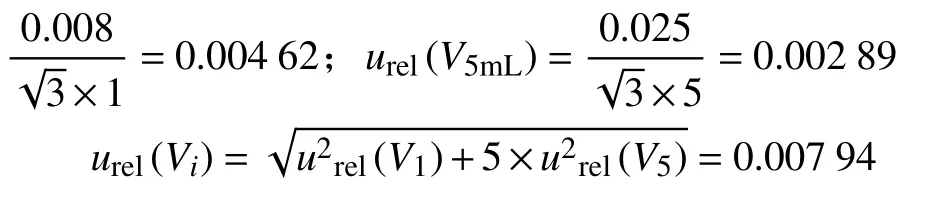
(2) 由上文可知,10 mL 容量瓶的相对标准不确定度为:urel()=0.001 15;环境温度变化的相对标准不确定度为:urel(t)=0.002 89。
由以上不确定度分量可得,标准系列溶液配制引入的相对不确定度为:
综合标准物质、标准储备液、标准工作溶液3 个分量的不确定度,标准溶液引入的相对不确定度为:
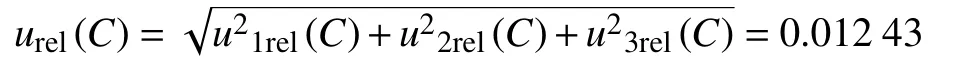
2.3.2 由样品制备引入的不确定度urel(m)2.3.2.1 由样品称量过程引入的不确定度u1rel(m)
称取2 g (精确至0.000 1 g) 茶叶样品或10 g (精确至0.000 1 g) 普通白菜、苹果样品,核查天平检定证书,其最大允许误差为±0.5 mg,k=2,则称量引入的相对不确定度:

2.3.2.2 由提取液总体积引入的不确定度u1rel(V)
用50 mL 瓶口分液器移取乙腈,核查检定证书,k= 2,当提取体积为10 mL 或15 mL 时,分液器引入的相对不确定度为:u1rel(V)=0.001 7

2.3.2.4 由样品最终定容体积引入的不确定度u3rel(V) 用1 mL 移液管移取1 mL 乙酸乙酯复溶样品,由上文可知:u3rel(V)=0.004 04
由上文可知,环境温度变化的相对标准不确定度:urel(t) = 0.002 89 综合以上5 个分量,样品制备引入的相对标准不确定度为:
茶叶:
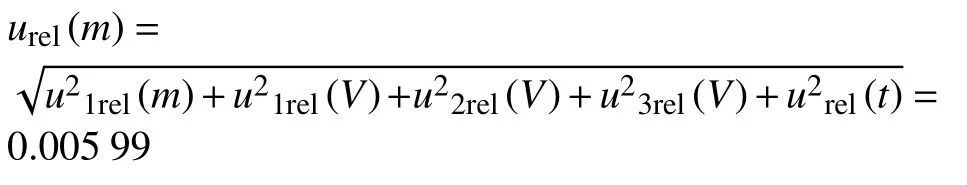
普通白菜、苹果:
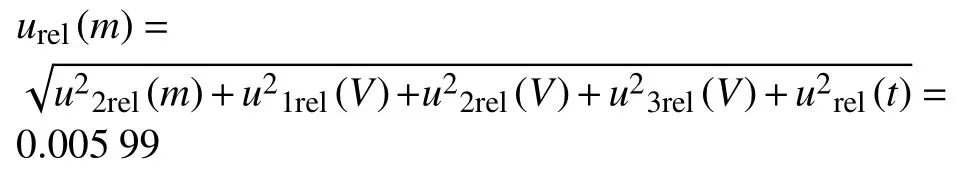
因此,茶叶、普通白菜和苹果由样品制备引入的不确定度均为:urel(m)=0.005 99。
2.3.3 由仪器引入的不确定度urel(M) 核查使用仪器的检定证书,当k=2 时,GC-MS/MS 的相对不确定度为0.06%, 则仪器引入的不确定度为:
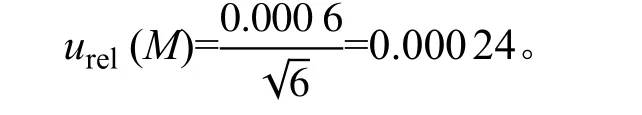
2.4 A 类不确定度评定
2.4.1 由工作曲线拟合引入的不确定度urel(Q)
按最小二乘法拟合工作曲线,计算标准曲线标准差:

式(2)中,yi为第i次测量的目标物峰面积与内标物峰面积的百分比;a为截距;b为斜率;ci为第i次测量的目标物浓度与内标物浓度之比(默认内标物质量浓度为1 μg/mL);n为标准溶液的测定总次数 (n= 6)。
曲线拟合引入的相对标准不确定度为:

式(3)中,SA为工作曲线的标准差;p为样品的测定次数 (p= 7);n为标准溶液的测定总次数(n= 6);b为工作曲线的斜率;c1为由工作曲线求得的样品溶液质量浓度平均值;为各标准系列溶液质量浓度的平均值,为0.13 μg/mL;ci为第i次测量的目标物质量浓度与内标物质量浓度之比 (赛默飞软件默认内标物质量浓度为1 μg/mL)。茶叶基质、普通白菜基质、苹果基质由工作曲线拟合引入的不确定度见表2。
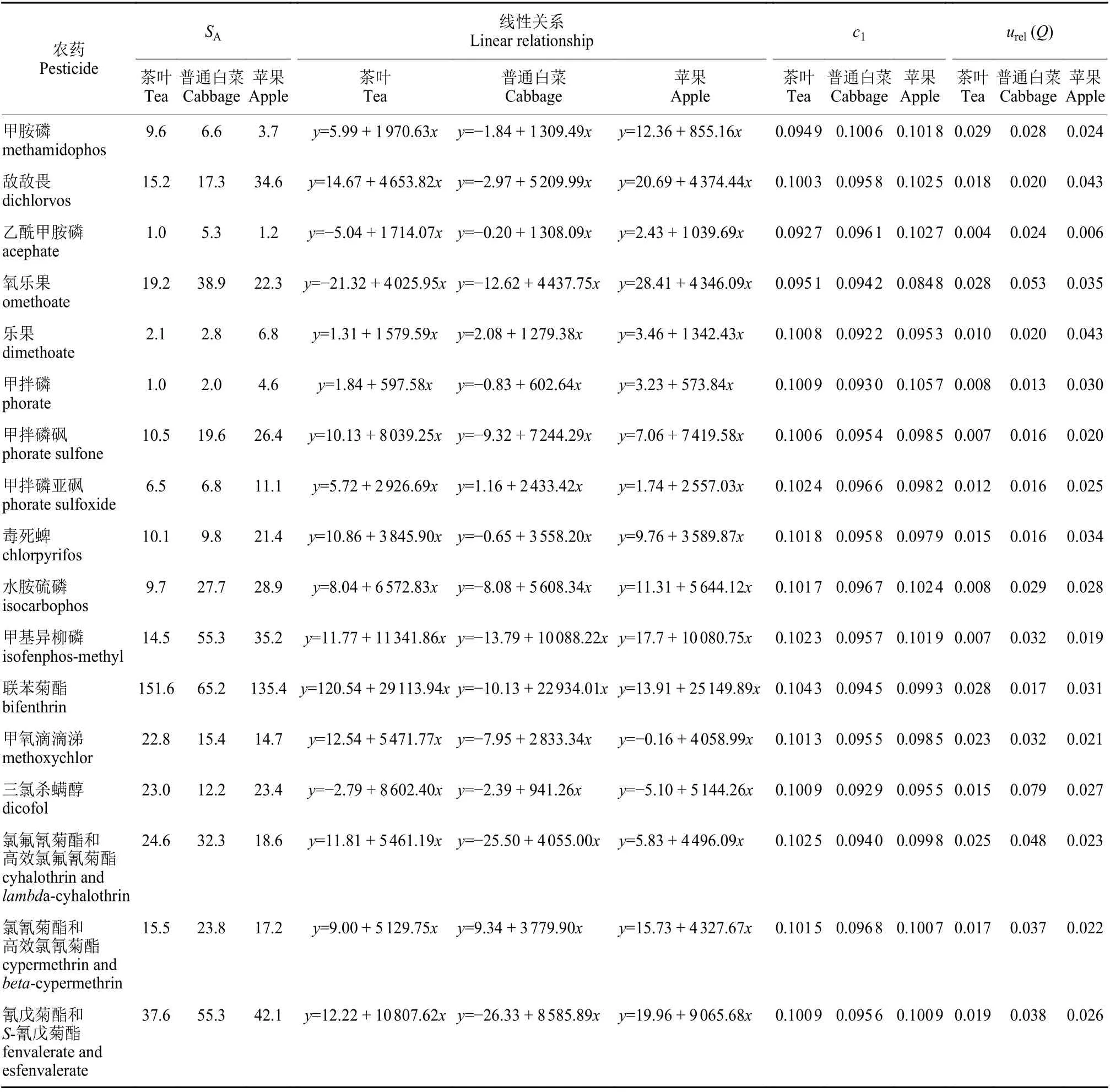
表2 由工作曲线引入的相对标准不确定度Table 2 Relative standard uncertainty caused by the working curves
2.4.2 由测量重复性引入的不确定度urel(X) 取样品重复测量7 次 (n= 7),计算平均值 (c1) 及标准偏差 (s(X)),则测量重复性引入的相对标准不确定度为:urel(X)=,茶叶、普通白菜、苹果由测量重复性引入的相对标准不确定度见表3。
2.4.3 由回收率引入的不确定度urel(R) 茶叶空白基质中分别加入质量分数为0.075、0.15 和0.75 mg/kg的目标分析物,每个水平重复测定5 次 (n= 15);普通白菜空白基质和苹果空白基质中分别加入质量分数为0.10、0.20 和0.75 mg/kg 的目标分析物,每个水平重复测定5 次 (n= 15)。计算平均添加回收率 () 及回收率标准偏差 (s(R)),则回收率引入的相对标准不确定度为:
urel(R)=,结果见表3。
2.5 合成标准不确定度、扩展不确定度及结果表示
根据以上不确定度评定过程,得到各农药残留的相对标准不确定度分量,按公式(4) 计算茶叶、普通白菜、苹果中15 种农药及其代谢物残留量的合成相对标准不确定度 (urel),见表3。
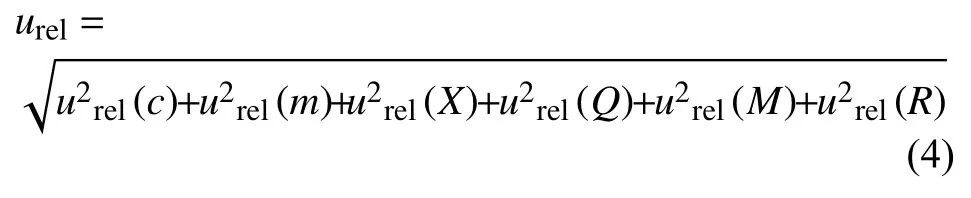
各农药残留的合成标准不确定度u按公式u=urel×c计算。依据JJF 1135—2005《化学分析测量不确定度评定》[4],在95%置信水平下,取k=2,茶叶、普通白菜、苹果中15 种农药及其代谢物残留的测定扩展不确定度U,按公式U=ku计算结果见表4。
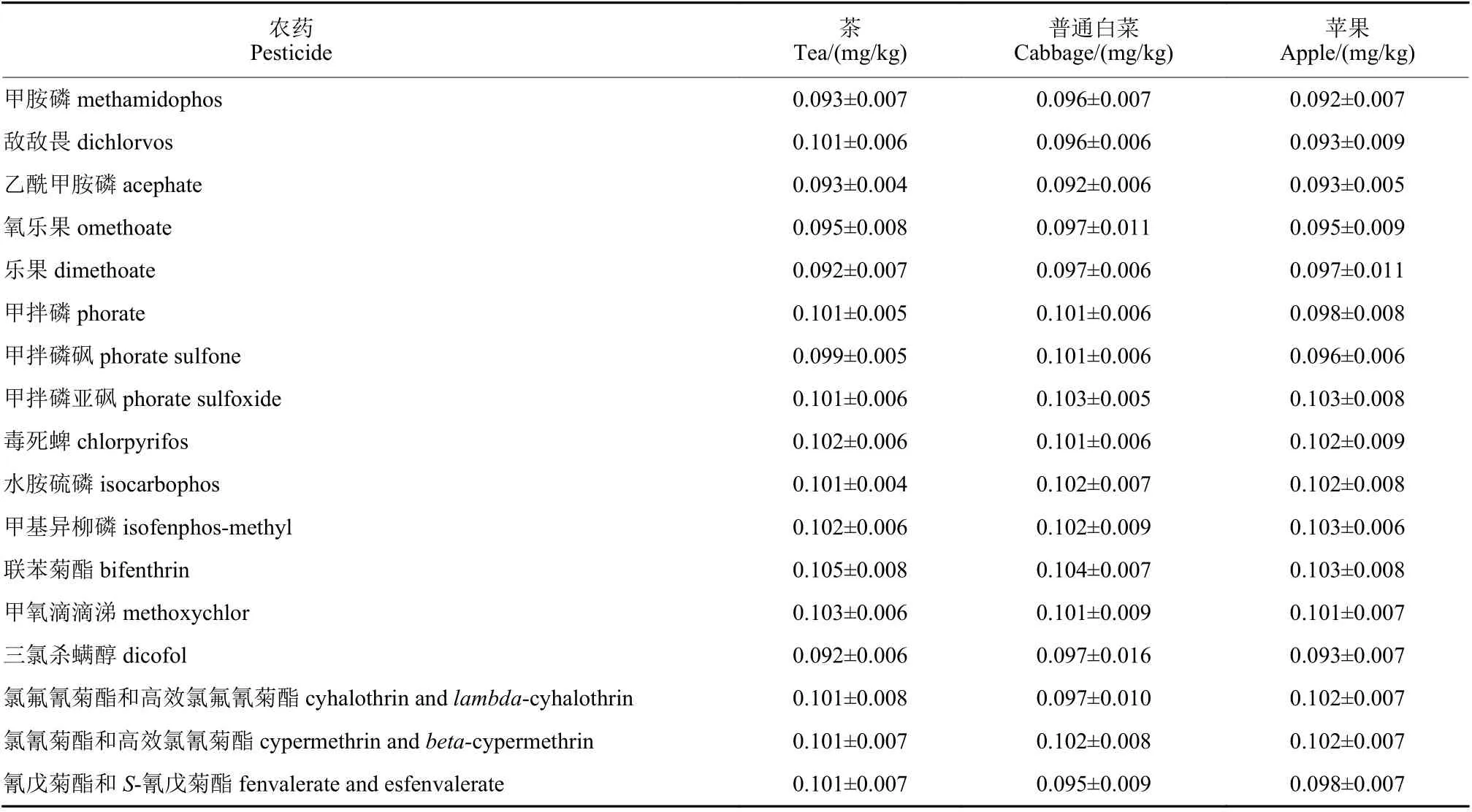
表4 15 种农药及其代谢物残留的结果表示Table 4 The residue results of 15 pesticides and metabolites
2.6 不同基质校正曲线分别对茶叶、普通白菜和苹果回收率及其所引入的相对标准不确定度的影响
分别用不同基质校正曲线定量2.4.3 节中的茶叶、普通白菜和苹果空白基质添加样品,考察基质匹配校正曲线和基质不匹配校正曲线分别对茶叶、普通白菜和苹果空白基质添加样品的平均回收率及其所引入的相对标准不确定度的影响,结果见表5 和表6。从中可以看出:
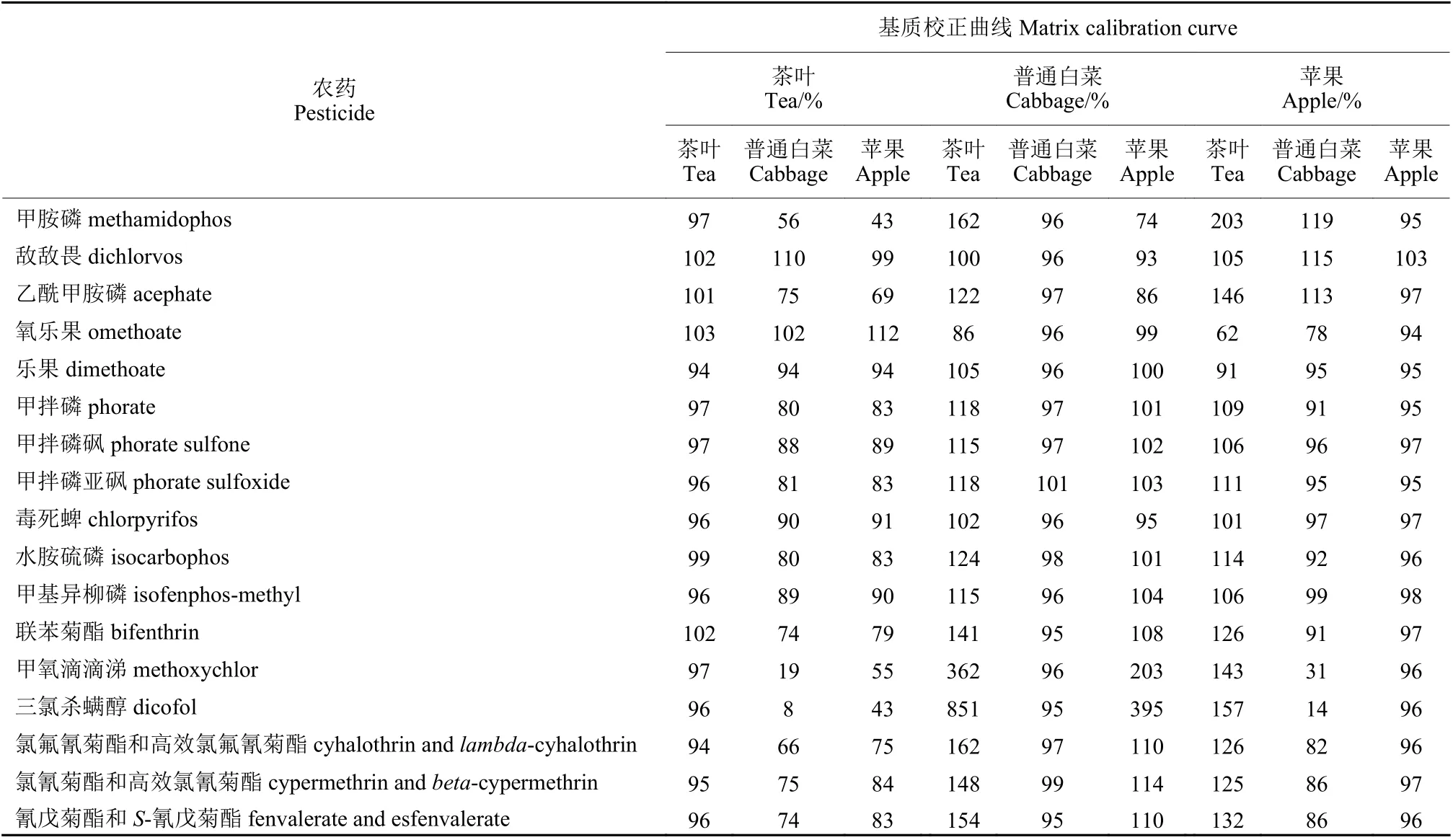
表5 不同基质校正曲线分别对茶叶、普通白菜和苹果的平均添加回收率对比表Table 5 The comparison of average recoveries caused by different matrix calibration curves

表6 不同基质校正曲线分别对茶叶、普通白菜和苹果所引入的回收率相对标准不确定度Table 6 Relative standard uncertainty of the recoveries caused by different matrix calibration curves
① 基质匹配校正曲线分别对15 种农药及其代谢物的平均回收率在94%~103%之间,回收率较好,准确度较高。
② 3 种基质不匹配校正曲线分别对15 种农药及其代谢物的平均回收率在8~851%之间,差异较大,主要是由于校正曲线基质类型不匹配造成的基质增强或者抑制效应,从而导致有的农药回收率偏高,有的农药回收率偏低。因此,建议选择基质匹配校正曲线或基质类型相似的校正曲线以提高农药及其代谢物的准确度。
具体表现为:
a. 用茶叶基质校正曲线定量普通白菜和苹果空白基质添加样品时发现,甲胺磷、三氯杀螨醇和甲氧滴滴涕的回收率较低,在8%~56%之间,其余12 种农药及其代谢物的平均回收率在66%~112%之间。
b. 用普通白菜基质校正曲线定量茶叶空白基质添加样品时发现,甲胺磷、乙酰甲胺磷、水胺硫磷、联苯菊酯、甲氧滴滴涕、三氯杀螨醇、氯氟氰菊酯和高效氯氟氰菊酯、氯氰菊酯和高效氯氰菊酯、氰戊菊酯和S-氰戊菊酯的回收率较高,在122%~851%之间,其余6 种农药及其代谢物的回收率在86%~118%之间;而定量苹果空白基质添加样品时发现,除甲氧滴滴涕和三氯杀螨醇的回收率偏高 (203%~395%) 外,其余13 种农药及其代谢物的回收率在74%~114%之间。
c. 用苹果基质校正曲线定量茶叶空白基质添加样品时发现,甲胺磷、乙酰甲胺磷、联苯菊酯、甲氧滴滴涕、三氯杀螨醇、氯氟氰菊酯和高效氯氟氰菊酯、氯氰菊酯和高效氯氰菊酯、氰戊菊酯和S-氰戊菊酯的回收率较高,在125%~203%之间,其余7 种农药及其代谢物的回收率在62%~114%之间;而定量普通白菜空白基质添加样品时发现,除甲氧滴滴涕和三氯杀螨醇的回收率偏低(14%~31%) 外,其余13 种农药及其代谢物的回收率在78%~119%之间。
③ 不同基质校正曲线对茶叶、普通白菜和苹果空白基质添加样品所引入的回收率相对标准不确定度影响不大,结果见表6。因此,基质不匹配校正曲线对所引入的回收率相对标准不确定度无较大影响。
2.7 降低不确定度可采取的措施
如表7 所示,6 个不确定分量所引入的不确定度百分比大小为:工作曲线拟合、回收率 > 标准溶液配制 > 样品制备 > 测量重复性 > 仪器。其中,影响不确定度的主要因素为工作曲线拟合、回收率和标准溶液配制,其次为样品制备和测量重复性,仪器对不确定度的影响相对较小。通过分析6 个不确定度分量的引入过程发现,可通过采取以下措施来降低不确定度:
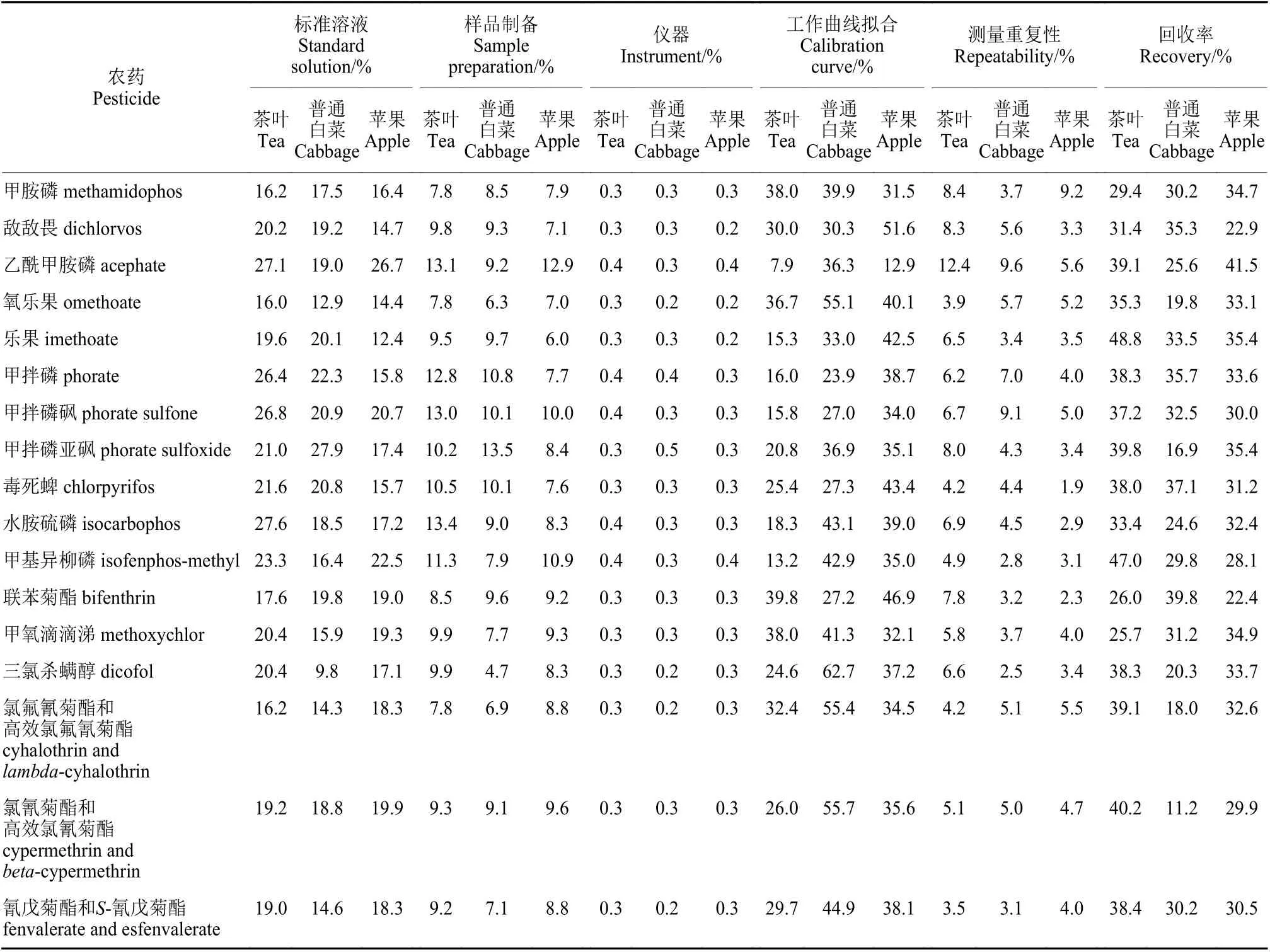
表7 各不确定度分量所引入相对标准不确定度百分比Table 7 The percentage of relative standard uncertainty
① 根据工作曲线拟合的相对标准不确定度计算公式可知,当样品中待测物浓度越高时,由工作曲线拟合所引入的不确定度越大,因此配制合适浓度的标准溶液来拟合工作曲线,能有效降低检测过程中由工作曲线拟合和标准溶液配制引入的不确定度。
② 由于待测物在食用农产品中含量低,在提取、净化和浓缩过程中易损失,易受基质效应干扰等。因此,在严格按照标准所要求的条件进行相关的提取、净化和浓缩过程的基础上,可通过配制基质标准工作溶液、采用内标法定量等手段来降低因回收率引入的不确定度。
③ 通过提高样品制备人员和检测人员的实验操作能力等,可降低由样品制备和测量重复性所引入的不确定度。
④ 通过定期对仪器进行维护和期间核查,可降低由仪器引入的不确定度。
⑤ 通过采用多种质控手段来监控和提高实验室的检测质量,进一步降低检测过程的不确定度。
3 结论与讨论
本文对采用GB 23200.113—2018[20]中茶叶、蔬菜水果分别对应的QuEChERS 前处理,并运用GC-MS/MS 法测定茶叶、普通白菜和苹果3 种基质中15 种农药及其代谢物。通过bottom up 法,对A 类不确定度 (测量重复性、工作曲线拟合、回收率) 及B 类不确定度 (标准溶液配制、样品制备、仪器) 进行分析和评估,结果发现:
① 标准溶液配制、样品制备、测量重复性、工作曲线拟合、仪器、回收率6 个分量均会引入不确定度,引入的不确定度大小为:工作曲线拟合、回收率>标准溶液配制>样品制备>测量重复性>仪器。
②不同基质不会对标准溶液配制、样品制备和仪器所引入的不确定度造成影响,但却使工作曲线拟合、回收率、测量重复性所引入的不确定度存在一定差异。
③ 3 种基质不匹配校正曲线对部分农药及其代谢物的回收率影响较大,但对所引入的回收率相对标准不确定度影响较小。建议采用基质匹配校正曲线来定量样品中各农药及其代谢物的含量,目的是为了消除因不同基质造成的基质增强效应或抑制效应,从而在一定程度上提高样品中待测农药及其代谢物的准确度。
④ 不确定度的来源除了标准溶液配制、样品制备、测量重复性、工作曲线拟合、仪器、回收率外,还有样品制备过程造成的样品均匀性所引入的不确定度等,但因其无法用A 类或B 类不确定度评定来计算,因此在一定程度上降低了本文扩展不确定度的实测值。可通过采取增加测量次数与培训检测人员检测能力等措施来降低其引入的不确定度。
⑤ CNAS-GL015—2022《判定规则和符合性声明指南》[23]指出:扩展测量不确定度越大,错误接受的风险越高。因此,通过分析不确定度分量的引入过程发现,可通过采取以下措施来降低检验检测结果合格判定的风险:
a. 依据相关规范、标准或法规选择适用的判定规则;
b. 配制基质标准工作溶液;
c. 选择合理的工作曲线浓度范围;
d. 采用多种质控手段来监控和提高实验室的检测质量;
e. 提高检测人员的实验操作能力等。
