大豆苗期根系根际酶谱原位分析
2022-12-27姜振峰李珊珊温明星孙亚男赵宛瀛刘志华
姜振峰,李珊珊,温明星,孙亚男,赵宛瀛,刘志华
(1.东北农业大学大豆生物学教育部重点实验室/农业农村部东北大豆生物学与遗传育种重点实验室,哈尔滨 150030;2.东北农业大学资源与环境学院,哈尔滨 150030)
根系是植物吸收养分和水分的重要器官。作物正常生长发育是地上部光合作用与地下部根群吸收水分和养分协调的结果[1]。发育强壮的根系对促进地上部分光合作用与有机物质积累具有重要意义,影响作物产量[2]。Weaver指出,科学理解作物生产过程必须全面认识作物根系发育、根群分布及不同环境条件下根系变化[3]。研究表明,健壮根系可有效提高大豆抗倒伏能力,提高产量[4]。大豆根系在不同品种、发育时期和环境条件作用下形态学特点不同。傅金民等指出,在大豆生育中前期,根系生长良好对提高产量具有积极作用[5]。田佩占研究表明,大豆育种应注重培育后期根系发达且不早衰的新品种[6]。有关大豆根系形态研究,主要集中在不同抗逆性及不同生态类型大豆基因型差异方面[7-8]。对南方主栽大豆有限生长习性和北方主栽大豆亚有限生长习性根系形态比较研究少,大豆根系生物学特性不明确。明确作物根系生长发育时空分布特征及其与土壤环境相互关系,对作物新品种定向培育及在特定土壤条件下适时实施农艺措施、创造良好根系生长环境、提高作物产量均具有重要指导意义[9-10]。
根系与土壤接触界面、根系周围几毫米范围内微小土壤体积,形成独特而复杂的生境生态位,称之为根际[11]。根系向根际分泌多种物质,包括单糖及氨基酸等可溶性单体,及与植株生长发育密切相关的各类水解酶。这些活性酶可促进C、N、P循环,刺激微生物富集代谢,通过与养分水平正向反馈,达到提升营养周转率的作用[12-13]。因此,根际被认为是最具活力的酶活性热点之一。酶降解有机高分子聚合物,产生可溶性低聚物和单体,对土壤有机质动态变化乃至生物全球化学循环均极为敏感[14]。根系向土壤中释放的酶是土壤质量可靠指标,提供土地污染、改良和其他利用变化信息。例如,以β-葡糖苷酶与纤维二糖水解酶为代表的纤维素酶群,可将土壤中存在的纤维素大分子分解为葡萄糖等易被吸收单体,为根系和微生物提供碳源,是调控纤维素连续降解过程关键,其活性直接限制纤维素水解[15]。将此类酶作为指标,测量并观察其活性变化,可探知根系向外部环境释放营养物质的规律及在根际间根系与土壤环境之间的交流过程[16-17]。马星竹等利用酶活性测定技术,初步研究长期不同施肥条件下大豆田黑土酶活性[18]。刘慧璐等针对抗草甘膦转基因大豆,利用化学方法,测定大豆根际土壤中脲酶、蔗糖酶、碱性磷酸酶和过氧化氢酶活性,补充大豆根际酶活性研究[19]。目前需全面、系统分析各种酶活性变化规律,为强壮根系栽培技术及品种选育提供理论支持。
研究表明,不同土壤类型所固有理化性质以及各种田间管理手段,包括施肥和对同一土壤的改良措施等,均对土壤酶活性造成影响[19]。不同质地土壤理化性质可能差异较大。土壤中矿物成分可与OM(有机质)紧密结合,导致OM降解变缓。二者之间相互作用可促进土壤形态和生化特性稳定,使其更加肥沃[20]。土壤肥力下降是我国农业生产中影响产量提升的重要因素。明确土壤肥力下降对农作物根系生长发育的影响是稳定和恢复粮食产量的必要前提,在大豆中报道较少。针对上述问题,本研究分析生长习性不同的3个大豆品种在正常和退化土壤根系表型特征;同时,建立根系发育碳代谢和能量代谢相关酶活性变化,试图明确土壤中有机质含量对大豆根系生长发育的影响规律,为培育不同环境条件下栽培高产抗倒伏大豆新品种提供根系角度的理论支持。
1 材料与方法
1.1 材料
1.1.1 田间试验材料
大豆品种Charleston、东农594和DN50由东北农业大学大豆研究所提供。Charleston为有限生长习性,适合窄行密植栽培,是南方地区主栽大豆品种类型;东农594为亚有限生长习性,是北方地区主栽大豆类型;DN50为亚有限生长习性,小粒品种,有分枝,属特用大豆。
1.1.2 酶谱活性原位测定材料
1.1.2.1 土壤样品基本信息
根据土样有机质含量不同将土样1定义为高有机质土壤;土样2为低有机质土壤(见表1)。土壤样本取回后经天然晒干,过2 mm筛子筛选土壤样品,剔除较大板结土块及石砾等杂质,以获得颗粒均匀的土壤样本。

表1 试验用土壤基本信息Table 1 Information of the soils used in current experiment
1.1.2.2 蛭石
实验室植物苗培养使用常规蛭石。
1.1.2.3 尼龙膜
N66有机尼龙膜,直径200 mm,孔径0.45μm,购自浙江海宁桃园医疗化工仪器厂。
1.1.3 主要试剂药品
4-甲基伞形酮-β-D-葡萄糖苷(MUF-G)、4-甲基伞形酮酰磷酸酯(MUF-P)、4-甲基伞形酮(MUF)、MES buffer均购自德国Sigma-Aldrich公司。
1.2 方法
1.2.1 根盒培养根系分析表型方法
1.2.1.1 根盒土壤和溶液准备
取田间有机质含量较高的地表20 cm表层土和有机质含量较低土壤,室内通风晾干。碾碎过筛,去除石块和秸秆杂质,用于根盒培养根系试验。因土壤颗粒较细,田间土壤孔隙结构差异较大,本研究向土壤中添加蛭石以提高土壤样品孔隙度和吸水特性,尽量还原田间土壤原位状态。另外,为还原土壤中营养环境,本研究利用高低有机质土壤浸出液为根盒提供水分,模拟不同土壤环境。
1.2.1.2 根盒准备
根盒为前后均可拆卸的长方形透明盒,规格为23 cm×17 cm×3 cm。根盒上端有一长方形开口,4 cm×2 cm,为出苗口;下端开有6个圆形小口,直径6 mm,作为渗水口。
1.2.1.3 根盒土壤准备
本研究分析高低有机质土壤环境中根系生长状态。将蛭石与两种土壤混合均匀,设置两类处理(L与H类)。每个处理设置6个重复,每个根盒为1个重复。打开根盒将混合土样缓慢连续倒入根盒中,获得均匀的填充环境且避免分层。关闭开口侧,缓慢立起根盒,轻轻摇动使上层土壤保持水平。将根盒前后两侧严格密封,垂直静置,利用重力夯实混合样品环境。将根盒放在浸出液中,达到土壤相对含水量为60%,以保证种子萌发。
1.2.1.4 播种
选择种粒饱满,无损伤,大小一致Charleston、DN594、DN50种子作为试验用种。每个根盒中平行相距1~2 cm种植2粒种子,种植深度为表土层下0.5~1 cm。将根盒外侧遮光处理,仅保留出苗口,以使幼苗长出。将根盒放入培养箱(GXZ-380,宁波江南,中国)中培养。培养箱条件:白天温度30℃,保持光照13 h,光合有效辐射强度均为300μmol·m-2·s-1;黑夜温度为20℃,维持11 h。培养时,种子所在一面向下,倾斜60°放置根盒。由于重力作用,根系趋于表层土壤生长。种子萌发8 d后根尖已到达根盒底部,根系主根和侧根特征呈现不同规律。因此,本研究以种子萌发8 d后根系为酶活性分析提供根系长度及生长边界的表型基础。
1.2.2 土壤酶活原位测定
1.2.2.1 酶谱法测定及紫外成像
在Kuzyakov Lab根际酶活性分析方法基础上稍加修改作β-葡糖苷酶酶谱活性原位分析[21]。所用底物分别为:4-甲基伞形酮-β-D-葡萄糖苷(MUF-G)。底物本身结合一种荧光染料:4-甲基伞形酮(MUF)。当底物与相应特异性酶反应时,MUF分子被释放,于紫外线下可产生荧光反应,实现酶活性可视化。底物需溶解于缓冲液中(MESbuffer,MEShemisodium salt),溶液浓度设定为12 mmol·L-1。
按照根盒大小与根系生长实际情况将聚酰胺滤膜剪切成相应尺寸,用每种酶的特异性底物溶液浸泡20 min,保证滤膜处于饱和状态。将浸泡好的饱和膜覆盖至土壤表面,孵育90 min。孵育后,暗室中将膜放置于紫外(UV)照射下,观察荧光反应(紫外线激发波长为355 nm,发射波长为460 nm),拍照。
1.2.2.2 酶谱图像处理与分析
紫外光下,底物中携带的荧光物质(MUF)呈现荧光反应的位置即为底物被特异性酶水解的区域。荧光反应强弱与酶活性呈正比。利用Image J处理酶谱图像,利用Office Excel 2010和R函数分析数据。
1.2.2.3 酶谱活性标准曲线建立
为计算酶活性,建立一个标准函数曲线。操作方法是:配制不同浓度梯度MUF溶液:0.01、0.10、0.20、0.25、0.50、1.00、2.00(mmol·L-1),将膜切割成1 cm2正方形,浸入梯度溶液。将饱和膜放入相同条件紫外光下,获得饱和荧光区域平均灰度值。以“实际浓度=C(MUF aq)·S-1(饱和荧光区域)(mM·cm-2)”为X轴,以“实际灰度值=饱和荧光区域平均灰度值-背景灰度值”为Y轴,获得标准曲线。利用标准曲线分析试验获得图像,获得酶活性值,单位均为mM·cm-2。
1.3 数据处理与分析
利用Office Excel 2010、SPSS 19.0、Phtoshop 6.0和Image J软件分析数据和处理图像。
2 结果与分析
2.1 β-葡糖苷酶来源确定
通过尼龙膜隔离土壤和大豆根系进行酶活性原位检测,结果证明大豆根系可分泌β-葡糖苷酶到根系表面(见图1),参与根际土壤中微生物种类和丰度变化,影响根际营养可利用的种类和丰度,反馈植株生长发育。酶活性原位分析可准确反应酶变化规律,所以本研究对β-葡糖苷酶活性进行原位分析。
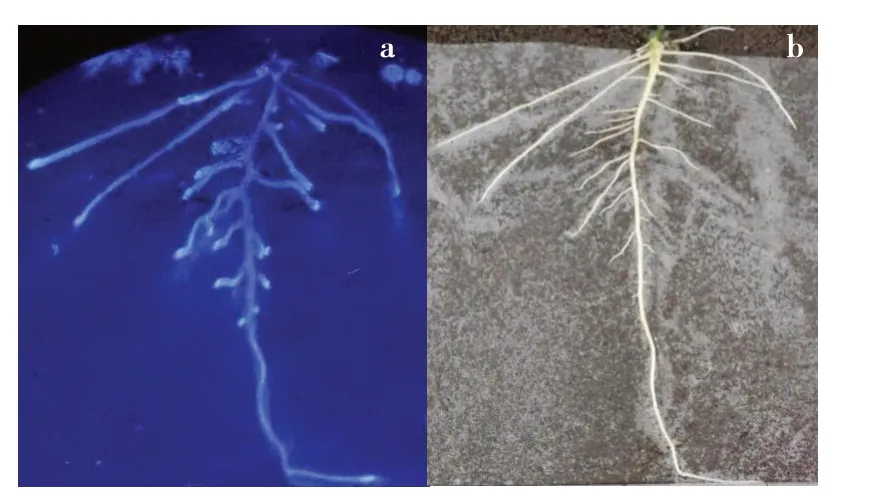
图1 大豆根系分泌β-葡萄糖苷酶至根表面Fig.1 Evidence of soybean root secretes β-glucosidaseto root surface
2.2 主根酶活性原位定量方法建立
虽然在玉米等作物中已确定根际酶活性较高区域,但在大豆中尚未见报道。本研究通过分析原位酶活性荧光图像,确定大豆根际酶活性较高区域,建立函数曲线对酶活性进行原位定量。
首先,配制浓度为0.01、0.1、0.2、0.25、0.5、1、2 mmol·L-1的MUF溶液,测定1 cm2尼龙膜在梯度溶液浸润后荧光值,建立标准曲线方程如下:

该方程R2=0.9538,证明该线性函数拟合优度较好,可用此函数代表两个变量相关性。可由式(1)得到式(2):

其中,x′为图像中荧光反应位点像素级灰度值,y′为该位点代表的实际定量酶活。利用公式(2)即可获得测定水解酶的根际活性变化规律。
2.3 主根酶活性分析
2.3.1 根系生长方向和直径方向酶活性分析
根据3个大豆品种所有样品主根系图像及酶谱图像进行数值转换,计算不同土壤环境下样品酶活性变化,分析3个大豆品种在高低有机质土壤β-葡糖苷酶活性沿根系生长方向及垂直根系生长方向分布规律。
结果如表2所示,沿Charleston主根方向β-葡糖苷酶在高低有机质条件下酶横向扩散宽度均为根基部最低,向根尖逐渐升高,在根尖酶活性热点区扩散宽度达到最高值,在两种土壤环境中扩散宽度为1.48~2.04 mm。高低有机质土壤间β-葡糖苷酶扩散宽度有差异,低有机质环境下β-葡糖苷酶活性横向扩散宽度大于高有机质含量。即根系土壤有机质含量较低时,β-葡糖苷酶活性分布向土壤中延伸程度更高。
沿DN594主根方向β-葡糖苷酶在根际向土壤中扩散方式和Charleston类似(见表2),表现为主根基部酶向根际土壤中扩散能力最低(1.34~1.73 mm),逐渐升高(根中部分布范围为1.73~1.80 mm),在根尖部位达到最高值(1.99~2.37 mm)。比较结果表明,大豆品种间β-葡糖苷酶在根际扩散能力上有差异。Charleston的β-葡糖苷酶在所有环境中扩散宽度平均值为(1.57±0.15)mm,而DN594扩散宽度为(1.83±0.17)mm。表明DN594根系β-葡糖苷酶活性更强。
DN50根际β-葡糖苷酶扩散能力规律和Charleston、DN594类似,酶扩散宽度均从根基部向根尖逐渐升高。在低有机质土壤中酶活扩散程度大于高有机质土壤环境(见表2)。

表2 沿大豆主根方向β-葡糖苷酶活性横向扩散宽度Table 2 Transverse diffusion width ofβ-glucosidase activity along thetap root of soybean(mm)
2.3.2 沿根系方向酶活性强弱变化
根际酶活性与根系生命活动强弱密切相关。3个品种分析结果表明酶活性变化规律为根基部最低,沿根系向根尖逐渐升高,在根尖达到最大值,形成根尖酶活热点。具体表现为Charleston的β-葡糖苷酶在有机质土壤中活性由根基部向根尖逐渐升高,根尖区域形成热点(见表3)。高有机质土壤条件下β-葡糖苷酶活性高于低有机质土壤。其中,高有机质土壤中酶活性强度最高为(4.41±0.33)mM·cm-2,低有机质土壤酶活性强度最高为(4.25±0.16)mM·cm-2。
DN594的β-葡糖苷酶沿主根生长方向酶活性变化规律和Charleston相似,均由根基部向根尖逐渐升高,根尖区域形成热点(见表3)。有机质对酶活性影响规律相同。高有机质土壤中主根基部、中部及根尖酶活性均强于低有机质土壤。

表3 沿大豆主根方向的β-葡糖苷酶活性强度Table3 Intensity ofβ-glucosidaseactivity along thetap root of soybean(mM·cm-2)
DN50的β-葡糖苷酶活性规律和Charleston、DN594类似,均在根尖形成活性最高热点区,根基部活性最弱。但DN50沿主根方向酶活性强度表现出高有机质环境小于低有机质环境,表明有机质含量对β-葡糖苷酶活性存在基因型差异。
2.4 侧根酶活性分析
与主根分析方式相同,将侧根分为上中下三段,即根基部、中间部分和尖端区域(根尖),分析侧根酶活性。
2.4.1 酶活性径向根际延伸
如表4所示,在两种有机质土壤环境条件下,Charleston植株侧根,沿生长方向,即由根基部到根尖,酶活性横向扩散宽度均呈逐渐增加趋势,在根尖区域达到最大宽度(1.70 mm)。

表4 沿大豆侧根方向β-葡糖苷酶活性横向扩散宽度Table 4 Transversediffusion width ofβ-glucosidase activity along the lateral root of soybean(mm)
沿DN594侧根方向β-葡糖苷酶在根际向土壤中扩散方式和Charleston类似,表现为侧根基部酶向根际土壤中扩散能力最低(为1.08~1.19 mm),逐渐升高(根中部分布范围为1.45~1.71 mm),根尖部位达到最高值(为1.88~1.90 mm)。土壤有机质对酶活性无影响。在低有机质环境下β-葡糖苷酶活性横向扩散宽度大于高有机质含量。
DN50根际β-葡糖苷酶扩散能力规律和Charleston、DN594类似。两种土壤中,酶扩散宽度均由根基部向根尖逐渐升高,在根尖区域达到最大扩散宽度,为1.63~1.70 mm。但DN50在低有机质环境中侧根基部酶活扩散宽度大于高有机质土壤;在侧根中部及根尖区域则相反,高有机质土壤中酶扩散宽度较大。
2.4.2 沿根系方向酶活性强弱变化
Charleston主根β-葡糖苷酶活性在高低有机质土壤中均由根基部向根尖逐渐升高,根尖达到最大值并形成热点(见表5)。
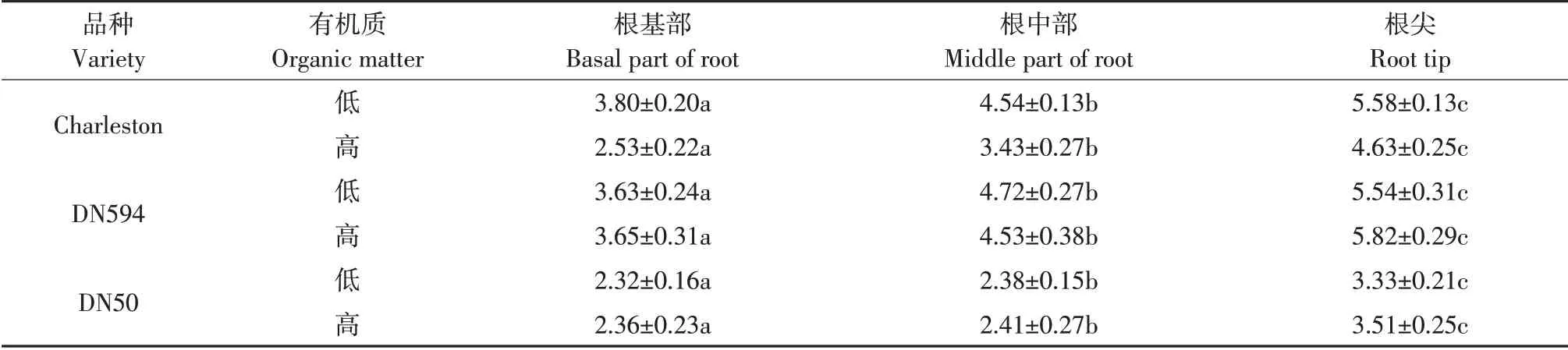
表5 沿大豆侧根方向β-葡糖苷酶活性强度Table 5 Intensity ofβ-glucosidase activity along the lateral root of soybean(mM·cm-2)
侧根也表现为相同规律。有机质含量对侧根根际酶活性影响不同。低有机质土壤中侧根的根基部到根尖酶活性强度最高为(5.58±0.13)mM·cm-2,高于高有机质土壤,最高为(4.63±0.25)mM·cm-2。DN594的β-葡糖苷酶在根际酶活性变化规律和Charleston相似,均从根基部向根尖逐渐升高,在根尖区域形成热点。在侧根基部及根尖区域,高有机质土壤中酶活性强于低有机质土壤,而在侧根中部相反。DN50的β-葡糖苷酶规律和Charleston、DN594类似,均在根基部活性最弱,根尖形成活性最高热点区。但沿DN50侧根方向酶活性强度表现高有机质环境高于低有机质环境,且在侧根各部位均有此规律。综上所述,不同生长习性大豆侧根根际的β-葡糖苷酶活性均表现为由根基部向根尖逐渐升高的规律,但有机质含量对β-葡糖苷酶活性影响存在基因型差异。
3 讨 论
3.1 酶活性根际延伸规律
土壤是农作物根系生长载体。根系从土壤中吸收水分及各种矿物质元素,供应地上部生长。在此过程中,根系细胞代谢活动向土壤中分泌多种酶类,影响根际微生物菌群种类和丰度。根际微生物直接影响根系吸收土壤中矿物质元素能力。因此,研究根系分泌到土壤中酶种类和活性对分析植株地下地上协同生长具有重要意义。土壤根际酶功能及影响因素逐渐成为国内外科学家研究热点。针对土壤胞外酶在根际间活性延伸范围,Razavi等试验证明根际酶活性具有植物物种特异性[22]。其中,玉米根系的酶活性在根系表层部位差异,扁豆则在根际间分布均匀。扁豆与大豆同为直根系作物,却并未将扁豆划分主侧根系进行讨论。本试验以多种大豆品系为对象,划分大豆直根系主根及主要侧根,细致研究酶活性。试验结果体现出,在设定两种不同环境处理间,Charleston主根根际β-葡糖苷酶活性扩散延伸宽度,沿主根方向呈先稳定随后在中部区域变宽,在中后部扩散宽度变窄,最后在主根尖端明显扩增。在DN594主根表层及根际间存在的β-葡糖苷酶,其活性延伸宽度在不同环境间均表现出于主根根部近前端区段增大,到达中部区段变窄,最后在尖端及根尖区域酶活性扩散宽度达到最大。同时,DN50主根系外部,β-葡糖苷酶活性扩散宽度表现为在主根前端增大,至主根中部维持一段较宽范围,随之在中后区段减小,在根尖区域变为最宽范围。说明土壤胞外酶在不同品种大豆主根表面及根际间活性扩散宽度沿根系生长方向变化一致。
3.2 沿根系方向酶活性变化
沿大豆主根与侧根胞外酶活性强度并非均匀统一。沿主根方向,在根系中部区段和根尖端存在酶的高活性区域;侧根上高酶活性集中于根尖区段。说明胞外酶活性强度分布与沿根系位置有关[23]。例如,主侧根均在其尖端部位表现为较高活性,具体可划分在距离根尖1~2 cm处。根尖高活性酶反应可能因根系对分泌物的释放与渗出集中于根尖[24],分泌物质积累引发分泌效应,刺激微生物活动和SOM分解,促使根尖细胞外酶产生。因此,根际间胞外酶活性分布可能与根际沉降和根系积累物的质量与数量有关。由于根渗出物质量和组成在根系不同部位均不同[25],分解根际各类物质的酶也随之变化。因此,反映微生物与根系活跃程度的酶活性强弱分布产生差异。
主根与侧根酶活性强弱分布具有统一性(根尖),也存在区别。主根上在中部出现酶活性高亮区域,侧根更集中于尖端。推测不同原因可能有以下两点:①主根与侧根生长进程不同,发育程度不同,可能与根系内部细胞结构有关;②可能与主侧根生长趋向和位置有关。由第一点引发思考,主根是大豆根系最先生长发育的一条根系,在侧根生成前便已进行内部结构细胞群分化。主根中部为根系成熟区,次生壁集中形成。次生壁是细胞停止生长后,在初生壁内侧继续积累的细胞壁层[26],主要组分为果胶、纤维素、半纤维素及木质素。次生壁形成需合成大量纤维素,纤维素合成及降解过程关键酶之一是β-葡糖苷酶,负责催化β-D-葡萄糖苷末端1,4-连接的β-D-葡萄糖残基水解,调控纤维素动态过程。纤维素是自然界中常见多聚糖,β-葡糖苷酶活性提供纤维素降解信息,该酶活性现已得到广泛评估。因此,在大豆主根中部区域,β-葡糖苷酶活性高亮反应再次展现其与根系结构形成的密切关系。从根系内部结构角度分析,根尖是整条根系中最为活跃部分,根尖中分生组织细胞不断分裂更新,为根系生长发育提供新细胞,根系对营养和水分吸收及其他重要过程均发生在这一区域。因此,根尖处出现β-葡糖苷酶极高活性正是此区域代谢活动活跃的重要体现。β-葡糖苷酶作为控制纤维素代谢关键酶,是监测C循环重要指标。植物通过根部以高分子质量和低分子质量有机化合物形式平均向土壤中释放20%光合碳(C)[27]。活体根系持续向根际中输入C流积累是土壤中易得有机物重要来源。在根系表面及根际酶活性热点区域,根系将内部产物释放至土壤,选择并刺激微生物代谢活动,微生物群落受益于根际积累与生境生态位,对根际分泌各种物质及胞外酶产生正向或负向反馈效应[28]。
3.3 根际酶活性品种间差异分析
本试验分析3种不同类型大豆品种土壤酶活性,以沿根系方向酶活性强度为代表,将上述3种大豆对比,结果显示,大豆主根系根际酶活性呈显著规律。由试验数据可看出(见表2和3),在高低两种土壤环境中,Charleston主根方向β-葡糖苷酶活性最高。DN594与DN50差异不同。在低有机质土壤中,DN594主根根际β-葡糖苷酶活性低于DN50;在高有机质土壤中呈相反规律。因此,土壤胞外酶与植物抗倒伏性可能存在一定关系。抗倒伏性较强作物在其主根根际酶活性表现较高,可能与主根较为成熟有关。研究表明,β-葡糖苷酶活性高促进纤维素大量合成,增厚根系机械组织与木质化程度,通过提高根系固着力提高抗倒伏性[29]。本研究结果也表明,不同品种间根系酶活性强度差异明显(如在低有机质土壤中Charleston主根β-葡糖苷酶活性强度比DN50最多高出0.65 mM·cm-2;比DN594最多高出1.08 mM·cm-2;DN50比DN594最多高出0.43 mM·cm-2),且对地上部生长发育产生影响。可尝试将根际酶活性作为一类用于区分大豆品种的土壤指标,对其他大豆品种作分类,分析地上部和地下部生长协调性。本研究选择3种大豆为代表开展试验,对其他品种区分效果则有待进一步验证。
3.4 根际β-葡糖苷酶来源分析
β-葡糖苷酶可将纤维素分解为葡萄糖等易被吸收的糖单体,为根系和微生物提供碳源,是调控纤维素连续降解过程关键,其活性和纤维素降解密切相关。因此,将该酶作为指标,可探知植物根系向外部土壤环境释放纤维素等含碳化合物的规律及根系与土壤环境之间存在何种碳循环过程。但土壤中微生物也分泌β-葡糖苷酶,需确定试验中所测β-葡糖苷酶来源。利用尼龙膜隔离土壤和大豆根系,本研究结果表明大豆根系能够分泌β-葡聚糖酶到根系表面参与根际生命活动。
4 结论
a.大豆根系表面存在比土壤中酶活性高的区域,即根际。主根根际酶活性沿根系方向扩散宽度与酶活性强度分布一致。
b.β-葡萄糖苷酶活性呈现在不同有机质含量土壤环境中,沿根系由低到高逐渐增加,到根尖活性最大的分布规律,在根尖形成酶活性热点。酶活性最强区域也是根际向土壤中扩散最大区域。
c.β-葡萄糖苷酶沿侧根方向的根际酶活性呈明显增加趋势,扩散宽度与酶活性强度分布一致,在侧根根尖区段形成酶活性热点。
