炒制对牵牛子中酚酸类成分含量的影响
2022-12-27高佩云杨晓芸王丽霞陈迎迎陈晓旭岳春雨唐力英王祝举
高佩云,杨晓芸,王丽霞,蒋 彤,陈迎迎,陈晓旭,吴 桐,岳春雨,唐力英*,王祝举*
炒制对牵牛子中酚酸类成分含量的影响
高佩云1, 2,杨晓芸2,王丽霞2,蒋 彤2,陈迎迎2,陈晓旭2,吴 桐2,岳春雨1, 2,唐力英2*,王祝举2*
1. 河南中医药大学药学院,河南 郑州 450046 2. 中国中医科学院中药研究所,北京 100700
建立牵牛子中6个酚酸类成分(新绿原酸、绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C)的HPLC含量测定方法,研究炒制前后牵牛子中这些成分的含量变化规律。采用HPLC法同时测定新绿原酸、绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C的含量,运用化学计量学方法对含量测定结果进行分析,并通过模拟炮制的方法对此类成分在不同温度下的转化进行初步研究。色谱条件为Kromasil C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为甲醇-0.1%甲酸水溶液,梯度洗脱(0~20 min,10%甲醇;20~25 min,10%~15%甲醇;25~45 min,15%甲醇;45~50 min,15%~30%甲醇;50~75 min,30%甲醇;75~80 min,30%~40%甲醇;80~110 min,40%甲醇),检测波长330 nm,体积流量1 mL/min,进样量10 µL,柱温30 ℃。与生品比较,炒制后牵牛子中绿原酸的含量无明显变化,新绿原酸、隐绿原酸和异绿原酸C在炒制后含量显著上升;咖啡酸和异绿原酸A在炒制后含量显著下降。层次聚类分析(hierarchical cluster analysis,HCA)将30批样品分为生品与炮制品2类,主成分分析(principal component analysis,PCA)和正交偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA)均标记了4个差异性成分。各单体化合物在模拟炮制过程中发生了相互转化,转化程度与加热温度相关。牵牛子与炒牵牛子的化学成分含量发生了一定程度改变,其中新绿原酸、隐绿原酸、异绿原酸A和异绿原酸C可作为牵牛子炒制前后质量评价的关键性指标,可为牵牛子与炒牵牛子质量标准的建立和深入研究提供科学依据。
牵牛子;HPLC;酚酸类;清炒法;新绿原酸;绿原酸;咖啡酸;隐绿原酸;异绿原酸A;异绿原酸C;层次聚类分析;主成分分析;正交偏最小二乘-判别分析;质量评价
牵牛子始载于《名医别录》[1],又名黑丑、白丑、二丑等。性寒,味苦,有毒。归肺、肾、大肠经。具有泻水通便、消痰涤饮、杀虫攻积之功效,主要用于水肿胀满、二便不通、痰饮积聚、气逆喘咳、虫积腹痛等证[2]。现代研究表明牵牛子主要化学成分为苯丙素类、木脂素类、香豆素类、萜类、生物碱、树脂苷类、脂肪油和糖类等,并认为牵牛子酚酸类成分及树脂苷类成分可能是其主要活性成分[3]。药理学研究发现,牵牛子主要具有泻下、利尿、兴奋子宫、杀虫、抗菌、抗癌等药理活性[4-6]。中医本草及医方书记载其“有毒”,现代研究认为其中的生物碱和树脂苷类成分有一定神经毒性和肾毒性[7-9]。牵牛子的炮制历代曾用过水煮、清蒸及各种辅料蒸、清炒及各种辅料炒、以及各种药汁制等10多种炮制方法[10],现在沿用了清炒法作为《中国药典》收载的炮制方法,认为牵牛子生用偏于逐水消肿、杀虫,炮制后毒性降低[11-12],药性缓和,免伤正气,并易于粉碎和煎出,以消食导滞见长。
《中国药典》2005年版曾采用咖啡酸和咖啡酸乙酯作为含量测定指标控制牵牛子的质量,随后发现该方法存在一定问题[13],自《中国药典》2010年版删除了该方法,直到现在,没有合适的定量方法控制质量。目前,对此问题有不少研究,但仍将指标成分聚焦在咖啡酸上,由于咖啡酸在牵牛子中含量较低,不是理想的指标性成分[14-16]。虽然有文献对牵牛子中系列酚酸类成分进行了成分指认或指纹图谱等定性分析[17-18],但尚无定量研究,炒制对此类化学成分影响的研究也未见报道。牵牛子中绿原酸类成分含量较高,能否选取该类成分作为定量指标控制牵牛子饮片的质量呢?药理学研究也表明绿原酸类成分具有促进胃排空、增加小肠推进率、抗炎、免疫增强、兴奋子宫作用[3]。基于此,本研究采用HPLC法建立6个酚酸类指标成分的含量分析方法,并对15批不同产地生、炒牵牛子样品进行含量测定,采用化学计量学方法分析炒制前后各成分含量的变化,探索牵牛子炒制前后成分变化规律,为牵牛子饮片的质量控制及炮制机制研究提供依据。
1 仪器与材料
1.1 仪器
LC-20A型高效液相色谱仪仪,日本岛津公司;DFT-50A型手提式高速万能粉碎机,温岭市林大机械有限公司;XS205DU型1/10万电子分析天平,瑞士Mettler-Toledo公司;BSA124S-CW型1/1万电子分析天平,赛多利斯科学仪器有限公司;JY-5002型电子天平,上海衡平仪器仪表厂;DK-S14型电热恒温水浴锅,上海森信实验仪器有限公司。
1.2 材料
对照品新绿原酸(批号CHB201129)、绿原酸(批号CHB201114)、咖啡酸(批号CHB201217)、隐绿原酸(批号CHB201129)、异绿原酸A(批号CHB180921)、异绿原酸C(批号CHB180925),均购自成都克洛玛生物科技有限公司,质量分数均≥98%;水为娃哈哈纯净水;甲酸、甲醇均为色谱纯,其他试剂均为分析纯。
15批牵牛子药材,产地分别为辽宁铁岭(编号Q1~Q5)、山东青州(编号Q6~Q8)、山东沂水(编号Q9~Q12)、河北(编号Q13~Q15),经中国中医科学院中药研究所王祝举研究员鉴定为旋花科牵牛属植物裂叶牵牛(L.) Choisy的干燥成熟种子。其中Q1~Q5为白丑,Q6~Q15为黑丑;编号Q6的牵牛子用于方法学考察用。
炒牵牛子为本实验室照清炒法[2020年版《中国药典》(四部)通则0213]炮制,取牵牛子生品15份,每份200 g,照清炒法操作,文火炒至稍鼓起,有香气,即得;炮制过程中,入锅前锅底温度210 ℃,出锅时饮片温度150 ℃,炒制时间4 min。炒制后的牵牛子相应编号为CQ1~CQ15。
2 方法与结果
2.1 色谱条件
色谱柱为Kromasil C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%甲酸水溶液,梯度洗脱:0~20 min,10%甲醇;20~25 min,10%~15%甲醇;25~45 min,15%甲醇;45~50 min,15%~30%甲醇;50~75 min,30%甲醇;75~80 min,30%~40%甲醇;80~110 min,40%甲醇;检测波长330 nm;体积流量1 mL/min;进样量10 µL;柱温30 ℃。对照品及部分样品色谱图见图1。
2.2 对照品溶液的制备
精密称取新绿原酸、绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C对照品适量,加50%乙醇制成质量浓度分别为19.4、880.0、15.88、140.8、129.2、71.4 μg/mL的混合对照品溶液。
2.3 供试品溶液的制备
取不同产地牵牛子和炒牵牛子粉末(过三号筛,下同)约0.2 g,精密称定,分别置于具塞锥形瓶中,精密加入50%乙醇25 mL,称定质量,回流提取120 min,放冷,称定质量,用50%乙醇补足减失的质量,摇匀,滤纸滤过,取续滤液,经0.22 μm微孔滤膜滤过,即得供试品溶液。
2.4 方法学考察
2.4.1 线性关系考察 将“2.2”项下的混合对照品溶液稀释2、5、10、25、50倍,按“2.1”项下色谱条件进行测定,以各酚酸类成分的进样量为横坐标(),峰面积为纵坐标()进行线性回归,得各成分的回归方程和线性范围,分别为新绿原酸=2.677 2×108-771 9.119 7,=0.999 9,线性范围0.038 8~1.940 ng;绿原酸=2.770 0×108- 162 282.205 1,=0.999 9,线性范围1.760~88.000 ng;咖啡酸=4.836 2×108-572 7.692 3,=0.999 9,线性范围0.031 76~1.588 ng;隐绿原酸=2.153 7×108-343 07.658 1,=0.999 9,线性范围0.281 6~14.080 ng;异绿原酸A=3.314 4×108-149 223.974 4,=0.999 2,线性范围0.258 4~12.920 ng;异绿原酸C=3.116 4×108-56 569.307 7,=0.999 6,线性范围0.142 8~7.140 ng。

1-新绿原酸 2-绿原酸 3-咖啡酸 4-隐绿原酸 5-异绿原酸A 6-异绿原酸C
2.4.2 精密度试验 取牵牛子(编号Q6)粉末适量,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,计算新绿原酸、绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C峰面积的RSD分别为1.0%、0.4%、2.0%、1.0%、0.7%、0.4%,结果表明仪器精密度良好。
2.4.3 重复性试验 取同一批牵牛子(编号Q6)粉末,称取6份,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,计算样品中新绿原酸、绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C的平均质量分数分别为0.248 2、10.603 3、0.219 0、1.018 0、1.911 1、1.036 9 mg/g,RSD分别为2.5%、0.5%、2.9%、2.4%、1.0%、1.5%。
2.4.4 稳定性试验 取同一份牵牛子(编号Q6)粉末的供试品溶液,分别于制备后0、2、4、8、12、24 h按“2.1”项下色谱条件测定,计算样品中新绿原酸、绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C峰面积的RSD分别为2.0%、0.7%、1.5%、1.5%、1.0%、0.6%,结果表明供试品溶液在24 h内稳定性良好。
2.4.5 加样回收率试验 取牵牛子(编号Q6)粉末约0.2 g,精密称定,共6份,分别精密加入混合对照品溶液25 mL(新绿原酸、绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C质量浓度分别为2.0、85.6,1.7、8.2、14.6、7.9 μg/mL),按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,计算上述成分的平均加样回收率分别为85.11%(新绿原酸含量为0.248 2 mg/g,药典规定含量为100 μg/g的成分加样回收率可放宽限度至85%~110%)、100.91%、100.79%、92.23%、90.36%、97.65%,RSD分别为2.9%、1.7%、1.8%、2.2%、1.0%、1.2%,结果表明建立的含量测定方法准确性良好。
2.5 样品测定
取不同产地的牵牛子和炒牵牛子粉末适量,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,用标准曲线法计算各成分含量,采用检验对牵牛子炒制前后的成分含量进行显著性差异分析。结果显示,首先观察到黑丑和白丑样本的差异,发现牵牛子和炒牵牛子中白丑的新绿原酸、绿原酸、咖啡酸、异绿原酸C含量均高于黑丑。其次是牵牛子炒制前后的差异,发现牵牛子炒制后,新绿原酸、隐绿原酸和异绿原酸C在炒制后质量分数均显著上升(<0.001),新绿原酸炒制前、后质量分数分别为0.20~0.47、0.50~0.96 mg/g,隐绿原酸炒制前、后质量分数分别为1.01~1.30、1.59~2.17 mg/g,异绿原酸C炒制前、后质量分数分别为0.93~1.46、1.55~1.88 mg/g。咖啡酸和异绿原酸A在炒制后质量分数均显著下降(<0.01、0.001),咖啡酸炒制前、后质量分数分别为0.11~0.58、0.10~0.38 mg/g,异绿原酸A炒制前、后质量分数分别为1.78~2.08、1.46~1.69 mg/g。绿原酸含量在炒制前、后则无明显变化,具体数据见表1。牵牛子炒制前、后含量变化见表2,结果表明,新绿原酸、隐绿原酸、异绿原酸A和异绿原酸C有极其显著的变化。

表1 不同牵牛子样品中6个成分的含量测定(n = 2)
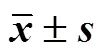
表2 牵牛子炒制前后6个化学成分含量变化(, n = 15)
与牵牛子比较:**<0.01***<0.001
**< 0.01***< 0.001
2.6 多元统计分析
为了探索牵牛子在炒制前后,酚酸类成分的差异,对“2.5”项中含量测定结果进行多元统计分析。首先,对15批样品进行无监督模式的层次聚类分析(hierarchical cluster analysis,HCA),在牵牛子样品是生品或炒品未知的情况下,根据样品中酚酸类成分的含量对样本进行分析。接着采用无监督模式的主成分分析(principal component analysis,PCA),根据酚酸成分含量在主成分的载荷权重,筛选出差异较大的特征成分。此外,采用有监督模式的偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA),根据VIP值筛选出牵牛子和炒牵牛子的特征变量,进而找出牵牛子炒制前后变化明显的关键成分。
2.6.1 HCA 以牵牛子和炒牵牛子中的6个成分的含量为变量,利用SIMCA 14.1对含量测定数据进行聚类分析,见图2。结果显示,30批样品整体聚为2大类,第1大类包括样品Q1~Q15,均为生牵牛子,第2大类包括样品CQ1~CQ15,均为炒牵牛子,说明牵牛子炒制前后样品质量存在明显的差异。第1大类可再分为Q1~Q5(白丑)和Q6~Q15(黑丑)2小类,说明黑丑和白丑之间此类化学成分含量也有一定差异。而Q6~Q15又分成了Q6~Q12(山东)和Q13~Q15(河北)2类,说明不同产地的牵牛子质量也存在差异。而第2大类除CQ1外,各分类情况与第1大类相同。
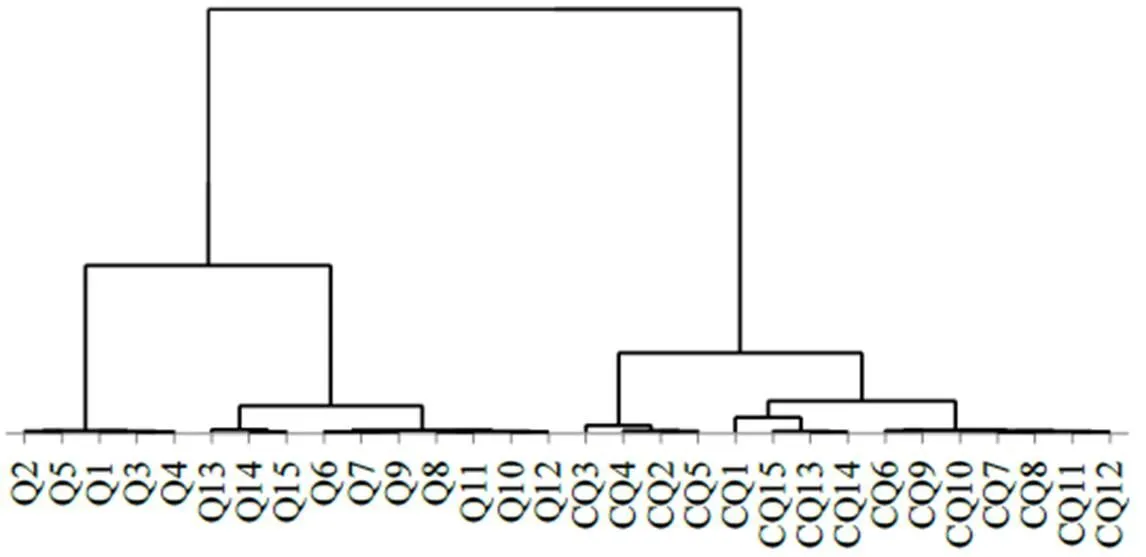
图2 不同牵牛子样品的HCA
2.6.2 PCA 为进一步探讨牵牛子和炒牵牛子之间的差异,在HCA基础上,对6个成分含量进行PCA处理,模型参数为2(在轴方向上模型的解释率)=0.987,2(模型预测率)=0.941,两参数均接近于1表示模型拟合数据效果良好,得到以第1和第2主成分为变量的双标图,见图3。在这种无监督的识别模式下,牵牛子样品自动聚为2类,一类(Q1~Q15)为牵牛子,在第II、III象限均有分布,另一类(CQ1~CQ15)为炒牵牛子,主要集中在第I~IV象限。而白丑在第I、II象限,黑丑在第III、IV象限,表明白丑和黑丑各化学成分含量也发生了变化。第1、2主成分对区分这2类的贡献率分别为63.4%、27.2%,这2个主成分可以反应全部信息的90.6%,说明2个主成分可替代原来6个酚酸类成分反映的样品信息。在这2个主成分中的权重值之和越大表明该成分在牵牛子和炒牵牛子中差别越大。权重之和值超过1的成分是隐绿原酸、异绿原酸C、异绿原酸A、新绿原酸,权重之和分别为1.158 7、1.144 1、1.092 9、1.079 8,说明这些成分是牵牛子炒制前后变化较大的成分。
2.6.3 PLS-DA 将6个成分含量数据导入SIMCA-14.1中进行有监督模式的PLS-DA,获得相应的模型,结果见图4,模型参数为R(在轴方向上模型的解释率)0.916,R(在轴方向模型的解释率)0.984,Q(模型预测率)0.931,均>0.5,表明该模型稳定可靠。牵牛子在第II、III象限而炒牵牛子在第I~IV象限,表明牵牛子和炒牵牛子2大类差别显著;而白丑在第III、IV象限,黑丑在第I、II象限,表明白丑和黑丑也差别明显。为了衡量每个成分在牵牛子炒制前后的变化,结合变量重要性投影(variable importance projection,VIP)值对6个成分含量的VIP值大小进行排列,见图5。以VIP值>1为标准,筛选炒制对牵牛子化学成分差异影响贡献较大的化合物,结果隐绿原酸、异绿原酸A、异绿原酸C、新绿原酸是引起牵牛子炒制前后质量差异的主要潜在标志性成分。该分析结果与HCA和PCA结果一致。

图3 不同牵牛子样品的PCA双标分析
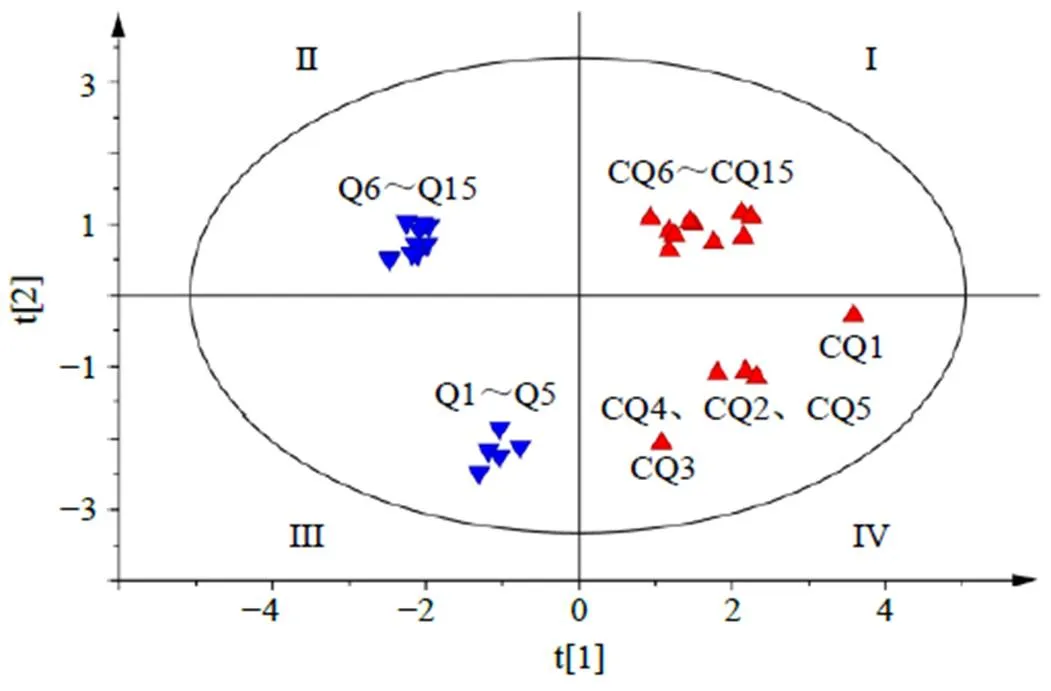
图4 不同牵牛子样品的PLS-DA得分散点

1-新绿原酸 2-绿原酸 3-咖啡酸 4-隐绿原酸 5-异绿原酸A 6-异绿原酸C
结合化学计量法对牵牛子炒制前后的各成分含量进行分析,结果表明炒制前后牵牛子中酚酸成分种类没有发生变化,但可以通过统计分析方法发现其中变化较为明显的成分以及黑丑白丑内在化学成分的差别。
2.7 牵牛子炒制前后酚酸类成分的变化规律考察
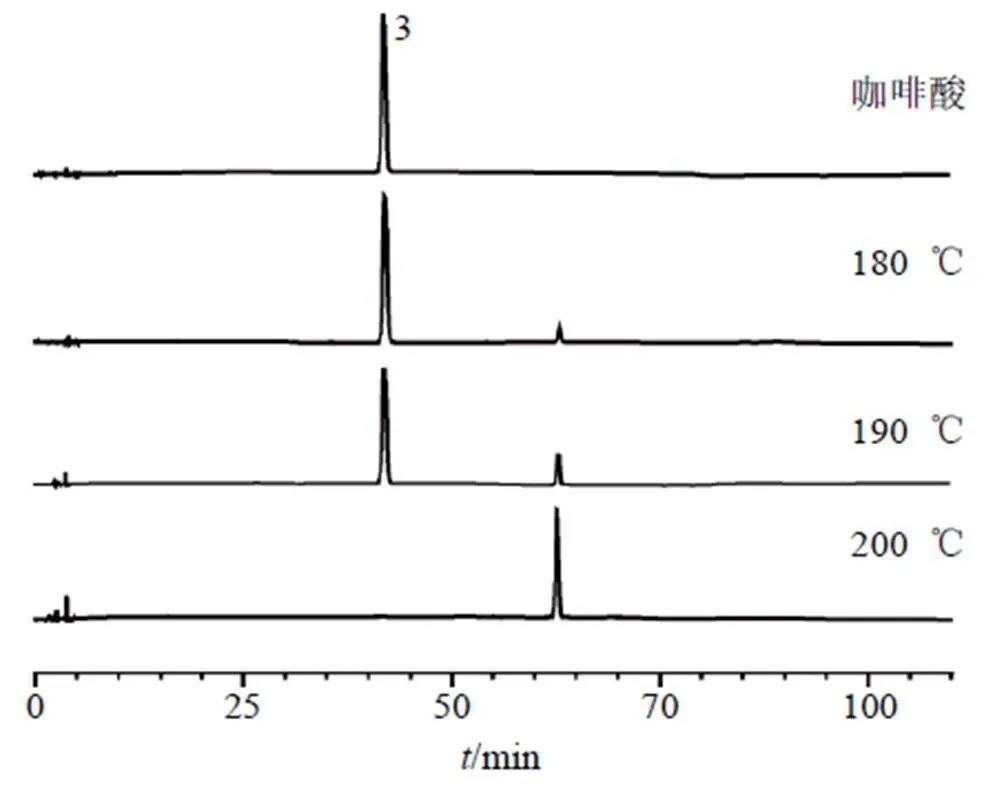
分析牵牛子中各成分含量变化的原因,可能是部分绿原酸类化合物结构不稳定,炒制过程中高温使其结构发生了转化。为了验证以上推测,将新绿原酸、绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C 6个单体化合物分别在不同温度下(参考牵牛子炒制过程的温度,并结合实际实验中各单体化合物发生转化的温度)加热30 min,用50%乙醇溶解后,经0.22 μm微孔滤膜滤过,取续滤液,按“2.1”项下色谱条件测定,结果见图6~11。结果发现:①新绿原酸在200 ℃开始裂解产生咖啡酸,转化产生少量异绿原酸A和异绿原酸C,210 ℃新绿原酸完全裂解,色谱峰消失,可检识到咖啡酸色谱峰等;②绿原酸在200 ℃开始少量异构化为隐绿原酸;③咖啡酸在180 ℃加热后,在260 nm波长下检识到生成了新的化合物,且随着温度升高,在200 ℃时全部转化,转化成的新化合物经液质联用检测,可能为2分子咖啡酸脱羧后聚合产生1对/为271.099 4 [M-H]−的顺反异构体,其结构如图12所示;④隐绿原酸随着温度升高异构化产生新绿原酸和绿原酸,并逐渐裂解产生咖啡酸,也转化产生少量异绿原酸C,在210 ℃隐绿原酸完全裂解,色谱峰消失,可检识到咖啡酸色谱峰等;⑤异绿原酸A随着温度的升高转化为异绿原酸C越来越多,也转化为少量绿原酸,在210 ℃异绿原酸A完全裂解,色谱峰消失,可检识到咖啡酸色谱峰等;⑥异绿原酸C随着温度升高逐渐异构化产生异绿原酸A,也转化为少量绿原酸和咖啡酸。此外,除咖啡酸外的5个绿原酸类成分经过高温加热分解后,都可以在55~60 min检识到的1组色谱峰,以新绿原酸为例,210 ℃加热后的产物经液质联用检测,可能是/为367.105 6 [M-H]−的3种同分异构体和/为335.079 1 [M-H]−的4种同分异构体的混合物,从质谱图中虽然可以看出几种化合物均含有咖啡酸片段,但由于二级质谱差别较大,无法得出准确结构。新绿原酸、绿原酸、隐绿原酸为同分异构体,由1分子咖啡酸和1分子奎宁酸组成,异绿原酸A和异绿原酸C为同分异构体,由2分子咖啡酸和1分子奎宁酸组成,在一定温度下这些同分异构体之间可以发生裂解、重排等反应,导致异构化,从而相互转化。

1-新绿原酸 3-咖啡酸 5-异绿原酸A 6-异绿原酸C

2-绿原酸 4-隐绿原酸
3-咖啡酸

1-新绿原酸 2-绿原酸 3-咖啡酸 4-隐绿原酸 6-异绿原酸C

2-绿原酸 3-咖啡酸 5-异绿原酸A 6-异绿原酸C
3 讨论
本研究建立6个酚酸类指标成分的HPLC含量分析方法,并对15批不同产地生、炒牵牛子样品进行含量分析,结果显示,炒制对6个酚酸类成分的影响是不一致的。绿原酸的含量比较稳定,其含量变化无统计学差异,而新绿原酸、咖啡酸、隐绿原酸、异绿原酸A和异绿原酸C的含量则发生了显著变化。新绿原酸、隐绿原酸和异绿原酸C的质量分数平均升高125.20%、61.66%、45.95%(以每批样品含量变化率的平均值计算,下同);咖啡酸和异绿原酸A的质量分数平均降低23.04%、18.58%,可见炒制对牵牛子中除绿原酸外的其他酚酸类成分有较大影响。多元统计分析结果表明,新绿原酸、隐绿原酸、异绿原酸A和异绿原酸C是牵牛子炒制前后酚酸类成分中变化较为明显的成分,可作为牵牛子炒制前后质量评价的关键性指标。

2-绿原酸 3-咖啡酸 5-异绿原酸A 6-异绿原酸C

图12 咖啡酸200 ℃加热后可能产生的2个化合物
从上述单体酚酸化合物在高温下的转化规律,可以初步解释牵牛子在炒制过程中各成分变化的原因。新绿原酸含量升高可能是隐绿原酸转化为新绿原酸更为容易(130 ℃就可以发生裂解);绿原酸相对稳定,故含量没有显著变化;咖啡酸在高温条件(高于180 ℃)下,也可以发生裂解反应,转化为其他成分,含量降低;绿原酸在达到200 ℃以上后可以转化为少量隐绿原酸,导致隐绿原酸含量升高;随温度升高,异绿原酸A向异绿原酸C转化更为明显,导致异绿原酸C含量升高,异绿原酸A含量降低。但牵牛子中成分复杂,在炒制过程中发生变化或转化的成分绝非仅限于检测的几个,可能存在未能检测到的其他酚酸类成分之间进行转化,所以,最后看到的各成分的变化幅度是一个综合的结果;另外,从上面单体成分实验结果可以看出,各成分之间的转化与炒制时的温度也有很大关系。
本实验在确定供试品溶液的制备方法时,考察了提取方式和提取溶剂对牵牛子不同成分含量的影响。结果选择提取溶剂时,甲醇制备的样品不稳定,久置或冷藏会析出絮状物或难溶物,经分离鉴定为脂肪酸类化合物,而乙醇制备的样品较稳定;回流提取6个指标性成分的含量均略高于超声提取法;选择不同体积分数乙醇(50%、70%、90%、100%)提取时,50%乙醇对各成分均具有较好的提取效果且样品稳定,选择不同回流时间(0.5、1.0、1.5、2.0 h)提取时,提取2.0 h各成分含量较高,故确定了“2.3”项下供试品溶液的制备方法。
本实验建立的6种酚酸类成分含量测定方法,可为牵牛子及炒牵牛子的质量评价提供有益借鉴,初步揭示了牵牛子炒制前后化学成分的含量变化规律,可为牵牛子及炒牵牛子的质量评价和临床应用提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 梁·陶弘景集. 尚志钧辑校. 名医别录 [M]. 北京: 人民卫生出版社, 1986.
[2] 中国药典[S]. 一部. 2020: 265.
[3] 孙延平, 王艳宏, 杨炳友, 等. 牵牛子化学拆分组分的性味药理学评价及药味归属研究 [J]. 世界中医药, 2015, 10(12): 1837-1846.
[4] 张丹宇, 季宇彬, 许旭东, 等. 牵牛子的化学成分和药理作用研究进展 [J]. 科学技术创新, 2018(30): 13-14.
[5] 向玉林, 罗征, 孙媛, 等. 牵牛子化学成分及其生物活性研究进展 [J]. 中华中医药学刊, 2022, 40(6): 114-122.
[6] 钮婧杰, 孙延平, 王秋红, 等. 牵牛子药理作用最新研究进展 [J]. 辽宁中医杂志, 2020, 47(5): 201-204.
[7] 贺晓丽, 于蕾, 杨秀颖, 等. 中药牵牛子毒的历史考证与现代研究 [J]. 中药药理与临床, 2018, 34(4): 194-196.
[8] 邙玲玲, 徐霞. 牵牛子的临床应用及安全性研究进展 [J]. 现代中医药, 2018, 38(2): 96-100.
[9] 敖冬梅, 魏群. 牵牛子研究进展 [J]. 中国中医药信息杂志, 2003, 10(4): 77-80.
[10] 范田慧, 孙延平, 王秋红, 等. 牵牛子的本草考证 [J]. 中医药学报, 2021, 49(9): 92-95.
[11] Ren S M, Zhang W, Xu X J,. Morning glory seed keeps laxative effect while retains less subchronic toxicity after being fried [J]., 2020, 251: 112522.
[12] 王初, 孙建宇. 炮制对牵牛子有效成分及药效的影响 [J]. 医药导报, 2008, 27(7): 781-782.
[13] 潘海峰, 李守拙. 对2005版《中国药典》牵牛子药材含量测定问题的商榷 [J]. 中药材, 2006, 29(6): 640.
[14] 田连起, 郑玉丽, 白吉星, 等. 牵牛子炮制前后咖啡酸的含量比较研究 [J]. 中医学报, 2011, 26(5): 595-597.
[15] 张琳, 卢彦芳, 蒋晔. 微波萃取-HPLC法快速分析牵牛子中的咖啡酸 [J]. 华西药学杂志, 2013, 28(1): 92-93.
[16] 冯鑫, 袁杰, 金传山, 等. 不同产地牵牛子生品及炒制品咖啡酸含量测定 [J]. 安徽中医药大学学报, 2016, 35(2): 91-93.
[17] 李亭亭, 徐新房, 王子健, 等. 牵牛子生品、炒品酚酸类成分的HPLC-MS分析 [J]. 中医药学报, 2016, 44(1): 11-14.
[18] Bao H, Yang H, Wang F,. HPLC fingerprint combined with multicomponent quantification as an efficient method for quality evaluation of[J]., 2020, 15(6): 1-8.
Effects of stir-frying on content of phenolic acids in
GAO Pei-yun1, 2, YANG Xiao-yun2, WANG Li-xia2, JIANG Tong2, CHEN Ying-ying2, CHEN Xiao-xu2, WU Tong2, YUE Chun-yu1, 2, TANG Li-ying2, WANG Zhu-ju2
1. College of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
To establish the HPLC method for the determination of six phenolic acids (neochlorogenic acid, chlorogenic acid, caffeic acid, cryptochlorogenic acid, isochlorogenic acid A, and isochlorogenic acid C) in Qianniuzi () and to study the content changes of the compounds inbefore and after stir-frying.The contents of neochlorogenic acid, chlorogenic acid, caffeic acid, cryptochlorogenic acid, isochlorogenic acid A, and isochlorogenic acid C were determined simultaneously by HPLC, and analyzed by chemometrics. The conversions among them at different temperatures were preliminary studied by simulated processing method. Kromasil C18(250 mm × 4.6 mm, 5 μm) was employed, and the mobile phase was methanol-0.1% formic acid aqueous solution for gradient elution (0—20 min, 10% methanol; 20—25 min, 10%—15% methanol; 25—45 min, 15% methanol; 45—50 min, 15%—30% methanol; 50—75 min, 30% methanol; 75—80 min, 30%—40% methanol; 80—110 min, 40% methanol). The detection wavelength was set at 330 nm, flow rate was 1 mL/min, the injection volume was 10 µL, and the column temperature was 30 ℃.Compared with raw, the content of chlorogenic acid had no significant change after processing, while the contents of neochlorogenic, cryptochlorogenic acid and isochlorogenic acid C were increased significantly. And the contents of caffeic acid and isochlorogenic acid A were decreased significantly. The 30 batches ofwere divided into two categories, raw and processed products, by hierarchical cluster analysis (HCA). Four components that caused the differences were marked by principal component analysis (PCA) and partial least squares-discriminant analysis (PLS-DA). Six monomers transformed into each other in the process of simulated processing, and the degree of transformation was related to temperature.The contents of chemical components inand friedhave changed to a certain extent. Among them, neochlorogenic acid, cryptochlorogenic acid, isochlorogenic acid A and isochlorogenic acid C can be used as the key indicators for quality evaluation ofbefore and after processing. It can provide a scientific basis for the establishment and in-depth study of quality standards forand fried
; HPLC; phenolic acids; stir-fried method;neochlorogenic acid; chlorogenic acid; caffeic acid; cryptochlorogenic acid; isochlorogenic acid A; isochlorogenic acid C; hierarchical cluster analysis; principal component analysis; partial least squares-discriminant analysis; quality evaluation
R283.1
A
0253 - 2670(2022)24 - 7721 - 09
10.7501/j.issn.0253-2670.2022.24.010
2022-06-28
国家重点研发计划项目(2018YFC1707106);山东省重点研发计划(2021SFGC1202)
高佩云(1997—),女,硕士研究生,研究方向为饮片化学成分及炮制原理。E-mail: gaopeiyun78@163.com
唐力英,副研究员,从事饮片化学成分及炮制原理研究。E-mail: bjtangliying@163.com
王祝举,研究员,从事饮片化学成分及炮制原理研究。E-mail: wangzhuju@sina.com
[责任编辑 郑礼胜]
