牛病毒性腹泻病毒全球基因型与亚型流行情况
2022-12-24左之才才冬杰付星鑫刘玲利张义琳苟丽萍任志华邓俊良
谌 婕,左之才,才冬杰,*,付星鑫,刘玲利,张义琳,2,苟丽萍,王 娅,任志华,邓俊良
(1.四川农业大学 动物医学院,动物疫病与人类健康四川省重点实验室,四川 成都611134;2.罗平县农业农村局动物疫病预防控制中心,云南 曲靖655800)
牛病毒性腹泻(bovine viral diarrhea,BVD)是由牛病毒性腹泻病毒(Bovineviraldiarrheavirus,BVDV)引起的一种接触传染性动物传染病。BVDV属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),同属的病毒还有猪瘟病毒(Classicalswinefevervirus,CSFV)和边界病病毒(Borderdiseasevirus,BDV)[1]。BVDV根据抗原性和基因组的差异可分为BVDV-1、BVDV-2和BVDV-3(又称Hobi-like瘟病毒)等不同的基因型,并且毒株之间无血清型差异[1]。目前,已报道的BVDV-1有22个基因亚型(1a~1v),BVDV-2有4个基因亚型(2a~2d),报道的BVDV-3型毒株有D32/00、Italy-129/07、Italy-83/10-cp、Italy-83/10-ncp等。大多数反刍动物都可感染BVDV,牛最易感。动物感染BVDV后的表现包括免疫抑制和生殖障碍,临床症状主要有发热、嗜睡、厌食、腹泻、溃疡、出血综合征等。由于BVDV可以透过胎盘屏障,因此感染后也可能引起妊娠期母牛子宫内感染,出现生殖损失,妊娠早期感染可导致流产、产出畸形胎或木乃伊胎等。根据BVDV能否引起细胞病变,可将其生物型分为致细胞病变型(CP)和非致细胞病变型(NCP),两者皆可导致宿主的急性感染;但是NCP型可在怀孕母牛妊娠期通过胎盘感染50~120日龄的胎儿,导致产出对BVDV免疫耐受的持续感染动物(persistent infection,PI)[1]。部分PI动物能像正常动物一样生长发育至成年,但其生长发育状况和繁殖性能比同龄健康动物低很多,且在其生长过程中会向环境中不断排出BVDV,是传染牛群BVDV的病源。因此,查明和清除PI动物对该病的预防和控制至关重要。
BVDV广泛流行于全球的多个国家,会导致牛群生产性能下降,从而造成严重经济损失。目前全球各国平均每年因BVDV每头牛损失约46.5美元,而每头普通奶牛直接损失比每头肉牛高出24.85美元。来自欧洲的数据显示,每年因此造成的损失平均每头高达87美元[2]。中国目前尚未有BVDV感染导致经济损失的相关统计。由于BVDV给养殖业造成的严重后果,世界动物卫生组织(Office International Des Epizooties,OIE)将其列为法定报告的牛传染病,我国在进出口动物检疫法规中也已将BVD定为二类传染病。疫苗免疫对该病的预防有所帮助,但由于BVDV的基因变异,导致对同源株有效的疫苗在预防变异株上可能失去效果,继而引起疾病的失控。
1 BVDV基因组结构
BVDV是一种小包膜单股正链RNA病毒,NCP型基因组全长约为12.3 kb,CP型由于存在基因组重复和RNA插入等原因,其基因组全长和具体毒株有关。BVDV基因组结构包含5′端非编码区(5′ untranslated region,5′UTR)、开放阅读框架区(open reading frame,ORF)和3′端非编码区(3′ untranslated region,3′UTR)3个部分[3],如图1所示。BVDV 5′UTR区末端无甲基化的“帽子”结构,具有保守稳定的二级结构,在各BVDV毒株间具有高度保守性,也是瘟病毒最保守的基因,因此可根据其序列合成引物,进行BVDV的检测和分型[3]。
ORF编码的是一个大多聚蛋白,与病毒抗原性、复制能力的强弱、是否致细胞病变有关[4],具体编码的蛋白质如图1所示。Npro蛋白负责产生自身C末端的非结构性病毒自蛋白酶;核衣壳蛋白C和3个包膜糖蛋白Erns、E1、E2分别代表BVDV的结构蛋白。C、Erns、E1、E2是高度可变的,且在免疫上占优势的糖蛋白是中和抗体的主要靶点[4];p7、NS2负责产生蛋白酶,可用于NS2和NS3之间切割肽键;NS3蛋白同时具有NTPase活性、丝氨酸蛋白酶活性和RNA解旋酶活性;NS4a是一种辅助蛋白,能协助NS3发挥作用;NS4b是膜整合蛋白,可与高尔基体接触结合组成部分病毒复合体;NS5a是一种亲水蛋白;NS5b[4]是RNA聚合酶。

图1 BVDV基因组结构示意图
2 全球BVDV亚型分布统计
查阅大量国内外文献发现,不同国家占据主导地位的BVDV亚型不完全相同。部分国家的BVDV基因亚型统计结果如表1、表2所示。BVDV-1b是世界范围内流行的主要基因亚型,其次是BVDV-1a和BVDV-1c。从各大洲来看,BVDV-1b是美洲、亚洲和欧洲流行的主要基因亚型。BVDV-1毒株在欧洲和亚洲有21种基因亚型出现,而在美洲、澳洲和非洲却仅有7种基因亚型出现,相比而言,BVDV-1毒株在美洲、澳洲和非洲比在欧洲和亚洲的变异程度更低。BVDV-2最初是在加拿大和美国被发现的,曾在20世纪90年代有过较高暴发率[2,5],且2001—2021年此基因型在当地的流行情况并没有明显变化[6]。

表1 BVDV在美洲、澳洲、非洲和欧洲的基因亚型分布
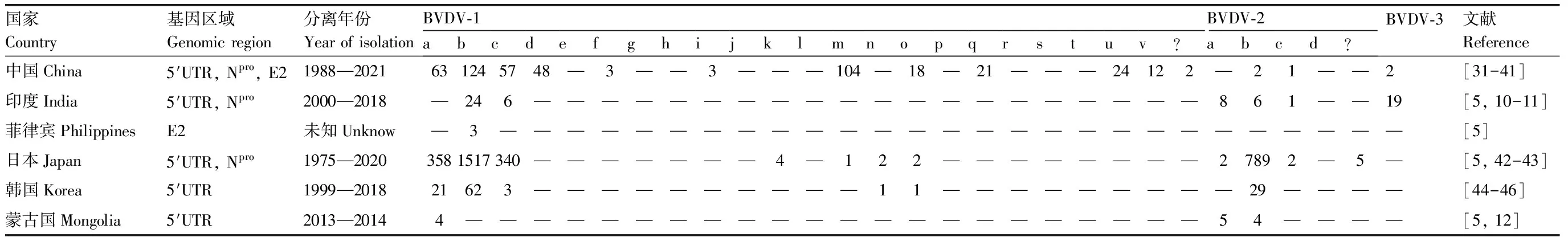
表2 BVDV在亚洲的基因亚型分布
Polak等[7]在2004年对波兰流行的BVDV首次进行分型,结果表明BVDV-1b是波兰流行最广的基因亚型,其次是BVDV-1d,无BVDV-1a流行。在1996年乌拉圭已发现BVDV流行,2000—2001年BVDV在牛群上的流行率为69%,但当时并未对乌拉圭的BVDV毒株进行基因亚型划分[8],直到2014年才首次划分其流行的BVDV毒株基因亚型[9]。印度从2000年开始对BVDV进行血清监测[10-11],蒙古国在1980年首次诊断出BVDV,但当时并未进行基因亚型的划分,直到2013年才正式有基因亚型分型相关数据报道[12]。
3 全球BVDV基因亚型流行情况
我国最早于1980年从引入欧洲种牛的农场中分离出BVDV-1b亚型,此后的一些研究数据也表明,1b亚型是我国主要流行的基因亚型之一[31,47]。2005—2015年,我国主要流行的基因亚型包括1a、1b、1m和2a,其中1b是我国流行分布最广的基因亚型,其流行地区包括陕西、四川、吉林、新疆、广西、北京、宁夏等地;1a基因亚型主要在陕西、山东和北京等地流行[47];1m亚型曾在四川西昌的临床健康牛中分离到,证明感染BVDV-1m亚型的牛可能不表现明显临床症状[38]。2009年,林燕清[39]对分离到的XJ-04株进行遗传发育分析,证明其属于2a亚型,这也是BVDV-2型在我国的首次报道。2008年,新疆地区主要流行的基因亚型是1b。王国超[48]的研究结果表明,新疆地区同时存在BVDV-1型和BVDV-2型感染,这可能是北疆地区规模化养殖的兴起、活体贸易和频繁引种引起的。2017—2021年我国主要流行的基因亚型包括1b、1a、1m、1q、1c和2a[40-41]。2019年,四川省邛崃市和广安市牛场发生腹泻病例,Tian等[34]利用抗原ELISA试剂盒检测了20份血液样品,结果阳性检出率为10%,并分离到一株1b和一种新基因亚型毒株“1v”。2007—2019年,邓宇等[38]对我国多个省份的田间猪样品检测,证明我国猪群中流行1a、1b和1m亚型。2013年,在我国西部地区双峰驼群中发现存在BVDV感染,主要流行的基因亚型包括1a、1b、1c、1m、1o、1p和1q,这也是我国首次为中国西部双峰驼自然感染高度分化的BVDV-1提供分子生物学证据[49]。
Olafson等[50]于1946年在纽约首次发现BVDV,当时只被当作一种导致牛发生腹泻的传染病报道。在1989年之前,已知的BVDV基因型只有一种,与如今发现的基因型相比,这种基因型显示出明显的遗传差异性,因此Ridpath等[51]在1994年引入专业术语BVDV基因型1(旧)和BVDV基因型2(新)。BVDV在意大利主要流行的基因亚型为1b,同时意大利也存在2b亚型的流行[5]。BVDV在美国存在的基因亚型较少,仅有1a、1b和2a 3种,其中1b亚型最为流行[6,18]。加拿大对BVDV根除效果较好,仅存少量1a、1b和2a亚型的流行[2]。对2000—2020年的数据进行分析发现,BVDV-2在许多欧洲国家都存在,包括德国、法国、英国和奥地利,而进一步的研究也揭示了BVDV-2更为广泛的分布。BVDV-2a是BVDV-2在各大洲分布最广的基因型,而BVDV-2c仅在欧洲和美洲发现。自2000年以来,在美国牛场由BVDV-2型引起的不同日龄牛发生急性BVD病例日益增多,且不断能从病料中分离得到高毒力BVDV-2毒株[38]。截止2013年,发现的大部分BVDV-3都是从源自巴西的胎牛血清中分离出来的,如2004年首次报告的BVDV-3就是从巴西进口的胎牛血清中分离出的,且后续的研究结果也表明,在欧洲测试的胎牛血清有30%以上均被来自南美的胎牛血清批次污染,推断该病原体可能广泛存在于南美的牛群中[52]。在东南亚和欧洲也有BVDV-3的相关报告,表明该病毒的流行不局限于南美洲。如奥地利在2009—2014年进行的流行病学调查报告中也有BVDV-3基因型的出现[23]。由于各国对胎牛血清的需求日益增加,可能导致该地区感染源自胎牛血清的BVDV-3。如今,BVDV-3的流行日益广泛,各国不断有BVDV-3的相关报道出现。迄今为止,BVDV-3主要流行于阿根廷、巴西、美国、澳大利亚、奥地利、爱尔兰、西班牙、英国和印度,其中印度的报道最多。
4 总结与展望
截止目前BVDV的基因型包括BVDV-1(1a-1v)、BVDV-2(2a-2d)、BVDV-3,有如D32/00、Italy-129/07、Italy-83/10-cp、Italy-83/10-ncp等Hobi-like毒株,但由于BVDV基因组的高度可变结构,未来极大可能会有更多的基因亚型被报道。本文收集了全球已被发现的基因亚型种类和数量并加以总结分析,可以更直观地看到BVDV的各个基因亚型在全球各地的分布。本文分析发现,不同地区BVDV流行株间存在一定差异,如BVDV-1m、1n、1o、1p、1q和1v这几种基因亚型迄今为止只在亚洲发现,但BVDV-1e、1g、1h、1j、1l、1r、1s、1t和BVDV-2c这几种基因亚型在亚洲各国却未见报道,这也表明BVDV在适应环境的过程中表现出高度突变频率。BVDV的这种变异主要源于以下2个过程,一个是RNA聚合酶在聚合底物时发生错误导致点突变并积累,另一个是同源与非同源的RNA重组[53]。BVDV每复制一个周期,就有一个点突变被引入到BVDV基因组中[53]。BVDV 5′UTR序列的平均进化率为一年9.3×10-3个置换位点,此外,5′UTR和E1-E2区域的取代率分别为一年5.9×10-4和1.26×10-3个位点[53]。BVDV基因亚型的不断增多是点突变随时间积累的结果,也被称为遗传漂变。由于目前国际上尚未建立BVDV的标准化和普遍接受的遗传分型系统,对同一段基因的不同区域或使用不同方法进行分析可能导致分析结果出现紊乱,因此某些毒株基因亚型的划分可能存在矛盾。制定国际统一的BVDV基因亚型鉴定规则更有利于减少毒株分型的不一致性,从而更好地防控BVDV。
