产香真菌M6-5的鉴定及其挥发性物质对库尔勒香梨果实采后黑斑病的抑制效果
2022-12-22刘峰娟秦新政鲁志远马昊翔张丽娟
黄 伟,王 宁,刘峰娟,宋 博,秦新政,罗 义,鲁志远,马昊翔,张丽娟,*,王 玮,*
(1.新疆农业科学院微生物应用研究所,新疆特殊环境微生物实验室,新疆 乌鲁木齐 830091;2.新疆农业科学院农业质量标准与检测技术研究所,新疆 乌鲁木齐 830091;3.新疆农业科学院植物保护研究所,新疆 乌鲁木齐 830091)
库尔勒香梨作为新疆地区贮藏量最大的水果,并且其产业化水平遥居新疆所有水果之首,是新疆尤其是南疆地区果农的主要经济支柱[1]。香梨果实在运输、贮藏过程中发生多种病害,尤其是由链格孢菌(Alternaria alternata)引起的黑斑病,严重影响香梨的食用品质和商业价值,给果农造成了巨大的经济损失[2],是香梨产业亟待解决的问题。目前对香梨采后保鲜的方法有低温冷藏[3]、气调贮藏[4]、短波紫外线照射[5]等物理方法,1-甲基环丙烯熏蒸[6]、水杨酸[7]等化学方法,然而物理方法对设备有一定要求,化学合成药物的使用在食品安全性方面存在极大的隐患。因此,寻找能持续防控此病害和其他果实采后同类病害的新途径具有重要意义。
使用有益微生物及其代谢产物作为合理而安全的果实采后病害防治措施是极具前景的方法[8-9]。其中拮抗真菌产生的挥发性物质(volatile organic compounds,VOCs)在果实采后病害防治方面的重要应用逐渐成为研究热点之一[10],Contarino等[11]发现异常威克汉姆酵母(Wickerhamomyces anomalus)和美极梅奇酵母(Metschnikowia pulcherrima)能产生乙醇、3-甲基-1-丁醇、苯乙醇、乙酸乙酯和乙酸异戊酯等挥发性物质,显著抑制葡萄灰霉病。巴西麝香霉(Muscodor brasiliensissp.)LGMF1256菌株在离体条件下能完全抑制指状青霉(Penicillium digitatum)的生长繁殖,产生的挥发性物质防治甜橙绿霉病的效果高达77%[12]。研究表明部分真菌能够产生具有香味的抑菌挥发性物质,甘薯长喙壳菌(Ceratocystis fimbriata)可以产生果香味挥发性有机物,其对桃褐腐病菌(Monilinia fructicola)等11种病原真菌的生长抑制率为50%~80%[13]。木霉产生的具有椰子香气的6-戊基-2H-吡喃-2-酮也具有抗真菌活性,单独施用2 mmol/L的6-戊基-2H-吡喃-2-酮能够增强拟南芥对灰葡萄孢菌(Botrytis cinerea)和芸薹生链格孢菌(Alternaria brassicicola)的抗性[14]。
目前对拮抗微生物非挥发性物质(主要为发酵液)防治香梨采后病害研究较多,穆香轶等[15]发现枯草芽孢杆菌Y2菌株的发酵液对库尔勒香梨黑头病(由芸薹生链格孢菌引起)的病斑直径抑制率达到了37.66%。乳酸菌LAB86菌株发酵液处理能够显著降低香梨超氧阴离子自由基产生速率及过氧化氢含量,起到延长贮藏时间的作用[16]。然而,鲜有利用拮抗微生物挥发性物质防治香梨采后病害的内容及数据。
本研究通过测定产香真菌M6-5挥发性物质对植物病原真菌的抑菌活性,筛选M6-5菌株抑制香梨黑斑病菌链格孢菌的最佳生长时期,采用气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)检测其挥发性物质,并通过纯品确定其有效抑菌成分,测试体内条件下M6-5菌株产生的挥发性物质对香梨果实采后黑斑病的抑制效果,为后续控制链格孢菌引起的果实采后病害提供一定理论依据。
1 材料与方法
1.1 材料与试剂
菌株M6-5为实验室于2020年11月从广州韶关农田土壤中分离所得,香梨黑斑病菌链格孢菌由新疆农业科学院植保所分离保存。库尔勒香梨采自新疆巴音郭楞蒙古自治州库尔勒市和什力克乡。
6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯、苯乙醇、琼脂糖、10×TEA缓冲液 上海源叶生物科技有限公司;真菌DNA提取试剂盒、Promega胶回收试剂盒 默克化工技术(上海)有限公司;TaqDNA聚合酶缓冲液、脱氧核糖核苷三磷酸、TaqDNA聚合酶、高扩增-高特异性DNA聚合酶、去离子水 北京康为试剂生物科技有限公司;玻璃纸 北京赛珂玛生物科技有限公司;甲醇(分析纯) 天津市鑫铂特化工有限公司;无水硫酸钠天津市北联精细化学品开发有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、马铃薯葡萄糖液体(potato dextrose broth,PDB)培养基 青岛海博生物技术有限公司。
1.2 仪器与设备
DHP-052型恒温振荡培养箱 上海一恒科学仪器有限公司;SX-500型高压灭菌锅 日本Tomy Digital Biology公司;FA-2204型电子天平 上海衡平仪器仪表厂;Rotina 380R型高速冷冻离心机 郑州长城科工贸有限公司;SW-CJ-2FD型无菌超净工作台 苏州净化设备有限公司;B-300旋转蒸发仪 瑞士步琦有限公司;50/30 μm DVB/CAR/PDMS固相微萃取头及萃取手柄 上海安谱实验科技股份有限公司;TQ8040NX三重四极杆型GC-MS仪 日本Shimadzu公司。
1.3 方法
1.3.1 菌株M6-5形态与分子生物学鉴定
将待观察的菌株M6-5接种到PDA培养基上,在30 ℃培养7 d,待菌落长满整个平板观察菌落特征记录并拍照保存。此外,使用插片法在光学显微镜下观察分生孢子梗和分生孢子的特征,记录拍照存档。
通过对ITS和tef1序列进行进化分子鉴定。收集在30 ℃培养7 d的M6-5接种,利用真菌DNA提取试剂盒提取其菌丝体DNA。以此为模板进行序列扩增。使用聚合酶链式反应(polymerase chain reaction,PCR)以引物对ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')扩增ITS序列。引物由生工生物工程(上海)股份有限公司合成。PCR扩增体系(50 μL):10×TaqDNA聚合酶缓冲液5 μL;脱氧核糖核苷三磷酸2 μL;上下游引物各1 μL;TaqDNA聚合酶1.2 μL;模板DNA 3.6 μL;去离子水补足至50 μL。PCR条件:94 ℃预变性5 min;94 ℃变性0 s,52.6 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃再延伸5 min,4 ℃保存[17]。使用PCR以引物对tef1-EF1(5'-ATGGGTAAGGARGACAAGAC-3')和tef1-EF2(5'-GGARGTACCAGTSATCATGTT-3')扩增tef1序列。PCR扩增体系(25 μL):模板DNA 1 μL;高扩增-高特异性DNA聚合酶12.5 μL;上下游引物各1 μL;去离子水补足至25 μL。PCR条件:95 ℃预变性3 min;94 ℃变性15 s,53 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃再延伸5 min,4 ℃保存[18]。用1%的琼脂糖凝胶电泳检测PCR产物,电泳条件:将10×TAE缓冲液稀释至0.5×TAE作为电泳液,调整电压为100 V,当条带移动到距胶板边沿1 cm时(约35 min),停止电泳。使用Promega胶回收试剂盒对PCR产物进行纯化,送到生工生物工程(上海)股份有限公司测序。将测序结果在NCBI上作比对(http://blast.ncbi.nlm.nih.gov/),下载获得同属菌株的ITS和tef1序列,使用MEGA中邻接法分别构建ITS和tef1的系统发育进化树。
1.3.2 M6-5挥发性物质对香梨黑斑病菌链格孢菌的体外抑菌活性测定
采用平板对扣法,使用无菌打孔器取已培养7 d的链格孢菌饼(直径0.8 cm),接种于PDA培养基正中央。去除培养皿盖,中间放置直径10 cm的灭菌玻璃纸,将其与含链格孢菌饼的培养皿对扣在一起,用两层封口膜密封。将已培养7 d的菌株M6-5菌饼(直径0.8 cm)接种于PDA培养基培养,记为0 d,置于30 ℃恒温培养,待其生长至第5、10、15、20、25天时,取出后分别与含链格孢菌饼的培养皿对扣。对照组为培养至相同时间点的未接种M6-5的PDA培养基,置于30 ℃恒温培养7 d。每组3个重复,培养结束后观察记录结果,按式(1)计算抑制率:

1.3.3 菌株M6-5挥发性物质组成成分的测定
1.3.3.1 菌株M6-5挥发性物质的提取
将菌株M6-5接种于PDA培养基,30 ℃培养5 d。将培养基置于纯甲醇中(1∶1,g/mL)超声提取30 min,重复提取2~3次,合并提取液。使用布氏漏斗抽滤,除去菌体、收集滤液。旋转浓缩至初始体积的1/3,置于三角瓶中,加入无水硫酸钠(每10 mL浓缩液中添加1 g无水硫酸钠),4 ℃过夜。再次过滤,收集滤液。
1.3.3.2 顶空固相微萃取
参考Sun Dongdi等[19]的方法,并有所改动。称取20 g滤液样品,放入100 mL带有硅胶垫帽的顶空萃取瓶中,置于60 ℃水浴中预平衡15 min后,推出老化过的萃取头,顶空吸附40 min。取出萃取针头后进样,250 ℃解吸5 min。
1.3.3.3 GC-MS/MS分析
参考Lamanaka等[20]的方法,并有所改动。GC条件:InertCap WAX色谱柱(30 m×0.25 mm,0.25 μm);不分流进样;进样口温度250 ℃;流速1 mL/min;程序升温:初始温度35 ℃保持5 min,以3 ℃/min升至100 ℃,再以4 ℃/min升至240 ℃,保持4 min。MS条件:电子电离源;载气为氦气;离子源温度230 ℃;数据采集方式Q3扫描;扫描范围m/z45~500。
将分析所得的质谱图和NIST-17谱库中的标准图谱进行比对检索,确定匹配度高于80%的组分[21]。采用峰面积归一化法计算各组分的相对含量,进行定量分析[22]。
1.3.4 菌株M6-5产生的挥发性物质纯品对香梨黑斑病菌链格孢菌的体外抑菌活性测定
用无菌打孔器取已培养7 d的链格孢菌饼(直径0.8 cm),接种于PDA培养基正中央。在另一个培养皿中加入一个已灭菌的2 mL离心管盖,用移液枪分别移取3.125、6.25、12.5、25.0、50.0、100.0 μL液体主要挥发性物质纯品(6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯、苯乙醇)至离心管盖中。培养皿体积为80 mL,扣除PDA培养基占用体积20 mL,对扣后培养皿的体积为140 mL,对应挥发物纯品含量分别为22.32、44.64、89.28、178.57、357.14、714.28 μL/L。对照组中离心管盖不添加挥发物纯品。去除培养皿盖后,迅速对扣好,用两层封口膜封住培养皿边缘。置于30 ℃培养10 d后,采用十字交叉法测量处理组和空白对照组菌落直径。每组3个重复,按式(1)计算抑制率。
1.3.5 菌株M6-5产生的挥发性物质对香梨黑斑病菌链格孢菌的体内抑菌活性测定
挑选成熟度一致(八成熟)、大小均一、无病虫害的库尔勒香梨,使用3%过氧化氢溶液对香梨表面进行消毒,晾干备用。干燥器隔板下方放置两个生长至5 d的菌株M6-5培养皿,去除皿盖后用玻璃纸封住表面,以排除菌株M6-5孢子和菌丝的影响。对照组为生长至5 d的PDA培养皿。采用打孔器在香梨果实赤道部位打一个直径0.8 cm、深度0.5 cm的孔;同时将生长7 d的链格孢菌打孔,取菌饼朝外放置于香梨预先打孔位置,然后放在干燥器(直径300 mm)隔板上方,7 d后观察并测定果实的病斑直径。每个处理组30个果实,每组3个重复。
1.4 数据处理
采用SPSS 20软件的Duncan多重比较检验法进行差异显著性分析(P<0.05,差异显著),Excel绘制图表,MEGA 7.0软件构建系统发育树。
2 结果与分析
2.1 菌株M6-5形态与分子生物学鉴定
菌株M6-5在PDA培养基上生长较快,3 d即可长满全皿。初期在培养基表面形成白色致密的菌丝,生长7 d后,菌落表面逐渐产生白色点状物,呈绒毛状(图1A),带有明显的椰子香气,背面为明显的黄色。由图1B~D可知,分生孢子梗大小为10.1~22.3 μm×2.2~4.3 μm,多为2个一组,由菌丝不规则伸出,分枝简单,互生呈树枝状排列,其基部缢缩,中间膨大,顶部变细;分生孢子为卵圆形,大小为3.5~5.9 μm×3.0~4.0 μm;厚垣孢子为圆形或椭圆形,大小为7.0~12.1 μm×5.2~12.2 μm。
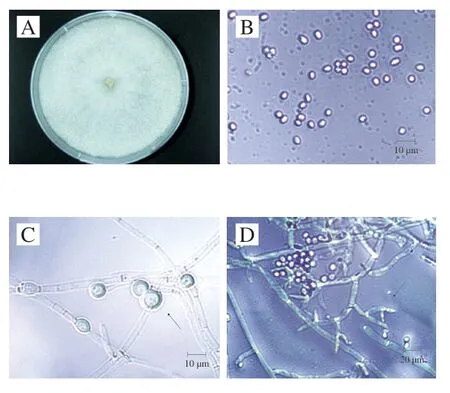
图1 菌株M6-5形态特征菌落图(A)、显微镜下分生孢子形态图(B)、厚垣孢子形态图(C)和分生孢子梗形态图(D)Fig. 1 Morphological characteristics of colonies (A), microscopic conidium morphology (B), chlamydospore morphology (C) and conidium stem morphology (D) of strain M6-5
菌株M6-5的ITS序列长度为609 bp,将序列提交至GenBank数据库,登录号为MZ930280.1。在NCBI数据库中进行BLAST比对,与Trichoderma erinaceum(NR_111837.1)和T. erinaceum(DQ083009.1)序列相似性最大,达99.33%。选取同源性较高的序列构建ITS系统发育树(图2),菌株M6-5与T. erinaceum(NR_111837.1)和T. erinaceum(DQ083009.1)亲缘关系最近,归属于猬木霉(T. erinaceum)。菌株M6-5的tef1序列长度为912 bp,将序列提交至GenBank数据库,登录号为OK324541。在NCBI数据库中进行BLAST比对,与T. erinaceum(AY750880.1)序列相似性最大达99.27%。选取同源性较高的序列构建tef1系统发育树(图3),菌株M6-5与T. erinaceum(AY750880.1)亲缘关系最近,支持度bootstrap值达100%,归属于猬木霉。菌株M6-5的ITS序列与tef1序列系统发育树结果一致,均为猬木霉。
综上所述,结合形态学特征和分子生物学结果可以确定菌株M6-5为猬木霉。

图2 基于ITS序列的M6-5菌株的系统发育进化树Fig. 2 Phylogenetic tree of strain M6-5 based on ITS sequence analysis
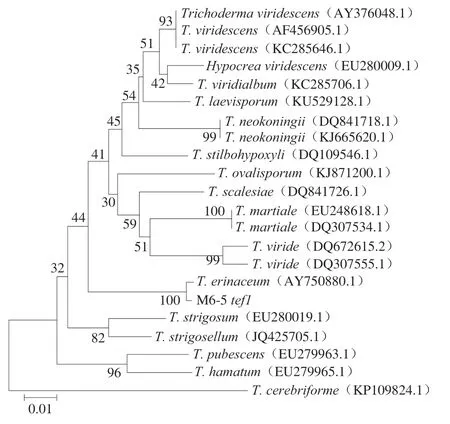
图3 基于tef1序列的M6-5菌株的系统发育进化树Fig. 3 Phylogenetic tree of strain M6-5 based on tef1 sequence analysis
2.2 不同生长时期的菌株M6-5挥发性物质对香梨黑斑病菌链格孢菌的体外抑菌活性分析
由图4可知,随着生长时期的延长,菌株M6-5产生的挥发性物质对链格孢菌的抑菌活性呈现先上升后下降的趋势。培养第5天时,菌株M6-5产生的挥发性物质对链格孢菌的抑菌作用最强,抑菌率达(82.48±1.17)%,显著高于其他生长时期(P<0.05);培养5 d后,菌株M6-5产生的挥发性物质对链格孢菌的抑制率逐渐减弱,培养5~10 d,菌株M6-5产生的挥发性物质对链格孢菌的抑菌率维持在较高水平;而培养第25天时,菌株M6-5产生的挥发性物质对链格孢菌已无抑制效果(图5),由此可以得出菌株M6-5产生的挥发性物质对链格孢菌的抑菌作用持续时间为20 d。综上,生长5 d的菌株M6-5挥发性物质对香梨黑斑病菌链格孢菌的体外抑菌活性最强,应用于后续实验中。
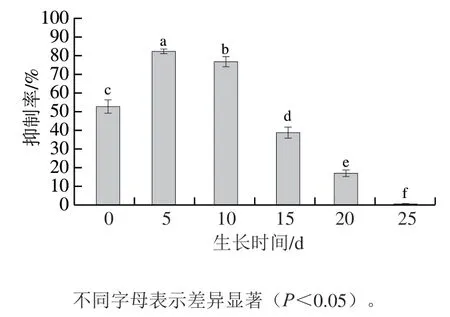
图4 不同生长时期的菌株M6-5对香梨黑斑病菌链格孢菌的抑制率Fig. 4 Inhibition percentage of M6-5 at different growth stages on A. alternata
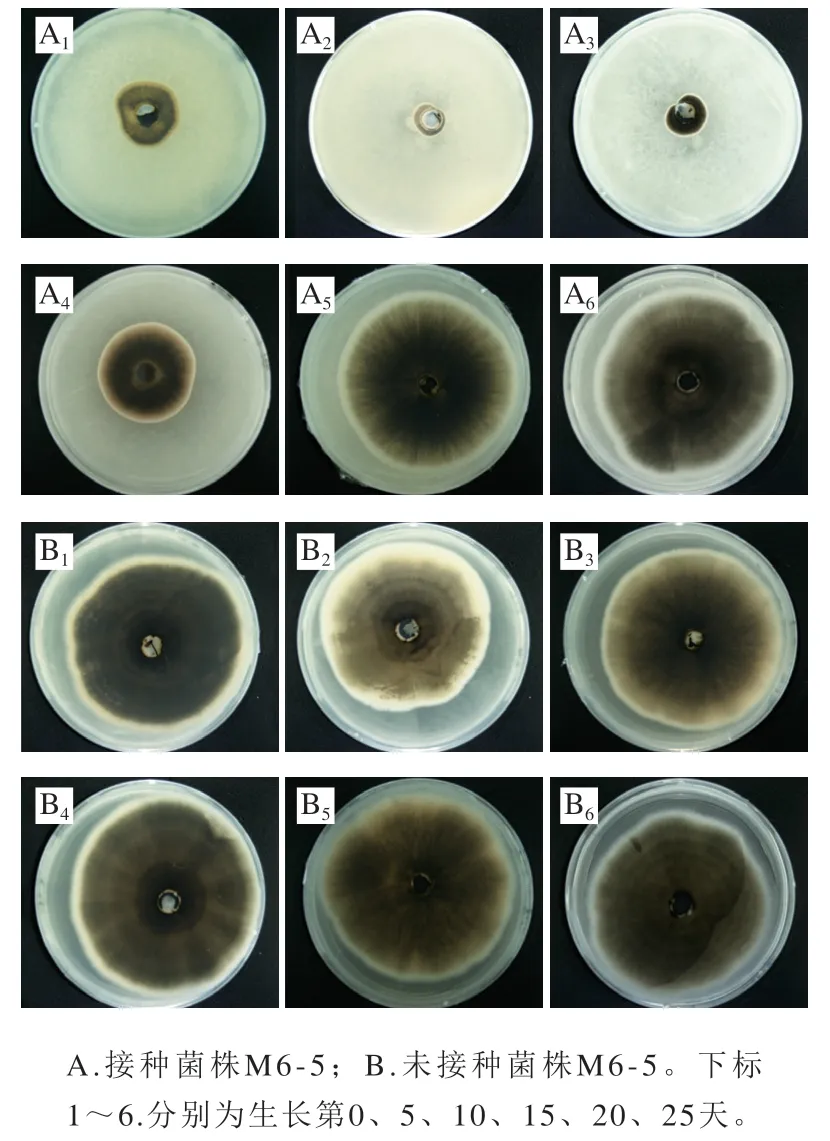
图5 不同生长时期的M6-5对香梨黑斑病菌链格孢菌的抑制效果Fig. 5 Inhibitory effect of M6-5 at different growth stages on A. alternata
2.3 菌株M6-5挥发性物质组成成分分析
如表1所示,检测到菌株M6-5共产生了65种挥发性物质,其中主要组分为6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯、苯乙醇、2-烯丙基呋喃、棕榈酸甲酯等,分别占挥发性物质总量的40.12%、6.49%、4.38%、4.13%和3.48%。
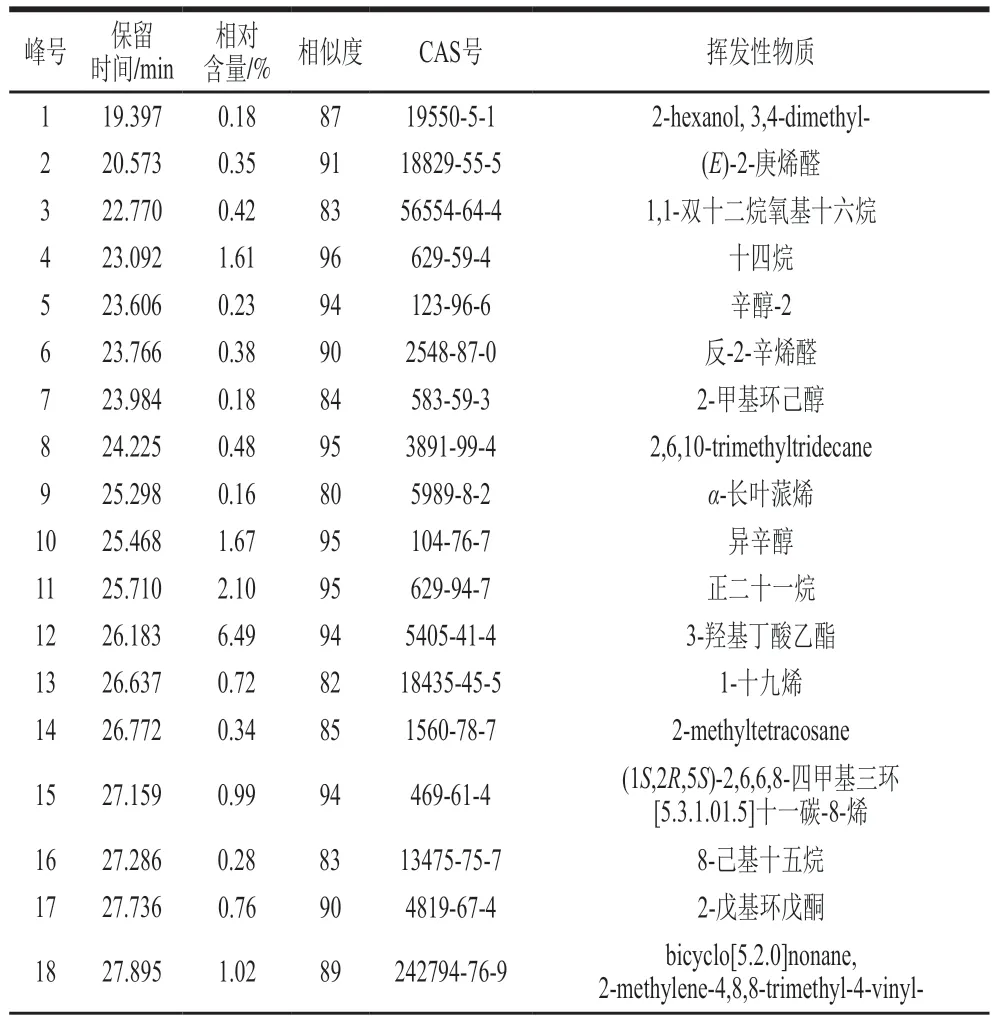
表1 菌株M6-5挥发性物质组成成分的GC-MS/MS鉴定Table 1 GC-MS/MS identification of volatile components from strain M6-5
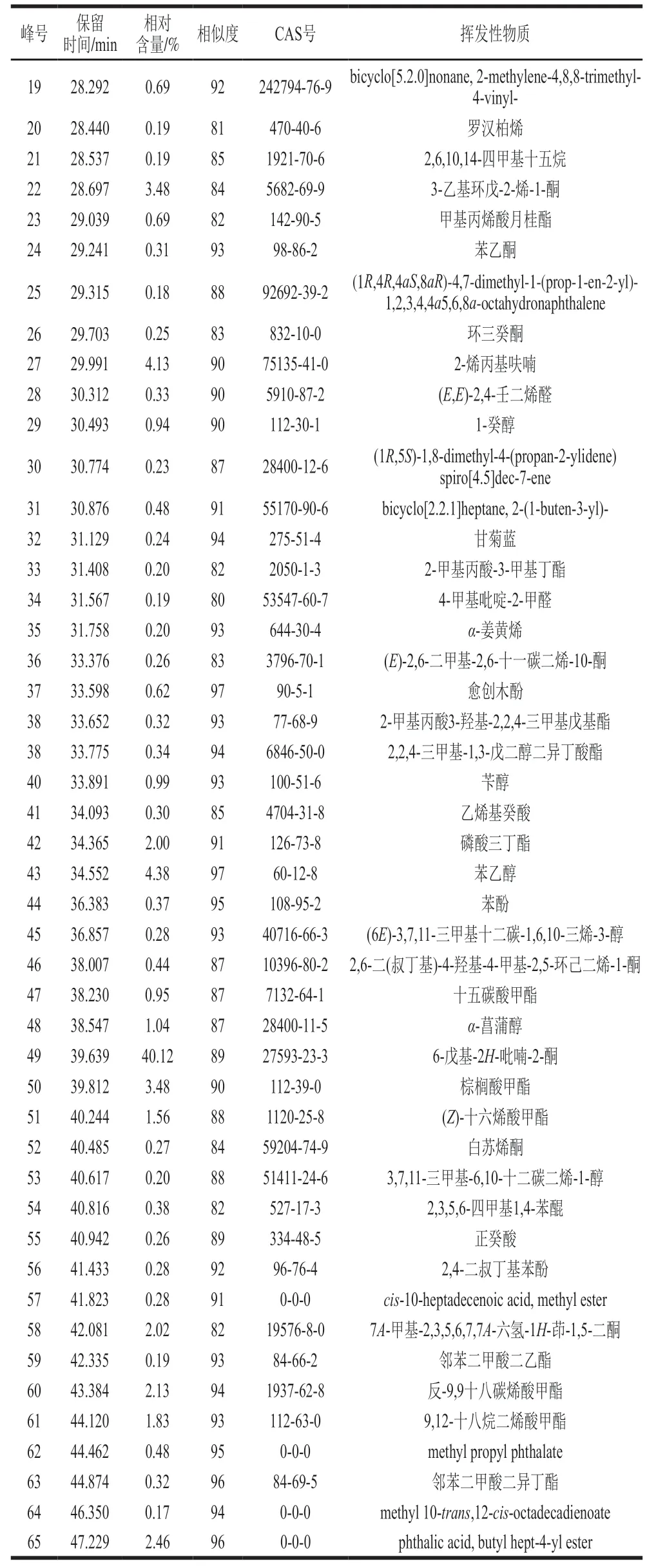
续表1
2.4 菌株M6-5产生的挥发性物质纯品对香梨黑斑病菌链格孢菌的体外抑菌活性分析
通过平板对扣检测不同含量的3种主要挥发性物质纯品(6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯和苯乙醇)对香梨黑斑病菌链格孢菌的抑制率。由表2可知,6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯、苯乙醇均对链格孢菌具有一定抑制作用,且表现出浓度依赖效应,即随着挥发性物质纯品含量的升高,抑制率也呈现升高的趋势。6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯、苯乙醇含量为714.28 μL/L时,抑制率分别为(21.27±0.60)%、(41.43±2.36)%、(50.23±1.07)%。由图6可知,使用714.28 μL/L的3-羟基丁酸乙酯与苯乙醇组合处理后,抑制率为(69.38±2.42)%。

表2 不同含量挥发性物质纯品对香梨黑斑病菌链格孢菌的抑制率Table 2 Inhibition percentages of volatile substances purified from a culture of M6-5 at different concentrations on A. alternata %
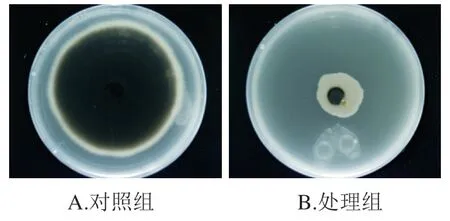
图6 714.28 μL/L 3-羟基丁酸乙酯与苯乙醇对香梨黑斑病菌链格孢菌的抑制效果Fig. 6 Inhibitory effect of 714.28 μL/L ethyl 3-hydroxybutyrate and phenylethanol on A. alternata
2.5 菌株M6-5产生的挥发性物质对香梨黑斑病菌的体内抑菌效果分析
如图7所示,熏蒸7 d后,通过测量得到处理组果实的病斑直径为(1.45±0.06)cm,对照组的病斑直径为(2.53±0.08)cm,处理组较对照组的病斑直径降低了(42.46±4.44)%,说明体内条件下,菌株M6-5产生的挥发性物质对香梨黑斑病具有一定的抑制效果。

图7 菌株M6-5产生的挥发性物质对香梨黑斑病的体内抑制效果Fig. 7 Inhibitory effect of volatile substances produced by strain M6-5 on black spot of Korla fragrant pear
3 讨论与结论
木霉是一类资源丰富且在植物病害生物防治中应用较为广泛的生防真菌[23],对木霉的准确鉴定是对其进行资源利用及开发的基础,绝大部分菌株都能通过ITS序列确定种类,而对于具有相同ITS等位片段的木霉菌株,需要通过tef1序列才能区分出来,对于极少数菌株,还需要借助rpb2序列的分析[24-25]。本研究中使用ITS(ITS1和ITS4)序列及tef1序列鉴定,并分别构建了系统发育树,结果表明均归属于猬木霉,结合形态学观察与文献中的比对[26-28],将菌株M6-5鉴定为猬木霉。
微生物挥发性物质的释放是一个动态过程,挥发性物质的成分和含量等因为培养基种类(如碳源、氮源、无机盐等)及培养条件(如温度、pH值、培养时间等)的不同而变化[29-30],其抑菌效果也会受到影响[31-32]。经不同生长时期的菌株M6-5熏蒸后,链格孢菌的受抑制效果呈现先增强后减弱,最后无抑制作用,其中生长至5 d的M6-5平板对扣后对链格孢菌的抑制率达到最高,推测其在生长第5天含有高效抑菌成分。随着培养时间的延长,链霉菌TD-1产生的挥发性物质对灰霉病菌的抑制作用呈现出先上升后下降的趋势,当培养至第8天时,链霉菌TD-1产生的挥发性物质对灰霉病菌抑菌作用最强,而后抑菌率逐渐减弱[33],与本研究结果一致。说明拮抗微生物产生的挥发性物质的抑菌效果会随着生长时间逐渐减弱,需要选择最佳产抑菌挥发性物质的时间。
菌株M6-5对链格孢菌的抑菌作用持续期为20 d,目前文献中对拮抗微生物产抑菌挥发性物质持续期的研究甚少。产香真菌GS-1产生的挥发性物质释放量在第12天达到最大[34],将接种灰霉菌的番茄果实置于该菌培养至第14天的容器中,结果表明熏蒸3 d后防效为53.62%[35]。本研究中将培养至第5天的猬木霉M6-5用于库尔勒香梨黑斑病的防治,与对照组相比,处理组显著降低了果实的病斑直径。已有研究表明木霉的挥发性物质在果实采后病害防治中取得了良好的效果,刺孢木霉产生的挥发性物质能够防治甜瓜果实采后镰刀菌病害[36],经熏蒸处理后,较对照组的病斑直径降低了0.5 cm。
6-戊基-2H-吡喃-2-酮是木霉中研究最为广泛的抑菌挥发性物质[37],具有“椰子香气”,这也是菌株M6-5的产香特征,虽然6-戊基-2H-吡喃-2-酮在M6-5中挥发性物质总量占比最大,对链格孢菌的抑菌效果却不是最好的,当含量为714.28 μL/L时抑制率显著低于3-羟基丁酸乙酯和苯乙醇。说明就链格孢菌而言,挥发性物质的含量与其抑制效果并不一定呈正比。有类似研究结果显示,2-壬醇在解淀粉芽孢杆菌XJ5的挥发性物质中峰面积占比仅0.77%,但对苹果褐腐病菌(Monilinia fructigena)的半最大效应浓度值却最小,为3.43 µg/mL[38]。
3-羟基丁酸乙酯是本研究中首次发现的具有抑制作用的挥发性物质,尚未查询到关于3-羟基丁酸乙酯抑菌的文献,且3-羟基丁酸乙酯与苯乙醇联合处理优于单独使用对链格孢菌的抑菌效果。表明3-羟基丁酸乙酯存在与其他挥发性物质组合产生协同增效抑菌作用的潜力。研究表明苯乙醇对果实采后病原菌具有较好的抑菌效果,方静凡[39]使用4%苯乙醇溶液处理柑橘可以延缓其青霉病的发生时间。苯乙醇也能与其他抑菌剂组合使用[40]。
本研究仅对购买到的6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯和苯乙醇3种挥发性物质纯品开展了对链格孢菌的抑菌实验,而没有将含量超过1%的其他挥发性物质进行检测,可能还存在对链格孢菌具有较好抑制作用的挥发性物质,下一步需要考虑相关实验。6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯和苯乙醇均为食品用香料,能安全用于果实采后贮藏保鲜,因此后续将开展它们在体外对链格孢菌的抑制机理研究,包括对菌丝和孢子的影响,对菌丝体细胞膜和细胞壁的影响,以及对果实病害的抑制效果,这将为挥发性物质在果实采后病害防治提供一定理论依据。
综上所述,猬木霉M6-5在培养至第5天时可产生主要抑菌挥发性物质——6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯和苯乙醇,当这些物质含量为714.28 μL/L时,可显著抑制链格孢菌的生长。6-戊基-2H-吡喃-2-酮、3-羟基丁酸乙酯和苯乙醇作为食品用香料,能安全用于库尔勒香梨果实采后贮藏保鲜。
