构建氯化血红素/G-四链体DNA酶比色生物传感器检测食品中苏丹红
2022-12-22卢春霞闫圣坤刘成江林祥群王双慧冯晓汀
卢春霞,闫圣坤,刘成江,林祥群,王双慧,冯晓汀
(1.长江师范学院现代农业与生物工程学院,重庆 408100;2.新疆农业科学院农业机械化研究所,新疆 乌鲁木齐 830091;3.新疆农垦科学院农产品加工研究所,新疆 石河子 832000;4.新疆石河子职业技术学院,新疆 石河子 832000)
苏丹红是一种人工合成的亲脂类偶氮染料,主要包括苏丹红I、II、III、IV 4种类型。由于其增色效应显著,常被作为非法添加剂用于改良番茄、辣椒等产品外观,直接或间接危害人体健康。苏丹红被国际癌症研究机构列为三类致癌物,其中苏丹红III的初级代谢产物4-氨基偶氮苯被列为二类致癌物[1]。我国及欧盟严禁将苏丹红作为色素添加剂在食品和饲料中使用。除了人为添加,一些农产品在生产过程中由于环境污染、肥料、农药和塑料包装等不规范使用以及一些不明因素,导致其一定程度上受到苏丹红交叉污染[2]。因此,准确、灵敏、快速地检测食品中苏丹红染料的方法对食品安全监管有着十分重要意义。
目前,苏丹红检测方法主要包括仪器分析方法,如高效液相色谱法[3]、液相色谱-质谱联用等技术[4]。色谱与质谱技术灵敏度较高、结果可靠,但样品预处理复杂、检测成本高、有机溶剂用量大、且仪器设备昂贵,需要专业的操作人员。免疫分析方法[5]是应用较为广泛的快筛检测方法,与仪器分析法相比具有特异性强、操作简单、灵敏度高等优点,但抗体制备周期长,成本较高。
核酸适配体是与靶分子特异性结合的一段单链DNA或RNA,由指数富集配体系统进化技术从随机单链寡核苷酸库中筛选获得。适配体与靶标结合时可折叠成发夹、茎环、假结体及G-四链体等结构,通过氢键、范德华力和碱基堆积等作用进行分子识别。基于随机文库的庞大库容和单链核苷酸空间结构的多样性,适配体几乎可以与所有种类的靶标[6-12]发生结合。与传统的抗体相比,核酸适配体具有不受免疫原限制、可人工合成、成本低廉、应用范围广、易于标记和保存等优点。因此,适配体作为新型识别探针在食品分析领域得到广泛研究和应用[13-15]。
在常规比色检测中,纳米材料和生物酶常作为发光信号标记在识别探针上。但是这种标记方法耗时耗力,且天然酶成本高,对保存环境要求高。血红素/G-四链体DNA酶则是近年来迅速发展起来的一种人工合成的DNA酶。富含鸟嘌呤碱基(G)的DNA序列通过氢键作用折叠成特殊的G-四链体结构,当与氯化血红素结合后,形成一种具有过氧化物酶活性的DNA酶,能催化H2O2氧化3,3',5,5'-四甲基联苯胺(tetramethylbenzidine,TMB)或2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸二胺盐(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS),生成蓝色TMB+或绿色ABTS阳离子自由基。与天然酶相比,该酶热稳定性高、价格便宜、合成简单、易于标记,被广泛应用于生物传感器领域[16]。由于食品样品成分复杂、干扰大,基质效应可能影响检测灵敏度。为实现对靶标的高灵敏检,有研究者将G-四链体DNA酶与杂交链式反应(hybridization chain reaction,HCR)相结合,构建生物传感器应用于生物标记物、微生物、毒素、金属离子等检测[17-18]。但目前尚未见到基于适配体识别-氯化血红素/G-四链体DNA酶检测苏丹红的研究报道。
本研究以苏丹红III适配体为识别元件,以氯化血红素/G-四链体DNA酶为信号探针,结合HCR信号放大策略构建一种比色生物传感器。检测原理如图1所示,该传感器由一个检测探针和两个发夹DNA探针(H1和H2)组成,检测探针由苏丹红III适配体序列、触发HCR反应的启动序列,以及与适配体互补的序列组成,H1和H2包括非活性构型的G-四链体序列作为功能元件。无靶标时,检测探针形成发夹折叠结构,无法引发HCR反应,当靶标结合适配体后打开检测探针引发HCR反应,生成大量富G-四链体的双链DNA纳米线,加入血红素后,形成具有过氧化物酶活性的氯化血红素/G-四链体DNA酶,催化H2O2氧化底物并显色。构建的传感器可用于简单、灵敏、快速地进行苏丹红比色检测,为食品中苏丹红的检测提供一定的技术支撑。

图1 基于氯化血红素/G-四链体DNA酶比色测定苏丹红示意图Fig. 1 Schematic illustration of colorimetric detection of Sudan based on hemin/G-quadruplex DNAzymes
1 材料与方法
1.1 材料与试剂
火锅料、辣椒酱、辣椒粉均购于本地超市。
苏丹红I(CAS号842-07-9)、苏丹红II(CAS号3118-97-6)、苏丹红III(CAS号85-86-9)、苏丹红IV(CAS号85-83-6)、对位红(CAS号6410-10-2)、日落黄(CAS号2783-94-0)标准品 上海安谱实验科技股份有限公司;牛血清白蛋白、二甲基亚砜、氯化血红素、吐温-20、TMB显色试剂盒、HgCl2、Pb(NO)2、CdCl2、AgNO3生工生物工程(上海)股份有限公司;链霉亲和素包被的酶标板 苏州海狸生物医学工程有限公司;其余常规试剂均为国产分析纯。实验用水为超纯水(电阻率≥18.2 MΩ·cm)。
用乙腈将苏丹红配制成质量浓度为100 μg/mL的苏丹红原液,置于-20 ℃避光保存。使用时用pH 7.4磷酸盐缓冲液(phosphate buffer saline,PBS)(含8 g NaCl、0.2 g KCl、0.24 g KH2PO4、1.44 g Na2HPO)稀释苏丹红原液至所需的质量浓度。
将氯化血红素溶于二甲基亚砜中配制成5 mmol/L的氯化血红素原液,置于4 ℃避光保存。使用时用PBS稀释至所需浓度。
生物素化检测探针由苏丹红III核酸适配体[19]和触发HCR反应的启动序列组成;发夹DNA探针在5'(或3')和3'(或5')端分别含有3/4和1/4的G-四链体序列[20];探针均由生工生物工程(上海)股份有限公司合成,其碱基序列见表1。

表1 检测探针及发夹DNA探针序列Table 1 Sequences of the detection probe and hairpin DNA probes
1.2 仪器与设备
5MX 96 孔板混匀仪 美国赛洛捷克公司;Mk3酶标仪 美国赛默飞世尔科技公司;MS3 basic涡旋混合器德国IKA公司;Milli-QReference超纯水系统 美国密理博公司;5424R台式冷冻离心机 德国艾本德公司。
1.3 方法
1.3.1 氯化血红素/G-四链体DNA酶比色生物传感器测定苏丹红III
链霉亲和素包被的酶标板使用前用PBST溶液(0.05%吐温-20+PBS)洗涤3次,加入100 μL 80 nmol/L生物素化检测探针,室温孵育20 min。PBST溶液洗涤3次,加入质量分数为5%的牛血清白蛋白溶液,封闭2 h,PBST洗涤后备用。将100 μL一定质量浓度的苏丹红III标准品加入到酶标板,室温孵育30 min,PBST洗涤。H1和H2使用前于95 ℃加热5 min,然后缓慢冷却至室温。分别向酶标板中加入50 μL 400 nmol/L的H1和H2,37 ℃孵育60 min。PBST洗涤后加入100 μL 0.8 μmol/L氯化血红素,室温孵育30 min。PBST洗涤,加入100 μL TMB底物(含H2O2),室温孵育5~8 min后,加入100 μL 1 mol/L HCl溶液停止反应。通过颜色变化定性检测苏丹红,用酶标仪在450 nm波长处测定吸光度。pH 7.4 PBS设置为空白对照。
1.3.2 检测条件优化
采用单因素优化试验分别优化检测探针浓度、靶标与适配体结合时间、H1和H2浓度、HCR反应时间、氯化血红素浓度、氯化血红素/G-四链体反应时间的实验条件。均以苏丹红III为待测靶标,固定其质量浓度为100 ng/mL。
1.3.2.1 检测探针浓度优化
固定适配体与靶标结合时间50 min,发夹探针H1和H2浓度均为600 nmol/L、HCR反应时间2 h,氯化血红素浓度为1.5 μmol/L,氯化血红素和G-四链体反应时间为60 min,设置检测探针浓度分别为20、40、80、100、150、200 nmol/L,采用1.3.1节方法进行检测,考察检测探针浓度对检测性能的影响。
1.3.2.2 靶标与适配体结合时间优化
采用上述优化条件,固定发夹探针H1和H2浓度均为600 nmol/L、HCR反应时间为2 h,氯化血红素浓度为1.5 μmol/L,氯化血红素和G-四链体反应时间为60 min,设置适配体与靶标结合时间分别为10、20、30、60、100 min,采用1.3.1节方法进行检测。
1.3.2.3 发夹探针浓度优化
采用上述优化条件,固定HCR反应时间2 h,氯化血红素浓度为1.5 μmol/L,氯化血红素和G-四链体反应时间为60 min,设置发夹探针H1和H2浓度分别为50、100、200、400、600、800 nmol/L,采用1.3.1节方法进行检测。
1.3.2.4 HCR反应时间
采用上述优化条件,固定氯化血红素浓度为1.5 μmol/L,氯化血红素和G-四链体反应时间为60 min,设置HCR反应时间分别为30、60、90、120、150 min,采用1.3.1节方法进行检测。
1.3.2.5 氯化血红素浓度优化
采用上述优化条件,固定氯化血红素和G-四链体反应时间为60 min,设置氯化血红素浓度分别为0.4、0.6、0.8、1.0、1.5、2.0 μmol/L,采用1.3.1节方法进行检测。
1.3.2.6 氯化血红素和G-四链体反应时间优化
采用上述优化条件,设置氯化血红素和G-四链体反应时间分别为10、30、60、90、120 min,采用1.3.1节方法进行检测。
1.3.3 重金属离子对氯化血红素/G-四链体DNA酶比色生物传感器检测的干扰测定
采用1.3.2节中优化的实验条件,将相同浓度(1 μmol/L)的Hg2+、Ag+、Pb2+、Cd2+、Cu2+分别添加到苏丹红III溶液中,按照1.3.1节方法进行检测,测定重金属离子对该方法的干扰程度。
1.3.4 氯化血红素/G-四链体DNA酶比色生物传感器检测性能测定
1.3.4.1 灵敏度测定
在优化条件下,用pH 7.4 PBS将苏丹红III标准溶液稀释系列梯度质量浓度(0、0.1、0.5、1、5、10、50、250 ng/mL),用1.3.1节方法进行检测,观察溶液颜色变化,在450 nm波长处测定吸光度。以苏丹红III质量浓度的对数为横坐标,吸光度为纵坐标,绘制标准曲线,进行线性拟合,得到线性方程和相关系数,计算方法的检测限(limits of detection,LOD):
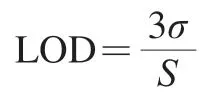
式中:σ为空白对照检测10次的平均标准偏差;S为斜率。
1.3.4.2 特异性测定
采用1.3.1节的方法检测相同质量浓度(100 ng/mL)的苏丹红I、苏丹红II、苏丹红IV、对位红、日落黄标准品,同时设PBS为空白对照。观察溶液颜色变化,在450 nm波长处测定吸光度。
1.3.4.3 实际样品测定
参考GB/T 19681—2005《食品中苏丹红染料的检测方法 高效液相色谱法》[21]对样品进行前处理,称取2 g辣椒酱、辣酱粉、番茄酱样品(精确到0.001 g),分别添加高、中、低3种水平的苏丹红III标准溶液,使加标含量分别为5、50、200 ng/g。然后加入10 mL正己烷,振荡混匀,超声提取10 min,以5 000 r/min离心5 min。移取正己烷层,残渣用正己烷重复提取1次,合并两次上清液。氮吹仪浓缩上清液,乙腈定容至1 mL,用PBS稀释5 倍后采用1.3.1节的方法进行检测,计算加标回收率和相对标准偏差(relative standard deviation,RSD)。同时采用GB/T 19681—2005[21]对样品进行检测,并对两种方法的检测结果进行比较。
1.4 数据处理
2 结果与分析
2.1 氯化血红素/G-四链体DNA酶比色生物传感器检测条件优化
如图2A所示,吸光度随着检测探针浓度的增加而增加,当浓度超过80 nmol/L后,吸光度无显著变化(P>0.05),故检测探针最佳浓度为80 nmol/L。如图2B所示,吸光度随着结合时间的延长而增大,当结合时间大于30 min后,吸光度无显著变化(P>0.05),意味着反应基本达到饱和状态。因此,后续实验选择靶标与适配体的结合时间为30 min。如图2C所示,当H1和H2浓度均达到400 nmol/L后,吸光度无显著变化(P>0.05),可能是由于H1和H2浓度过大产生了空间位阻,影响了杂交链的进一步形成。HCR反应时间过短会影响检测灵敏度,但时间过长则会影响检测效率,图2D表明,当时间超过60 min后,吸光度无显著变化(P>0.05),说明反应达到饱和状态,故HCR反应时间选择60 min。由图2E和F可知,氯化血红素最佳浓度为0.8 μmol/L,氯化血红素和G-四链体最佳反应时间为30 min。


图2 不同实验条件对苏丹红III检测的影响Fig. 2 Effects of different experimental conditions on the detection of Sudan III
2.2 重金属离子对氯化血红素/G-四链体DNA酶比色生物传感器检测的干扰分析
一些金属离子可选择性地与DNA双链中的碱基结合,形成金属介导的碱基对。研究证明一些金属离子能促进或阻碍氯化血红素/G-四链体DNA酶的形成,进而影响DNA酶活性[22-27]。从图3可以看出,金属离子对溶液的吸光度无显著影响,主要原因可能与设计的探针序列及功能不同有关,基于氯化血红素/G-四链体DNA酶测定重金属离子的传感器,大都依赖于设计富含特定碱基的功能序列识别重金属离子来完成检测[22-26]。比如,利用Ag+通过C-Ag+-C配位键促进氯化血红素/G-四链体DNA酶活性以实现Ag+检测[22]。利用Hg2+与T碱基特异性结合原理,通过形成T-Hg2+-T结构抑制或促进该DNA酶活性实现Hg2+的检测[23-25]。而本实验所用探针(H1和H2)并不是针对重金属离子设计的功能探针,在形成G-四链体结构时,无法形成错配的双链结构。所以,重金属离子对DNA酶的活性影响不大。
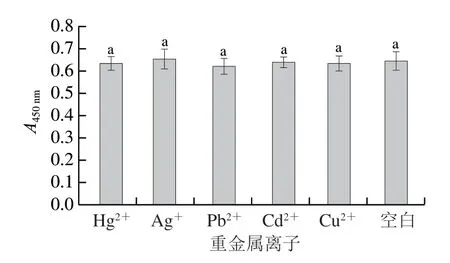
图3 重金属离子对氯化血红素/G-四链体DNA酶比色生物传感器的影响Fig. 3 Effect of heavy metal ions on the colorimetric biosensor based on hemin/G-quadruplex DNAzymes
2.3 氯化血红素/G-四链体DNA酶比色生物传感器检测性能分析
2.3.1 灵敏度分析
如图4A所示,当苏丹红III质量浓度为0.5 ng/mL时,肉眼可见明显的颜色变化,因此,该方法可视化LOD为0.5 ng/mL。由图4B可知,吸光度随着苏丹红III质量浓度的增加而增加,苏丹红III在0.5~250 ng/mL范围内呈良好线性关系(R=0.995),LOD为0.09 ng/mL。由表2可知,与GB/T 19681—2005方法[21]和文献的苏丹红检测方法相比,本研究建立的方法具有高灵敏度。

图4 不同苏丹红III质量浓度下的检测体系颜色(A)与吸光度(B)变化Fig. 4 Changes in the detection system’s color (A) and absorbance value (B) versus concentrations of Sudan III

表2 苏丹红检测方法比较Table 2 Comparison of reported methods for the detection of Sudan dyes
2.3.2 特异性分析
如图5所示,当检测体系中含有质量浓度为100 ng/mL的苏丹红I~IV时,溶液在450 nm波长处的吸光度达到0.47~0.62,而对位红和日落黄并未引起反应溶液颜色明显变化,其吸光度与空白样品差异不显著(P>0.05)。表明该适配体对苏丹红I~IV具有类选择性,可能是由于苏丹红I~IV结构高度相似,这对检测一类结构相似的靶标时可能更有应用意义。然而Wang Ying等[19]的特异性分析结果显示,苏丹红III适配体与苏丹红I、II和IV没有明显交叉反应,具体原因有待进一步研究。

图5 氯化血红素/G-四链体DNA酶比色生物传感器检测苏丹红特异性评估Fig. 5 Specificity analysis of colorimetric biosensor based on hemin/G-quadruplex DNAzymes for Sudan detection
2.3.3 实际样品分析
如表3所示,本方法的加标回收率为84.3%~101.6%,RSD为4.13%~8.36%。本方法的加标回收率与GB/T 19681—2005法相比差异不显著(P>0.05),表明本方法结果准确可靠。

表3 氯化血红素/G四链体DNA酶比色生物传感器法与GB/T 19681—2005高效液相色谱法加标回收对比(n =3)Table 3 Comparison of spiked recoveries between colorimetric biosensor based on hemin/G-quadruplex DNAzymes and HPLC (n = 3)
3 结 论
以苏丹红III适配体为识别分子,以氯化血红素/G-四链体DNA酶为信号探针,结合HCR信号放大策略,构建了一种简单、新颖、高灵敏的比色生物传感器,用于检测食品中苏丹红。在优化条件下,该比色传感器方法LOD为0.09 ng/mL,加标回收率为84.3%~101.6%,RSD为4.13%~8.36%,可特异性识别苏丹红I、II、III、IV,检测结果准确可靠。与GB/T 19681—2005方法相比,本方法样品前处理简单、不需要大型仪器;与传统的免疫方法相比,不需要制备抗体,检测成本低廉,同时也可实现高通量检测;可为批量实现食品中苏丹红的快速检测提供一定技术支撑。
