贝莱斯芽孢杆菌对浓香型白酒酒醅微生物群落结构及挥发性风味物质的影响
2022-12-22李子健张玲玲罗惠波
杨 阳,李子健,2,张玲玲,王 洪,黄 丹,2,罗惠波,2,*
(1.四川轻化工大学生物工程学院,四川 自贡 643000;2.酿酒生物技术及应用四川省重点实验室,四川 自贡 643000;3.宜宾五粮液股份有限公司,四川 宜宾 644000)
浓香型白酒是中国白酒中较为典型的代表,以粮谷为原料,采用中高温大曲为糖化发酵剂,经泥窖固态发酵、蒸馏、陈酿、勾调而成。浓香型白酒生产采用的是复杂且独特的半开放、固态发酵模式[1],其中酒醅发酵过程是影响浓香型白酒酒质好坏的一个重要因素[2]。
酒醅是微生物发酵的主要载体和白酒呈香物质的直接来源[3],其微生物来源于大曲及窖泥,种类丰富,细菌和真菌属数量分别高达496种和155种,其中乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、片球菌属(Pediococcus)和醋酸杆菌属(Acetobacter)等是优势的细菌属,哈萨克斯坦酵母菌属(Kazachstania)、嗜热真菌属(Thermomyces)、酵母菌属(Saccharomyces)等为优势的真菌属[4-5]。近年来为进一步认识白酒风味物质合成的影响因素,白酒功能微生物对酿酒微生物组结构及功能的影响越来越受到关注。王鹏[6]将地衣芽孢杆菌强化后的大曲应用到窖池中,改变了酒醅微生物群落结构,显著提高了酒醅中芳香族化合物的含量。黄晓宁等[7]将优选得到的具有产淀粉酶和蛋白酶能力的地衣芽孢杆菌和枯草芽孢杆菌分别应用于清香型白酒酿造过程中,发现经过强化发酵后均出现了差异代谢物,且4-乙基-2-甲氧基苯酚、辛酸乙酯、3-甲基丁酸乙酯和四甲基吡嗪含量均显著增加。周新虎等[8]将4 株筛选得到的高产蛋白酶活性和液化酶活性的芽孢杆菌制成复合培养液应用到调味型酒的堆积和窖池发酵中,增加了酒体中杂环化合物的种类和含量。芽孢杆菌属是酒醅微生物中的重要菌属之一,能分泌水解淀粉、蛋白质、果胶等底物的酶类,促进发酵进程的顺利进行[9]。而贝莱斯芽孢杆菌(Bacillus νelezensis)是芽孢杆菌属中的一种,具有产淀粉酶、蛋白酶和纤维素酶的特性[10]。贝莱斯芽孢杆菌在白酒领域已有报道,杨斌等[11]从大曲中获得1 株具有高发酵力的贝莱斯芽孢杆菌;胡宝东等[12]从酱香型大曲中分离出了甲基营养型芽孢杆菌(现已归属于贝莱斯芽孢杆菌),因其能产高活性的中性蛋白酶、糖化酶、纤维素酶和脂肪酶等,对提高酱香型大曲的品质具有广阔的应用前景。
目前贝莱斯芽孢杆菌在酒醅微生物组中的研究还鲜有报道。因此,本研究以贝莱斯芽孢杆菌为研究对象,在实验室进行发酵实验,采用顶空固相微萃取气相色谱-质谱联用技术和扩增子测序技术,探究与未接种的对照组酒醅相比微生物群落结构的变化和挥发性风味物质的变化情况,以期提高浓香型白酒风味物质。
1 材料与方法
1.1 材料与试剂
贝莱斯芽孢杆菌FZB42由四川某酒厂中高温大曲中筛选出。本研究所用酒醅、大曲、黄水、高粱、糠壳均由四川省宜宾市某酒厂提供。
乙酸正戊酯 安捷伦科技(中国)有限公司;乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,Na2EDTA)、Na2HPO4、NaH2PO4、蜗牛酶、溶菌酶、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 生工生物工程(上海)股份有限公司;CHCl3(分析纯) 成都市科隆化学品有限公司;异丙醇 天津市津东天正精细化学试剂有限公司。
1.2 仪器与设备
LYNX 6000高速冷冻离心机 美国Thermo公司;HVE全自动高压灭菌锅 日本Hirayama公司;LS-l201生化培养箱 美国Fisher Scientific公司;50/30 μm DVB/CAR on PDMS萃取头 上海安谱实验科技股份有限公司;5975B-7890A气相色谱-质谱联用仪 安捷伦科技(中国)有限公司;ST2100 pH计 奥豪斯仪器(常州)有限公司。
1.3 方法
1.3.1 发酵实验
采用浓香型白酒生产工艺流程在实验室进行发酵。将高粱粉碎为4~6 瓣,再加入约高粱质量70%的80 ℃以上的热水,润粮4 h;将约高粱质量20%的糠壳清蒸30 min;配料时粮糟比为1∶4.5,再与清蒸后的糠壳混合均匀上甑蒸馏,蒸完酒后再蒸50 min左右,使高粱达到熟而不黏、内无生心;摊晾时泼洒高粱质量20%的50 ℃温水补充水分,摊晾至25 ℃;加入高粱质量20%的大曲、高粱质量3%的黄水,实验组加入高粱质量15%的浓度为106CFU/mL的菌液,对照组以蒸馏水补足水分,分别均匀混合后,装入灭菌冷却后的玻璃瓶中,装瓶量为0.65 kg,要求疏松程度适中且各处均匀,用封口膜封口,对照组和实验组各18 瓶。将密封好的36个玻璃瓶放入生化培养箱发酵,根据酒厂温度曲线进行温度设置,初始温度为20 ℃,以0.5 ℃/d升至23 ℃,再以2 ℃/d升至29 ℃后以1 ℃/d升至32 ℃,保持20 d,再以0.5 ℃/d的降温幅度降至26 ℃,发酵期结束,共45 d。在发酵的第0、6、12、22、32、45天取样检测,每组每次各取3 瓶进行实验。
1.3.2 酒醅风味代谢物组分析
取3 g酒醅于20 mL顶空瓶中,加入2 g NaCl、20 μL内标物(乙酸正戊酯),50 ℃平衡5 min,插入50/30 μm DVB/CAR on PDMS固相微萃取头,萃取45 min,解吸3.5 min[13]。
气相色谱条件:DB-WAX毛细管色谱柱(60 m×0.25 mm,0.25 μm);进样口温度250 ℃,不分流进样;升温程序:起始温度50 ℃,维持2 min,然后以4 ℃/min升温至230 ℃,维持5 min;氦气以1 mL/min的恒定流速用作柱载气。
质谱条件:电子电离源,电子能量70 eV,离子源温度230 ℃,四极杆温度100 ℃,恒压10 Pa,全扫描。
1.3.3 酒醅微生物DNA的提取和测序
提取酒醅总基因组DNA[14],以引物对338F(5'-ACTCCTACGGGA GGCAGCA-3')、806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌16S rRNA基因序列中的V3-V4高变区进行扩增,引物对ITS5F(5'-GGAAGTAAAAGTCGTAACAAGG-3')、ITS1R(5'-GCTG CGTTCTTCATCGATGC-3')对真菌ITS1区进行扩增。由上海美吉生物科技有限公司在Illumina MiSeq 2500平台上进行双端测序。
1.4 数据分析
按照QIIME 2标准流程对原始序列进行处理。使用DADA2对序列进行质量过滤、去噪、合并和去除嵌合体[15]。使用多样性插件计算α多样性指数。在R(version 4.0.3)的vegan(version 2.5-7)软件包中进行了物种组成分析、相似性分析(analysis of similarities,ANOSIM)。利用SIMCA-P 13软件建立偏最小二乘-判别分析(partial least squares-discriminant analysis,PLSDA)模型,对风味数据进行可视化趋势分析,并筛选差异挥发性风味化合物。利用R语言绘制层次聚类-热图和计算酒醅微生物与差异挥发性风味物质间的Spearman相关性系数,使用Cytoscape 3.7.1进行相关性网络图可视化分析。
2 结果与分析
2.1 贝莱斯芽孢杆菌对酒醅微生物α多样性的影响
由表1可知,实验组和对照组酒醅细菌群落丰富度指数Chao1具有先降低再升高的趋势,而多样性指数Shannon具有先升高再逐渐降低趋势。实验组和对照组酒醅真菌群落丰富度指数Chao1具有先升高后降低的趋势,而多样性指数Shannon呈持续增加的趋势。实验组酒醅细菌群落和真菌群落的丰富度及多样性与对照组酒醅相比没有显著差异(P>0.05)。

表1 酒醅发酵过程中实验组和对照组α多样性Table 1 α-Diversity of microbial communities in the experimental and control groups during the fermentation process
2.2 贝莱斯芽孢杆菌对酒醅微生物群落演替规律的影响
对照组和实验组酒醅发酵过程中分别共检测到107个属和152个属的细菌微生物。如图1A所示,对照组和实验组酒醅中优势细菌属(相对丰度>0.05%)为沙雷氏菌属(Serratia)、乳杆菌属(Lactobacillus)、卡氏伯克霍尔德菌属(Burkholderia-Caballeronia-Paraburkholderia)、未分类的肠杆菌属(unclassified Enterobacteriaceae)、寡养单胞菌属(Stenotrophomonas)、芽孢杆菌属(Bacillus)、醋酸杆菌属(Acetobacter)、魏斯氏菌属(Weissella)。沙雷氏菌属相对丰度在对照组酒醅0~22 d呈下降趋势,在22~45 d逐渐上升。而实验组酒醅中沙雷氏菌属相对丰度属在0~6 d呈下降趋势而在6~45 d逐渐上升。乳杆菌属相对丰度在对照组和实验组酒醅的12~22 d均呈现较高的丰度,其中对照组酒醅第22天乳杆菌属相对丰度达到75.4%。对照组酒醅与实验组酒醅中卡氏伯克霍尔德菌属、未分类的肠杆菌属、寡养单胞菌属、醋酸杆菌属、魏斯氏菌属均呈现出相似的变化规律。对照组酒醅中芽孢杆菌属相对丰度含量极低为0.06%~1.7%。而实验组酒醅中芽孢杆菌属相对丰度在0~6 d呈增长趋势,在第6天达到最大值23.9%,随后在第6~22天开始逐渐减少,第22~45天芽孢杆菌相对丰度几乎消失。ANOSIM分析表面实验组酒醅与对照组酒醅细菌群落(R=-0.077 8,P=0.802)不存在明显差异。
对照组和实验组酒醅发酵过程中分别共检测到93个和115个属的真菌微生物。如图1B所示,对照组和实验组酒醅中优势真菌属(相对丰度>0.05%)为热子囊菌属(Thermoascus)、未分类的曲霉菌属(unclassified Aspergillaceae)、嗜热真菌属(Thermomyces)、毕赤酵母属(Pichia)、曲霉菌属(Aspergillus)、威克汉姆酵母属(Wickerhamomyces)、unclassified Rozellomycota、红曲霉属(Monascus)。对照组酒醅和实验组酒醅真菌群落在发酵过程中呈现高度相似的变化过程。热子囊菌属相对丰度在对照组和实验组酒醅发酵过程中占主要地位,并且在两组中都呈现逐渐降低的趋势。嗜热真菌属在实验组酒醅和对照组酒醅的32~45 d具有较高丰度。毕赤酵母属和红曲霉属分别在对照组酒醅的第32天和第45天时达到最大丰度27%和10.3%。对照组酒醅和实验组酒醅真菌群落结构在第12天开始逐渐复杂,直到发酵过程结束。ANOSIM分析表面实验组酒醅与对照组酒醅真菌群落(R=-0.103 7,P=0.916)不存在明显差异。
复杂的微生物群落对其他物种的入侵具有一定的抵御能力——系统鲁棒性[16]。由于鲁棒性的存在微生物群落结构面对外源物种扰动时不会发生太大的改变,只会发生微小的变化[17]。贝莱斯芽孢杆菌的接种不可避免会与酒醅原微生物群落发生相互作用,导致发酵过程中微生物的相对丰度出现短暂变化。而酒醅中微生物群落认为是一种复杂的微生物集合体具有系统鲁棒性。本研究中接种贝莱斯芽孢杆菌并没有打破该生态的系统鲁棒性,因此不足以改变整个发酵过程中微生物的群落结构。贝莱斯芽孢杆菌受酸度和酒精度的影响较大[18]。酒醅的酸度和乙醇含量在发酵过程中会不断增加[6],使芽孢杆菌生长受到抑制,导致在22~45 d对照组和实验组酒醅的芽孢杆菌相对丰度接近消失。对照组和实验组酒醅真菌群落表现出极为相似的变化规律且两组群落结构无显著差异,说明贝莱斯芽孢杆菌的接种对真菌群落的影响较小。

图1 酒醅发酵过程中对照组和实验组微生物群落演替规律Fig. 1 Succession of microbial communities in the control and experimental groups during the fermentation process
2.3 贝莱斯芽孢杆菌对挥发性风味物质的影响
通过数据库比对,对照组酒醅发酵过程中的挥发性风味物质共有46种,其中酯类物质23种、醇类物质12种、酸类物质4种、酚类物质3种、醚类物质2种、酮类物质和醛类物质各1种。实验组酒醅发酵过程中的挥发性风味物质共有44种,其中酯类物质22种、醇类物质11种、酸类物质4种、酚类物质3种、醚类物质2种、酮类物质和醛类物质各1种。图2中每种成分含量用不同颜色表示,红色越深代表其含量越多,而蓝色越深代表其含量越少。在对照组和实验组酒醅发酵过程中挥发性风味物质含量较高的有己酸(D04)、己酸乙酯(A03)、乙酸(D01)、乳酸乙酯(A01)、乙酸乙酯(A08)、棕榈酸乙酯(A04)、庚酸乙酯(A05)、辛酸乙酯(A02)。其中两组酒醅挥发性风味物质含量最高的是己酸。对照组酒醅中己酸含量在发酵过程中呈平稳状态,而实验组酒醅己酸含量呈现出先增加后降低的趋势,在第12天达到最高值。己酸乙酯在两组酒醅发酵过程中都呈不断增长趋势,均在第45天达到最大值。

图2 对照组和实验组酒醅发酵过程中挥发性风味物质的热图分析Fig. 2 Heatmap analysis of volatile flavor compounds in the control and experimental groups during the fermentation process
由于酚类、醚类、酮类和醛类物质所检测到的种类和含量较少,因此将其归为其他挥发性风味物质。如图3所示,对照组和实验组酒醅中总酯、总酸、总醇及其他挥发性风味物质含量具有相同变化趋势。对照组和实验组酒醅的总酯含量在发酵过程中逐渐增加直至发酵过程结束,总酸、总醇和其他挥发性风味物质的含量在发酵过程中呈现先增加后降低的趋势。与对照组酒醅相比实验组酒醅总酯含量在12~45 d显著增加,总酸含量在6~45 d显著增加,总醇含量在第22天时显著降低随后在32~45 d显著增加,其他挥发性风味物质仅在第45天时显著增加。
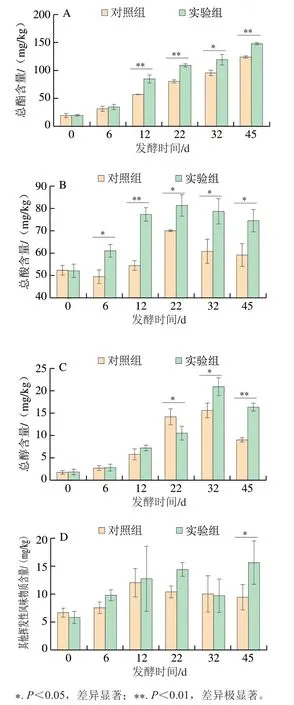
图3 对照组和实验组酒醅发酵过程中总酯(A)、总酸(B)、总醇(C)和其他挥发性风味物质(D)含量的变化情况Fig. 3 Changes in contents of total esters (A), total acids (B), total alcohols (C) and other volatile flavor substances (D) in the control and experimental groups during the fermentation process
微生物的相互作用会影响参与食品发酵的微生物的代谢行为,使得发酵培养基中的挥发性风味物质发生一定的变化[19]。因此接种贝莱斯芽孢杆菌会对原微生物群落的代谢活性产生一定的影响。酯类、酸类和醇类等香味物质是浓香型白酒中的重要风味物质,它们彼此相互协调共同构成浓香型白酒独特的风味[20]。酸类、酯类、醇类等挥发性风味物质之间会相互转化[21],因此实验组酒醅中酸类、酯类、醇类挥发性风味物质发生显著性改变可能不只是由于原微生物群落的代谢活性发生改变所导致,还可能与它们自身之间相互转化有关。酸类物质在浓香型白酒中主要起呈味和协调作用[22],更是在酒醅中作为酯类物质合成的重要前体物,因此酸类物质含量的增加不可避免会使酒醅中酯类物质含量增加。酒醅中酯类物质的形成不单是靠大曲中酯化酶以及脂肪酶作用下由酸和醇反应生成,还与微生物直接代谢有关[21,23]。因此实验组酒醅中酯类物质增加一方面可能与酸类物质增加有关,另一方面可能与贝莱斯芽孢杆菌接种后改变了原微生物群落有关。
2.4 贝莱斯芽孢杆菌影响酒醅挥发性风味物质的差异分析
为了进一步探究对照组和实验组酒醅挥发性风味物质的差异,利用SIMCA-P 13软件基于两组酒醅发酵过程中挥发性风味物质的定量结果建立了PLS-DA分类模型进行可视化分析,如图4所示。PLS-DA是基于PLS法回归的一种判别方式,因其分析有监督,预设了分组变量,可弥补主成分分析方法的不足,强化组间差异[24]。通过PLS-DA模型分析发现对照组和实验组酒醅的挥发性风味物质在第0天时无显著差异。随着发酵的进行,在第6天时开始出现差异直至发酵过程结束。模型分类良好,模型的解释变量和预测能力分别为0.809和0.647。
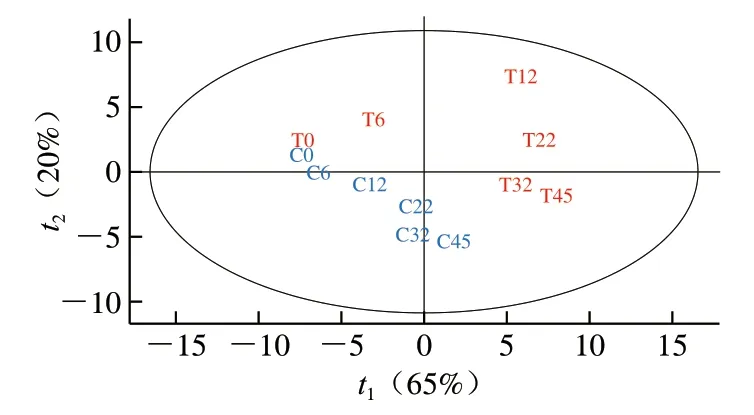
图4 对照组和实验组酒醅PLS-DA散点图Fig. 4 PLS-DA scatter plot for the control and experimental groups
变量投影重要性值(variable importance in projection,VIP)可以量化PLS-DA每个变量对分类的贡献度,是PLS-DA变量的重要性因子。如图5所示,VIP值越大,变量在两组酒醅间的差异越显著[25]。为了筛选出两组酒醅间差异的挥发性风味物质,以VIP值大于1为标准,确定了两组酒醅间有显著差异的挥发性风味物质15种,包含丁酸(VIP=1.695)、己酸(VIP=1.592)、八乙二醇(VIP=1.448)、正戊酸(VIP=1.387)、2,4-二叔丁基苯酚(VIP=1.335)、己酸己酯(VIP=1.294)、四甘醇(VIP=1.289)、乙酸丁酯(VIP=1.137)、苯酚(VIP=1.118)、15-冠醚-5(VIP=1.116)、戊酸丁酯(VIP=1.112)、糠醇(VIP=1.095)、对甲基苯酚(VIP=1.084)、庚酸乙酯(VIP=1.044)、戊酸乙酯(VIP=1.032)。与对照组酒醅相比实验组酒醅中丁酸、己酸、正戊酸、2,4-二叔丁基苯酚、己酸乙酯、苯酚、15-冠醚-5、糠醇、对甲基苯酚、庚酸乙酯、戊酸乙酯含量显著增加,而八乙二醇、四甘醇、乙酸丁酯、戊酸丁酯含量显著降低。其中丁酸、己酸、八乙二醇是差异最大的前3种挥发性风味物质。
接种贝莱斯芽孢杆菌后不会立刻改变酒醅中的挥发性风味物质,随着酒醅发酵过程的进行,实验组酒醅微生物群落及代谢活性与对照组酒醅相比发生变化,从而导致差异挥发风味物质的出现。两组中挥发性风味物质差异最大的是酯类,共有5种,占总差异挥发性风味物质的1/3,说明接种贝莱斯芽孢杆菌对酒醅酯类挥发性风味物质的影响最大。丁酸和己酸是浓香型白酒中重要的酸类物质,其中己酸是作为浓香型白酒中产窖香的主要成分之一[22],丁酸起呈味助香的作用同时还是己酸生成过程中的前提物质[26],并且它们分别是合成丁酸乙酯和己酸乙酯的重要前体物,因此实验组酒醅中己酸乙酯含量的增加与丁酸和己酸含量的增加有密切的联系。己酸乙酯是浓香型白酒中的主要特征风味物质,其含量的高低直接决定了浓香型白酒的品质[27]。
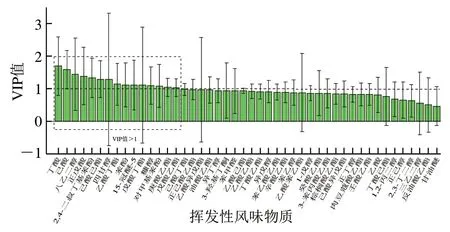
图5 对照组和实验组酒醅PLS-DA VIP值Fig. 5 PLS-DA VIP value for differential volatile flavor compounds between the control and experimental groups
2.5 酒醅微生物与差异风味物质的相关性分析
进行了基于Spearman等级相关性(|ρ|>0.5和P<0.05)的网络分析,以评估对照组和实验组酒醅微生物(相对丰度>0.05%)与差异挥发性风味物质的关系,利用Cytoscape软件绘制相关性网络图进行可视化分析。如图6A所示,对照组酒醅中有3种细菌和8种真菌表现出与差异挥发性风味物质有显著相关性(P<0.05)。魏斯氏菌属与糠醇、对甲基苯酚、2,4-二叔丁基苯酚、戊酸乙酯、庚酸乙酯呈负相关,而相对丰度较高的沙雷氏菌属仅与戊酸丁酯呈负相关。红曲霉属和曲霉菌属与对甲基苯酚,2,4-二叔丁基苯酚,戊酸乙酯,庚酸乙酯呈正相关,此外红曲霉属还与糠醇、苯酚呈正相关。而热子囊菌属却与对甲基苯酚、2,4-二叔丁基苯酚、戊酸乙酯、庚酸乙酯呈负相关。毕赤酵母属与戊酸乙酯、庚酸乙酯、乙酸丁酯呈正相关。如图6B所示,实验组酒醅中有4种细菌和6种真菌表现出与差异挥发性风味物质有显著相关性(P<0.05)。乳杆菌属与2,4-二叔丁基苯酚、对甲基苯酚、苯酚、己酸呈正相关。而未分类的肠杆菌属与对甲基苯酚、苯酚、己酸呈负相关。在实验组酒醅中红曲霉属仅与乙酸丁酯呈正相关,毕赤酵母属和威克汉姆酵母属仅与己酸乙酯呈正相关。而芽孢杆菌属在实验组酒醅中仅与己酸乙酯呈负相关。同时,与己酸乙酯呈负相关的还有热子囊菌属和魏斯氏菌属。
在对照组酒醅中红曲霉属是与差异挥发性风味物质具有最多相关性的微生物。曲霉菌属和红曲霉菌属是酒醅中重要的功能微生物,它们可代谢产生对白酒酿造过程中至关重要的糖化酶和酯化酶等[9,28],而酯化酶能催化酸类和醇类合成酯类物质,因此在两组酒醅中曲霉菌属和红曲霉菌属均表现出与酯类差异性挥发风味物质呈显著正相关。然而,在实验组酒醅中,乳杆菌属与差异挥发性风味物质具有最多相关性。这一结果也表现出贝莱斯芽孢杆菌的生物扰动会改变微生物的原位代谢活性。乳杆菌属能代谢产生乳酸、乙酸、乙醇和CO2[29],而己酸菌可以利用乙酸和乙醇生成己酸[30],己酸和乙醇又能够被酒醅中的酯化酶催化生成己酸乙酯,因此在实验组酒醅中己酸乙酯能和乳杆菌属呈正相关。梭状芽孢杆菌在酒醅中的含量极少(<0.01%),主要存在与窖泥中[31],而梭状芽孢杆菌是产生丁酸和己酸的主要微生物。胡承等[32]发现窖泥中硫酸还原菌、硝酸还原菌的存在并不直接产生呈香物质,但是它们与己酸菌等产氢菌相耦联,实现“种间氢转移”,促进己酸菌等功能菌生长。本研究虽未检测到梭状芽孢杆菌属,但接种贝莱斯芽孢杆菌后的生物扰动可能使微生物间发生某种相互关系,导致梭状芽孢杆菌属含量发生改变从而使得己酸和丁酸增加。因此在实验组酒醅中芽孢杆菌属并不会直接参与己酸乙酯的合成,芽孢杆菌属与己酸乙酯间呈负相关关系并不代表芽孢杆菌属的增殖会抑制己酸乙酯的合成,在复杂的微生物群落中,贝莱斯芽孢杆菌的接种反而改变了微生物间的代谢活性使得己酸和己酸乙酯的含量增加。
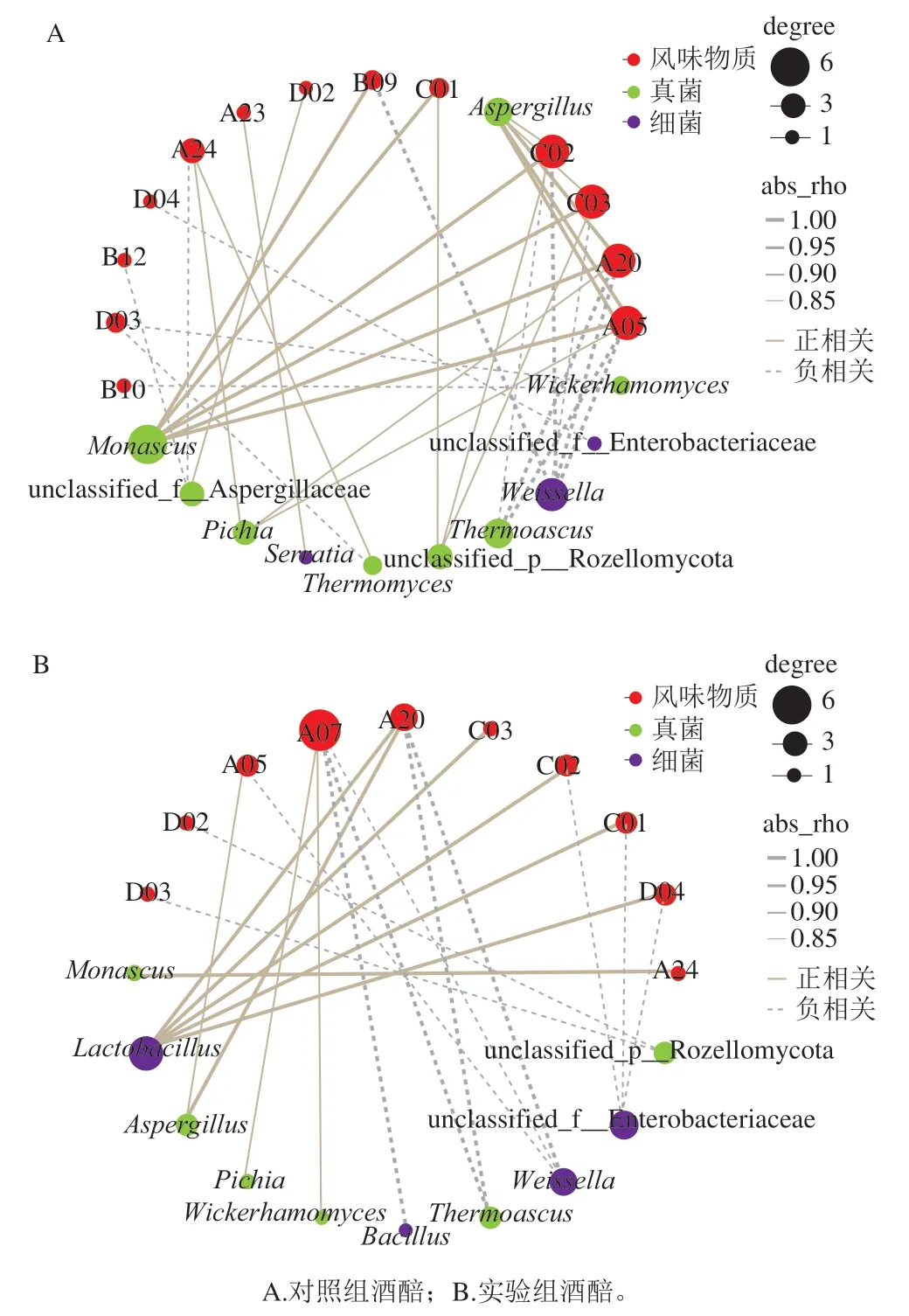
图6 相对丰度大于0.05%的细菌和真菌与差异挥发性风味物质之间显著相关性的共现网络图Fig. 6 Co-occurrence network diagram showing significant correlation between bacteria and fungi with relative abundance greater than 0.05%and differential volatile flavor compounds
3 结 论
结果显示添加贝莱斯芽孢杆菌酒醅微生物的丰富度和均匀度并没有发生显著改变,且微生物群落结构在整个发酵过程中也没有显著差异。然而,实验组酒醅中酸类、酯类、醇类挥发性风味物质与对照组酒醅相比都出现明显增加,两组间共有15种显著差异挥发性风味物质。实验组酒醅中己酸和己酸乙酯的含量显著增加,己酸与乳杆菌属有显著正相关,己酸乙酯与毕赤酵母属和威克汉姆酵母属呈正相关,与热子囊菌属、芽孢杆菌和魏斯氏菌属呈负相关。研究结果揭示了贝莱斯芽孢杆菌对浓香型酒醅微生物群落结构和挥发性风味物质的影响。
