甘草酸二铵脂质配体对大鼠急性肺损伤的改善作用*
2022-12-21刘梅梅黄焱平
刘梅梅,黄焱平,季 丹,王 齐
(安徽医学高等专科学校,安徽 合肥 230601)
急性肺损伤(Acute Lung Injury,ALI)是许多病理条件下,如感染、创伤、休克以及有害气体的吸入引起的肺水肿和肺扩张,表现为呼吸窘迫和难治性低氧血症[1]。急性呼吸窘迫综合征(Acute Respiratory Distress Syndrome,ARDS)是严重ALI的表现形式,患者预后差[2]。近年来临床和实验研究已经证明,肺毛细血管屏障损伤后引发肺水肿加重是ALI/ARDS最重要的病理特征[3-4]。甘草酸二铵脂质配体(Diammonium Glycyrrhizinate Lipid Ligand,DGLL)是中药甘草根的提取物,是一种天然的具有生物活性的五环三萜类糖苷,有抗病毒、抗炎、抗肿瘤特性。甘草素单独或与其他药物联合可以改善肺泡气体交换和抑制肺部炎症[5]。此外,我们先前的研究表明甘草可通过抑制炎症介质表达和白细胞黏附以及过氧化物释放,对大鼠非酒精性脂肪肝表现出的炎症有抑制作用[6]。然而,DGLL对肺水肿的潜在影响及在ALI中的作用、主要机制仍有待充分阐明。本文旨在探索DGLL对大鼠模型中脂多糖(Lipopolysaccharide,LPS)引起的ALI和肺水肿的影响及潜在机制。
1 材料与方法
1.1实验动物和药品 雄性SD大鼠123只,体重170~200 g,由安徽医学大学实验动物中心提供。给大鼠喂食标准谷物饲料,并于室温18~22 ℃常规饲养1周。DGLL肠溶胶囊,又名天晴甘平,由江苏正达大帝安药房有限公司提供。
1.2分组、造模和给药 本实验研究第一部分将SD大鼠随机分为6组。假手术组(n=20):灌胃给予生理盐水(5 mL/kg)1 h后,腹腔注射生理盐水(5 mL/kg);DGLL组(n=3):DGLL(120 mg/kg)灌胃1 h后,腹腔注射生理盐水(5 mL/kg);LPS组(n=20),灌胃给予生理盐水(5 mL/kg)1 h后,腹腔内注射LPS(10 mg/kg);DGLL 30+LPS组(n=20):给予DGLL(30 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg);DGLL 60+LPS组(n=20),给予DGLL(60 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg);DGLL 120+LPS组(n=20):给予DGLL(120 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg);LPS注射6 h后,腹腔注射2 %的青藤巴比妥(60 mg/kg)麻醉。
第二部分将SD大鼠随机分为5组。假手术组(n=4):灌胃给予生理盐水(5 mL/kg)1 h后,腹腔注射生理盐水(5 mL/kg);LPS组(n=4):灌胃给予生理盐水(5 mL/kg)1 h后,腹腔内注射LPS(10 mg/kg);DGLL 30+LPS组(n=4):给予DGLL(30 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg);DGLL 60+LPS组(n=4):给予DGLL(60 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg);DGLL 120+LPS组(n=4):给予DGLL(120 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg)1 h后,处死大鼠进行参数检测。
1.3细胞培养 小鼠巨噬细胞(RAW 264.7)培养密度为1x105个/cm2,在DMEM中添加10 %的胎牛血清(FBS)、链霉素(100 μg/mL)和青霉素(100 U/mL)。将细胞与LPS (100 ng/mL)培养6 h。DGLL预处理组在注射LPS前1 h加入DGLL,浓度分别为50、100 、200 μg/mL。
1.4组织学及免疫组化检测
1.4.1HE染色 LPS给药6 h后,处死大鼠取右肺中叶,4 %多聚甲醛4 ℃固定48 h后进行石蜡切片。用苏木精和伊红染色后使用光学显微镜观察。随机选取5个视野,给肺损伤评分:(1)局灶性肺泡膜增厚;(2)毛细血管堵塞;(3)肺泡内出血;(4)肺间质水肿;(5)肺泡内白细胞浸润。上述特征根据存在程度评分分级为0-3分:(1)每个区域均无上述特征评分为0分;(2)轻度评分为1,切片0 %~25 %区域具有上述特征;(3)中度评分为2,切片25 %~50 %区域具有上述特征;(4)重度评分为3,切片>50 %区域具有上述特征。肺损伤的总评分是每个特征的评分之和[7]。
1.4.2髓过氧化物酶(MPO)免疫组化染色 切片用梯度乙醇脱水,二甲苯透明后在0.01 M柠檬酸缓冲液中热介导提取抗原,过氧化氢(0.3 %)封闭30 min。滴加兔MPO多克隆一抗在4 ℃孵育过夜。将切片与山羊抗兔IgG二抗(HRP)孵育30 min,并使用DAB底物试剂盒观察显色情况。用光学显微镜观察肺组织中MPO阳性细胞表达水平。
1.4.3免疫荧光染色观察Occludin蛋白的表达 组织切片梯度乙醇脱水,二甲苯透明后在0.01 M柠檬酸缓冲液中回收热介导抗原,用PBS洗涤,用0.3 %Triton-X100浸透30 min。3 %山羊血清室温封闭30 min后,加入抗Occludin稀释过夜,用PBS冲洗后用荧光二抗孵育2 h。所有切片用Hoechst 33342细胞核染色20 min。使用显微镜扫描获得染色结果。
1.5ELISA检测 用ELISA试剂盒检测肿瘤坏死因子(TNF-α)和白细胞介素(IL-1β)在肺组织和RAW264.7细胞培养中的表达水平。
1.6测定肺湿干重比 注射LPS后,处死大鼠,取右上叶肺组织100 mg称重。在真空烘箱中干燥48 h,再次称重肺组织。计算烘干前后肺重量的比值。
1.7肺血管通透性检测 腹腔注射LPS 6 h后,将2 %伊文思蓝(EB)溶液(30 mg/kg)注入大鼠颈静脉。30 min后,冲洗肺血管内EB,称重肺组织并放于离心机管中。将100 mg肺组织加入1 mL甲酰胺,水浴后在室温下5 000×g离心30 min,然后提取上清液。用620 nm波长的分光光度计测量上清液的吸光度值。使用标准曲线法计算样品的EB含量。
1.8支气管肺泡灌洗液(BALF)的收集 腹腔注射LPS 6 h后,处死大鼠后气管插管,收集BALF,共3次。BALF样品在4 ℃下离心10 min后提取上清液。采用BCA法检测BALF样品中的总蛋白浓度。在室温下用Wright-Giemsa染色后使用细胞计数评估细胞总数。
1.9Western blot分析 从RAW 264.7巨噬细胞和大鼠肺组织中提取总蛋白后采用BCA法测定蛋白含量。使用的主要抗体和浓度如下:细胞间黏附分子(ICAM-1)(1 ∶1 000)、血管内皮钙黏蛋白(VE-cadherin)(1 ∶500)、黏附蛋白(ZO-1)(1 ∶1 000),Occludin(1 ∶500)、连接黏附分子(JAM-1)(1 ∶1 000)和内参蛋白甘油醛-3-磷酸脱氢酶(GAPDH)(1 ∶5 000)。所有一抗在4 ℃下孵育过夜。
另一组大鼠注射LPS 1 h后处死,检测右下叶肺组织p-VE-Cadherin磷酸化(1 ∶1 000)和总VE-cadherin(1 ∶500)。用HRP偶联的抗兔IgG二抗(1 ∶5 000)孵化1 h后,使用超敏化学发光检测试剂显示条带。Western blot条带的平均光密度采用Quantity One图像分析软件测定,计算目标带的平均光密度与GAPDH的平均光密度的比值。
1.10统计学分析 使用SPSS 15.0统计软件进行Tukey检验和ANOVA方差分析。
2 结果
2.1DGLL抑制LPS诱导的大鼠ALI和肺部炎症 HE染色结果显示,LPS组肺间质组织明显水肿增厚(图1 B,箭头),伴肺泡萎缩。免疫组化检测显示,注射LPS后大鼠肺组织中MPO阳性细胞明显增加。DGLL处理组的MPO阳性染色较弱(图1 D和E)。
2.2DGLL抑制LPS诱导的大鼠肺组织和巨噬细胞中细胞因子和黏附分子的表达 与假手术组相比,ELISA结果表明LPS肺组织中TNF-α和IL-1β的水平明显升高(图2 A和B)。Western blot分析显示,DGLL抑制LPS诱导的大鼠肺组织中ICAM-1水平(图2 C)。DGLL预处理消除了RAW264.7细胞100 μg/mL和200 μg/mL时LPS诱导的炎症细胞因子的释放以及ICAM-1的表达(图2 D-F)。
2.3DGLL防止LPS诱导的肺微血管通透性和肺水肿 与假手术组相比,大鼠腹腔注射LPS 6 h后肺组织湿干重比明显增高(图3 A)。LPS组与假手术组相比,肺组织EB外渗,BALF蛋白含量也明显升高(图3 B和C)。与LPS组相比,DGLL 60 mg/kg和120 mg/kg组的肺湿干重比、EB外渗、BALF蛋白浓度和BALF总细胞数均明显降低(图3 D)。

图2 DGLL对LPS引起肺组织炎症细胞因子和黏附分子表达水平的影响
2.4DGLL可阻止LPS诱导的VE-cadherin磷酸化和大鼠肺组织中VE-cadherin表达 Western blot分析显示,LPS组黏附连接蛋白VE-cadherin的表达水平明显降低,DGLL预处理增加了VE-cadherin的表达(图4 C和D)。
2.5DGLL抑制LPS诱导的大鼠肺组织紧密连接蛋白的下调 LPS组与假手术组相比,大鼠肺组织中Occludin表达水平降低,Occludin的定位呈现不连续现象(图5 A-b)。DGLL预处理可抑制上述表现(图5 A-d和5 A-e)。Western blotting结果也表明,LPS诱导后大鼠肺组织中紧密连接蛋白ZO-1、Occludin和JAM-1的表达水平明显降低(图5 B-E)。
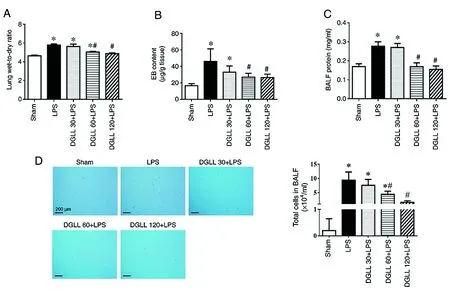
图3 DGLL对脂多糖诱导的肺微血管通透性和肺组织水肿的影响
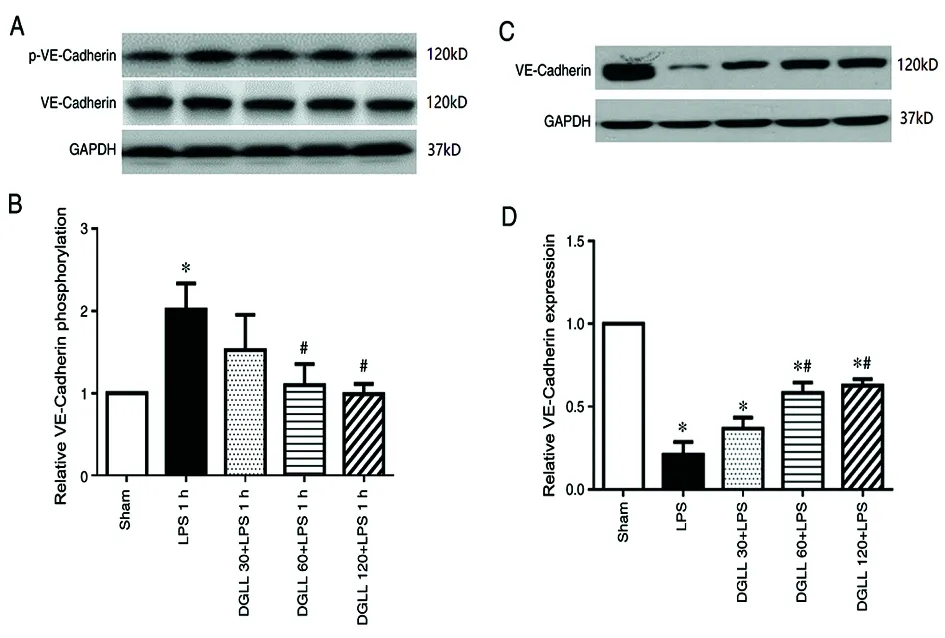
图4 DGLL对LPS引起的黏附连接蛋白VE-cadherin磷酸化及表达的影响
3 讨论
本研究表明,DGLL预处理可以阻止LPS诱导的大鼠ALI,降低MPO表达水平,减少细胞因子的产生,下调LPS炎症肺组织中黏附分子的表达。除了阻止VE-Cadherin和紧密连接蛋白ZO-1、Occludin和JAM-1在大鼠肺组织中的表达减少外,DGLL还减弱了LPS诱导的肺水肿和肺微血管通透性。
最近的研究表明,肺微血管屏障损伤和由此引起的肺水肿是早期ALI的主要病理特征,是治疗ALI/ARDS的关键靶点[8-9]。先前的研究表明,LPS通过与白细胞Toll样受体4结合激活NF-κB,诱导多种炎症因子的表达,包括TNF-α、IL-1β和IL-6,导致细胞旁连接的破坏[10]。黏附的白细胞通过释放蛋白酶和过氧化物间接损害微血管,增加肺微血管通透性和肺水肿,最终导致肺顺应性降低和功能损伤。甘草酸二铵通过减少呼吸道炎症、抑制肺组织中炎症因子的蛋白和mRNA表达以及抑制NF-κB的表达和活化来减轻肺损伤[11]。

图5 DGLL对LPS诱导大鼠肺组织紧密连接蛋白表达调控的影响
本研究进一步证实了DGLL抑制LPS诱导的炎性细胞浸润并降低MPO表达的上调。此外,DGLL还能降低肺组织中炎症细胞因子TNF-α和IL-1β的水平以及黏附分子ICAM-1的表达。DGLL还可以抑制LPS诱导的raw264.7巨噬细胞的细胞因子释放。LPS除了通过白细胞过度活化间接损害血管外,还直接损害微血管屏障功能,导致微血管通透性增加和肺水肿[12]。本研究结果表明,DGLL预处理组的肺组织湿干重比、BALF蛋白含量和EB外渗率降低,说明DGLL抑制了LPS诱导的肺微血管高通透性和肺组织水肿。微血管屏障主要由微血管内皮细胞之间的紧密和黏附连接调节。黏附连接主要是由VE-cadherin蛋白通过形成同型二聚体形成的,同型二聚体通过细胞骨架蛋白如F-actin与细胞质中的连环蛋白相连接[13]。紧密连接蛋白包括Claudin,Occludin和JAM通过与细胞质中的ZO家族蛋白连接,在稳定细胞间紧密相互作用中发挥关键作用。本研究结果显示DGLL显著抑制了LPS诱导的VE-cadherin在大鼠肺组织中的磷酸化,并抑制了LPS诱导的VE-cadherin表达的减少。此外DGLL还稳定了肺微血管紧密连接蛋白Occludin,并增加了JAM-1和ZO-1蛋白的表达水平。DGLL通过增加紧密连接和黏附蛋白的表达水平来调节肺组织中的微血管屏障,从而防止LPS诱导的肺微血管通透性增高和肺组织水肿。
