一氧化碳中毒致神经元能量代谢障碍探究
2022-12-20白美玲刘星亮王海滨
白美玲,刘星亮,王海滨
(1.河北北方学院 基础医学院,河北 张家口 075000;2.河北北方学院附属第一医院,河北 张家口 075000;3.张家口市第二医院,河北 张家口 075000)
一氧化碳(carbon monoxide,CO)是一种无色无味的气体,由碳或者其他含有碳的原料不完全燃烧产生。一氧化碳中毒是较为常见的生活性和职业性中毒,可引发机体多系统损伤,其中以中枢神经系统功能损害最为严重,出现以痴呆、精神症状和锥体外系症状为主的神经系统病症,目前发病机制尚不明确[1]。部分急性一氧化碳中毒患者在中毒症状缓解、意识恢复正常后,大约经历2~60 d表现正常或基本正常的间歇期后,会再次出现一系列脑病症状,称为迟发型脑病。神经元乳酸代谢变化是一氧化碳中毒主要病变特点[2]。
大鼠肾上腺嗜铬细胞瘤PC12细胞常用于制备神经元模型[3-5]。我们拟通过外源性一氧化碳释放分子2(carbon monoxide releasing molecule-2,CORM-2)诱导PC12细胞制备体外一氧化碳中毒神经元模型,检测细胞内乳酸浓度和单羧酸转运蛋白2(monocarboxylate transporter 2,MCT2)含量,探讨一氧化碳引起的细胞变化与MCT2参与的代谢机制障碍的相关性,为进一步探索一氧化碳中毒后的临床治疗提供理论依据。
1 材料与方法
1.1 实验材料
PC12细胞由河北北方学院药学系教师惠赠,MCT2抗体、AR-C155858均购自上海生物有限公司,乳酸检测试剂盒购自南京建成生物工程研究所。
1.2 细胞培养
PC12细胞用含有10%胎牛血清的DMEM高糖培养液(青霉素100 U·mL-1,链霉素100 μg·mL-1)悬浮,以约5×106个/mL的密度接种于直径10 cm的培养皿,置于细胞孵育箱中培养,待细胞覆盖率达90%左右时,常规胰酶消化传代。
1.3 乳酸浓度检测
PC12细胞于传代12 h后分别给予50、100、200 μM的CORM-2进行诱导,同时对PC12对照组和给予AR-C155858(MCT2抑制剂)1 μM组进行观察,诱导24 h后,收取细胞。按照乳酸含量试剂盒操作说明检测各组PC12细胞裂解液中乳酸浓度。
1.4 Western blot检测蛋白含量
PC12细胞于传代12 h后给予50、100、200 μM的CORM-2诱导,同时以未给予CORM-2和给予AR-C155858为对照组,诱导24 h后,收取细胞总蛋白,测定蛋白浓度,配制上样蛋白,SDS-PAGE蛋白电泳,转膜,膜免疫印迹检测,显影后照相,利用图像分析软件Image J进行定量分析。
1.5 统计学方法
应用SPSS 16.0进行数据处理,2组间均数比较采用t检验,多组资料比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 CORM-2诱导后PC12细胞形态学变化
PC12细胞在经50、100、200 μM的CORM-2诱导24 h后,将细胞置于倒置相差显微镜下进行观察。对照组PC12细胞贴壁良好,细胞间接触紧密,折光性好,细胞大小均匀,呈梭形,核大呈圆形或椭圆形。CORM-2诱导组PC12细胞贴壁数量减少,细胞大小不均,折光性减弱,随着CORM-2浓度增高,细胞变圆,可见大片细胞融合,出现悬浮及碎片(图1)。
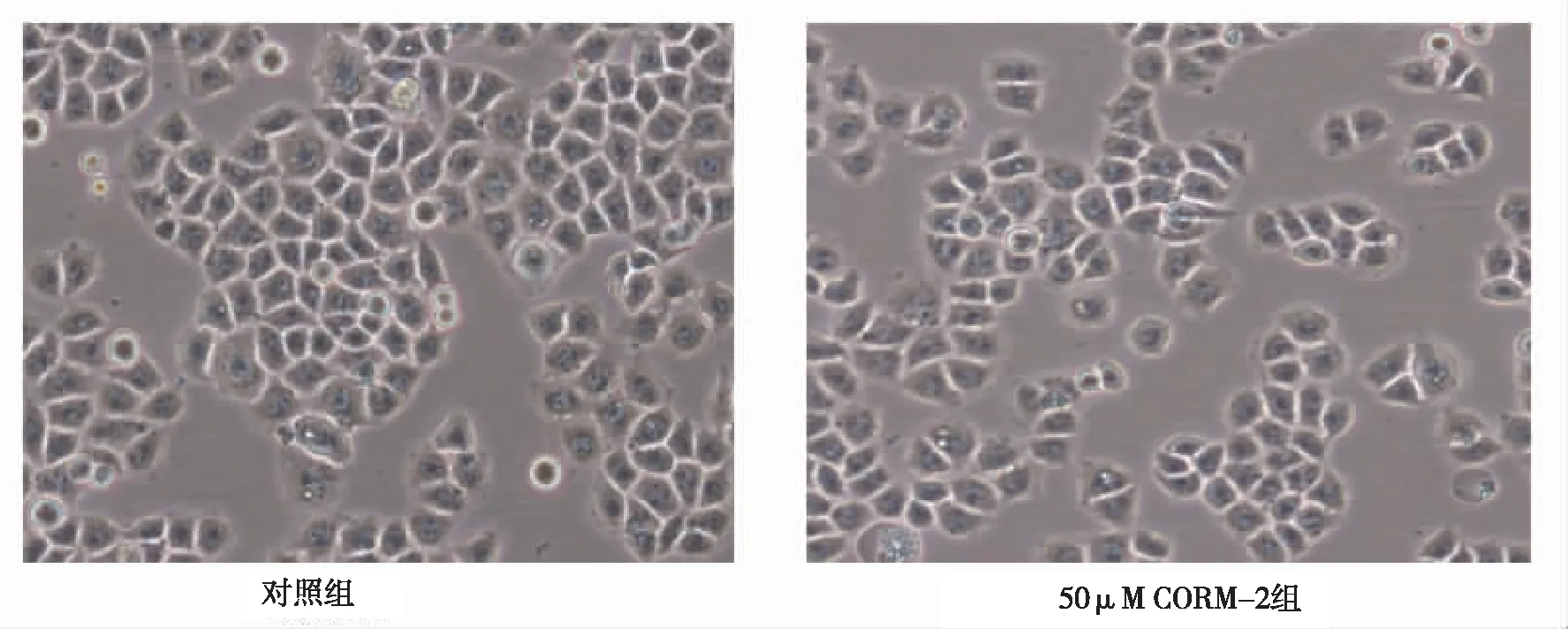
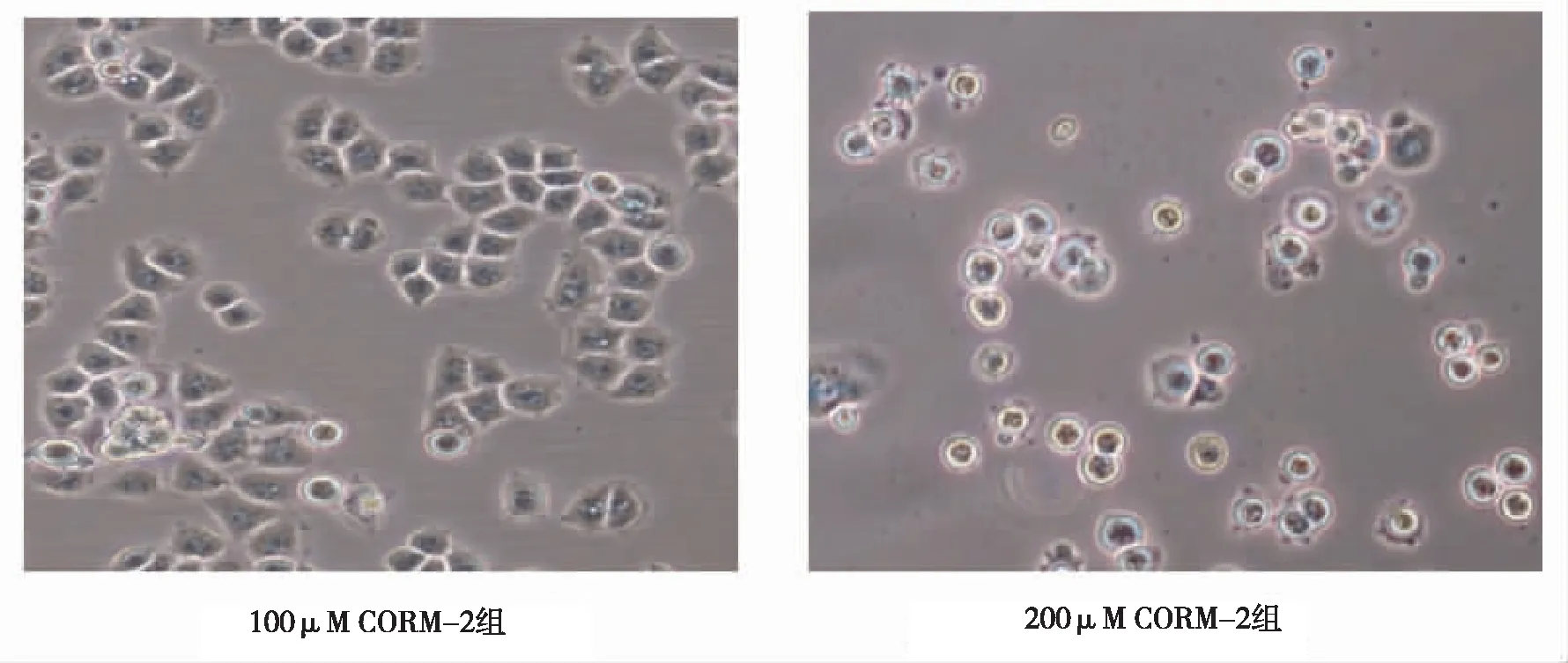
图1 对照组和不同浓度CORM-2组PC12细胞形态学(10×40)
2.2 PC12细胞内乳酸浓度检测
PC12细胞在经50、100、200 μM的CORM-2诱导后收取蛋白,按照乳酸盐检测试剂盒的要求进行细胞裂解液中乳酸盐浓度检测,并以MCT2抑制剂组为对照,结果显示PC12细胞内乳酸浓度在给予CORM-2后明显高于未给予CORM-2的对照组(P<0.05),其结果接近给予MCT2抑制剂的AR-C155858组(图2)。
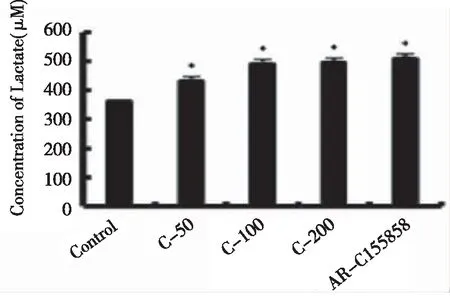
图2 对照组和不同作用组的乳酸盐浓度
2.3 各组PC12细胞内MCT2的表达
对照组、50、100、200 μM组收取总蛋白,采用Western blot方法进行MCT2检测并通过灰度值比进行分析,结果显示CORM-2诱导的MCT2表达改变不明显(P>0.05)(图3)。
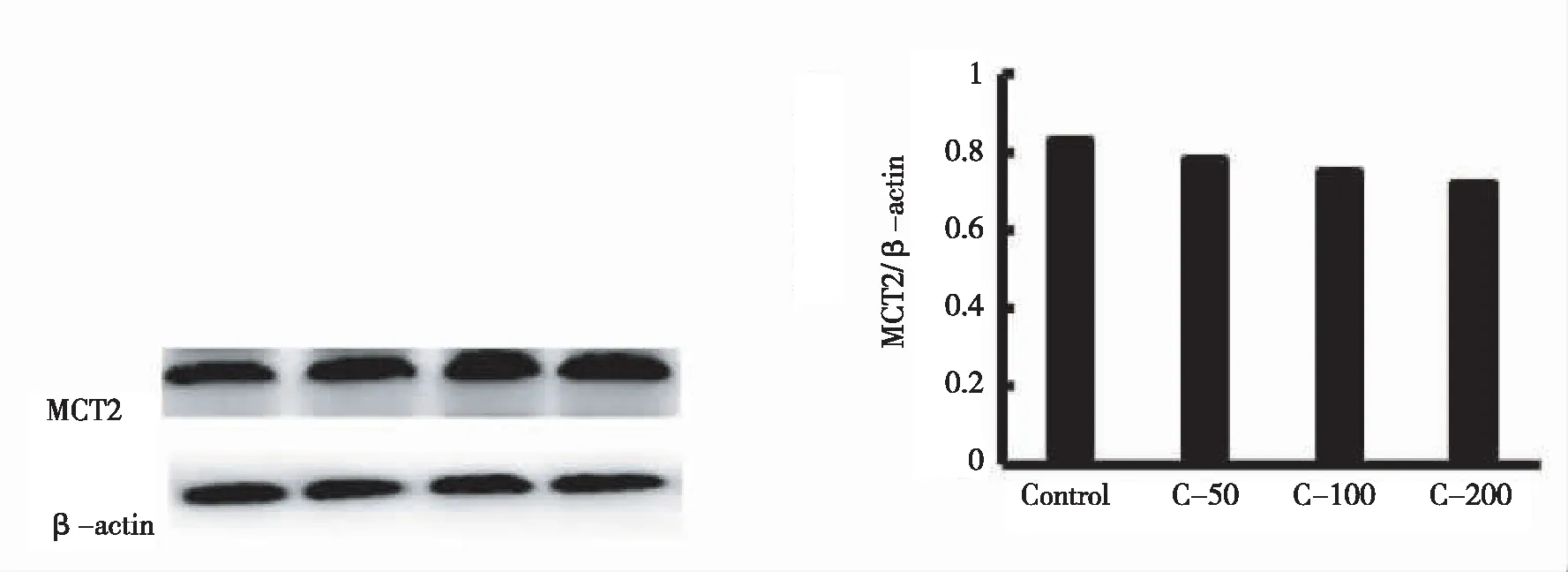
图3 PC12细胞内MCT2和β-actin表达情况
3 讨 论
单羧酸转运蛋白有多种亚型,分布在人体不同部位,其中中枢神经系统有MCT1、MCT2、MCT3和MCT4亚型[6-7]。高亲和性的MCT2主要在神经元表达,具有高氧化并发挥乳酸转运功能[8-9]。在神经元中,MCT2将乳酸转化成丙酮酸,为脂肪酸的合成及生成髓鞘结构提供原料[10-11]。MCT2在能量代谢产物从少突胶质细胞到轴突的传输及为轴突提供营养支持等方面发挥重要作用[12]。一氧化碳中毒引起机体缺氧,体内乳酸和丙酮酸比值增大,导致乳酸中毒症状出现,MCT2主要负责髓磷脂生成原料乳酸的转运,提示一氧化碳中毒后MCT2参与代谢机制功能障碍[13]。
本研究结果显示,PC12细胞内乳酸盐浓度在给予CORM-2后明显高于对照组,接近给予MCT2抑制剂的AR-C155858组,提示一氧化碳中毒后乳酸大量堆积可能是临床上一氧化碳中毒患者出现嗜睡昏迷的原因之一,与MCT2转运功能下降有关。进一步观察发现,随着CORM-2浓度升高,MCT2表达量变化不大(P>0.05),提示一氧化碳中毒对MCT2数量影响不明显。有学者[14]从出生第1天的SD大鼠脑组织中分离、提纯原代细胞——少突胶质细胞前体细胞,并进一步分化得到成熟的少突胶质细胞。将2种细胞分别置于无糖培养基、95%CO2与5%N2的细胞培养箱中,制备氧糖剥夺(oxygen glucose deprivation,OGD)细胞模型。OGD 1h后,少突胶质细胞前体细胞中MCT1表达量明显升高(P<0.05),而成熟的少突胶质细胞中MCT1表达量无明显变化(P>0.05),与细胞中细胞器数量及能量代谢有关。少突胶质细胞前体细胞体积较小,线粒体数量较少,产生的能量较少,在氧糖剥夺状态下迫切需要大量能量,故通过上调MCT1表达获取更多能量。成熟少突胶质细胞体积较大,线粒体数量较多,能量储备充分,较少突胶质细胞前体细胞更耐受氧糖剥夺环境,获取能量的紧迫性不高,MCT1变化不明显,与本研究结果相似。推测一氧化碳中毒可致MCT2化学结构改变,影响其乳酸转运功能,但不影响MCT2数量。一氧化碳分子中的碳原子可能与MCT2中的氧原子形成新的共价键使MCT2结构发生改变,化学修饰作用导致MCT2转运功能受到抑制,引发一系列能量代谢障碍,造成患者代谢异常而引发嗜睡、昏迷等临床症状。MCT2化学修饰可为临床进一步探索一氧化碳中毒后引发的临床症状体征治疗提供理论参考。
