梓醇-川芎嗪方对阿尔茨海默病模型小鼠的作用及对水通道蛋白4 表达的影响
2022-12-20邓楚珺孟胜喜陈慧泽郭起浩付剑亮
邓楚珺,孟胜喜,陈慧泽,王 兵,郭起浩,付剑亮
阿尔茨海默病(Alzheimer's disease,AD)是一种严重危害人类健康的神经系统退行性疾病,给病人家庭及社会均造成了较大的经济负担和照顾负担[1]。作为膜转运蛋白的水通道蛋白4(AQP4)通过β-淀粉样蛋白(amyloidβ-protein,Aβ)清除[2]、突触可塑性[3]、谷氨酸稳态[4]、离子稳态[5]、神经炎症[6]等方面对AD 发生、发展起着重要的作用。本课题组前期的研究已经发现,梓醇-川芎嗪方(CT 方)具有提高AD 模型小鼠认知功能的作用[7]。为了进一步验证梓醇-川芎嗪方对AD 的作用,并探讨其对AQP4 表达的影响,故开展本试验。
1 材料与方法
1.1 动物与分组 非特定病原体(SPF)级、雄性、β-淀粉样前体蛋白 swe 基因/早老蛋白 1dE9 基因(APPswe/PS1dE9)双转基因小鼠50 只,6 月龄,按照随机数字表法分为模型组、盐酸多奈哌齐片(安理申)组、梓醇-川芎嗪方低剂量组(CT-L 组)、梓醇-川芎嗪方中剂量组(CT-M 组)、梓醇-川芎嗪方高剂量组(CT-H组),每组均为10 只。另选10 只同月龄C57BL/6J 小鼠作为对照组。以上动物均购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2018-0006。以上动物饲养环境均为温度(23±2)℃、湿度(55±5)%、明暗循环为12 h,自由进食和饮水。
1.2 药物、试剂及仪器 梓醇-川芎嗪方是由4.274 mg 的梓醇和1.554 mg 的川芎嗪组成。梓醇,CAS 号:2415-24-9,分子式:C15H22O10,分子量:362.33,纯度≥98.0%,Batch No.DSTDZ000502。川芎嗪,CAS 号:1124-11-4,分子式:C8H12N2,分子量:136.19,纯度≥98.0%,Batch No.DST200602-032,以上均由上海沪峥生物科技有限公司提供。盐酸多奈哌齐片,规格:每片5 mg,商品名:安理申,国药准字:H20200978,lot:1705080,由卫材(中国)药业有限公司提供。
Morris 水迷宫(Morris water maze,MWM),型号JLBehv-MWMG-1,购自上海吉量软件科技有限公司。AQP4 多克隆抗体(lot:PB0500)及羊抗兔抗体(lot:KGAA35)购自美国Boster Biological Technology 公司。丙二醛(MDA,lot:A003-1-2)、超氧化物歧化酶(SOD,lot:A001-3-2)、过氧化氢酶(CAT,lot:A007-1-1)、总抗氧化能力(T-AOC,lot:A015-2-13),以上试剂盒均购自南京建成生物工程研究所。3-磷酸甘油醛脱氢酶(GAPDH,lot:AF7021)购自美国Affinity 公司。可溶性Aβ1-40试剂盒(lot:ZK-02895)、可溶性Aβ1-42试剂盒(lot:KB38007)、不可溶性Aβ1-40试剂盒(lot:ZK-H738)、不可溶性Aβ1-42试剂盒(lot:KB1200A)均购自北京索莱宝科技有限公司。
1.3 实验方法
1.3.1 给药 CT-L 组、CT-M 组及CT-H 组小鼠每日给予相对应剂量的梓醇-川芎嗪方灌胃,安理申组小鼠每日给予安理申灌胃。梓醇-川芎嗪方低剂量、中剂量、高剂量及安理申溶液给药浓度依据人和动物体表面积折算系数换算[8],经过计算:梓醇-川芎嗪方低、中、高剂量给药浓度分别为25 mg/kg、50 mg/kg、100 mg/kg,安理申溶液给药浓度为5 mg/kg。对照组和模型组小鼠每天给予等体积的生理盐水灌胃,各组均为每日1 次,连续灌胃8 周。
1.3.2 Morris 水迷宫行为学测试 干预8 周后,各组小鼠均进行Morris 水迷宫行为学测试,包括定位航行实验和空间探索实验。①定位航行实验:此实验进行5 d。Morris 水迷宫水池分为4 个象限,逃生平台放在其中1 个象限内。小鼠被面向池壁放入水中,其在120 s 内找到平台的时间为逃逸潜伏期(escape latency,EL)。若小鼠在120 s 内未找到平台,逃逸潜伏期则计为120 s。每次从不同的象限将小鼠面向池壁置入水中,共观察5 d。记录各组小鼠的逃逸潜伏期、游泳距离(swimming distance,SD)。②空间探索能力(space exploration capability,SEC):撤去平台,固定入水点,小鼠在水中游泳120 s,记录小鼠找到原平台的路线,记录首次到达原平台时间(time of first arrival at the platform,TFAP)和120 s 内穿越原平台的次数(number of crossing platforms,NCP)。
1.3.3 标本留取 在完成Morris 水迷宫行为学测试后,取小鼠的外周血,然后以4 ℃、3 000 r/min 离心20 min,取其上清。以10%水合氯醛深度麻醉后进行解剖实验,留取小鼠的脑组织等标本,存放于-80 ℃冰箱中。后续则用以上标本进行相关的观察和检测。
1.3.4 MDA、SOD、CAT 及T-AOC 水平测定 以二喹啉甲酸(BCA)试剂盒测定小鼠海马体中蛋白浓度,硫代巴比妥酸法测定小鼠海马体和血清中MDA 水平,水溶性四氮唑(WST-1)法测定小鼠海马体和血清中SOD 水平,钼酸铵法测定小鼠海马体和血清中过氧化氢酶水平,比色法测定海马体和血清中T-AOC。以上检测均严格按照各种试剂盒说明书的步骤进行操作。
1.3.5 脑内Aβ水平的测定 将各组小鼠大脑皮层组织的匀浆分别加入可溶性Aβ1-40和不可溶性Aβ1-40、可 溶 性Aβ1-42和 不 可 溶 性Aβ1-42试 剂 盒 中,然 后 加 入2,6-二乙基苯胺(DEA),以12 000 r/min 离心30 min后收集其上清液,以相应的酶联免疫吸附法(ELISA)按照试剂盒说明书测定可溶性和不可溶性Aβ水平。
1.3.6 AQP4 表达水平的检测 剪取小鼠的室周脑组织,匀浆、离心后提取其上清液。以总蛋白提取试剂盒来提取总蛋白,以考马斯亮蓝染液定量,加样、电泳,转膜120 min 后用TBST 洗膜3 次,每次10 min,加入AQP4 和GAPDH 的一抗,4 ℃孵育,过夜,二抗室温下进行振荡2 h。增强化学发光法(ECL)显色,G:BOX chemiXR5 成像,Gel-Pro32 软件分析图像灰度值。AQP4/GAPDH 积分值为AQP4 蛋白相对表达量。
1.4 统计学处理 采用SPSS 20.0 进行数据分析。符合正态分布的定量资料以均数±标准差(±s)表示,采用单因素方差分析(One-Way ANOVA)进行组间比较,最小显著差异t检验(LSD-t)分析方法进行两两比较。以P<0.05 为差异有统计学意义。
2 结 果
2.1 梓醇-川芎嗪方对APPswe/PS1dE9 双转基因小鼠行为学的作用
2.1.1 逃逸潜伏期 与对照组比较,模型组逃逸潜伏期明显延长,差异有统计学意义(P<0.05)。与模型组比较,CT-M 组、CT-H 组、安理申组逃逸潜伏期缩短,差异均有统计学意义(P<0.05);在第5 天,CT-L组逃逸潜伏期缩短,差异有统计学意义(P<0.05)。与CT-L 组比较,安理申组、CT-M 组、CT-H 组逃逸潜伏期缩短,差异均有统计学意义(P<0.05)。与CT-M组比较,CT-H 组逃逸潜伏期缩短,差异有统计学意义(P<0.05)。与安理申组比较,CT-H 组逃逸潜伏期缩短,差异有统计学意义(P<0.05)。详见表1。
表1 各组小鼠逃逸潜伏期比较(±s) 单位:s

表1 各组小鼠逃逸潜伏期比较(±s) 单位:s
模型组与对照组比较,①P <0.05;与模型组比较,②P <0.05;与CT-L 组比较,③P <0.05;与CT-M 组比较,④P <0.05;CT-H组与安理申组比较,⑤P <0.05。
组别 只数 第1 天 第2 天 第3 天 第4 天 第5 天对照组 10 35.14±3.26 26.42±3.44 21.45±3.82 17.44±2.71 12.11±1.22模型组 10 58.26±5.25① 49.21±4.36① 41.62±4.46① 36.52±3.82① 32.24±3.34①安理申组 10 46.47±4.34②③ 35.36±3.28②③ 30.23±3.39②③ 25.13±2.65②③ 20.32±2.51②③CT-L 组 10 55.32±5.56 43.44±4.67 36.28±3.47 30.26±2.43 26.28±2.43②CT-M 组 10 47.48±4.15②③ 34.12±3.58②③ 30.41±3.52②③ 24.28±2.26②③ 20.46±2.52②③CT-H 组 10 40.20±4.43②③④⑤ 28.24±3.77②③④⑤ 23.27±2.38②③④⑤ 20.16±2.37②③④⑤ 16.74±1.47②③④⑤
2.1.2 空间定位航行游泳距离 与对照组比较,模型组小鼠游泳距离明显延长,差异有统计学意义(P<0.05)。与模型组比较,安理申组、CT-M 组、CT-H 组游泳距离较模型组缩短,差异均有统计学意义(P<0.05);第4 天、第5 天,CT-L 组游泳距离较模型组缩短,差异均有统计学意义(P<0.05)。与CT-L 组比较,CT-M 组、CT-H 组、安理申组游泳距离缩短,差异均有统计学意义(P<0.05)。与CT-M 组比较,CT-H组游泳距离缩短,差异有统计学意义(P<0.05)。与安理申组比较,CT-H 组游泳距离缩短,差异有统计学意义(P<0.05)。详见表2。
表2 各组小鼠游泳距离比较(±s) 单位:cm

表2 各组小鼠游泳距离比较(±s) 单位:cm
模型组与对照组比较,①P <0.05;与模型组比较,②P <0.05;与CT-L 组比较,③P <0.05;与CT-M 组比较,④P <0.05;CT-H 组与安理申组比较,⑤P <0.05。
组别 只数 第1 天 第2 天 第3 天 第4 天 第5 天对照组 10 1 327.14±48.22 1 138.54±40.36 803.22±36.44 536.34±34.53 413.14±32.42模型组 10 1 613.26±53.34① 1 546.62±51.51① 1 388.40±48.35① 1 239.36±44.26① 1 135.12±41.33①安理申组 10 1 501.63±50.26②③ 1 378.71±48.67②③ 1 215.35±45.17②③ 956.52±42.37②③ 811.23±38.41②③CT-L 组 10 1 578.18±60.64 1 489.66±52.25 1 307.45±50.26 1 102.63±47.65② 1 003.52±43.29②CT-M 组 10 1 512.22±62.55②③ 1 382.53±46.74②③ 1 201.61±43.35②③ 969.73±40.74②③ 826.71±37.74②③CT-H 组 10 1 371.34±52.46②③④⑤ 1 205.11±42.76②③④⑤1 014.72±40.11②③④⑤ 802.44±38.83②③④⑤ 650.40±35.50②③④⑤
2.1.3 空间探索能力 与对照组比较,模型组TFAP明显延长,NCP明显减少,差异均有统计学意义(P<0.05);与模型组比较,CT-M 组、CT-H 组、安理申组TFAP 缩短,NCP 增加,差异均有统计学意义(P<0.05)。与CT-L 组比较,CT-M 组、CT-H 组、安理申组TFAP缩短,NCP增加,差异均有统计学意义(P<0.05)。与CT-M 组比较,CT-H 组TFAP 缩短,NCP 增加,差异均有统计学意义(P<0.05)。与安理申组比较,CT-H 组TFAP 缩短,NCP 增加,差异均有统计学意义(P<0.05)。详见表3。
表3 各组小鼠空间探索能力比较(±s )

表3 各组小鼠空间探索能力比较(±s )
模型组与对照组比较,①P <0.05;与模型组比较,②P <0.05;与CT-L 组比较,③P <0.05;与CT-M 组比较,④P <0.05;CT-H 组与安理申组比较,⑤P <0.05。
组别 只数 TFAP(s) NCP(次)对照组 10 7.16±1.02 5.24±0.71模型组 10 26.58±3.26① 1.28±0.13①安理申组 10 17.37±2.51②③ 3.08±0.24②③CT-L 组 10 23.28±3.71 1.89±0.15 CT-M 组 10 17.35±2.63②③ 3.10±0.26②③CT-H 组 10 11.04±1.97②③④⑤ 4.02±0.57②③④⑤
2.2 梓醇-川芎嗪方对APPswe/PS1dE9 双转基因小鼠脑内Aβ水平的影响 与对照组比较,模型组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水平均明显升高,差异均有统计学意义(P<0.05)。与模型组比较,CT-M组、CT-H 组、安理申组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水 平 下 降,差 异 均 有 统 计 学 意 义(P<0.05);CT-L 组小鼠脑内可溶性Aβ1-42水平较模型组下降,差异有统计学意义(P<0.05)。与CT-L 组比较,安理申组、CT-M 组、CT-H 组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水平下降,差异均有统计学意义(P<0.05)。与CT-M 组比较,CT-H 组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水平下降,差异均有统计学意义(P<0.05)。与安理申组比较,CT-H 组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水平下降,差异均有统计学意义(P<0.05)。详见表4。
表4 各组小鼠脑内Aβ水平比较(±s) 单位:ng/mg

表4 各组小鼠脑内Aβ水平比较(±s) 单位:ng/mg
模型组与对照组比较,①P <0.05;与模型组比较,②P <0.05;与CT-L 组比较,③P <0.05;与CT-M 组比较,④P <0.05;CT-H 组与安理申组比较,⑤P <0.05。
组别 只数 可溶性Aβ1-40 不可溶性Aβ1-40 可溶性Aβ1-42 不可溶性Aβ1-42对照组 10 176.36±12.26 1.23±0.11 180.02±10.14 16.11±1.79模型组 10 433.25±18.33① 30.43±2.92① 756.47±20.25① 211.23±13.65①安理申组 10 327.41±16.46②③ 18.54±1.36②③ 603.62±16.37②③ 153.52±11.27②③CT-L 组 10 402.37±15.28 26.68±2.44 690.73±17.63② 197.61±10.24 CT-M 组 10 320.18±15.26②③ 17.71±1.40②③ 611.88±18.41②③ 149.43±8.16②③CT-H 组 10 295.22±13.31②③④⑤ 10.69±1.11②③④⑤ 532.64±14.60②③④⑤ 80.39±5.38②③④⑤
2.3 梓醇-川芎嗪方对APPswe/PS1dE9 双转基因小鼠SOD、MDA、CAT、T-AOC 水平的影响 与对照组比较,模型组小鼠海马体和血清SOD、CAT 和T-AOC 水平均明显下降,MDA 水平明显升高,差异均有统计学意义(P<0.05)。与模型组比较,安理申组、CT-M 组、CT-H 组小鼠海马体和血清SOD、CAT 和T-AOC 水平升高,MDA 水平下降,差异均有统计学意义(P<0.05)。与CT-L 组比较,安理申组、CT-M 组、CT-H 组小鼠海马体和血清SOD、CAT 和T-AOC 水平升高,MDA 水平下降,差异均有统计学意义(P<0.05)。与CT-M 组比较,CT-H 组小鼠海马体和血清SOD、CAT和T-AOC 水平升高,MDA 水平下降,差异均有统计学意义(P<0.05)。与安理申组比较,CT-H 组小鼠海马体和血清SOD、CAT 和T-AOC 水平升高,MDA 水平下降,差异均有统计学意义(P<0.05)。详见表5、表6。
表5 各组小鼠海马体中MDA、SOD、CAT、T-AOC 水平比较(±s )

表5 各组小鼠海马体中MDA、SOD、CAT、T-AOC 水平比较(±s )
模型组与对照组比较,①P <0.05;与模型组比较,②P <0.05;与CT-L 组比较,③P <0.05;与CT-M 组比较,④P <0.05;CT-H 组与安理申组比较,⑤P <0.05。
组别 只数 SOD(U/mg) MDA(mmol/mg) CAT(U/mg) T-AOC(U/mg)对照组 10 368.37±17.28 2.06±0.12 0.38±0.03 0.31±0.03模型组 10 178.22±10.36① 24.34±2.54① 0.15±0.02① 0.05±0.00①安理申组 10 236.14±14.45②③ 15.12±1.13②③ 0.24±0.02②③ 0.13±0.01②③CT-L 组 10 165.26±11.37 21.26±2.43 0.16±0.01 0.06±0.00 CT-M 组 10 243.76±12.49②③ 15.41±1.22②③ 0.25±0.02②③ 0.12±0.01②③CT-H 组 10 352.84±16.33②③④⑤ 9.25±0.65②③④⑤ 0.35±0.03②③④⑤ 0.23±0.02②③④⑤
表6 各组小鼠血清SOD、MDA、CAT、T-AOC 水平比较(±s )
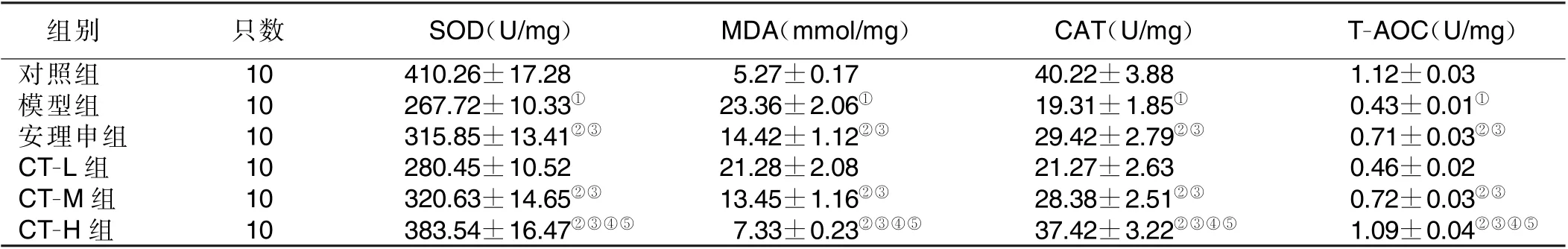
表6 各组小鼠血清SOD、MDA、CAT、T-AOC 水平比较(±s )
模型组与对照组比较,①P <0.05;与模型组比较,②P <0.05;与CT-L 组比较,③P <0.05;与CT-M 组比较,④P <0.05;CT-H 组与安理申组比较,⑤P <0.05。
组别 只数 SOD(U/mg) MDA(mmol/mg) CAT(U/mg) T-AOC(U/mg)对照组 10 410.26±17.28 5.27±0.17 40.22±3.88 1.12±0.03模型组 10 267.72±10.33① 23.36±2.06① 19.31±1.85① 0.43±0.01①安理申组 10 315.85±13.41②③ 14.42±1.12②③ 29.42±2.79②③ 0.71±0.03②③CT-L 组 10 280.45±10.52 21.28±2.08 21.27±2.63 0.46±0.02 CT-M 组 10 320.63±14.65②③ 13.45±1.16②③ 28.38±2.51②③ 0.72±0.03②③CT-H 组 10 383.54±16.47②③④⑤ 7.33±0.23②③④⑤ 37.42±3.22②③④⑤ 1.09±0.04②③④⑤
2.4 梓醇-川芎嗪方对APPswe/PS1dE9 双转基因小鼠室周脑组织AQP4 蛋白表达水平的影响 与对照组比较,模型组小鼠室周脑组织AQP4 蛋白表达水平明显降低,差异有统计学意义(P<0.05);与模型组比较,CT-M 组、CT-H 组小鼠室周脑组织AQP4 蛋白表达水平升高,差异均有统计学意义(P<0.05)。详见图1、图2。

图1 各组小鼠室周脑组织AQP4 蛋白表达条带图
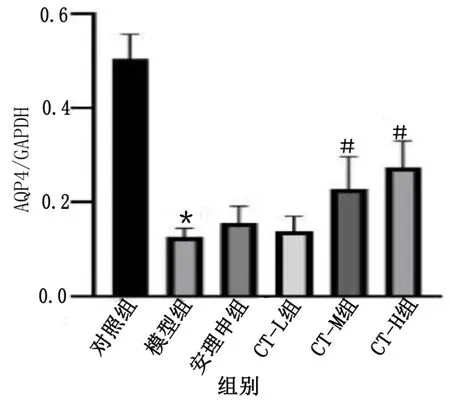
图2 各组室周脑组织AQP4 蛋白表达比较
3 讨 论
中医药具有多途径、多成分、多靶点、多通路、多层次作用的特点,且副作用小,对发病机制非常复杂的AD 的治疗具有独特的优势。中药有效组分是指中药复方中具有相似化学性质或化学结构,对疾病具有治疗作用的一类或多类有效成分群[9]。中药有效组分配伍,不仅避免了传统中药方剂成分复杂等缺点,而且还保留了传统方剂的特点和优势[10]。
梓醇为玄参科植物地黄新鲜或干燥块根中提取的小分子环烯醚萜类化合物[11],可以改善AD 大鼠大脑皮质结构异常,升高其大脑皮质胆碱能毒蕈碱受体M1亚型受体表达[12]。在血脑屏障的体外模型中,梓醇可以对Aβ1-42诱导的血脑屏障破坏具有保护作用[13]。川芎嗪为川芎的主要有效成分,可以下调AD 大鼠海马神经元晚期糖基化终产物受体(RAGE)-细胞外信号调节激酶(ERK)1/2-p38 丝裂原活化蛋白激酶(p38 MAPK)-核转录因子-κB(NF-κB)信号通路,从而有效抑制神经元活性氧生成,降低Aβ的神经毒性,改善AD 大鼠脑组织炎性,进而发挥其抗AD 作用[14]。
本研究结果表明,与模型组比较,CT-M 组、CT-H组、安理申组小鼠逃逸潜伏期、游泳距离、TFAP 均缩短,NCP 增加,差异均有统计学意义(P<0.05);与CT-L 组比较,安理申组、CT-M 组、CT-H 组逃避潜伏期、游泳距离、TFAP 均缩短,NCP 增加,差异均有统计学意义(P<0.05)。与CT-M 组比较,CT-H 组小鼠逃避潜伏期、游泳距离、TFAP 均缩短,NCP 增加,差异均有统计学意义(P<0.05)。与安理申组比较,CT-H 组小鼠逃避潜伏期、游泳距离、TFAP 均缩短,NCP 增加,差异均有统计学意义(P<0.05)。这表明梓醇-川芎嗪方可以有效提高AD 模型小鼠的认知和记忆能力,其作用呈剂量依赖性,高剂量梓醇-川芎嗪方的效果优于安理申。本研究结果表明,与模型组比较,CT-M 组、CT-H 组、安理申组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水平降低,海马体和血清SOD、CAT 和T-AOC 水平升高,MDA水平下降,差异均有统计学意义(P<0.05)。与CT-L 组比较,安理申组、CT-M 组、CT-H 组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水平均降低,海马体和血清SOD、CAT 和T-AOC 水平均升高,MDA水平降低,差异均有统计学意义(P<0.05)。与CT-M组比较,CT-H 组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水平降低,海马体和血清SOD、CAT 和T-AOC 水平升高,MDA水平降低,差异均有统计学意义(P<0.05)。与安理申组比较,CT-H 组小鼠脑内可溶性及不可溶性Aβ1-40、Aβ1-42水平降低,海马体和血清SOD、CAT和T-AOC 水平升高,MDA 水平降低,差异均有统计学意义(P<0.05)。与模型组比较,CT-M 组、CT-H 组小鼠室周脑组织AQP4 蛋白的表达水平升高,差异有统计学意义(P<0.05)。
综上所述,梓醇-川芎嗪方可以有效提高AD 模型小鼠的认知和记忆能力,作用优于安理申。其作用机制可能与降低AD 模型小鼠脑组织中Aβ沉积、调节氧化应激、上调AD 模型小鼠室周脑组织AQP4 蛋白表达水平有关。
