热习服分子机制、特异性标志物及遗传差异研究进展
2022-12-20胡明李萍刘吉洛曹广文谭晓
胡明,李萍,刘吉洛,曹广文,谭晓
海军军医大学海医系海军流行病学教研室,上海 200433
湿热环境中人体各系统会对热产生适应性的调节,按照是否可遗传,分为热适应及热习服。热适应是指世居或长期在热环境中生活劳动的人群,其热耐受能力比初入热环境者强的环境生理学现象。热适应具有可遗传的特点,即使脱离湿热环境一段时间,这种对热的适应能力仍然存在。热习服是后天获得的,是在热刺激的反复长期作用下逐步建立的,可出现一系列生理、心理、形态改变的适应性反应[1]。热习服与热适应最显著的差异是已习服的机体离开热环境后会发生脱习服[2]。然而,目前人体热适应的遗传基础及热习服的分子调控机制尚不清楚,用于跟踪热习服进程或甄别不同热适应能力人群的关键生物标志物亦不明确。本文从生理功能、生化代谢及表观遗传等多个角度对热习服的分子机制进行综述,总结与热习服相关的关键标志物;探讨全基因组关联分析(genome-wide association study,GWAS)技术在甄别不同热适应能力人群之间主要遗传差异中的应用,为今后研发预防热损伤、提高耐热能力的药物以及热射病预警监测设备等提供科学依据。
1 人体热习服的形成机制
1.1生理功能 人体热习服后,其体温、心率升高幅度较习服前明显下降,并且出汗更早、更快。人体核心温度通常保持在37 ℃左右,波动范围较窄(35~41 ℃)。为应对极端热环境,机体启动多个独立的体温调节反射以加快散热[3],包括改变血管功能,使血液从中枢(脑、脊柱及大血管)流向外周(皮肤),因为四肢更大的表面积与质量之比能加快皮肤与环境的热交换,以及通过血管扩张增强发汗功能[4]。热习服改变了人体中枢及外周热效应器的敏感性。在中枢层面,引起出汗的体温阈值降低;而在外周层面,表现为出汗率增高[5]。最终皮肤血管扩张,汗液分泌时间提前,机体更早启动散热效应[6]。随着出汗率的增高,汗液中Na+、Cl-被重新吸收,形成更低渗的汗液[7],低渗汗液更易蒸发,散热进一步加快,皮肤温度随之降低[8]。热习服导致的心率降低及每搏输出量增加可能是由心肌自主神经张力改变引起的[9],交感神经活动的减少有助于在热习服期间减慢心率[10]。此外,温度对心脏起搏细胞的直接影响也可能是特定负荷下运动时心率降低的原因[11]。
1.2生化代谢 人体获得热习服后血浆容量扩张,全身水分可增加2~3 L或5%~7%[1],主要原因是保水保钠激素醛固酮及精氨酸加压素的分泌增加,以及饮食中补充的NaCl在机体内富集。钠的保持有助于维持细胞外液(extracellular fluid,ECF)渗透压,从而在反复热暴露期间维持或增加ECF容量[12]。热习服后总水分及ECF增加,血浆容量也会扩大,平均膨胀4%~15%,最大可能在3%~27%[13]。血浆容量扩张有两个明显的生理益处:(1)增加血管充盈以维持心血管稳定性;(2)增加血液比热以略微降低核心到皮肤的热传递[14]。
热习服后机体代谢下降,主要表现为线粒体mRNA的表达下调,从而降低全身及骨骼肌能量代谢[15],减少内源性产热。值得注意的是,热习服过程中机体核心温度及皮肤温度的降低,主要是由全身代谢产热、肌肉内源性产热减少推动,而不是由热量散失加快所推动的[16]。
1.3表观遗传 热习服后热休克蛋白(heat shock protein,HSP)转录活性增强及线粒体呼吸链钙释放增多。表观遗传是指在DNA序列不变的情况下,通过影响转录因子的活性,调节基因表达及改变表型的现象[17]。在热习服过程中,HSP的产生及线粒体呼吸链中钙流动发生的表观遗传修饰最为重要。热诱导的氧化应激反应促进了热休克转录因子(heat shock transcription factor 1,HSF1)的产生[18-19],同时热习服加速了HSP的表达[20]。HSF1调控HSPmRNA的方式主要有DNA甲基化、磷酸化及组蛋白修饰。甲基化能沉默特定基因,抑制基因转录[21]。在热习服大鼠模型中,DNA甲基化使miR-1及miR-206水平降低,促进了HSP70的合成[22]。甲基化的另一个作用是形成表观遗传记忆。脱习服1个月后,重新获得热习服只需要2 d的热运动刺激(而最初形成热习服需要约21 d)[2]。HSF1亦能以磷酸化的方式激活并促进HSP的转录表达[23];组蛋白修饰则是通过影响染色体结构域实现对单个基因的调控[24-25]。线粒体呼吸链主要影响机体的代谢能力,热习服后能量代谢降低的重要原因是线粒体钙含量升高[26]。热应激增加了氧气消耗,导致呼吸链中活性氧(reactive oxygen species,ROS)水平增加,造成细胞损伤[27],而钙刺激三羧酸循环酶及线粒体氧化磷酸化,减少ROS的产生,从而可防止细胞损伤及降低能量代谢[28]。HSP表达升高及线粒体呼吸链代谢降低对细胞的保护具有协同作用。HSP70能抑制热习服生物体中线粒体呼吸链的代谢过程,减少细胞内ROS的生成,改善热适应,最终促进热习服的形成[29]。
总之,获得稳定热习服的机体可通过降低体温、降低心率升高的幅度以及降低骨骼肌代谢以减少内源产热,通过更早更快地发汗加快外源散热,通过增加全身及血浆液体、减少钠损失来维持心血管稳定性,通过表观遗传修饰增加HSP的表达以增强耐热能力。这些全方位的适应调整,共同促进了机体热耐受能力的全面提升。人体热习服相关的表型适应及主要功能机制见表1。

表1 与人体热习服相关的表型适应及功能机制Tab.1 The phenotype adaptation and functional mechanisms related to human heat acclimatization
2 热习服的关键生物标志物
2.1 细胞保护蛋白HSP 人类HSP对湿热环境的应激反应一直是热习服领域研究的焦点[30]。HSP是一组催化新生蛋白及变性蛋白正确重折叠,提供加速修复及细胞保护作用的伴侣蛋白,能减少热应激反应及其引发的细胞损伤[31]。HSP家族按照分子量大小(27~110 kD)可分为HSP90家族、HSP70家族、HSP60家族及小分子量HSP家族(sHSP)[31]。与人类耐热性相关的主要是HSP70家族,其中HSP72最具热敏性及诱导性,故文献中一般以HSP72或HSP70代表HSP70家族。HSP70是适应性表达蛋白,在正常情况下几乎不表达,但在应激条件下如热变性或蛋白质错误折叠时,其mRNA转录活跃,蛋白表达升高[32]。HSP70在运动后即可升高,但1 h后基本恢复到训练前水平;而获得热习服后,细胞内HSP70的高表达会维持较长时间,从而推断这种细胞内的适应性改变可能会增强机体的热耐受能力[33]。中暑易感人群与热耐受者的基础HSP70水平存在明显差异,表明人类耐热性可能是通过HSP系统上调介导的,HSP70是潜在的鉴别热适应良好者(热区士兵、消防员、运动员等)与较差者的关键遗传指标[34]。
2.2 汗液中的离子标志物 一直以来,人们对通过汗液诊断疾病或预测体内物质的变化颇感兴趣[35]。将汗液作为血液分析的非侵入性替代方法,对判断人体生理状态及健康状况具有潜在的应用价值。相比血液,汗液大样本采集更加简便,人群接受度高。已有报道采用可穿戴设备联合汗液诊断传感技术(即利用汗液中氯含量升高)可有效筛查囊性纤维化患者[36]。汗液的主要成分是水及氯化钠[37]。研究显示,汗液中Na+、Cl-浓度的变化趋势与其在血浆中的变化具有高度一致性,即汗液中Na+、Cl-可用于跟踪热习服的进程[38]。在探索热习服相关的汗液变化研究中,Na+、Cl-表现出较快的反应[7]。热习服能减少血液中Na+、Cl-的损失,同时降低汗液中Na+、Cl-浓度[7]。它对机体的保护作用至少有两个方面:(1)降低汗液渗透压,使热习服机体有更多的溶质留在细胞外液,以施加渗透压维持血浆容量[39];(2)低渗的汗液更有利于蒸发散热。
汗液中令研究者感兴趣的成分还有K+及乳酸。与Na+、Cl-不同,汗腺导管中缺乏K+的重吸收机制。尽管环境条件或运动强度会发生变化,但汗液K+浓度似乎相对恒定[40]。汗液中的乳酸与来自肌肉运动的血乳酸无关,它仅仅表明汗腺的糖酵解活性[41]。因此,汗液K+及乳酸均不能反映热习服的进程。观察近5年国内外研究者关于热习服后体液中潜在生物标志物变化的研究进展[42-51](表2),多数研究结果尚未得到一致认可,且这些标志物在汗液及血浆中是否一致尚不清楚,故在人群中的应用需谨慎对待。

表2 热习服相关的潜在体液标志物研究Tab.2 Research on the potential humoral markers related to heat acclimatization
2.3 骨骼肌的能量代谢 机体在热环境下运动能力的提高与骨骼肌的能量代谢密切相关[52-53]。骨骼肌能量代谢中细胞间质、T管、细胞内的离子跨膜示意图(图1)显示[54-55]:人体骨骼肌肌膜包括表面肌膜及T管膜,电刺激或运动过程中的主要离子流途径包括K+通过延迟整流K+通道、K+/ATP通道及K+/Ca2+通道外流,Na+通过电压依赖性Na+通道及牵张激活通道内流,Ca2+通过L型钙通道、牵张激活通道及储藏通道内流,Cl-通过ClC-1通道内流。Na+-K+泵起到维持Na+、K+浓度梯度的作用。骨骼肌细胞的兴奋收缩、抵抗疲劳及运动耐力与Ca2+诱导的肌丝滑动[56]及Na+-K+-ATP酶[57](钠钾泵)密切相关。肌浆Ca2+促进有氧氧化中糖原的快速分解[58];Ca2+促使肌球蛋白与肌动蛋白相互作用,产生经典的肌丝滑动[56]。因此,细胞质中Ca2+浓度越高,骨骼肌的收缩及舒张转换就越快。骨骼肌中钠钾泵含量及Na+/K+转运活性升高共同促进了骨骼肌的能量代谢过程[57]。钠钾泵活性主要与血浆K+浓度有关。骨骼肌兴奋收缩完成后细胞内K+外流、细胞外Na+内流,造成细胞外K+积累,是导致骨骼肌收缩能力下降的重要原因[55]。热习服训练可改善K+稳态,即减少细胞内K+外流或促进细胞外K+的清除,从而维持骨骼肌较高的收缩性能[59]。与细胞外K+累积造成的抑制结果相似,电压门控氯通道开放(细胞外Cl-内流)的大幅增加会导致骨骼肌兴奋性降低、收缩能力下降及容易疲劳[60]。磷在骨骼肌能量代谢中的作用尚不明确。一方面骨骼肌收缩能力下降可以部分归因于无机磷酸的积累,并间接导致肌浆网Ca2+释放减少[61];另一方面,磷可能诱导热休克蛋白的合成增加[62]。然而,最近的一项研究发现,在运动中补充磷酸盐对骨骼肌运动能力无影响[63]。

图1 骨骼肌能量代谢中细胞间质、T管、细胞内的离子跨膜示意图Fig.1 Schematic diagram of intercellular substance, T-tube and intracellular ion transmembrane in skeletal muscle energy metabolism
综上,血浆中适度高Na+、高Cl-、高Ca2+及低K+有助于增强机体耐热能力并促进热习服的形成,可作为热习服研究的潜在目标。但是,热习服的形成是机体功能全方位提升的过程,是多种分子、离子交互作用的综合结果,上述离子的确切效应还需获得更多的研究支持。
目前对于热习服的关键生物标志物尚需在人群中进行科学的评价。研究者可结合国内外的传统标准[64-66],通过在大样本人群中对关键生物标志物的检测,获得标志物的灵敏度及特异度,从而进行客观评估。
3 热适应相关的遗传基础
3.1 原住民的热适应 有遗传基础的热适应与热习服的急性反应不同,它体现出一种长期慢性进化的过程,是经过几代人自然选择的结果,能导致某些优势耐热基因的积累及遗传。生活在炎热环境(如南亚、非洲、澳大利亚)中的原住民表现出来的进化上的热适应,包括形态变化及功能调整等[8]。形态适应方面表现为最大表面积与体重比,较大的体表面积可增加汗液蒸发面积,较轻的体重则可减少身体的总热量,从而增强机体在炎热环境中的体温调节能力[67]。功能调整方面,表现为汗腺激活能力改善及静息代谢率降低[8]。如前文所述,出汗更早更快是短期热习服引起的变化之一[1],最后这些短期调整可能进化成了长期适应[8]。有研究发现炎热地区的印第安人在休息及睡眠时核心温度较低,可能与其较低的静息代谢率有关[8]。然而,原住民长期适应产生的形态及功能变化是环境或生活方式可塑性引起的表型变异或是基因变异,长期以来都没有足够的证据将它们区分。以下两项研究可能有助于将上述生理及形态差异归因于遗传起源:一是一项移民流行病学研究提示,热带地区原住民的平均体重低于移民的体重,其中,婆罗洲土著的平均体重为46 kg,而移民者的平均体重为51 kg[68],二是有研究发现大约50个基因的表达水平会随着热环境应激程度的不同而改变[69]。因此,通过基因与环境相互作用进化而来的热适应能力在不同人群中存在差异。
3.2 全基因组关联分析策略筛选耐热基因 近年来,随着全基因组关联分析(genome-wide association study,GWAS)技术的广泛应用,为系统了解热适应表型及遗传的关联性[70]、甄别不同热适应能力人群提供了新的视角。目前利用GWAS大样本分析及高密度单核苷酸多态性(single nucleotide polymorphism,SNP)分子标记已经定位了上千个与复杂疾病相关的遗传SNP位点[71-72]。GWAS及SNP技术可用于解释特定性状的大部分遗传变异,已被广泛用于研究人体复杂性状的遗传结构[73],最新研究已经用于发现新型冠状病毒肺炎新的遗传生物标志[74]。热习服可以提高人体在热环境中的作业能力,但是同样的热习服训练对不同人群的效果却不同,部分人员经过一段时间能进入热习服状态,然而也有些人员即使经过训练也难以适应热环境。未来研究可通过GWAS大数据分析影响人群耐热表型的表达数量性状位点(expression quantitative trait locus,eQTL),确定SNP影响的主要耐热功能基因及信号通路,以此挖掘耐热基因并用于甄别不同热适应能力的人群。GWAS策略探索表型及基因型相关性的流程见图2。
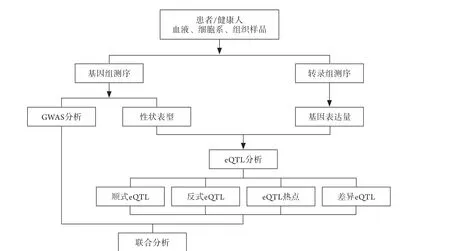
图2 全基因组关联分析(GWAS)策略探索表型及基因型相关性Fig.2 GWAS strategy to explore the correlation between phenotype and genotype
4 总结与展望
机体体温调节系统的可塑性决定了对极端热环境刺激的适应性及极端温度条件下作业能力的发挥。增强体温调节系统的可塑性与先天遗传易感性、后天训练导致表观遗传修饰引起的基因表达改变及信号通路活化具有相关性。热习服训练可使机体在生理功能、生化代谢及表观遗传等各个方面得到进行性增强。同时,在热习服过程中,机体血液、汗液中各种分子标志物的改变,如血液中HSP及汗液中的Na+、Cl-浓度的变化在不同热适应能力人群中存在显著差异,这种差异具有潜在的遗传基础。探索与热适应能力相关的遗传位点及其信号通路,进而甄别不同的热适应人群,研发预防热损伤、提高耐热能力的药物以及热射病的预警监测设备,可作为未来的研究方向。
