大黄对脓毒症患者血管内皮细胞功能的保护作用
2022-12-20何龙平窦建林钟林翠林青伟余甜宋景春
何龙平,窦建林,钟林翠,林青伟,余甜,宋景春*
1江西中医药大学研究生院,江西南昌 330004;2解放军联勤保障部队第908医院重症医学科/南昌市血栓止血学重点实验室,江西南昌 330002
脓毒症是由宿主对感染反应失调所致的危及生命的器官功能障碍,是重症患者死亡的主要原因之一[1-3]。据统计,全球每年脓毒症发病人数超过3100万,死亡600万,由于中低收入国家脓毒症流行病学数据缺失,其全球累计发病率还可能被低估[4-5]。发生脓毒症时内毒素可导致内皮细胞损伤,从而激活凝血及免疫系统,以达到控制感染的目的[6]。内皮细胞损伤持续加重可导致凝血功能障碍,甚至发展为致命的弥散性血管内凝血(disseminated intravascular coagulation,DIC)[7-8]。因此,严重或持续的内皮细胞功能障碍是脓毒症发生发展的关键环节[9],保护血管内皮细胞也成为治疗脓毒症的重要手段之一[10-11]。大黄是中医学治疗血证的经典药物,现代药理学研究表明,大黄具有抗炎、减轻氧化应激、调节胃肠道功能、改善微循环障碍、纠正凝血功能紊乱及增强免疫等作用[12-15],但其对血管内皮细胞功能的影响目前研究较少。本研究采用大黄治疗脓毒症患者,旨在评价大黄对脓毒症患者血管内皮细胞功能的保护作用。
1 资料与方法
1.1一般资料 本研究采用前瞻性单中心随机对照设计,选取2020年7月-2021年9月解放军联勤保障部队第908医院ICU收治的脓毒症患者41例。纳入标准:(1)符合2016年Sepsis 3.0诊断标准[1]:疑似或确认感染,序贯器官衰竭(SOFA)评分≥2分可诊断为脓毒症;(2)年龄≥18岁。排除标准:(1)近1个月内服用过可引起凝血功能异常或血小板减少的药物;(2)存在可引起血小板变化的其他疾病如血小板减少性紫癜、脾功能亢进等;(3)血液系统恶性肿瘤;(4)慢性肝功能不全;(5)先天性凝血功能障碍。本研究经解放军联勤保障部队第908医院伦理委员会批准(LC2018003/908yyLL208),患者和(或)家属对本研究知情并签署知情同意书。
1.2分组及治疗方法 依据随机数字表法将41例患者随机分为大黄治疗组(20例)与对照组(21例)。大黄治疗组根据《中国严重脓毒症/脓毒性休克治疗指南》[16]采取以液体复苏、抗感染及器官支持为主的基础治疗联合大黄治疗。大黄治疗方案为经鼻胃管灌喂大黄15 g/d,连续给药3 d[17]。大黄配制方法:将15 g大黄放入100 ml沸水浸泡10 min,待温度适宜后,去渣取汁,经鼻胃管灌注。灌胃前排空患者胃内容物,灌胃结束后,夹闭胃管0.5~1.0 h。对照组采取与大黄治疗组同样的基础治疗,同时联合生理盐水灌胃。
1.3观察指标 测量患者入住ICU时的平均动脉压。分别于给药前、给药24 h、给药72 h采血,采用BC-6900全自动血细胞分析仪(中国迈瑞生物医疗电子股份有限公司)检测白细胞计数、血小板计数、血小板分布宽度、血红蛋白水平;采用BS2000生化仪(中国迈瑞生物医疗电子股份有限公司)检测谷丙转氨酶、谷草转氨酶及血肌酐水平;采用TOP700全自动凝血分析仪(美国Werfen公司)检测凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,AP TT)、凝血酶时间(thrombin time,TT)、纤维蛋白原、纤维蛋白原降解产物(plasma fibrin degradation products,FDP)、D-二聚体及抗凝血酶Ⅲ(antithrombin Ⅲ,AT-Ⅲ)水平;采用Sysmex HISCL-800自动化学发光免疫检测系统(日本Sysmex公司)检测降钙素原、血栓调节蛋白(thrombomodulin,TM)、凝血酶-抗凝血酶复合物(thrombin-antithrombin complex,TAT)、纤溶酶-α2抗纤溶酶复合物(plasmin-α2-antiplasmin complex,PIC)、组织型纤溶酶原激活剂-纤溶酶原激活剂抑制剂-1复合物(t-PAIC)水平。计算急性生理与慢性健康Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHE Ⅱ)评分、序贯器官衰竭评分(Sequential Organ Failure Assessment,SOFA)、DIC评分,记录患者在ICU内的治疗时间及治疗14 d的预后。
1.4 临床资料分析 比较两组脓毒症患者一般资料,以及不同时点的感染指标、凝血功能、血管内皮分子标志物水平。采用Kaplan-Meier法绘制生存曲线,用Log-rank检验比较两组脓毒症患者生存情况。
1.5 统计学处理 采用SPSS 26.0软件进行统计分析。计数资料以例(%)表示,组间比较采用χ2检验。计量资料采用单样本S-W法进行正态分布检验。正态分布数据以±s表示,两组比较采用t检验,多组间比较,方差齐者采用单因素方差分析,进一步两两比较采用LSD-t法,方差不齐者采用Tamhane's T2法;非正态分布数据以M(Q1,Q3)表示,两组比较采用非参数Mann-WhitneyU检验,多组比较采用Kruskal-Wallis法。P<0.05为差异有统计学意义。
2 结 果
2.1 两组脓毒症患者一般资料比较 两组年龄、性别、平均动脉压、红细胞计数、血红蛋白、感染部位、谷丙转氨酶、谷草转氨酶、血肌酐、APACHEⅡ评分、SOFA评分、DIC评分、ICU住院时间和14 d病死率之间差异无统计学意义(P>0.05,表1)。
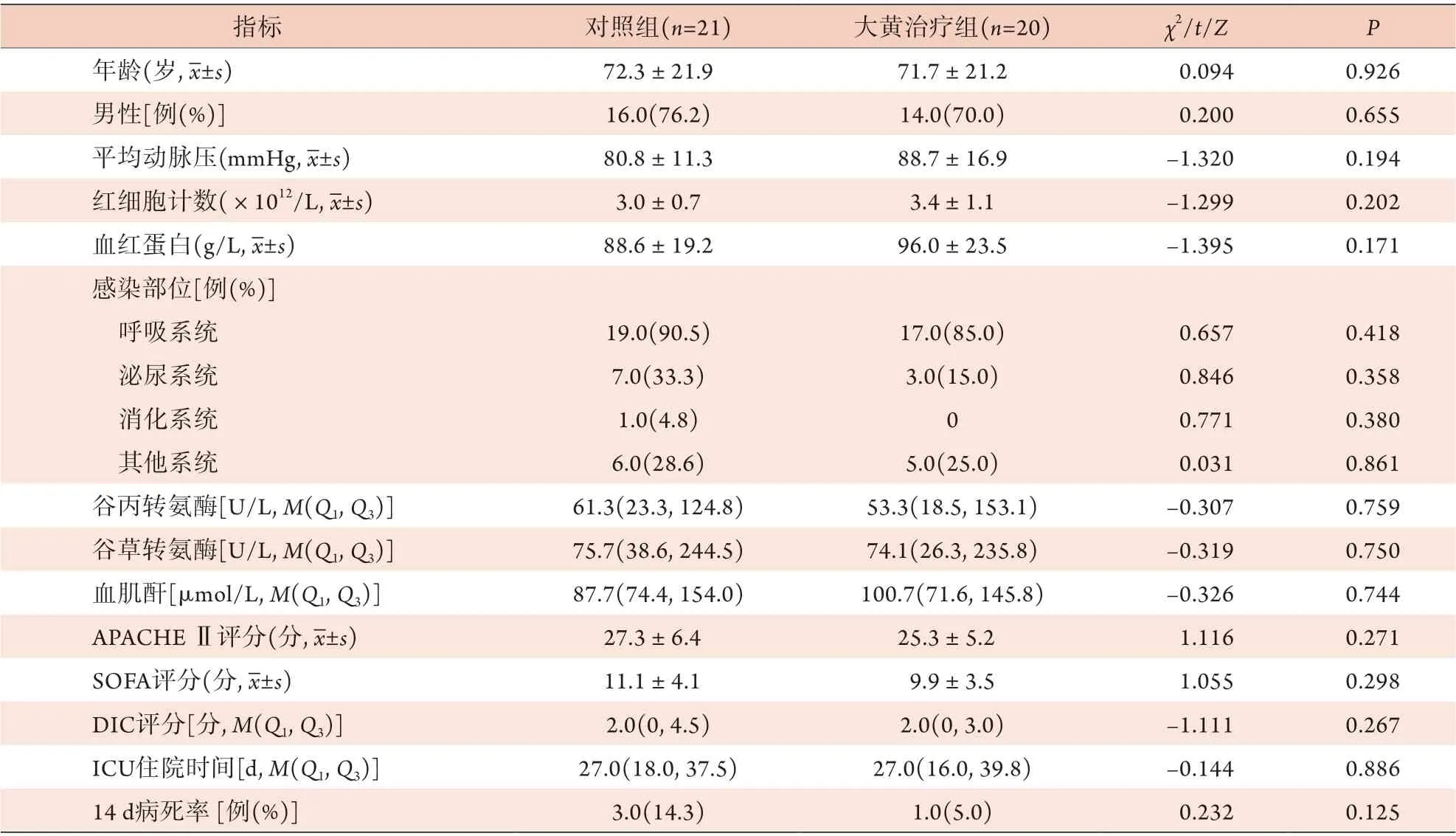
表1 两组脓毒症患者一般资料比较Tab.1 Comparison of general data between two groups of patients with sepsis
2.2 两组脓毒症患者不同时点的感染指标比较对照组与治疗组不同时点的白细胞计数、C反应蛋白及降钙素原水平差异无统计学意义(P>0.05,表2)。

表2 两组脓毒症患者不同时点感染指标比较[M(Q1, Q3)]Tab.2 Comparison of infection indexes at different time points between the two groups of patients with sepsis [M(Q1, Q3)]
2.3 两组脓毒症患者不同时点凝血功能指标比较
大黄治疗组72 h的纤维蛋白原水平显著高于对照组72 h,较大黄治疗组给药前的纤维蛋白原水平也明显升高,差异有统计学意义(P<0.05)。两组不同时点的PT、APTT、TT、FDP、D-二聚体、AT-Ⅲ、血小板计数、血小板分布宽度、TAT、PIC差异均无统计学意义(P>0.05,表3)。
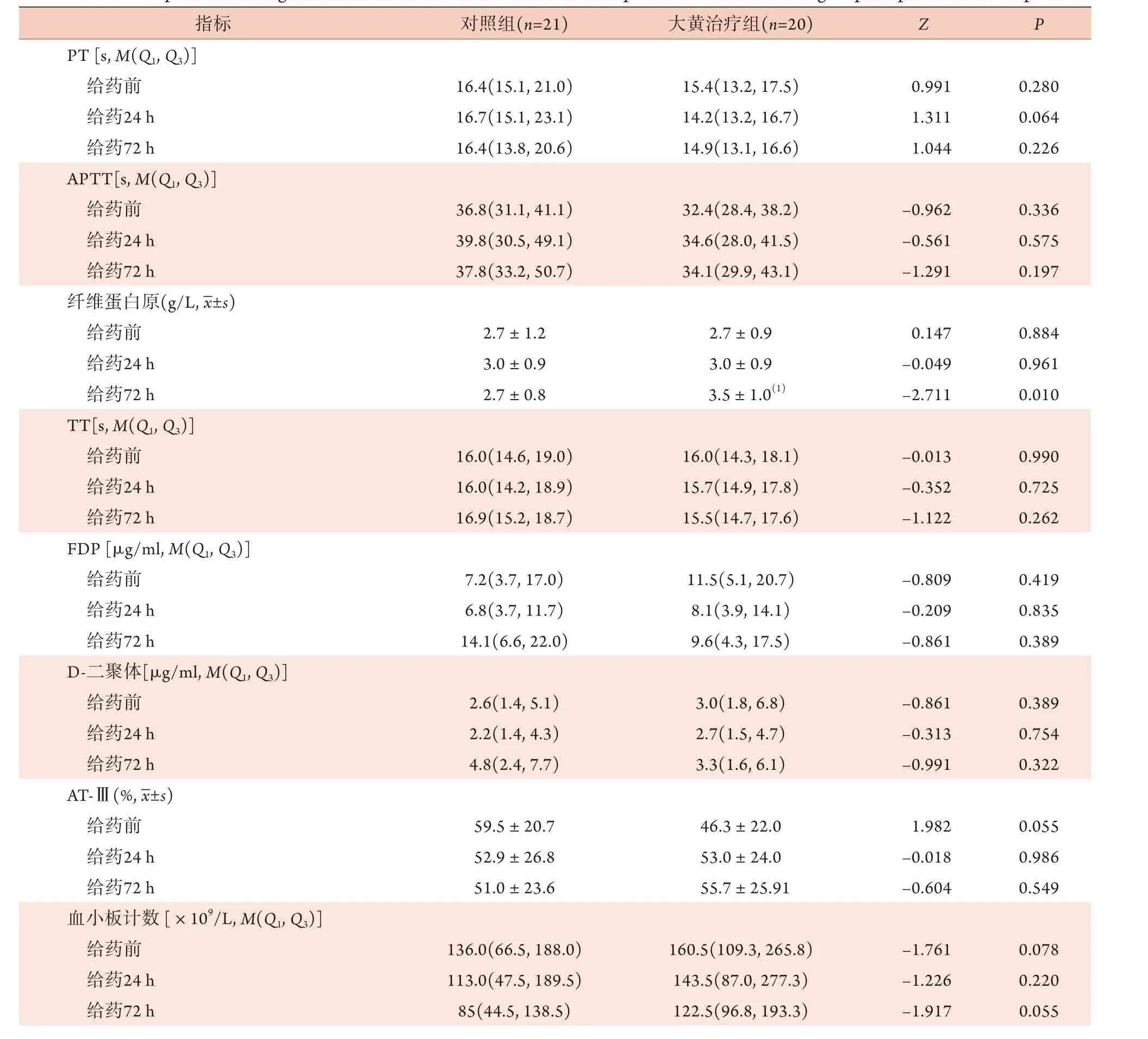
表3 两组脓毒症患者不同时点的凝血功能指标比较Tab.3 Comparison of coagulation function indexes at different time points between the two groups of patients with sepsis
2.4 两组脓毒症患者不同时点血管内皮分子标志物比较 对照组72 h的TM、t-PAIC水平高于大黄治疗组72 h,差异有统计学意义(P<0.05);在对照组内,给药72 h的TM、t-PAIC高于给药前,差异有统计学意义(P<0.05);在大黄治疗组内,给药72 h的TM低于给药前及给药24 h,差异有统计学意义(P<0.05,表4)。

表4 两组脓毒症患者不同时点的TM、t-PAIC水平比较[M(Q1, Q3)]Tab.4 Comparison of TM and t-PAIC at different time points between the two groups of patients with sepsis [M(Q1, Q3)]
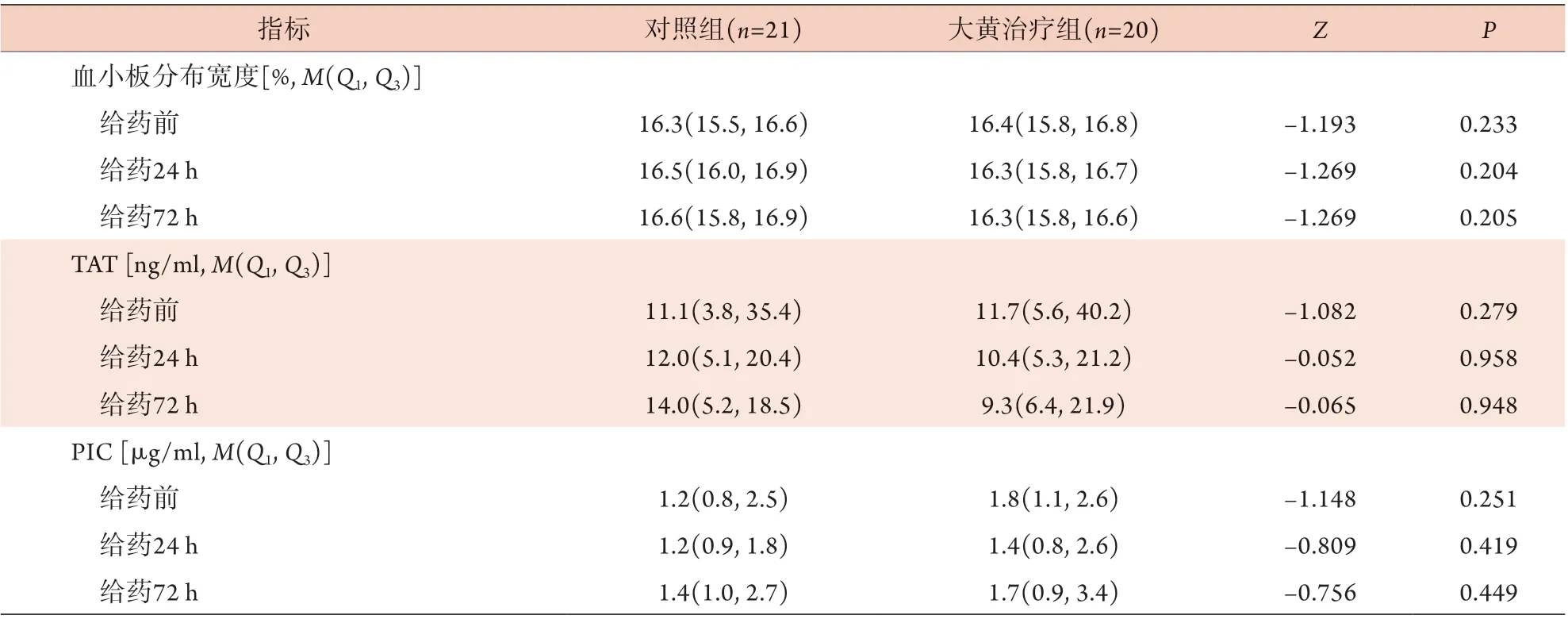
(续 表)
2.5 两组脓毒症患者生存情况比较 对照组与大黄治疗组的14 d生存率比较差异无统计学意义(P>0.05,图1)。
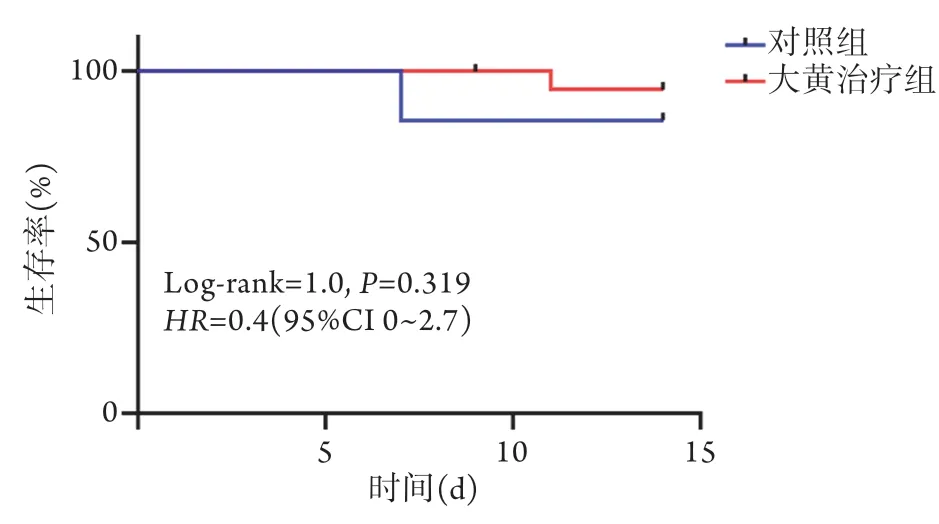
图1 两组脓毒症患者的14 d生存曲线Fig.1 14-day survival curve of patients with sepsis in the two groups
3 讨 论
血管内皮功能障碍在脓毒症发生发展中发挥了关键作用[18]。脓毒症发生时,病原体诱发炎症级联反应,此时血管内皮细胞被激活,上调白细胞黏附分子,增强免疫反应,释放中性粒细胞外诱捕网等活性因子,促进免疫血栓形成,以达到控制感染的目的。但持续的炎症反应可引起肿瘤坏死因子、白细胞介素-1、白细胞介素-6等大量细胞因子释放,导致全身性炎症反应,反而引起内皮细胞损伤[19]。血管内皮细胞持续损伤可导致大量组织因子入血,使促凝活性增加,生理性抗凝物质活性下降,凝血酶大量生成,促进凝血功能障碍,同时毛细血管通透性增加,形成毛细血管渗漏,导致组织有效灌注不足,促发器官功能障碍[20-21]。
TM是由内皮细胞分泌的一种质膜蛋白,可与凝血酶结合形成复合物促进蛋白C活化发挥抗凝作用[22]。当内皮细胞受损时,TM被水解成可溶性血栓调节蛋白并释放入血,导致血浆TM水平明显升高,可反映血管内皮细胞损伤[23-24]。t-PAIC是活化的组织型纤溶酶原激活物(tissue plasminogen activator,t-PA)与纤溶酶原激活物抑制物(plasminogen activator inhibitor-1,PAI-1)1:1结合形成的,t-PA及PAI-1主要由内皮细胞合成,t-PAIC升高提示血管内皮细胞持续受损[25-28]。本研究结果显示,与对照组72 h相比,大黄治疗组72 h的TM、t-PAIC降低,表明大黄能减轻脓毒症患者的内皮细胞损伤。Jin等[29]研究147例新型冠状病毒肺炎患者的凝血功能指标发现,死亡组的TM、t-PAIC较生存组明显升高,内皮损伤明显更重,与本研究结果一致。既往研究显示,肿瘤坏死因子可通过激活细胞信号转导通路促使细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule 1,VCAM-1)及内皮白细胞黏附因子-1(endothelial leukocyte adhesion molecule-1,ELAM-1)等细胞因子释放,进而促进单核细胞及内皮细胞的黏附。大黄素是中药大黄的主要活性成分之一,可发挥核因子-кB的天然抑制剂作用,能够抑制ICAM-1、VCAM-1及ELAM-1等细胞因子的释放,减轻炎症对血管内皮细胞的损伤[30]。Cui等[31]研究发现,大黄还能通过拮抗基质金属蛋白酶-9来降低血管内皮细胞钙黏连蛋白的浓度,从而发挥调控人脐静脉内皮细胞通透性的作用。
纤维蛋白原作为一种急性时相反应蛋白,脓毒症时可因炎症刺激导致其在肝脏的合成增多,从而表现为血浆水平明显升高。随着病情加重,肝脏合成纤维蛋白原的能力下降,且纤维蛋白原的消耗增加,导致纤维蛋白原水平出现进行性下降[32]。本研究发现,大黄治疗组72 h的纤维蛋白原水平明显高于大黄治疗组给药前及对照组72 h的纤维蛋白原水平,与本课题组前期在盲肠结扎鼠脓毒症模型上的结果一致,提示大黄可通过保护血管内皮减轻异常凝血活动,从而减少凝血底物消耗[15]。
张娴[33]对368例危重症患者开展的回顾性研究发现,大黄组的ICU住院时间明显短于常规治疗组[12(9~18) dvs. 14(9.5~21) d],差异有统计学意义。但本研究中大黄治疗组与对照组的ICU住院时间无明显差异,究其原因,本研究中纳入的脓毒症患者的APACHE Ⅱ评分[(27.3±6.4)分]明显高于张娴[30]研究的患者[(13.7±6.0)分],提示本研究纳入的患者病情更危重。本研究中两组脓毒症患者的14 d生存率差异无统计学意义,表明在本研究条件下大黄不能改善脓毒症患者的结局。
综上所述,脓毒症发生时可因血管内皮细胞损伤导致TM及t-PAIC升高,大黄具有保护脓毒症患者血管内皮细胞功能的作用。作为一项单中心研究,样本量偏小是本研究的不足之处,下一步应继续扩大样本量并进行多中心队列研究,以验证大黄对脓毒症患者血管内皮细胞功能的保护作用。
