嗜酸乳杆菌LA-GHB1756对阿司匹林引起的小鼠肠道炎症的影响
2022-12-20张丽娟田欣圆赵璟石瑞文张烨关海滨
张丽娟,田欣圆,赵璟,石瑞文,张烨,关海滨*
1内蒙古医科大学附属医院内分泌科,内蒙古呼和浩特 010110;2内蒙古医科大学药学院,内蒙古呼和浩特 010110
非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)具有解热、镇痛、抗炎等作用,在临床上被广泛用于心脑血管疾病、风湿免疫性疾病、骨关节疼痛、发热等的治疗[1-2]。但大量研究表明,长期应用NSAIDs会导致肠道黏膜损伤[3],其机制是NSAIDs抑制环氧合酶(cyclooxygenase,COXs),进而阻断前列腺素(prostaglandin,PGs)这类具有胃肠道黏膜保护作用的局部激素的生成。长期的肠道黏膜损伤可导致小肠、结肠部位出现溃疡、出血、穿孔及慢性缺铁性贫血等并发症。有研究表明,服用NSAIDs的人群中50%以上出现不同程度的肠黏膜损伤,可导致溃疡(发生率为4.5%)、溃疡性出血(发生率为1%)等[4-7]。目前尚无针对这类不良反应的有效预防及处理措施。
嗜酸乳杆菌(Lactobacillus acidophilus,LA)属于乳杆菌属,为人体肠道的一种益生菌,可定植于肠道细胞表面,维持肠道菌群的微生态平衡,参与营养物质的消化、吸收及代谢等过程[8-10]。LA具有改善肠道功能、抑制病原微生物入侵、免疫增强、抗肿瘤等作用,已被广泛应用于肠道微生物感染、肠易激综合征(irritable bowel syndrome,IBS)及溃疡性肠病等疾病的预防和治疗[11-14]。NSAIDs在损伤肠道黏膜的同时,也能影响肠道菌群构成,导致炎症应答失调,从而增加病原微生物感染的风险,加重IBS症状,诱发溃疡性肠病[15]。本研究采用嗜酸乳杆菌LA-GHB1756干预长期大量应用NSAIDs诱导的小鼠肠炎,探讨LA-GHB1756对肠黏膜的保护作用,以期为LA-GHB1756的应用提供依据。
1 材料与方法
1.1 材料 嗜酸乳杆菌LA-GHB1756由本实验室保存。40只6~8周龄BALB/c雄性小鼠购自本校动物实验中心,体重18~22 g。阿司匹林(货号:A2093,美国Sigma公司);髓过氧化物酶(MPO)检测试剂盒(货号:A0441-1-1,南京建成生物工程研究所)。肿瘤坏死因子(tumor necrosis factor,TNF)-α检测试剂盒(货号:PT512)、白细胞介素-6(interleukin-6,IL-6)检测试剂盒(货号:PI326)、细胞裂解液(货号:P0013)、细胞核蛋白与细胞质蛋白抽提试剂盒(货号:P0027)、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(货号:P0012S)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)一抗(货号:AF0261)、核转录因子-κB(nuclear transcription factor-κB,NF-κB p65)一抗(货号:AF1234)均购自上海碧云天生物技术有限公司。其他试剂均为国产分析纯。
1.2 实验方法
1.2.1 动物分组及给药 将小鼠适应性喂养1周,随机分为4组,分别为空白对照组、阿司匹林组、LA低剂量组、LA高剂量组,每组10只。除空白对照组外,其余各组小鼠给予0.5 mg/(100 g·d)的阿司匹林溶液连续灌胃8周引起肠黏膜损伤;LA低剂量组及LA高剂量组在给予阿司匹林的同时给予LAGHB1756菌液灌胃,LA低剂量组的剂量为2000菌落形成单位(cfu)/(100 g·d),LA高剂量组的剂量为10 000 cfu/(100 g·d),给药时间与阿司匹林相同,空白对照组及阿司匹林组给予同等体积的生理盐水灌胃。8周后取血并处死小鼠,摘取小鼠结肠,生理盐水冲洗,横切一半放入4%甲醛溶液浸泡,其余组织存于液氮中冷冻保存备用。实验过程符合国家和单位有关实验动物的管理和使用规定。
1.2.2 一般情况观察 每周观察并记录小鼠体重、排便情况及毛发色泽等一般情况。
1.2.3 结肠形态及病理学观察 取小鼠结肠,格尺拍照,记录长度。截取1 cm长的组织,冲洗内壁,4%甲醛溶液固定,脱水,石蜡包埋,切片,HE染色,放置二甲苯中浸泡3次,每次10 min脱蜡,将切片分别在无水乙醇、90%乙醇、80%乙醇中各浸泡2 min,纯净水冲洗2 min。用苏木精染色3 min,浸泡于0.2%的盐酸乙醇中分化5 s,纯净水冲洗,伊红染色2 min。切片分别在80%乙醇、90%乙醇、无水乙醇中各浸泡5 min,二甲苯浸泡2次,每次10 min。切片滴加中性树脂封片,盖上盖玻片,晾干后于400倍显微镜下观察并拍照。
1.2.4 ELISA法检测肠组织MPO含量 精密称定100 mg肠组织样品,液氮冷冻研磨,10 000 r/min离心10 min,加入细胞裂解液提取总蛋白,BCA法测定蛋白浓度。按MPO试剂盒说明书操作,每50 mg组织加入960 μl缓冲液混匀制备成5%的组织匀浆液。吸取900 μl组织匀浆液,加100 μl反应试剂一,于37 ℃反应15 min得到样品,吸取200 μl样品加200 μl反应试剂四,加3 ml显色剂,于37 ℃反应30 min,加50 μl试剂七60 ℃反应10 min,终止反应,于460 nm波长处测定光密度(OD)值,以纯净水为空白对照。按以下公式计算MPO含量:MPO含量=(测量OD值-空白OD值)/11.3×取样量。
1.2.5 ELISA法检测血清TNF-α及IL-6浓度 将全血室温放置2 h,于4 ℃下2000 r/min离心10 min得到血清,吸取100 μl血清加入待测孔内,用封板膜封住反应孔,室温孵育2 h,洗板5次,最后一次置于厚吸水纸拍干,每孔加入100 μl生物素化抗体,封板室温孵育1 h,洗板5次,吸水纸拍干。每孔加入100 μl辣根过氧化物酶标记的链霉亲和素,封板室温孵育20 min,洗板5次,吸水纸拍干。每孔加入100 μl的3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)显色剂,封板室温孵育20 min,每孔加入50 μl终止液,于460 nm波长处测定OD值。以纯净水为空白对照,以标准品制作标准曲线,根据标准曲线计算TNF-α及IL-6浓度。
1.2.6 Western blotting检测肠组织NF-κB p65表达量 精密称定500 mg肠组织样品,剪成细小的碎片,按20:1的比例混合抽提试剂A和试剂B,得到组织匀浆液,将500 mg肠组织加入1667 μl组织匀浆液中,冰浴15 min,于4 ℃下1500 r/min离心5 min,吸取上清液,沉淀加1 ml含苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的抽提试剂A,剧烈震荡5 s,冰浴15 min,加入50 μl抽提试剂B,剧烈震荡5 s,冰浴1 min,再次剧烈震荡5 s,于4 ℃下15 000 r/min离心5 min,吸去上清液。将沉淀加入250 μl含PMSF的核蛋白抽提试剂,剧烈震荡30 s,放置冰浴,每隔2 min剧烈震荡30 s,共30 min,于4 ℃下15 000 r/min离心10 min,吸取上清液即为细胞核蛋白。将细胞核蛋白加入SDSPAGE蛋白上样缓冲液,100 ℃水浴加热5 min变性。将10 μl样品加到胶孔内,浓缩胶电压100 V,样品进入分离胶后,设置电压150 V进至溴酚蓝到底部。切除浓缩胶,分离胶转膜,400 mA恒流转膜40 min。使用Western快速封闭液浸泡膜封闭30 min,4 ℃一抗孵育过夜,洗涤3次,每次5 min,二抗室温孵育1 h,洗涤3次,每次5 min。ECL法显色,以PCNA为内参计算蛋白的相对表达量。
1.3 统计学处理 采用SPSS 17.0软件进行统计分析。实验数据以±s表示,组间比较采用单因素方差分析,进一步两两比较方差齐时采用LSD-t检验,方差不齐时采用Tamhane's T2法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况比较 对照组小鼠体重平稳增长,饮食情况良好,毛发较润泽,大便呈颗粒状,精神状况良好,第8周的体重为(24.1±0.6) g。阿司匹林组小鼠在第6~8周出现腹泻,毛发稀疏无光泽,黏液样便,精神萎靡,活动减少,第8周的体重为(21.6±0.5) g,明显低于对照组,差异有统计学意义(P<0.05)。LA低剂量组小鼠饮食情况有所改善,大便逐渐成形,精神状况有所改善,第8周的体重为(22.8±0.4) g,高于阿司匹林组,差异有统计学意义(P<0.05)。LA高剂量组小鼠饮食情况明显改善,大便逐渐成形,精神状况有所改善,第8周体重为(23.1±0.3) g,明显高于阿司匹林组,差异有统计学意义(P<0.05,图1)。
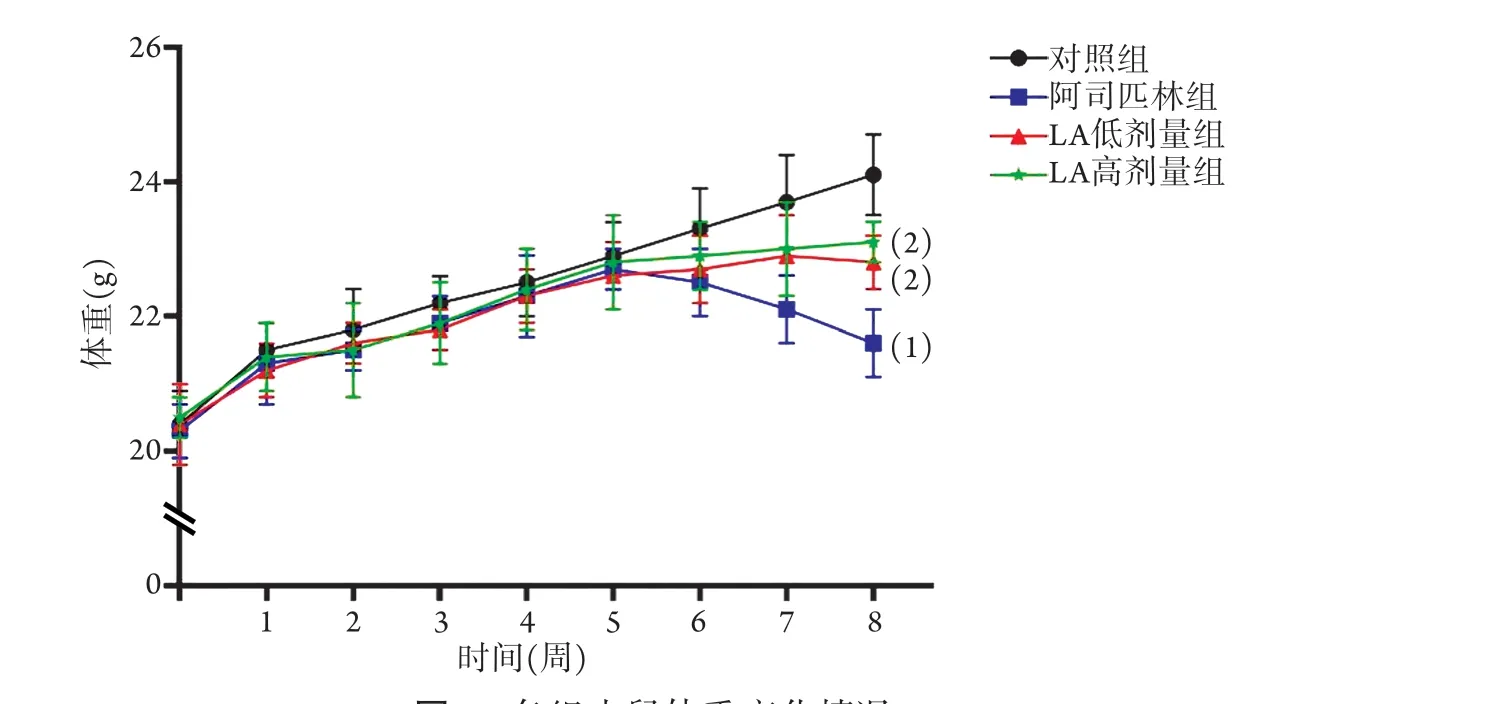
图1 各组小鼠体重变化情况Fig.1 Weight change of mice in each group
2.2 各组小鼠结肠形态及病理学检查结果 对照组小鼠结肠形态正常,长度(7.87±0.06) cm,其余组小鼠结肠明显缩短变粗,且伴有炎症、充血现象(图2A)。阿司匹林组小鼠结肠长度为(5.80±0.43) cm,小于对照组,差异有统计学意义(P<0.05);LA低剂量组小鼠结肠长度为(6.17±0.15) cm,与阿司匹林组比较无明显差异(P>0.05);LA高剂量组小鼠结肠长度为(6.50±0.26) cm,明显长于阿司匹林组,差异有统计学意义(P<0.05,图2B)。小鼠结肠HE染色结果显示,在第8周时对照组小鼠肠黏膜结构完整;阿司匹林组小鼠肠黏膜明显水肿、炎症,伴有大量空泡;LA干预组肠黏膜水肿程度、炎症程度明显减轻,空泡减少,且随着给药剂量的加大,炎症的缓解程度更加明显(图2C)。

图2 各组小鼠结肠形态(A)、长度(B)及病理学变化(C)Fig.2 Colon macroscopic (A), length (B) and pathological changes (C) of mice in each group
2.3 各组小鼠肠组织MPO含量比较 对照组小鼠肠组织MPO含量为(15.01±2.57) pg/mg,阿司匹林组为(95.90±11.34) pg/mg,阿司匹林组高于对照组,差异有统计学意义(P<0.05)。LA低剂量组及LA高剂量组小鼠肠组织的MPO含量分别为(76.03±8.72) pg/mg和(51.40±9.12) pg/mg,均低于阿司匹林组,差异有统计学意义(P<0.05,图3A)。
2.4 各组小鼠血清TNF-α及IL-6浓度比较 对照组小鼠血清TNF-α、IL-6浓度分别为(43.5±6.56) pg/mg、(6 6.2 5±9.8 1) p g/m g,阿司匹林组分别为(238.75±17.80) pg/mg、(292.00±15.51) pg/mg,均高于对照组,差异有统计学意义(P<0.05)。LA低剂量组TNF-α和IL-6浓度分别为(207.75±12.04) pg/mg、(250.25±11.50) pg/mg,L A高剂量组分别为(80.25±10.24) pg/mg、(108.50±13.38) pg/mg,均低于阿司匹林组,差异有统计学意义(P<0.05,图3B)。

图3 各组小鼠肠组织MPO含量(A)及血清TNF-α和IL-6浓度(B)比较Fig.3 Comparison of MPO content in intestinal tissue (A) and TNF-α and IL-6 expression in serum (B) of mice in each group
2.5 各组小鼠肠组织NF-κB p65表达量比较 与对照组(1.00)比较,阿司匹林组小鼠肠组织NF-κB p65的相对表达量明显增高,是对照组的5.07倍,差异有统计学意义(P<0.05)。使用LA干预后,LA低剂量组及LA高剂量组中NF-κB p65的表达量分别降低至阿司匹林组的83.74%和82.95%,与阿司匹林组比较,差异有统计学意义(P<0.05,图4)。

图4 各组小鼠肠组织NF-κB p65表达量比较Fig.4 Comparison of NF-κB expression in intestinal tissues
3 讨 论
长期服用NSAIDs可引起肠道疾病如肠炎、肠黏膜溃疡等,并增加了贫血的发生风险。NSAIDs可与COXs的活性中心结合,抑制COXs的活性,并阻止PGs的生成,生理浓度的PGs对于细胞增殖、血管新生及黏膜修复具有重要作用,因此NSAIDs可能通过阻止PGs的生成而破坏肠道黏膜。本研究使用阿司匹林灌胃小鼠8周建立NSAIDs诱导肠炎模型,结果发现模型小鼠出现体重减轻、黏液样便等情况;结肠长度变短、发生炎症并充血,病理学检查结果显示结肠出现黏膜水肿、炎症现象;肠组织中MPO含量升高;血清TNF-α及IL-6水平升高;肠组织NF-κB p65表达升高。该结果提示阿司匹林可引起肠炎,与文献报道NSAIDs可引起下消化道炎症一致[16]。
目前尚无有效手段可缓解这种类型的炎症。有研究表明,益生菌可修复溃疡性结肠炎患者的肠黏膜屏障[17-18],并可有效降低其血清TNF-α、γ干扰素(interferon-γ,IFN-γ)及IL-6水平[19-21];通过抑制烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶的表达,减轻肠组织的氧化应激损伤[22];激活辅助性T细胞17(Th17)等免疫细胞,促进免疫球蛋白A(immunoglobulin A,IgA)的产生;使IL-22、α防御素等细胞因子表达升高,抵御病原微生物的入侵;刺激肠道上皮细胞分泌黏蛋白(MUC),使肠上皮细胞与肠道内容物之间形成屏障,促进肠黏膜的修复[23-26]。嗜酸乳杆菌LA作为人体重要的一类益生菌,在进入人体肠道后可产生大量的乳酸,降低肠道内pH值,有效阻止病原菌的增殖,且LA可黏附于肠道上皮细胞,阻止病原菌对肠上皮细胞的入侵,竞争病原菌的生长空间,有效调节肠道微生态系统的平衡[27-29]。本实验使用阿司匹林灌胃导致小鼠肠炎,并采用LA-GHB1756进行干预,结果发现,小鼠饮食情况、精神状况、体重降低、结肠缩短等均有不同程度的改善,病理学检查结果表明,LA-GHB1756可有效缓解肠道炎症。
MPO是一种血红素过氧化物酶,当发生炎症时,MPO能生成过量的强氧化剂次氯酸(HOCl),其生成量超过机体的抗氧化能力后,则会导致氧化应激损伤[30]。研究表明,结肠炎患者及葡聚糖硫酸钠(DSS)诱导的肠炎动物模型均可导致MPO明显升高[31-32]。乳酸菌可明显降低MPO水平,缓解由MPO引起的氧化应激损伤[33]。NF-κB是在炎症刺激下发生核移位的转录因子,被激活后引起细胞核NFκB p65的表达升高,诱导TNF-α、IL-6及IL-1β等炎性因子的大量表达,这些细胞因子又会促进NF-κB的核移位,形成正反馈通路;乳酸菌可通过下调NF-κB p65抑制炎性因子的表达,起到减轻肠道炎症的作用[34]。本研究结果表明,LA-GHB1756可降低由阿司匹林引起的肠组织MPO高表达,缓解由炎症引起的氧化应激损伤,同时降低血清TNF-α、IL-6的表达,减少炎性因子的分泌,降低肠组织NF-κB p65的表达,减轻肠道炎症反应,且呈一定的剂量依赖性。
LA是具有多种功能的益生菌。赵琳等[35]的研究表明,LA85能够通过提高小鼠淋巴细胞增殖分化能力、巨噬细胞吞噬能力及NK细胞的活性而提升小鼠的免疫功能;孔庆敏等[36]报道LA28可缓解由丙戊酸引起的子代大鼠外周炎症及肝损伤。本研究结果显示LA-GHB1756可缓解阿司匹林所致的小鼠肠炎,其机制可能与抑制肠组织MPO、NF-κB p65的表达相关,然而LA-GHB1756作用于肠上皮细胞的具体靶点尚不明确,其对肠道菌群的调节作用及肠免疫细胞的影响也有待进一步研究。
