程序性死亡受体1抑制剂一线治疗晚期非小细胞肺癌的预后及安全性Δ
2022-12-19王根和
左 刚,王根和,方 平
(黄山市人民医院肿瘤内科,安徽 黄山 245000)
肺癌是世界上发病率和死亡率最高恶性肿瘤之一,其中非小细胞肺癌(non-smal1 cel1 lung cancer,NSCLC)患者约占所有类型肺癌患者的85%[1]。临床指南通常根据晚期NSCLC患者表达的表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)驱动基因突变等特征选择相应的小分子抑制剂(铂类药物)为基础的一线治疗方案进行化疗,以控制疾病进展[2-3]。但研究结果发现,晚期NSCLC患者接受以铂类药物为基础的一线化疗,其中位无病生存期仅为4~6个月,中位总生存期为10~12个月[4];NSCLC患者5年生存率仅为15%[5]。因此,探索新的一线治疗方案对于改善晚期NSCLC患者预后意义重大。2015年起,经美国食品药品监督管理局批准的以程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)为靶点的免疫治疗药物被用于晚期NSCLC的二线治疗[6]。最近的专家指南依据国内外Ⅲ期临床结果,推荐使用PD-1抑制剂用于晚期NSCLC的一线治疗。但PD-1抑制剂一线治疗晚期NSCLC的大型Ⅲ期临床研究多为国外人群,且国产PD-1抑制剂的不良反应相关报道较少,基于此,本研究对PD-1抑制剂一线治疗晚期NSCLC患者的预后及安全性进行观察,为临床研究提供资料。
1 资料与方法
1.1 资料来源
收集2019年5月至2021年1月于我院就诊且接受PD-1抑制剂一线治疗的90例晚期NSCLC患者的资料进行回顾性研究。纳入标准:病理诊断组织学类型为NSCLC,TNM分期(第8版)为Ⅲb、Ⅲc或Ⅳ期;一线接受过卡瑞利珠单抗、信迪利单抗和替雷利珠单抗治疗,临床可评估疗效者;所有患者要求PD-L1检测,EGFR、ALK和c-ros肉瘤致癌因子-受体酪氨酸激酶基因型均为野生型。排除标准:合并其他恶性肿瘤者;合并有系统性红斑狼疮、类风湿关节炎等免疫相关性疾病者;合并严重的心、肝、肾等疾病者;第1次治疗前2周合并感染或者使用过激素、免疫抑制剂等治疗者。
1.2 方法
所有患者均接受每3周1次的卡瑞利珠单抗、信迪利单抗和替雷利珠单抗200 mg,静脉注射治疗,3周为1个治疗周期进行疗效评价,观察终点为疾病进展或不良反应使患者不可耐受。收集患者的性别、年龄等基本人口学信息,病理类型、疾病分期和转移部位等临床信息,PD-L1表达水平,患者对治疗的反应及相应不良反应等治疗数据。
联合化疗方案一致,化疗方案:(1)一线鳞癌,使用信迪利单抗(200 mg)/卡瑞利珠单抗(200 mg)/替雷利珠单抗(200 mg)联合吉西他滨(1 000 mg/m2)/卡铂[曲线下面积为5 mg/(mL·min)],3周为1个周期,接受6个周期,PD-1 200 mg维持治疗直至疾病进展(PD)或不可耐受或死亡。(2)非鳞癌,信迪利单抗(200 mg)/卡瑞利珠单抗(200 mg)/替雷利珠单抗(200 mg)联合培美曲塞(500 mg/m2)/卡铂[曲线下面积为5 mg/(mL·min)],3周为1个周期,接受4个周期,PD-1 200 mg联合培美曲塞(500 mg/m2)维持治疗直至不能耐受化疗者采用PD-1维持治疗直至PD或不可耐受或死亡。
1.3 观察指标
PD-L1表达由我院病理科检测,采用免疫组化法,检测试剂为单克隆鼠抗人PD-L1克隆22C3,检测平台为VENTANAULTRA。根据抗体着色后细胞表面颜色深浅来评价表达量,表达水平用肿瘤细胞阳性比例评分(TPS)表示,TPS<1%为阴性,TPS为1%~<50%表示弱阳性,TPS≥50%为强阳性。患者不良反应/事件的评价采用不良反应标准(CTCAE)版本5.0记录。
1.4 疗效评定标准
根据实体瘤疗效评价标准1.1版[7],患者在4~8周采用CT检查,疗效评价最终结果分为以下几种类型:完全缓解(CR),病灶消失;部分缓解(PR),病灶直径总和<初始30%;疾病稳定(SD),病灶未达到PR和PD;PD,病灶直径总和增加>初始20%。客观缓解率(ORR)=(CR病例数+PR病例数)/总病例数×100%;疾病控制率(DCR)=(CR病例数+PR病例数+SD病例数)/总病例数×100%。无进展生存期(PFS)指患者开始接受免疫治疗直至PD或死亡之间的时间差。
1.5 随访
治疗结束后每月进行电话或门诊随访,每隔2个月进行影像学检查用于评估患者病情,随访截至2021年8月,随访时间为1.8~17个月,中位随访时间为7.4个月。
1.6 统计学方法
所有数据均采用SPSS 25.0软件进行统计分析。分类变量以频数和百分比表示,数值变量以中位数和两侧值范围表示,分类变量组间的比较采用χ2检验或数值资料采用Wilcoxon秩和检验,采用多因素Logistic分析PD-1抑制剂一线治疗晚期NSCLC的DCR影响因素,采用COX回归分析探究PD-1抑制剂一线治疗晚期NSCLC的PFS影响因素,纳入标准为α<0.1,同时应用log-rank检验对Kaplan-Meier生存曲线进行生存分析,赋值见表1,双侧检验水准α=0.05。
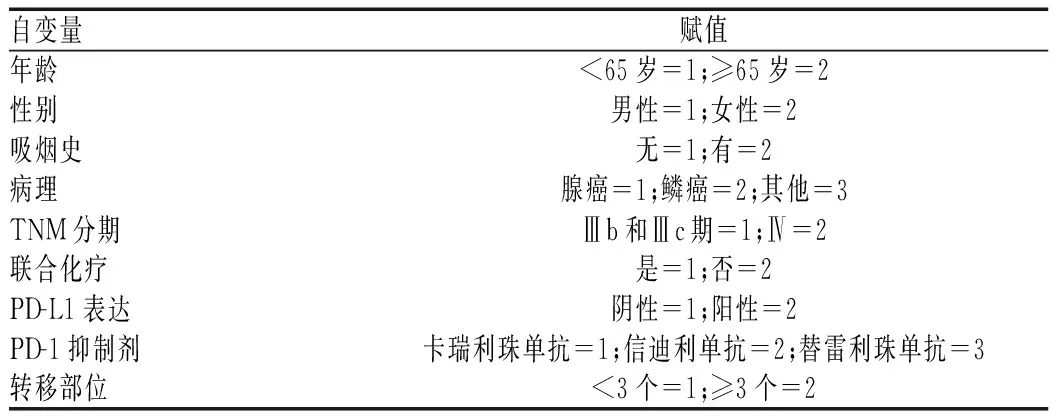
表1 赋值表Tab 1 Assignment table
2 结果
2.1 不同临床因素对患者疗效的影响
Ⅲb和Ⅲc期、联合化疗、PD-L1阳性及转移部位<3个患者的ORR、DCR均较高,差异均有统计意义(P<0.05),见表2。

表2 不同临床因素对患者治疗疗效的影响Tab 2 Effects of different clinical factors on the treatment efficacy of patients
2.2 影响患者DCR的多因素分析结果
将单因素分析P<0.1的变量纳入多因素分析,结果显示,Ⅲb和Ⅲc期、联合化疗和PD-L1表达阳性为影响晚期NSCLC的DCR保护因素(P<0.05),见表3。

表3 影响晚期NSCLC疾病控制的多因素分析Tab 3 Multivariate analysis of influencing factors for disease control in patients with advanced NSCLC
2.3 生存分析
随访观察中,90例患者的中位PFS为8.6个月。单因素分析结果显示,TNM分期、联合化疗、PD-L1表达与晚期NSCLC的PFS相关;COX回归分析结果显示,Ⅲb和Ⅲc期、联合化疗和PD-L1表达阳性是晚期NSCLC的PFS保护因素,见表4。生存分析结果显示,Ⅲb和Ⅲc期(中位PFS:11.0个月vs.7.2个月,χ2=4.152,P=0.042)、联合化疗(中位PFS:9.6个月vs.7.6个月,χ2=4.066,P=0.044)和PD-L1表达阳性(中位PFS:10.9个月vs.6.6个月,χ2=13.978,P<0.001)有较长的PFS,见图1—3。
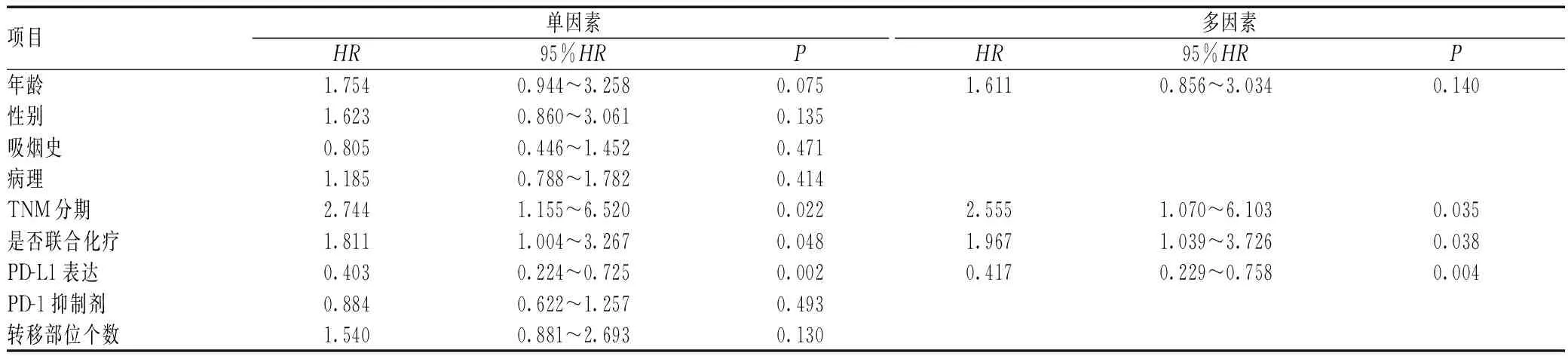
表4 影响晚期NSCLC的PFS单因素和多因素分析Tab 4 Univariate and multivariate analysis of PFS in patients with advanced NSCLC
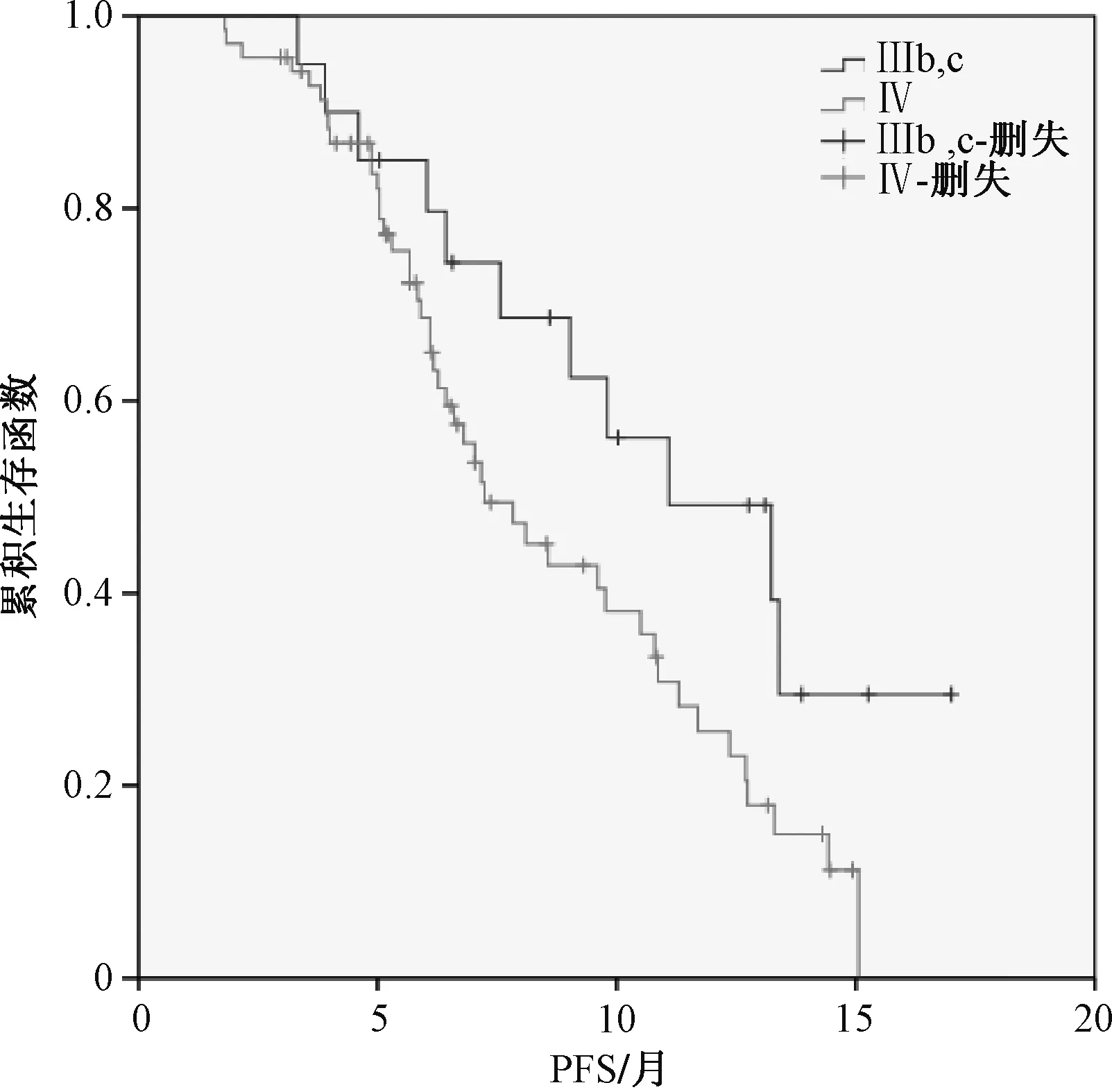
图1 不同TNM分期的PFSFig 1 PFS in different TNM stages
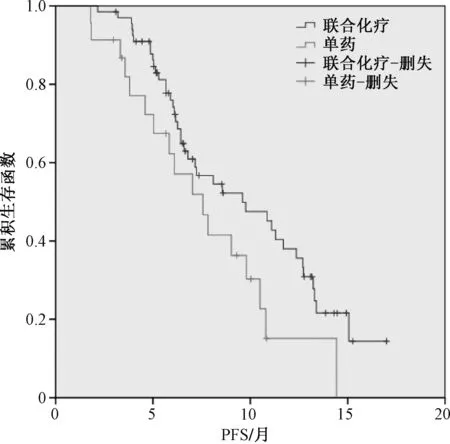
图2 是否联合化疗的PFSFig 2 PFS with or without combined chemotherapy

图3 不同PD-L1表达的PFSFig 3 PFS according to PD-L1 expression
2.4 不良反应
根据CTCAE 5.0版[8],大多数不良反应级别为1—2级,少部分3—4级不良反应,而3—4级不良反应中大多数对症治疗后可进行后续治疗。90例患者主要出现的不良反应包括肝肾功能损害、高尿酸血症和甲状腺功能减退等,总不良反应发生率为67.8%(61/90),3—4级不良反应发生率为12.2%(11/90),使用卡瑞利珠单抗、信迪利单抗及替雷利珠单抗患者的不良反应发生率、3—4级不良反应发生率分别为[75.0%(21/28)、17.9%(5/28)]、[73.3%(22/30)、10.0%(3/30)]及[56.3%(18/32)、9.4%(3/32)],三组患者不良反应发生率、3—4级不良反应发生率比较,差异均无统计学意义(χ2=3.041,P=0.218;χ2=1.209,P=0.546),见表5。

表5 治疗过程中的不良反应发生情况[例(%)]Tab 5 Adverse drug reactions during treatment [cases (%)]
3 讨论
肺癌是危害我国国民健康排序居第1位的恶性肿瘤,晚期NSCLC未发现突变基因行单纯化疗患者的总生存期很难超过1年[9]。近年来兴起的免疫治疗是晚期肺癌治疗的新选择,恶性肿瘤患者(以实体瘤为主)中,淋巴细胞表面普遍表达的PD-1与肿瘤细胞表面表达的PD-L1特异性结合,使T淋巴细胞耗竭,导致肿瘤细胞逃避免疫细胞杀伤从而促进肿瘤生长[10]。针对PD-1开发的具有阻断PD-1与PD-L1之间的相关结合,提高T细胞的免疫应答,增强抗肿瘤免疫功能的一类药物,即免疫检查点抑制剂[11]。基于此,本研究探讨了一线接受PD-1抑制剂(卡瑞利珠单抗、信迪利单抗和替雷利珠单抗)治疗的晚期NSCLC患者的预后及安全性。
Comel-303研究[12]结果显示,对晚期非鳞肺癌采用瑞利珠单抗联合化疗的ORR为60.0%,高于本研究的54.4%,可能由于本研究中仍有部分患者使用PD-1抑制剂单药治疗,且本研究中>65岁患者占66.7%,因此与上述ORR存在一定差异,但差别不大。对于驱动基因阴性晚期NSCLC的传统治疗方案而言,PD-1/PD-1抑制剂可显著提高患者的治疗效果,在一定程度上延长患者生存时间,也预示着无论晚期NSCLC患者PD-L1的表达如何均可从PD-1抑制剂中获得收益[13-14]。KEYNOTE-042研究[15]也有相似结论。但相对于PD-L1<1%或PD-L1<50%的晚期NSCLC患者,PD-L1>50%的NSCLC患者的ORR(约45%)较高,且高于经典化疗方案(约30%)[14]。本研究在进一步进行多因素及生存分析中发现,PD-L阳性表达是晚期NSCLC的DCR和PFS的保护因素。在临床治疗中,采用免疫治疗模式的方式较多,如单药治疗、联合化疗和联合靶向治疗等。KEYNOTE-042研究[15]结果显示,尽管免疫单药组生存曲线高于化疗组,但两组生存曲线图像发生交叉,表明仍有部分患者无法从免疫单药中获得预期效果。因此,在患者可耐受的情况下采用免疫治疗联合化疗优势明显,在Zhou等[12]的研究结果表明,免疫联合化疗较单独化疗或免疫治疗预后较好,与本研究多因素分析结果类似,即Ⅲb和Ⅲc期和PD-1联合化疗是晚期NSCLC的DCR、PFS的保护因素。
与传统化疗以血液系统、胃肠道和肾脏等不良反应较为常见不同[16],PD-1抑制剂的不良反应多发生于肝脏、内分泌系统和肾脏等器官[17-18]。本研究中,患者的不良反应多集中于肝、肾功能损害,其中肝功能损害发生率最高;总不良反应的发生率为67.8%,3—4级不良反应发生率为12.2%,与江洁美等[19]的研究结果相似。目前多数研究认为,PD-1抑制剂带来的不良反应是患者在治疗过程能够耐受的。本研究中,50例发生不良反应的患者经过对症处理均继续治疗,9例患者因不能耐受不良反应而停止PD-1治疗。其中1例患者使用信迪利单抗联合紫杉醇、顺铂治疗,出现3级中性粒细胞计数降低,经对症治疗,中性粒细胞计数仍较低,立即停药后,中性粒细胞计数仍无明显提升;1例患者使用卡瑞利珠单抗单药治疗后出现3级肝功能损伤,停药对症治疗后,肝功能仍未见明显好转。因此,医师应注意患者的不良反应,尤其是肝脏不良反应,必要时应立即停止相关治疗。
由于本研究采用回顾性研究,论证强度受限,加之未设置对照组,仅能通过与过往研究对比显现PD-1抑制剂治疗晚期NSCLC的临床效果和安全性;而且,能够使用PD-1抑制剂的人群经济状况较好,可能会引起一些选择偏倚带来的混杂[20-21]。此外,本研究随访时间也较短,因此,上述结论仍需要更大样本量和更长时间的随机对照研究加以证实。
综上所述,PD-1抑制剂作为一线治疗晚期NSCLC的方案可以使患者生存获益,患者不良反应发生率较高,但可耐受。Ⅲb和Ⅲc期、PD-L1表达阳性的晚期NSCLC患者使用PD-1抑制剂的临床效果较好,同时采用PD-1联合化疗患者收益更佳。
