基于网络药理学和分子对接技术探讨参附注射液治疗失血性休克的相关机制Δ
2022-12-19叶浩然郭玉红何莎莎王宇琛
叶浩然,郭玉红,何莎莎,杜 元,王宇琛
(1.首都医科大学附属北京中医医院急诊科,北京 100010; 2.北京市中医药研究所,北京 100010; 3.北京中医药大学,北京 100029)
失血性休克是由于出血引起的有效循环血容量减少、组织器官灌注不足,以组织缺氧、细胞代谢紊乱和器官功能受损为主要改变的病理过程[1]。由于血液广布全身,失血性休克损伤范围也具有多系统、多器官、多靶点的病理特点。在微观层面上,组织细胞缺血缺氧并开始无氧代谢,这个过程中会累积大量乳酸、磷酸盐以及氧自由基,最终导致细胞死亡[2]。不同时期对失血性休克的治疗也反映了当时人们对其病理生理过程的认识水平。大量补液、扩充血容量是治疗休克的关键,但是复苏所致的缺血再灌注损伤也不容忽视,可能与自由基、钙超载和炎症激活相关[3-5]。
参附注射液是依据宋代《校注妇人良方》中记载的 “参附汤”结合现代制药方法研制而成,主要成分为红参和黑附片,具有回阳救逆、益气固脱之效。动物研究结果发现,参附注射液可以改善休克大鼠血流动力学,维持重要脏器的灌注,并通过降低炎症因子水平、减少氧化应激及抑制钙超载等方式减少IRI[5-8]。中药成分复杂、靶点众多,导致有关中药机制的实验研究选择众多,造成实验人员“无从下手”的局面,而网络药理学的整体性和系统性特点恰好符合中医的整体观念,从理论层面将生物学与药理学结合,通过药物网络和生物网络之间的相互关系寻找药物可能的作用机制[9]。目前,有关参附注射液的研究较多,但是其治疗失血性休克作用机制方面仍存在研究空白。本研究通过网络药理学预估参附注射液作用靶点,并通过蛋白质-蛋白质相互作用(PPI)网络、基因本体(GO)功能富集分析、京都基因与基因组百科全书(KEGG)通路富集分析及分子对接等多种分析手段探究其治疗失血性休克的主要活性成分、重要靶点和可能存在的通路机制。
1 资料与方法
1.1 参附注射液有效成分及作用靶点筛选
通过中药系统药理学数据库与分析平台(TCMSP,https://www.tcmspw.com)[10]检索参附注射液主要组成中药的化学成分,再根据药物吸收、分布、代谢及排泄过程特性进行潜在活性成分及相关靶点筛选。以口服生物利用度(OB)≥30%,类药性(DL)≥0.18为条件进行筛选[11];将筛选后的结果在Uniprot数据库(https://www.uniprot.org/)中查找对应基因。
1.2 疾病靶点筛选
以“Hemorrhagic shock”为检索词,通过GeneCard数据库(https://www.genecards.org/)检索人类失血性休克相关靶点,并用相同检索词检索人类孟德尔遗传综合数据库(OMIM,https://omim.org/)、治疗靶点数据库(TTD,http://db.idrblab.net/ttd/)、Drugbank数据库(https://www.drugbank.ca/)中的相关靶点作为补充,最终建立失血性休克相关靶点数据库。
1.3 疾病靶点与药物靶点交集
利用R语言对参附注射液靶点和失血性休克靶点取交集,并绘制韦恩图。
1.4 PPI网络构建及核心靶点筛选
为了研究药物靶点和疾病靶点之间的相互作用,将交集靶点通过STRING平台构建PPI图。相关参数如下:基因物种设为“Homo sapiens”,蛋白相互关系为0.4,其余为默认设置。将结果用Cytoscape 3.9.1软件进行可视化,得到参附注射液关于失血性休克的PPI图。
1.5 药物-有效成分-基因靶点-疾病网络图的构建
将参附注射液治疗失血性休克的成分及相关靶点通过Cytoscape 3.9.1软件构建参附注射液-有效成分-基因靶点-疾病网络图,网络图以节点和边的方式描述成分之间的关系,初步研究参附注射液治疗失血性休克可能的药理作用和机制[12]。使用Cytoscape内嵌的cytoHubba-Degree程序对网络图进行分析,得到不同节点的度值(Degree),依据Degree调节靶点颜色,Degree越大则颜色越红。
1.6 富集分析
通过R语言clusterProfiler包进行GO功能富集分析和KEGG通路富集分析,明确参附注射液和失血性休克相关靶点功能[13]。设定筛选标准P<0.05,根据P值由小到大排序,选取GO富集分析生物学过程(BP)、细胞组分(CC)和分子功能(MF)各过程前10个,以及KEGG前20条通路绘制圈图。
1.7 分子对接
基于Degree分别选取排序居前4位的药物成分和排序居前4位的疾病靶点进行分子对接。从Protein Data Bank(PDB)数据库(https://www.pdbus.org/)和PubChem数据库(https://www.ncbi.nlm.nih.gov)中获得成分、靶点的三维结构。使用Pymol 2.4.0先对受体大蛋白进行预处理,包括去除水分子、盐离子及配体,然后使用AutoDock Tools 1.5.7对Pymol处理后的大分子受体进行加氢、计算电荷数。小分子配体通过AutoDock Tools 1.5.7 的Torsion Tree功能进行处理。再调整对接盒子位置和大小,使其能够完全覆盖大分子。最后运行对接盒子,使用Docking内Local Search Parameters算法进行对接,用autodock运行对接后结果,通过对结果分析,选取对接能量最稳定的形式用Pymol作图,并标出相应对接位点以及结合氢键。分子对接结合能表示受体配体结合所需能量,结合能>0 kJ/mol表示结合过程所需要的能量,结合能<0 kJ/mol表示结合过程所释放的能量;一般而言,结合能<0 kJ/mol的受体配体存在自发结合的可能,具有较强的结合活性。
2 结果
2.1 药物-疾病靶点
参附注射液主要成分为红参、黑附片提取物,通过TCMSP数据库检索红参、附子,初步检索得到红参化学成分74种,附子65种。设定OB≥30%、DL≥0.18后,得到红参主要有效成分4种,附子21种,将参附注射液主要有效成分结果在Uniprot数据库中查找对应靶点基因。以“Hemorrhagic shock”为检索词,对Genecards、OMIM、TDD和Drugbank数据库进行检索,合并数据库后去除重复共得到4 058个不同靶点。失血性休克和参附注射液的交集靶点共30个,其韦恩图见图1。失血性休克与参附注射液交集靶点列表见表1。

图1 失血性休克靶点与参附注射液靶点韦恩图Fig 1 Venn diagram of hemorrhagic shock target and Shenfu injection target

表1 失血性休克与参附注射液交集靶点列表Tab 1 List of intersection targets of hemorrhagic shock and Shenfu injection
2.2 参附注射液治疗失血性休克的PPI图
将30个交集靶点导入STRING数据库,结果显示,PDE3A与其他靶点无相互作用,剩余靶点用Cytoscape 3.9.1软件进行PPI可视化,得到交集靶点PPI图;通过cytoHubba-Degree值筛选出重要靶点,颜色越深、点越大则代表靶点越重要,前6位重要靶点为肿瘤坏死因子(TNF)、胱天蛋白酶(CASP)3、白细胞介素(IL)1β、前列腺素内过氧化物合酶(PTGS)2、雌激素受体(ESR)1和CASP8,见图2。

图2 交集靶点PPI网络图Fig 2 PPI network diagram of intersection target
2.3 药物-成分-靶点-疾病网络图构建
根据失血性休克与参附注射液交集靶点列表(表1),用Cytoscape 3.9.1软件构建药物-有效成分-基因靶点-疾病网络图,明确参附注射液中发挥治疗效果的成分和靶点,见图3。图3显示,参附注射液通过9个活性成分作用于30个失血性休克靶点;节点颜色与该节点Degree呈正相关,颜色越红代表Degree越大,表示生物学重要性越强。

FZ为附子;FZ1为sitosterol;FZ2为11,14-eicosadienoic acid;FZ3为Delphin_qt;FZ4为 Deltoin;FZ5为Deoxyandrographolide;FZ6为Karanjin;HSh为红参;HSh1为beta-sitosterol;HSh2为DNOP;HSh3为ginsenoside rh2;HS为失血性休克FZ is epimedium; FZ1 is sitosterol; FZ2 is 11,14-eicosadienoic acid; FZ3 is Delphin_qt; FZ4 is Deltoin; FZ5 is Deoxyandrographolide; FZ6 is Karanjin; HSh is red ginseng; HSh1 is beta-sitosterol; HSh2 is DNOP; HSh3 is ginsenoside rh2; HS is Hemorrhagic Shock图3 药物-有效成分-基因靶点-疾病调控网络Fig 3 Drug-active component-gene target-disease regulatory network
2.4 富集分析
对参附注射液治疗失血性休克的30个靶点通过R语言进行GO、KEGG富集分析,见图4。GO富集结果显示,参附注射液治疗失血性休克涉及的分子功能主要为细胞凋亡,参与对激素、脂质和含氧化合物等生物过程,作用于细胞膜、线粒体外膜等部位。KEGG富集结果表明,参附注射液治疗失血性休克主要涉及甲型流感病毒、军团杆菌病、乙型肝炎、人类巨细胞病毒感染和IL-17信号通路等。
2.5 分子对接
将Degree排序居前4位的化合物和排序居前4位的靶点蛋白进行分子对接,分别为HSh1 (Beta-sitosterol)、HSh3(Ginsenoside rh2)、FZ4 (Deltoin)、FZ6(Karanjin)和PTGS2、核受体辅激活蛋白(NCOA)2、PTGS1、肾上腺素受体β(ADRB)2(表2)。结果显示,除Ginsenoside rh2和NCOA2结合能为87 864 kJ/mol外,其余均<0 kJ/mol,表明大部分受体和配体可自发结合,利用Pymol制作对接模式图,见图5。

表2 配体-受体结合能Tab 2 Ligand-receptor binding energy

A.GO-MF;B.GO-BP;C.GO-CC;D.KEGGA.GO-MF; B.GO-BP; C.GO-CC; D.KEGG图4 富集分析Fig 4 Enrichment analysis
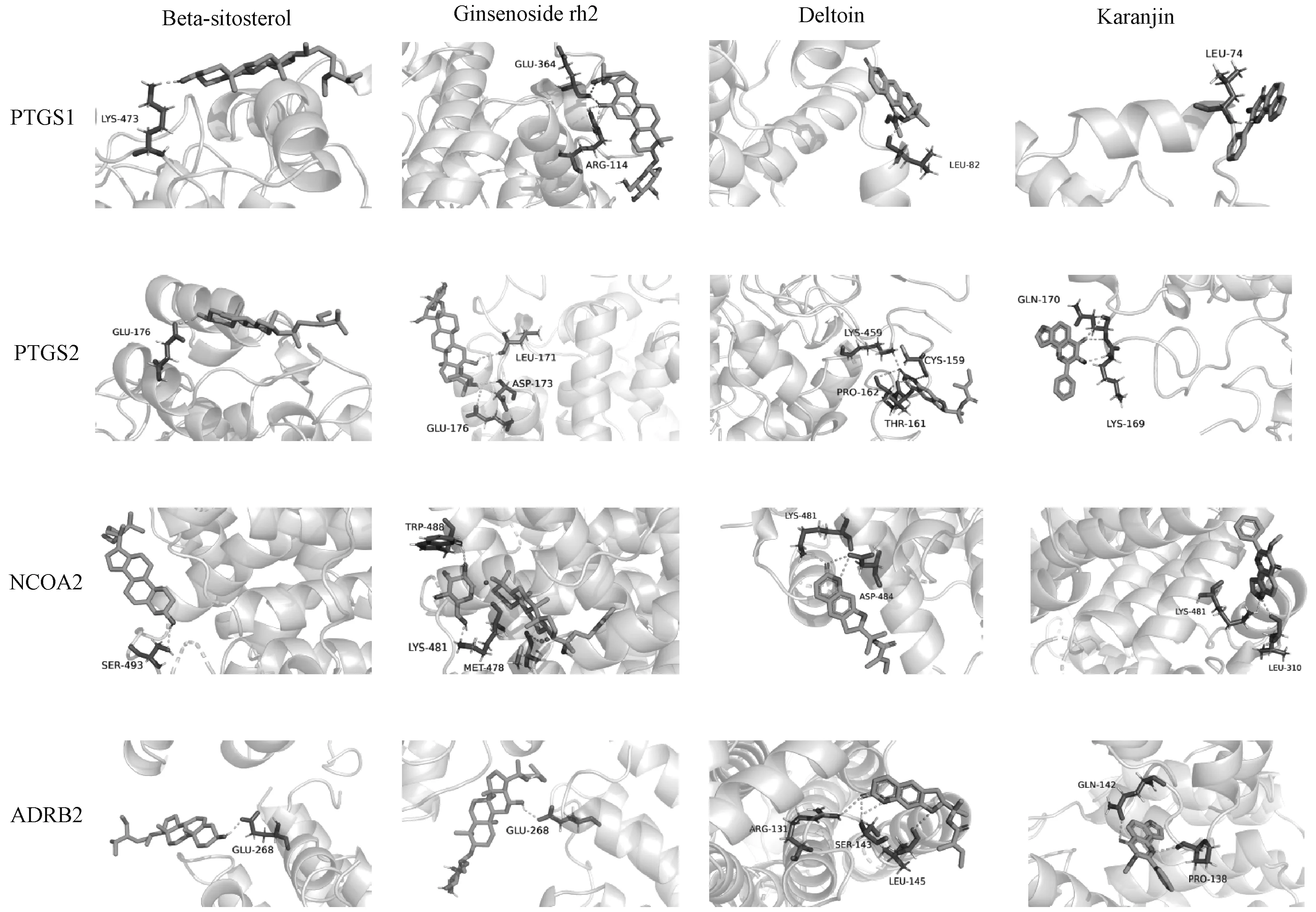
图5 配体-受体结合位点图Fig 5 Diagram of ligand-receptor binding sites
3 讨论
休克属于现代医学中的急危重症,属于中医“厥脱证”范畴,病机主要为气血逆乱,血行障碍,内闭外脱,阴阳不相承接,其演变常为由气及血,由阴涉阳,由厥而脱,由脱而亡。古籍中虽无失血性休克病名,但对大量失血所致临床症状的描述较为丰富,《医林绳墨·厥》记载,“有血厥者,因而吐衄过多,上竭下厥,先致足冷,有如水洗,冷过腰膝,入腹即死,此血竭而作厥也”;《景岳全书》记载,“血脱者,如大崩大吐,或产血尽脱,则气亦随之而脱,故致卒仆暴死”。厥脱以回阳救逆、益气固脱为治则治法,参附注射液基于古方参附汤,改变原有口服用药方式,通过静脉给药更利于临床危重患者的治疗和管理。
通过分析参附注射液治疗失血性休克的主要成分,筛选出β-谷甾醇、人参皂苷rh2和去氧穿心莲内酯等小分子物质。失血性休克发展过程中,类似损伤相关的分子模式、核因子κB(NF-κB)的激活致使体内产生大量炎症因子[14-18]。研究结果显示,β-谷甾醇可通过下调IL-6、TNF的表达,抑制NF-κB活化,以减轻炎症反应所带来的损害[19-20]。去氧穿心莲内酯不但具有抑制NF-κB激活的抗炎作用[21],还可以提高体内谷胱甘肽水平、激活核因子NF-E2相关因子,防御因缺血造成的氧化应激损伤[22-23]。心脏为了维持休克后血压等循环系统的正常生理功能,会代偿性搏动增快[24]。而人参皂苷rh2可以通过抑制Na+-K+-ATP酶使胞内Na+增多,促进心肌细胞Na+和Ca2+交换,使心肌细胞内Ca2+浓度升高,增强心肌收缩力,帮助维持血流动力学的稳定[25]。
从PPI结果看,IL-1β和TNF均属于促炎因子,可用于评估失血性休克治疗效果。既往研究结果发现,有效的治疗可以显著降低IL-1β和TNF水平,提示体内炎症得到较好控制[26]。也有动物实验研究结果显示,IL-1β水平与失血性休克72 h内死亡率有相关性[27];抑制TNF、IL-1β基因的表达可以帮助维持失血性休克后平均动脉压[28]。从细胞凋亡途径来看,参附注射液可通过抑制CASP3的表达而发挥抗凋亡作用[29]。
GO功能富集分析分别从MF、BP和CC 3个角度阐述参附注射液的作用机制。GO-MF中,可见多条炎症、凋亡相关分子功能,这一点与PPI中PTGS的作用具有密不可分的关系。PTGS是环氧合酶(COX)的编码基因,COX对维持正常生理功能、炎症反应和细胞凋亡过程都有着重要作用[30]。参附注射液可通过抑制COX,减轻炎症反应、细胞凋亡过程[31]。GO-CC描述参附注射液在细胞内的作用部位,其中死亡诱导信号复合体(DISC)由Fas/FADD/Caspase8酶原组成,是启动细胞凋亡的关键途径之一[32-33]。研究结果显示,参附注射液可以使Fas显著降低,干扰DISC介导的凋亡发生,从而减少细胞死亡[34]。KEGG分析结果中,甲型流感通路从病因学方面带来了新的启示,即甲型流感也可以发展成为失血性休克,其原因可能与炎症反应和细胞凋亡导致胃肠道出血相关[35]。最后,分子对接过程依据氢键的形成确定了参附注射液有效成分与失血性休克相关靶点结合的明确可能。
总之,参附注射液治疗失血性休克的成分很多,可能治疗失血性休克的靶点也很多,但真正深入进行的动物研究甚至临床研究却不多,如对人参皂苷这样的“明星物质”的研究也并不是很透彻。究其原因,可能是中药成分复杂,疾病靶点众多,有时让研究人员感觉无从下手。故本研究试图从目前已知分子结构和功能的基础上,为临床前研究提供理论研究依据,预测可能有效的机制,为后续动物实验、临床实验提供思路。
