基于UPLC-Q-TOF-MS技术及网络药理学方法探讨六味地黄丸入脑成分改善D-gal模型大鼠学习记忆能力的作用机制Δ
2022-12-19徐艳明王业秋徐红丹
邱 琦,徐艳明,薛 傲,王业秋,孙 琪,薛 慧,徐红丹,3#,张 宁,#
(1.黑龙江中医药大学药学院,哈尔滨 150040; 2.黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007; 3.无锡卫生高等职业技术学校,江苏 无锡 214028)
阿尔茨海默病(Alzheimer’s disease,AD)是一种起病隐匿、与年龄相关的中枢神经退行性疾病[1]。目前,其发病机制尚未明确,而解释该病发病机制的假说较多,可能为多因素参与的结果[2]。但不论是现有AD治疗药物或其他候选药物,多仅针对AD的某个单一靶点或相关途径,只能短期改善症状,不能从根本上治疗AD[3]。相比于仅能调控单一靶点或途径的药物,中医药因其具有多成分、多靶点等优势,在发病机制复杂的AD等疾病的防治中有着巨大潜力[4]。中医学中,AD的发病与肾虚密切相关,认为“肾精虚,脑髓空”为其基本病机,“补肾填精益髓”为根本治法[5]。六味地黄丸由熟地黄、山茱萸、山药、茯苓、泽泻和牡丹皮6味中药组成,是我国传承千年的经典补肾名方,AD正是六味地黄丸适应之证候。同时,六味地黄丸作为中药复方,具有成分多、靶点广等优点,能够针对疾病多个病理环节进行调控,与AD发病机制的复杂性和综合性特征契合。研究结果表明,六味地黄丸可改善快速老化小鼠学习记忆功能,其改善作用可能与影响白细胞介素2(IL-2)、白细胞介素6(IL-6)在脑组织的表达有关[6];六味地黄丸可能通过影响中枢神经胆碱能系统,改善β淀粉样蛋白(Aβ)前体蛋白/早老蛋白-1(APP/PS1)双转基因小鼠学习记忆能力[7];六味地黄丸可对自然衰老大鼠海马CA1区、CA3区及大脑皮质初级躯体感觉皮质区(S1Tr)神经元起到一定保护作用[8];六味地黄丸脑脊液对Aβ1-40诱导的细胞活力降低也有明显抑制作用[9]。目前,关于六味地黄丸在神经退行性疾病中的研究多集中于单靶点机制通路或环节,难以解释其多成分、多靶点协同作用的问题;且现有研究结果也提示,六味地黄丸可通过血脑屏障发挥一定的中枢性药理作用,而其脑通透性特征亦尚不清楚。
超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF-MS)技术灵敏度高、选择性好、分离准确,被广泛应用于中药复杂体系成分的定性鉴别研究[10];网络药理学方法具有系统性及整体性的研究特点,可在一定程度上弥补单一机制通路研究方法的局限性[11]。本研究基于UPLC-Q-TOF-MS技术分析六味地黄丸入脑成分,并根据获得的入脑成分,应用网络药理学方法与体外验证实验,探讨六味地黄丸入脑成分改善D-半乳糖(D-gal)模型大鼠学习记忆能力的潜在机制。
1 材料
1.1 实验动物与细胞
雌性SD大鼠24只(辽宁长生生物技术股份有限公司),体重210~250 g,饲养于无菌环境,自然光源(12L∶ 12D),温度20~22 ℃,相对湿度55%~65%,自由给水进食,适应性饲养1周后开始实验,研究由黑龙江中医药大学伦理委员会批准(编号:2020021907)。高分化型PC12细胞(上海中乔新舟生物科技有限公司,批号:ZQ0150)。
1.2 仪器
SCIEX ExionLC AD液相色谱仪、SCIEX 5600+Q-TOF质谱仪(美国AB sciex公司);RD-1121-NR-M新物体识别(上海移数信息科技有限公司);ZH-Morris水迷宫设备(正华生物仪器设备有限公司);MK3型酶标仪(上海热电仪器有限公司);HPC-150型流式细胞仪(加拿大Handyem公司)。
1.3 药品与试剂
六味地黄丸浓缩丸购于北京同仁堂药店(佳木斯店),经黑龙江中医药大学陈效忠教授鉴定符合《中华人民共和国药典:一部》标准;D-gal(上海麦克林生化科技有限公司,批号:D810319);色谱级甲醇(美国Dikma公司,批号:W-50102);苏木精-伊红(HE)染液(碧云天生物技术研究所,批号:C0105 S)。噻唑蓝(MTT)粉末(美国Sigma公司,批号:20130716);Aβ酶联免疫吸附试验(ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:E-EL-R3030);活性氧(ROS)试剂盒(碧云天生物技术研究所,批号:S0033);IL-6 ELISA试剂盒(上海西唐生物科技有限公司,批号:F15870);5-羟色胺(5-HT)、多巴胺(DA)ELISA试剂盒(广州佰而林生物科技有限公司,批号:BI140723059、BI140722023)。
2 方法
2.1 药液的配置
取六味地黄丸浓缩丸,研细,精密称定20.25 g,置于具塞锥形瓶中加入去离子水100 mL,超声(频率40 kHz,功率180 W)处理1 h,搅拌,得六味地黄丸灌胃药液。按89∶ 10∶ 1比例混合DMEM培养基、胎牛血清和青霉素-链霉素,得DMEM培养液于4 ℃备用;采用新鲜或保存时间较短的含药脑脊液进行实验,不做特殊处理。
2.2 分组及给药
(1)动物实验。将24只SD大鼠随机分为空白(Control)组、模型(Model)组和给药(LWDHW)组,每组6只。Model组、LWDHW组大鼠腹腔注射D-gal 250 mg/(kg·d),连续4周,Control组大鼠注射等量0.9%氯化钠溶液。同时,按人鼠等效剂量折算,LWDHW组大鼠每日以给药量1.62 g/(kg·d)六味地黄丸药液灌胃,Control组和Model组以等量0.9%氯化钠溶液灌胃。(2)细胞实验。分为空白(Control)组、模型(Model)组和六味地黄丸含药脑脊液(LWDHW)组。将对数期细胞接种于DMEM培养液中培养24 h。Control组更换DMEM培养液,继续培养 24 h;Model组更换DMEM培养液培养2 h,再给予20 mg/mL的D-gal培养液,继续培养24 h;LWDHW组加入六味地黄丸脑脊液培养2 h,再给予20 mg/mL的D-gal培养液,继续培养24 h。
2.3 行为学实验
2.3.1 新物体识别实验:各组大鼠在箱体内熟悉5 min后,放置两个完全相同的小正方体到箱体一端,将大鼠背向小正方体放置在对侧箱壁中点熟悉5 min。训练1 h后,用另外一个完全不同的球形物体替换其中一个小正方体。从相同位置放入大鼠,记录大鼠5 min内对新物体的接触时间(Tn)和对旧物体的接触时间(Tf)。识别指数=(Tn-Tf)/(Tn+Tf)。
2.3.2 Morris水迷宫实验:整个实验区域被分为四个象限,实验包括定位航行实验(前4日)与空间探索实验(第5日)。定位航行实验,于第四象限水下2 cm处放入平台,保持平台位置不变。将大鼠面向池壁,于一、二、三象限规定点放入水中。90 s内,找到目标平台的大鼠,在平台上停留30 s,未找到平台的大鼠,人为将其放置在平台上30 s,记录大鼠找到平台时间为逃避潜伏期。空间探索实验,移除平台,于一、二、三象限规定点将大鼠放入水迷宫中,记录大鼠90 s内在目标(第四)象限的停留时间,记录穿过平台位置及有效(2倍平台直径)区域的次数。
2.4 样品的采集
行为学实验结束后,将Control组、LWDHW组大鼠头部固定,用输液针抵达小脑延髓池,抽取脑脊液,3 500 r/min(离心半径8.5 cm)离心10 min,取上层脑脊液用于分析及细胞实验;并摘取各组大鼠新鲜大脑,洗去残留的血液,置于4%多聚甲醛中固定48 h,制HE染色病理切片。
2.5 HE染色观察大鼠海马神经元状态
采用常规病理学方法对固定的脑组织进行脱水、包埋,制成蜡块,切成4 μm厚度的蜡片。依次用二甲苯脱蜡,95%乙醇脱水,HE染色,乙醇梯度脱水,二甲苯透明,中性胶封片。
2.6 入脑成分分析
2.6.1 样品前处理:脑脊液样品进样前,取脑脊液200 μL于离心管中,加入甲醇800 μL,涡旋混合1 min,超声(频率40 kHz,功率180 W)1 min,13 000 r/min(离心半径8.5 cm)离心10 min,取上清液,氮吹后用甲醇溶液60 μL复溶,过0.22 μm微孔滤膜,进样5 μL。
2.6.2 UPLC-Q-TOF-MS分析:(1)色谱条件。采用ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);柱温40 ℃;进样量5 μL;流速0.4 mL/min;检测时间30 min,流动相为0.1%甲酸水溶液(A)-纯乙腈(B),进行梯度洗脱(0~12 min,0~70%B;12~12.5 min,70%B;12.5~16 min,70%~100%B;16~22 min,100%B)。(2)质谱条件。采用正、负离子检测模式,一级质谱(ESI-MS)和二级质谱(ESI-MS2)扫描范围分别为100~1 200、50~1 200 m/z;各气路均使用He;离子化电压(ISVF)为5 500 V,喷雾气(GS1)、辅助加热气(GS2)压力均为50 psi(1 psi≈6.895 kPa),气帘气压力(CUR)为35 psi,离子源温度为550 ℃,锥孔电压(DP)为90 V,一级质谱碰撞能量(CE)为10 V,二级质谱CE为35 V、碰撞能量范围(CES)为15 V。
2.7 网络药理学方法
2.7.1 六味地黄丸入脑成分靶点收集:选取鉴定的全部六味地黄丸入脑成分作为目标成分,在中药系统药理学数据库与分析平台(TCMSP)数据库和Swiss Target Prediction数据库筛选六味地黄丸入脑成分的分子靶点。在Uniprot(https://www.uniprot.org/)蛋白质数据库中将入脑成分所作用的靶点名称进行标准化。
2.7.2 AD相关靶点收集:以“Alzheimer’s disease”为关键词在治疗靶点数据库(TTD)(http://db.idrblab.net/ttd/)、GeneCards数据库(http://genecards.org)检索AD疾病靶点,使用UniProt数据库校正检索靶点结果名称。
2.7.3 蛋白质-蛋白质相互作用(PPI)核心网络的构建:将六味地黄丸入脑成分靶点与AD疾病靶点取交集并绘制韦恩图。将交集靶点提交至STRING(https://string-db.org/cgi/input.pl)在线网站,设定物种为人源基因“Homo sapiens”,构建PPI网络模型,保存tsv文件。
2.7.4 六味地黄丸“入脑成分-靶点-AD”的网络构建:将上述tsv文件导入CytoScape 3.7.2软件,构建六味地黄丸“入脑成分-靶点-AD”网络关系图。
2.7.5 基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析:将交集靶点导入Metascape在线网站(http://metascape.org/gp/index.html),选择对应的物种“H.sapinens”,对获取的靶点信息进行GO功能富集分析和KEGG通路富集分析。最后,将得到的数据导入微生信在线网站(http://www.bioinformatics.com.cn/)可视化。
2.8 细胞实验
2.8.1 MTT比色法检测细胞增殖率:收集依据不同分组情况处理后的细胞,在96孔板中加入MTT(5 g/L)20 μL/孔,孵育4 h,移除上清液,加入DMSO 150 μL/孔摇晃10 min,在570 nm下用酶标仪检测吸光度。
2.8.2 DCFH-DA荧光探针检测ROS含量:收集依据不同分组情况处理后的细胞,移除培养液,在6孔板中加入 DCFH-DA(10 μmol/L)1 mL/孔,放入培养箱内静置20 min后,每5 min混匀1次。孵育结束,用无血清培养液洗涤细胞3次,收集细胞,加入无血清培养液1 mL,上流式细胞仪检测。
2.8.3 ELISA检测Aβ1-42、ROS、IL-6、5-HT和DA的含量:收集依据不同分组情况处理后的细胞,采用常规双抗体夹心ELISA法测定,具体步骤按照各ELISA试剂盒说明书进行。
2.9 统计学方法

3 结果
3.1 行为学测试结果
3.1.1 对D-gal模型大鼠新物体识别实验中识别指数的影响:与Control组相比,Model组大鼠新物体识别指数显著降低(P<0.01);与Model组相比,LWDHW组大鼠新物体识别指数显著升高(P<0.01),上述差异均有统计学意义,见表1。
表1 新物体识别实验中三组大鼠识别指数比较Tab 1 Comparison of recognition indexes among three groups of rats in the new object recognition test
3.1.2 Morris水迷宫实验结果:(1)对D-gal模型大鼠定位航行实验中逃避潜伏期的影响。与Control组相比,Model组大鼠定位潜伏期显著延长(P<0.01);与Model组相比,LWDHW组大鼠定位潜伏期显著缩短(P<0.01),上述差异均有统计学意义。各组大鼠在训练过程中寻找平台潜伏期逐渐缩短,但Control组和LWDHW组大鼠定位航行潜伏期缩短较快,Model组潜伏期缩短幅度较小,见表2。(2)对D-gal模型大鼠空间探索实验中穿越平台次数和靶象限停留时间的影响。与Control组相比,Model组大鼠穿越平台次数显著减少,靶象限停留时间显著缩短(P<0.01);与Model组相比,LWDHW组大鼠穿越平台次数显著增加,靶象限停留时间显著延长(P<0.01),上述差异均有统计学意义,见表3。
表2 定位航行实验中三组大鼠逃避潜伏期比较Tab 2 Comparison of escape latency among three groups of rats in place
表3 空间探索实验中三组大鼠穿越平台次数和靶象限停留时间比较Tab 3 Comparison of the number of platform crossing and dwell time of target quadrant among three groups of rats in the space exploration n=6)
3.2 对D-gal模型大鼠海马神经元状态的影响
Control组的大鼠海马区细胞排列规整,神经元数量较多,染色均一,核仁清晰可见,未见核固缩现象;与Control组相比,Model组大鼠海马细胞排列紊乱,部分神经元丢失,神经元数目减少,细胞缩小,核仁不明显,核固缩现象明显;与Model组相比,LWDHW组海马神经元排列较为规整,神经元数量较多,形态正常,核仁较清晰,没有明显核固缩现象,见图1。

A. Control组;B. Model组;C. LWDHW组A. Control group; B. Model group; C. LWDHW group图1 三组大鼠海马神经元状态比较(HE,×40)Fig 1 Comparison of morphology of hippocampal neurons among three groups of rats (HE, ×40)
3.3 六味地黄丸入脑成分分析结果
以峰面积的有无判断该离子是否为含药脑脊液中的特有成分即潜在入脑成分,通过质核比碎片的裂解规律以及数据库比对确定7个原型入脑成分,分别为莫诺苷、(-)-奎宁酸、阿魏酸、芍药苷、泛酸、5-羟甲基糠醛和尿苷,见表4,总离子流图见图2。
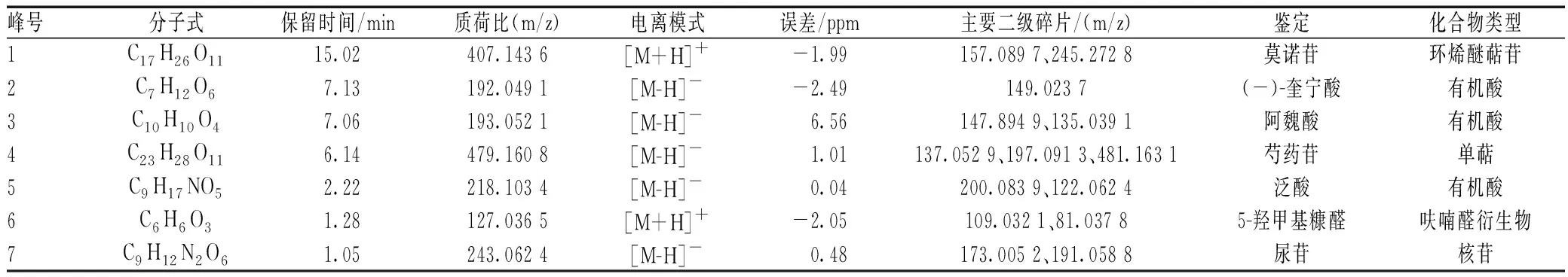
表4 六味地黄丸入脑成分分析结果Tab 4 Analysis results of brain-absorption components of Liuwei Dihuang pills
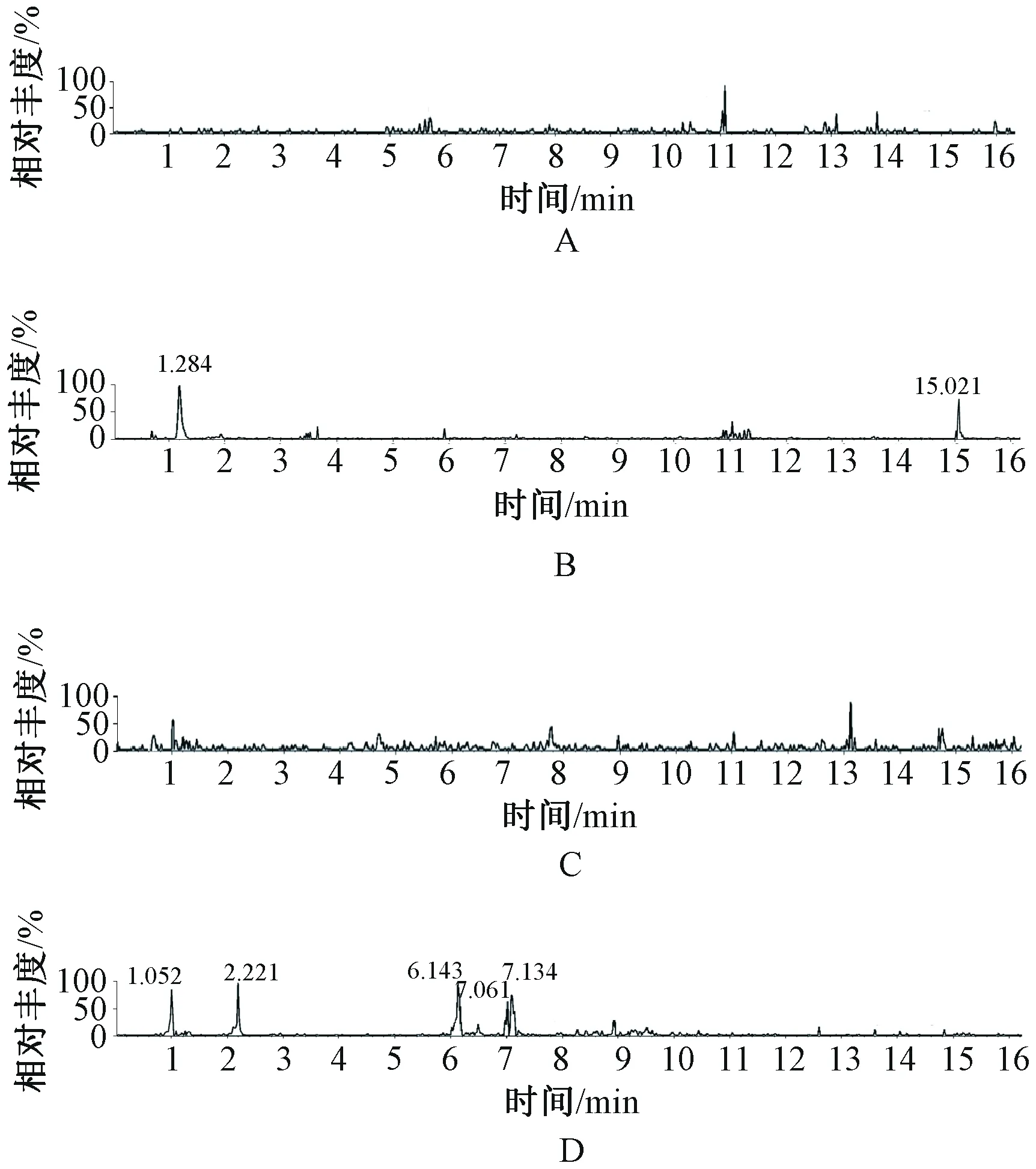
A.Control组(正离子模式);B.LWDHW组(正离子模式);C.Control组(负离子模式);D.LWDHW组(负离子模式)A. Control group (positive ion model); B. LWDHW group (positive ion model); C. Control group (negative ion model); D. LWDHW group (positive ion model)图2 Control组和LWDHW组大鼠脑脊液样品在正离子和负离子模式下的UPLC-Q-TOF-MS总离子流图Fig 2 Total ionization chromatography of UPLC-Q-TOF-MS of rats cerebrospinal fluid samples in Control group and LWDHW group under positive and negative ion model
3.4 网络药理学研究结果
3.4.1 六味地黄丸入脑成分靶点与AD相关靶点的收集:根据表4,在TCMSP、Swiss Target Prediction数据库筛选获取102个六味地黄丸入脑成分的分子靶点。以“Alzheimer’s disease”为关键词在TTD、GeneCards数据库检索得到1 560个与AD相关的作用靶点。
3.4.2 PPI网络的构建:将六味地黄丸入脑成分靶点与AD疾病靶点取交集,共得到47个交集靶点,韦恩图见图3。采用STRING构建PPI网络模型,见图4。图4中包括46个节点,136条边;节点越大、颜色越暗,表示Degree值越大,高的Degree值可作为靶点预测的重点;边越粗,表示Combine score值越大,代表两种蛋白之间的相互作用关系越强,相互作用多的靶点可能是六味地黄丸抗AD的关键。

图3 六味地黄丸入脑成分靶点与AD疾病靶点的韦恩图Fig 3 Venn diagram of brain-absorption components of Liuwei Dihuang pills and AD disease
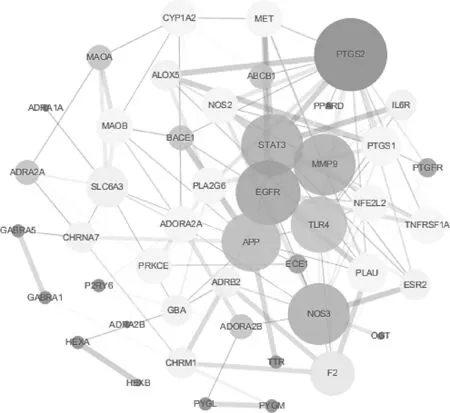
图4 六味地黄丸入脑成分靶点与AD疾病靶点的PPI核心网络Fig 4 PPI core network of brain-absorption components of Liuwei Dihuang pills and AD disease
3.4.3 六味地黄丸“入脑成分-靶点-AD”的网络构建:六味地黄丸“入脑成分-靶点-AD”网络关系图见图5,获得的网络共包括53个节点,95条边,7个六味地黄丸入脑成分中6个与AD靶点有直接作用,说明六味地黄丸抗AD可能是多成分、多靶点作用的结果。其中可能起到关键作用的成分为泛酸(pantothenic acid)、尿苷(uridine)和(-)-奎宁酸[(-)-quinic acid]。

图5 六味地黄丸入脑成分-靶点-AD网络构建Fig 5 Construction of “brain-absorption components-target-AD” network of Liuwei Dihuang pills
3.4.4 GO功能和KEGG通路富集分析:GO富集包括生物学过程(BP)、细胞组分(CC)以及分子功能(MF),通过 GO功能富集分析可以获得基因的生物学功能。本研究GO富集中富集到的主要条目44个,见图6,其中BP主要涉及对β淀粉样蛋白的反应、活性氧代谢、炎症反应的调节、脂质分解代谢等;CC主要涉及多巴胺能突触等;MF主要涉及β淀粉样蛋白的结合、蛋白磷酸酶的结合、丝氨酸水解酶活性、神经递质受体活性等。利用KEGG数据库对代谢通路进行富集分析,气泡图见图7,结果表明,除涉及“Alzheimer’s disease”通路外,六味地黄丸入脑成分治疗AD还涉及了精氨酸和脯氨酸代谢通路、5-羟色胺能突触通路等14条信号通路。
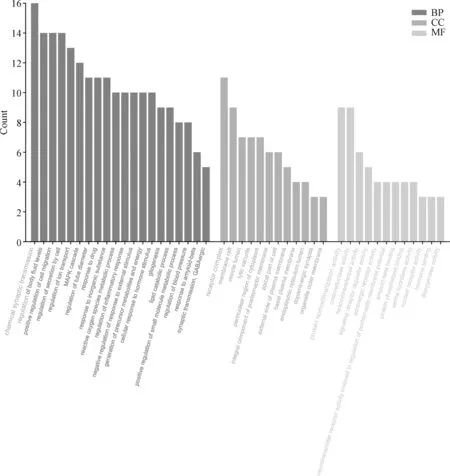
图6 六味地黄丸入脑成分与AD疾病交集靶点的GO功能富集分析Fig 6 GO functional enrichment analysis on the intersection targets of brain-absorption components of Liuwei Dihuang pills and AD disease
3.5 细胞实验结果
3.5.1 对D-gal损伤PC12细胞增殖率的影响:与Control组比较,Model组细胞的增殖率显著降低(P<0.01);与Model组比较,LWDHW组细胞的增殖率显著升高(P<0.01),上述差异均有统计学意义,见表5。

表5 三组PC12细胞增值率比较(n=6)Tab 5 Comparison of proliferation rates among three groups of PC12 cells (n=6)

图7 六味地黄丸入脑成分与AD疾病交集靶点的KEGG通路富集分析Fig 7 KEGG pathway enrichment analysis on the intersection targets of brain-absorption components of Liuwei Dihuang pills and AD disease
3.5.2 对D-gal损伤PC12细胞中Aβ1-42、ROS、IL-6、5-HT和DA的影响:与Control组比较,Model组细胞的Aβ1-42、ROS和IL-6水平显著升高(P<0.01),5-HT、DA水平显著降低(P<0.01);与Model组比较,LWDHW组细胞的Aβ1-42、ROS和IL-6水平显著降低(P<0.01),5-HT、DA水平显著升高(P<0.01),上述差异均有统计学意义,见表6。
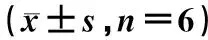
表6 三组PC12细胞Aβ1-42、ROS、IL-6、5-HT和DA水平比较Tab 6 Comparison of Aβ1-42, ROS, IL-6, 5-HT and DA levels among three groups of PC12 cells
4 讨论
老年斑(SPs)和神经原纤维缠结(NFTs)是被广泛接受的AD神经病理标志[12]。Aβ沉积作为SPs的核心成分,主要来源于淀粉蛋白前β-分解酶1(BACE1)及γ-分解酶对Aβ前体蛋白(APP)的不当剪切;Tau蛋白在脑中促进微管的形成和稳定,过度磷酸化的Tau蛋白从微管分离、聚集形成NFTs,二者均会改变神经元形态,诱导学习记忆能力损伤[13]。现有研究结果表明,Aβ诱导的神经毒性主要由皮层和海马神经元中Tau蛋白磷酸化的升高介导,Tau磷酸化水平的升高也被认为是Aβ诱导的神经毒性机制之一[14];Aβ与Tau蛋白之间可能也存在一定的协同作用,二者可相互促进、共同发挥神经毒性,影响AD进展[15]。
在Aβ异常沉积情况下,Aβ及其前体APP的N端金属结合域中的铜离子大量聚集,高效介导自由基氧化,导致脑中氧化应激等神经毒性的发生[16];有研究结果发现,Tau的初期纤维化过程可能也与神经元中发生的氧化应激有关[17]。在氧化应激条件下,机体内ROS大量产生并蓄积[18],对神经元膜脂质、蛋白质及核酸造成破坏,是氧化应激发生的直接标志,抑制其积累可能是抑制Aβ诱导神经毒性的有效途径。同时,AD发病过程与慢性缺氧状态密切相关,缺氧条件同样会使ROS的积累增加,缺氧条件下的鼠脑切片也显现出存在更多的Aβ斑块沉积[19]。缺氧诱导因子1(HIF-1)与机体缺氧直接相关[20],可通过抑制其亚型之一的HIF-1α表达,改善AD缺氧相关的氧化应激损伤。
同时,Aβ的异常沉积还可能是诱发AD中炎症反应的原因之一,可随着疾病的发展使小胶质细胞持续过度表达促炎因子,如IL-6、诱导性一氧化碳酶(iNOS/NOS2)等[21],导致小胶质细胞对Aβ的清除减少,引起病变。Toll-Like受体4(TLR4)是小胶质细胞中表达最主要受体之一,丝裂原激活的蛋白激酶(MAPK)作为TLR4的下游,是炎症中主要的信号传导途径[22-23]。黄贞伟等[24]发现,抑制TLR4/MAPK信号通路激活可明显改善LPS诱导的BV2小胶质细胞中IL-6 mRNA及iNOS蛋白的高表达,降低炎症损伤。而炎症与氧化应激的关系也十分密切,研究结果表明,在炎症引发小鼠认知障碍过程中,ROS-p38 MAPK系统可相互作用,通过影响小胶质细胞激活、炎症因子释放及氧化应激的发生,导致认知功能障碍[25]。
过多的ROS还会加剧线粒体功能损伤,导致能量代谢障碍[26]。能量代谢异常是AD的主要特征之一,机体内脂质及氨基酸代谢异常对AD相关的能量代谢障碍具有重要影响[27-28]。花生四烯酸(AA)是一种多不饱和必需脂肪酸,具有抑制脂肪生成、促进脂肪分解的作用。前列腺素G/H合酶2(PTGS2)和多不饱和脂肪酸5-脂氧合酶(ALOX5)分别是AA合成各种内源性前列腺素和白三烯类介质的限速酶,二者均可以通过AA途径参与机体的多种生理及病理过程,与AA共同在能量代谢(脂质代谢)的调节中发挥作用[29-30]。研究结果表明,机体内氨基酸对线粒体能量代谢同样有着重要的调控作用。如丝氨酸可促进脂肪和脂肪酸的新陈代谢,Le等[31]发现通过给予营养的丝氨酸,AD小鼠的记忆功能得以恢复;精氨酸代谢可以通过一氧化氮合酶生成的NO,影响大鼠体内的脂类代谢,促进葡萄糖和脂肪酸的氧化分解以及脂肪细胞的脂解[32]。
此外,脑内神经递质作为突触间传递信息的重要媒介,是神经元发挥功能的基础,包括乙酰胆碱类、单胺类和氨类等多种,其中乙酰胆碱、DA、γ-氨基丁酸(GABA)、5-HT及肾上腺素与AD密切相关[33]。而这些神经递质的功能状态也会受到Aβ和Tau的影响,Aβ沉积和过度磷酸化Tau蛋白会阻碍神经递质的释放,干扰神经元突触蛋白活性、Ca2+和转录因子等重要因子,促进AD发展[34]。
本实验利用UPLC-Q-TOF-MS技术鉴定出7个入脑化合物成分,其中6个与AD靶点有直接作用,分别为(-)-奎宁酸、阿魏酸、芍药苷、泛酸、5-羟甲基糠醛和尿苷,可能在六味地黄丸治疗AD中发挥重要作用。其中,阿魏酸是熟地黄中的活性成分,已被证实具有抗氧化和神经保护特性,可改善认知障碍[35];5-羟甲基糠醛可通过提高脑组织抗氧化酶活力、降低脂质过氧化反应,改善学习记忆能力[36];芍药苷具有抗抑郁、抗炎和保护神经等多种药理作用[37];非腺苷核苷如尿苷,可对细胞外兴奋性神经递质谷氨酸或GABA水平起到一定的调节作用[38]。结合网络药理学结果,六味地黄丸入脑成分可对Aβ沉积相关的BACE1、APP等靶点参与的Aβ结合及反应过程;高度磷酸化Tau蛋白相关的蛋白磷酸酶的结合;氧化应激相关的ROS代谢过程、HIF-1信号通路;炎症相关的TLR4、IL-6R和NOS2等靶点参与的MAPK级联、炎症反应的调节过程;能量代谢相关的PTGS2、ALOX5等靶点参与的脂质分解代谢过程、丝氨酸水解酶活性、精氨酸和脯氨酸代谢通路;神经递质相关的α7烟碱型乙酰胆碱受体(CHRNA7)、多巴胺转运体(SLC6A3)、α1亚型γ-氨基丁酸A受体(GABRA1)和β2肾上腺素受体(ADRB2)等靶点、参与突触后膜电位调节的神经递质受体活性、肾上腺素能受体活性、多巴胺能突触、5-羟色胺能突触通路和神经活性配体-受体相互作用通路等,起到一定调节作用。应用细胞实验对前期预测的部分结果进行验证,发现六味地黄丸脑脊液可对D-gal损伤PC12细胞增殖率及Aβ1-42、ROS、IL-6、DA和5-HT水平起到一定的调节作用。但作为预测性实验及体外细胞实验,本实验结果可能存在一定局限性,未来将继续探索六味地黄丸在动物模型中发挥神经保护作用的相关机制。
综上所述,本实验结合UPLC-Q-TOF-MS技术与网络药理学方法,确定六味地黄丸入脑成分,并预测其改善学习记忆能力的相关机制,可为六味地黄丸在AD防治中的潜在应用提供参考。
