铁掺杂二硫化钼纳米片作为高效的双功能电解水催化剂
2022-12-19丁仕久刘培涛冯爱玲
丁仕久,刘 亮,刘培涛,冯爱玲
(宝鸡文理学院 物理与光电技术学院,陕西 宝鸡 721016)
0 引 言
由于化石燃料的过度消耗导致了全球气候变暖和环境污染,人们越来越重视对可再生能源的研究,这使得可再生能源载体(如氢气)的开发最近取得了长足的进展[1]。和依赖化石能源的工业制氢技术(例如甲烷重整、水煤气法等)相比,电解水制氢更加高效、环保[2]。水的电解主要涉及到两个半反应(HER和OER),如果能用高效的催化体系打破强的氧-氢键,则是一种理想的制氢和制氧方法[3]。贵金属衍生的Pt/C和Ir/C分别是HER和OER的高效催化剂[4-6]。然而,贵金属的稀缺性和高昂的成本限制了其大规模应用,所以最近广泛研究的重点是寻找性能良好且储量丰富的催化剂,以取代昂贵和稀有的贵金属催化剂。最近的研究表明,基于非贵金属硫化物的功能纳米材料是一种潜在的可以替代贵金属电催化剂的材料,其中最具代表性且性价比高的替代品是MoS2基催化剂[7-9]。尽管块体MoS2的HER性能并不理想,但剥离形成二维MoS2纳米片后电催化性能则显著增强。在2018年,Liu的团队就成功在MoS2纳米片中掺杂Zn元素,激活了MoS2的活性基面,极大地提高了MoS2的HER催化活性[10]。然而此类研究工作大多数都集中在HER或OER半反应的单功能电催化剂的开发上,这主要是由于在单一催化剂中实现两种催化功能是一个巨大挑战。所以研制出能够同时改善HER和OER缓慢动力学的双功能电催化剂,对于实现高效的分解水至关重要[11-13]。
Wei的团队使用贵金属吸附的方式,在制备MoS2过程中加入Ir离子,使Ir离子与MoS2之间产生强烈的吸附作用使得2H-MoS2转化为活性位点更多,催化效果更好的1T-MoS2。有效的提高了MoS2在碱性条件下的双功能电解水催化效果[14]。然而贵金属的使用还是使此种材料的价格变贵,性价比相对会降低。所以开发出不含贵金属的MoS2双功能催化剂就成了下一个目标。近期的多种研究表明通过合金化、合成和掺杂等方法将多种活性组分引入到单一催化剂中,可以使其具备双功能催化效果,从而进行有效地电催化分解水。近期,Xiong的团队报道了一种共价掺杂方法来诱导制作双功能电水解MoS2催化剂,将Co离子掺入到MoS2中,使MoS2边缘的活性位点增加,从而极大的提高了在碱性条件下MoS2催化剂的HER与OER催化性能,提高了其电解水性能[15]。因此,制定有效的策略,在单一的电催化剂中创造具有优越的HER和OER催化活性的双功能活性位点,在给定的电解质中进行电催化分解水具有重要意义[16]。
受到上述实验的启发,本工作报告了一项结合实验和原理的研究,致力于开发具有高效性、稳定性并且经济和生态友好的双功能催化剂。实验采用简单又经济的水热法制备了在MoS2基材料中具有良好电解水催化活性的Fe掺杂MoS2纳米片。对Fe-MoS2进行了电化学测试,发现其具有较好的OER性能,在1 mol/L KOH电解质中达到10 mA cm-2的电流密度时过电位为250 mV,塔菲尔斜率为219 mV dec-1,且在这些条件下可稳定超过10 h以上。同时还测试了其HER活性,在0.5 M H2SO4电解质中达到10 mA cm-2的电流密度时过电位为220 mV。此外,对Fe-MoS2进行了分解水测试,在1 mol/L KOH电解液中,Fe-MoS2/C(阳极)∥Fe-MoS2/C(阴极)两电极体系下,在低电位为1.77 V时即可达到10 mA cm-2的电流密度,实现有效分解水。
1 实 验
1.1 Fe-MoS2的制备
采用水热法制备了Fe掺杂MoS2纳米片。首先将钼酸钠(H4MoNa2O6;0.5 g)、硫代乙酰胺(CH3CSNH2;1 g)和硝酸铁(Fe(NO3)3;10、50和100 mg,分别表示为样品Fe-MoS210 mg、Fe-MoS250 mg和Fe-MoS2100 mg)混合在烧杯中。然后将80 mL的乙醇加入烧杯中,在搅拌条件下溶解混合物,直到形成澄清溶液。之后,倒入100 mL水热釜中,将水热釜放入200 ℃的烘箱中加热24 h。最后,将所得溶液分散在水中,在超声作用下洗涤3次,再将所得溶液分散在乙醇中,再在超声作用下洗涤3次,并在80 ℃干燥箱中充分干燥,研磨。
1.2 样品的性能及表征
电化学测试:首先将样品(3 mg)和炭黑(3 mg)混合制备电化学测试电极。将混合物加入石油醚(3 mL)中,超声处理4 h,然后在60 ℃下干燥。之后将干燥的混合催化剂(6 mg)加入到5 mL容器中,加入N,N-二甲基甲酰胺(1 460 μL)和Nafion-117(40 μL)的溶液,形成催化剂油墨,再超声处理6 h。之后将新鲜油墨催化剂(9 μL)滴在玻碳电极(0.071 cm2几何面积)上,干燥箱中60 ℃干燥。使用CHI660E电化学工作站对标准的三电极电池进行所有的电化学测试,其中石墨碳棒用作对比电极,Ag/AgCl 用作参比电极。
材料特征:使用X射线衍射仪(XRD;日本理学--DMAX U1TIMA IV,日本东京)分析样品的成分与晶体结构。采用扫描电子显微镜(SEM;美国FEI--Quanta250 FEG,美国俄勒冈州波特兰)和高分辨率透射电子显微镜(HRTEM;Hitachi-SU8010,日本东京)观察产品的形态和结构。用X射线光电子能谱(XPS;ThermoFisher-“NEXSA”,美国马萨诸塞州沃尔瑟姆)分析了其化学状态和键合特性。拉曼光谱是在室温下使用英国Renishaw/inVia光谱仪上测量的。
2 结果与讨论
2.1 Fe-MoS2的表征
在本实验中,通过优化的水热法制备了不同Fe含量的Fe掺杂MoS2纳米片,如图1a所示。首先用硫代乙酰胺与二水钼酸钠制备出了MoS2样品,之后在上述两种药品之外再加入不同质量的硝酸铁使用相同的制作方法制备了3个样品,分别命名为Fe-MoS210 mg、Fe-MoS250 mg和Fe-MoS2100 mg。所有4种MoS2基样品都表现出相似的纳米片形态。如图1b所示,一个典型的扫描电子显微镜(SEM)图像显示Fe-MoS250 mg具有清晰的层状纳米片边缘。此外,用X射线衍射(XRD)对4个样品进行了测试,以研究其晶体结构。如图1c所示,该材料的XRD只显示了MoS2的晶体相。在32.5°和58.1°处的主峰分别代表了(100)和(110)的晶面反射,而在14.3°处的主峰被9.5°和17.2°处的两个峰所取代,这是由于Fe离子的掺杂使得MoS2的层间距扩大造成的[17]。Zheng等,报道过通过插入Li、K和Na离子可以增加相邻MoS2层之间的间距[18]。层间距的扩大可能有利于导电性的提高,从而提高材料的电解水催化活性。
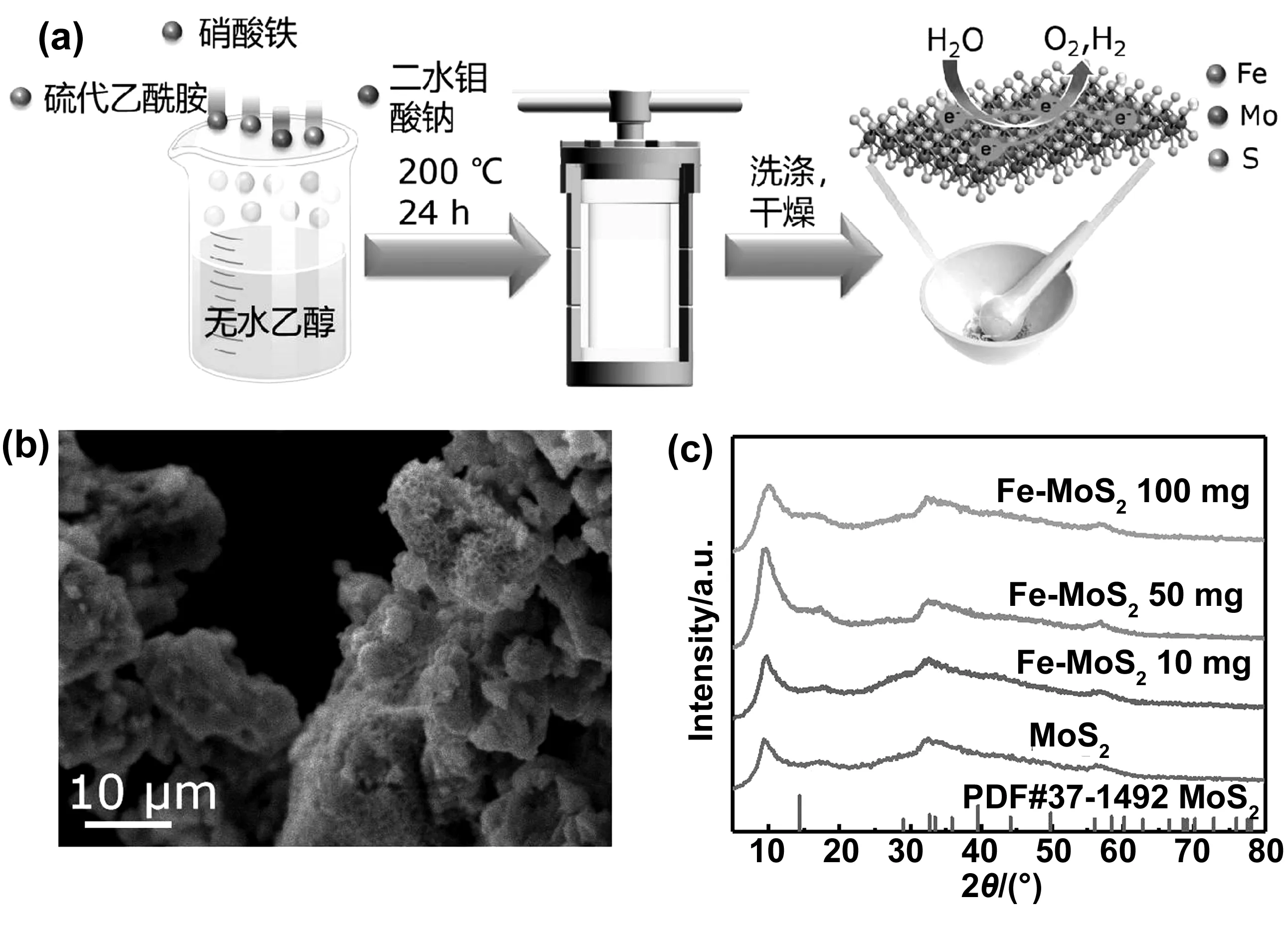
图1 (a)合成Fe-MoS2的实验流程图;(b) Fe-MoS2 50 mg的SEM图;(c) Fe-MoS2和MoS2的XRD图
本文利用透射电子显微镜(TEM)观察了Fe-MoS250 mg和MoS2的形态和微观结构。如图2(a)、(b)和(c)所示,Fe-MoS250 mg和MoS2具有相似的纳米片形状。图2(b)中相邻单层间距为0.6~0.61nm,较图2a中0.44~0.45 nm明显扩大,晶格间距略有增加。我们认为层间间距的扩大有利于提高物质电导率,有利于电子转移,从而提高Fe-MoS250 mg的电解水催化活性[19-20]。此外,还利用能量色散X射线(EDX)元素映射分析来验证Mo、S和Fe元素的存在于纳米片中且均匀分布(图2(d))。

图2 (a)Fe-MoS2 50 mg的HRTEM图;(b) MoS2的HRTEM图;(c) Fe-MoS2 50 mg的TEM图;(d)Fe-MoS2 50 mg的mapping图。
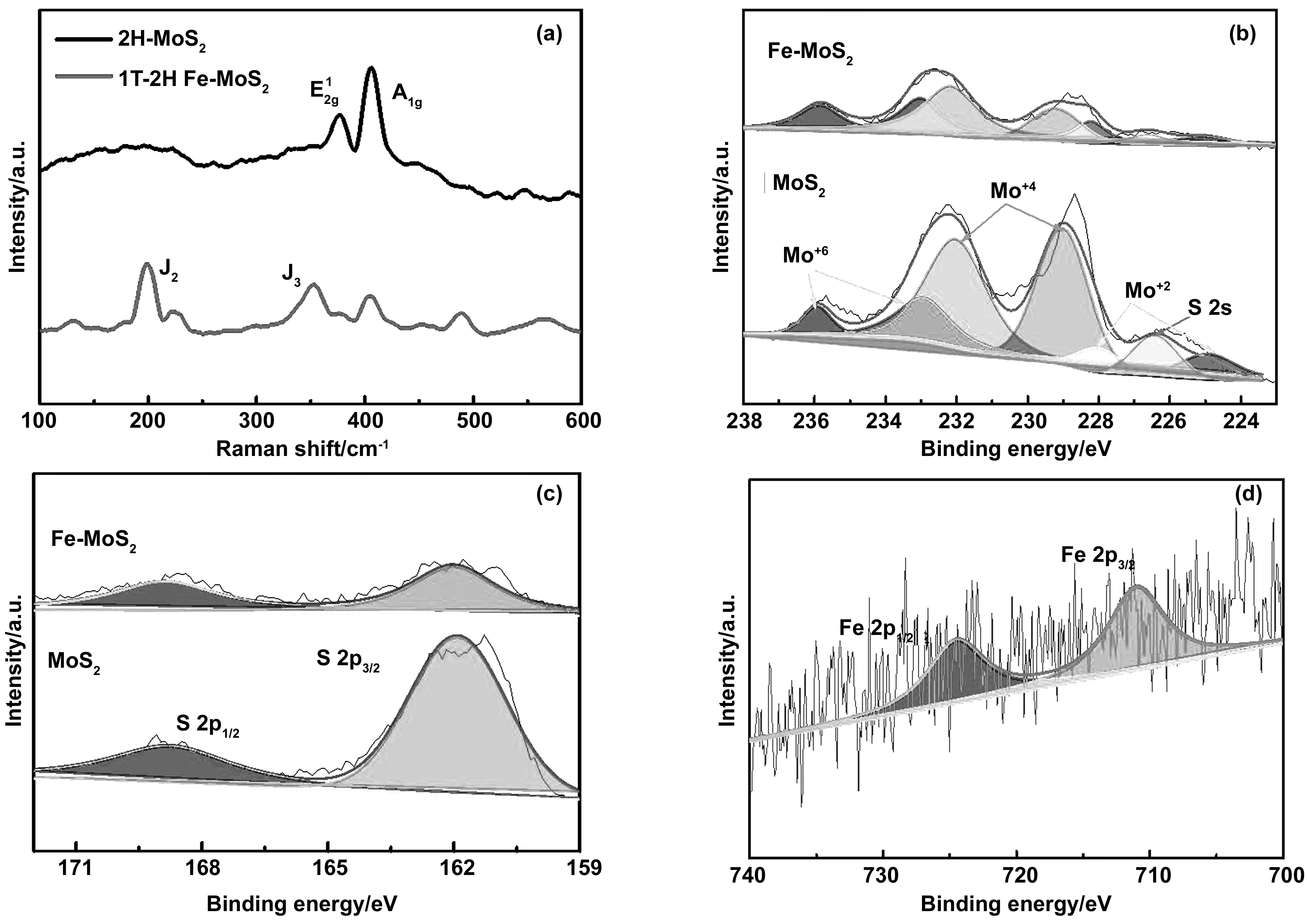
图3 Fe-MoS2 50 mg和MoS2的(a)拉曼光谱;(b)Mo 3d XPS谱;(c)S 2p XPS谱;(d)Fe-MoS2催化剂的Fe 2p XPS谱
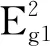
2.2 Fe-MoS2的电化学测试
通过线性扫描伏安法(LSV)曲线评估了几种Fe-MoS2样品和MoS2在1M KOH溶液下的OER活性。如图4(a)和4(b)所示,Fe-MoS250 mg在电流密度为10 mA cm-2时的过电位为250 mV,显著低于Ir/C的340 mV并且优于MoS2(304 mV)。与其他样品相比,Fe-MoS250 mg表现出最好的OER催化活性。结果表明,Fe掺杂有效地提高了MoS2的OER催化活性。此外,还通过Tafel斜率进一步评估了催化剂的OER活性(图4c)。Fe-MoS250 mg的Tafel斜率为219 mV dec-1,低于MoS2的254 mV dec-1,表明Fe-MoS2纳米片的催化活性有所提高。
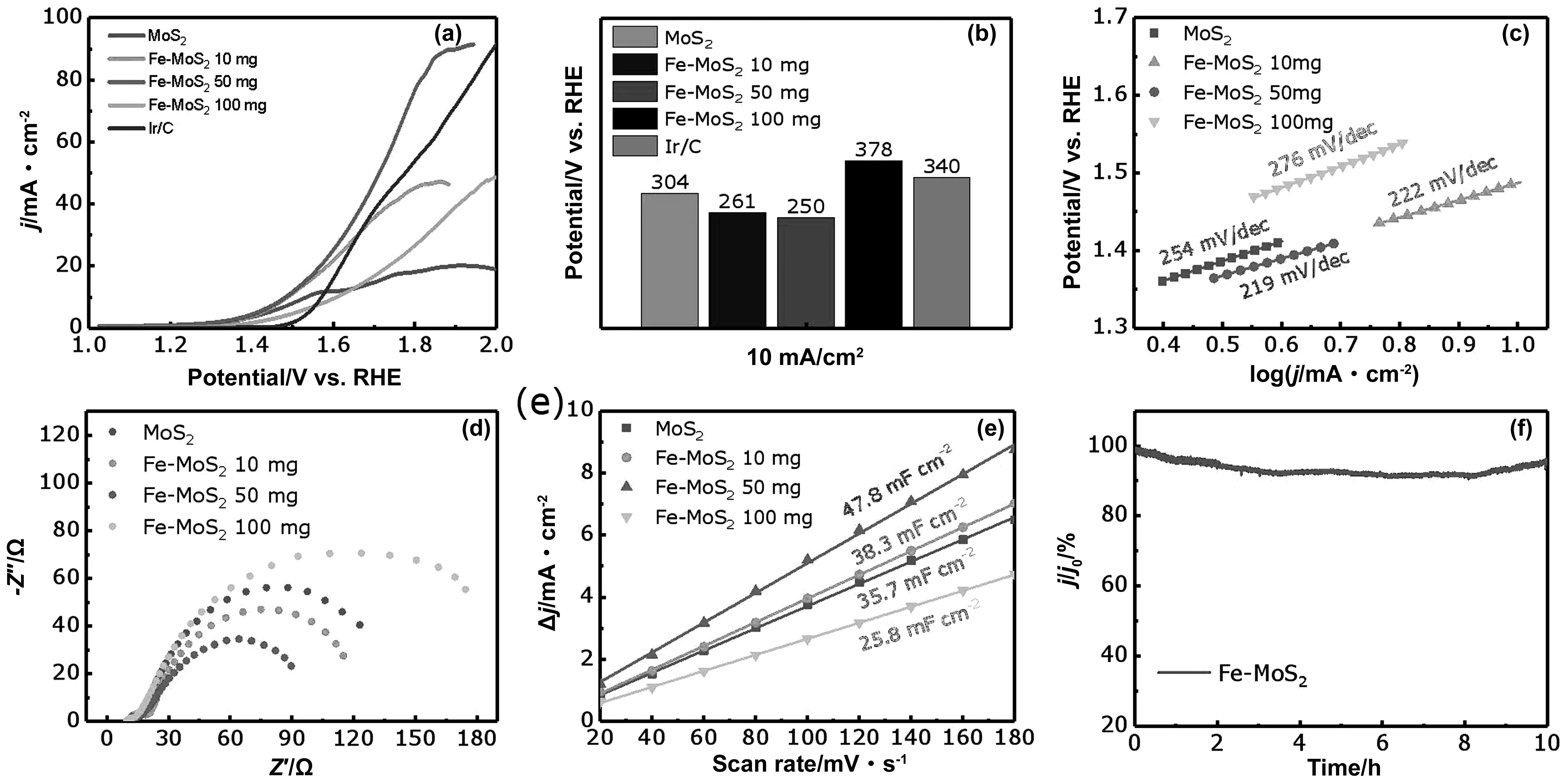
图4 Fe-MoS2的OER电化学性能。(a)LSV曲线、(b)过电位、(c)Tafel斜率、(d)电化学阻抗曲线和(e)电化学表面积曲线;(f)Fe-MoS2 50 mg在1M KOH下的i-t曲线
这些结果表明,引入Fe掺杂剂进一步提高了MoS2纳米片的OER催化活性[27]。为了揭示OER的机理,从电导率和活性位点等方面分析了催化剂的OER性能。这些因素被认为是OER催化剂的最关键因素[28-30]。从图4(d)所示的电化学阻抗谱(EIS)可以看出,在0.48 V的电压下Fe-MoS250 mg(100 Ω)比MoS2(145 Ω)更小,说明OER动力学过程更快,电导率得到提高。用电化学双层电容可以估算出样品的电化学表面积。如图4(e)显示,Fe-MoS250 mg(47.8 mF cm-2)的电化学表面积大于MoS2(35.7 mF cm-2)。因此可以预测的是Fe掺杂后的Fe-MoS2比MoS2有更多的OER催化活性位点,更重要的是,如图4(f)所示,Fe-MoS250 mg在随后的10 hi-t曲线上没有进一步的变化,这表明了Fe-MoS250 mg催化剂在强碱性电解质中具有长期稳定性。
同时,在0.5 mol/L H2SO4中测量了Fe-MoS250 mg的HER性能,图5(a)显示了LSV对样品MoS2、Fe-MoS210 mg、Fe-MoS250 mg 和Fe-MoS2100 mg催化剂进行IR校正后得到的极化曲线,扫描速率为20 mV/s。根据图5(a)显示,样品Fe-MoS250 mg在电流密度为10 mA cm-2时其过电位为220 mV,在电流密度为100 mA cm-2时其过电位为363 mV,在高电位下的过电势与MoS2(392 mV)相比有明显的降低。证明Fe的掺杂确实可以有效提高MoS2的HER催化活性。接着通过对塔菲尔斜率的研究,进一步评价了催化剂的本征HER活性(图5(b)),Fe-MoS250 mg的Tafel斜率为82 mV/dec、低于MoS2的101 mV/dec,表明Fe-MoS250 mg纳米片的反应动力学有所提高。为了揭示HER的机理,本文从电子电导率方面分析了催化剂的HER性质,从图5(c)的电化学阻抗谱(EIS)中可以看出,在-0.45 V电压下相比于MoS2(45 Ω),Fe掺杂后的Fe-MoS250 mg(32 Ω)具有更小的电化学阻抗,证明其动力学过程更快,且导电率有所提升。更重要的是,如图5(d)中所示。Fe-MoS250 mg在随后的20 hi-t曲线上没有进一步的变化,这表明Fe-MoS250 mg催化剂在HER的强酸性电解质中的长期稳定性。上述结果表明,通过引入Fe掺杂剂,Fe-MoS2纳米片的HER催化活性得到了进一步的增强。
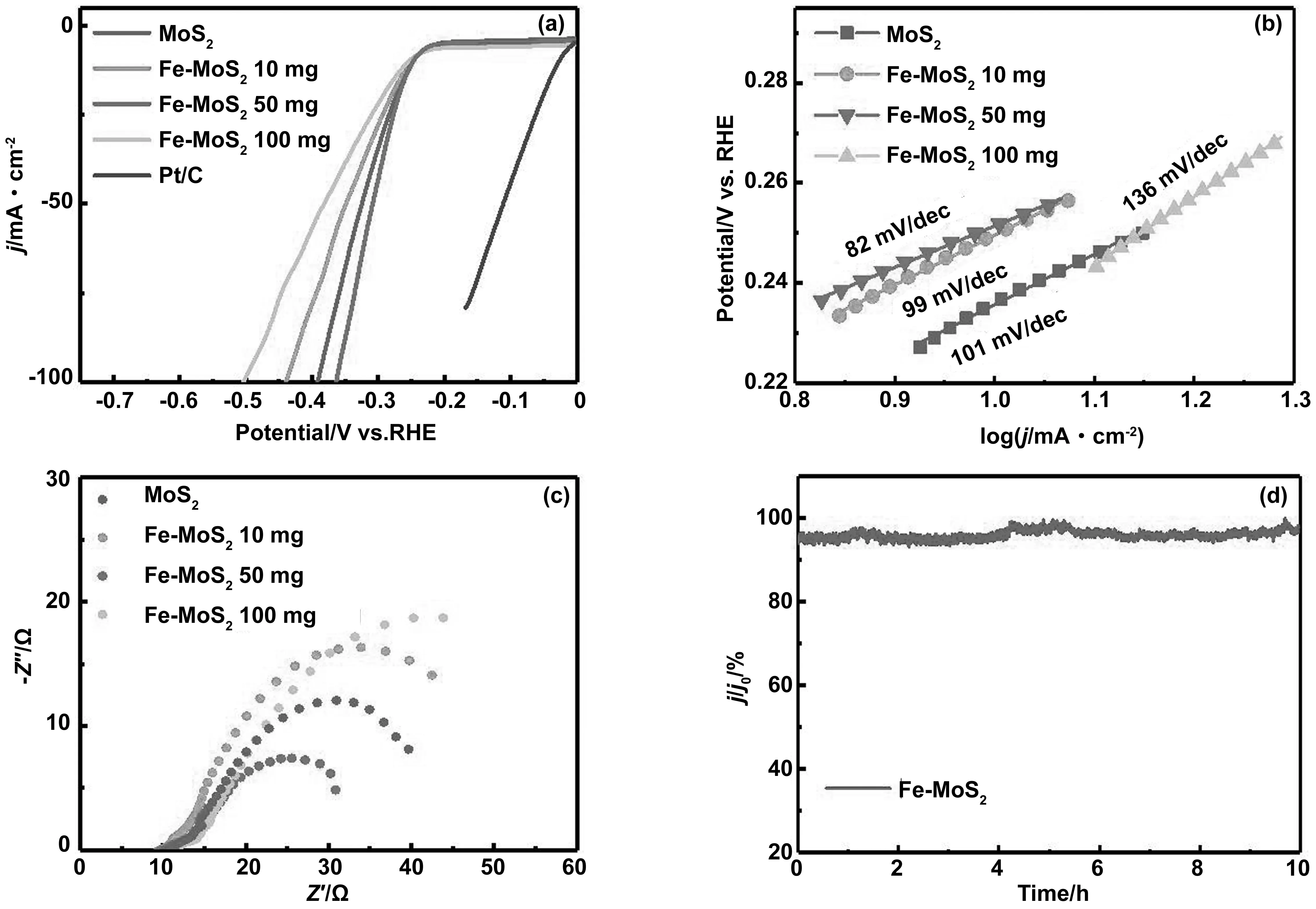
图5 Fe-MoS2的HER电化学性能。(a)LSV曲线、(b)Tafel斜率、(c)电化学阻抗曲线和(d)Fe-MoS2 50 mg在0.5 M H2SO4下的i-t曲线
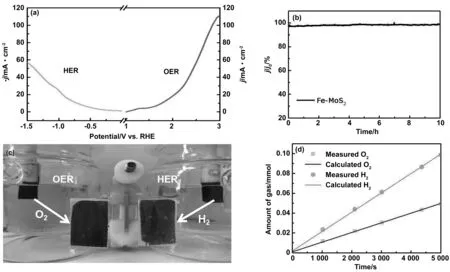
图6 (a)Fe-MoS2/C双电级的分解水LSV曲线、(b)i-t曲线;(c)分解水过程中阴阳级状态图;(d)分解水过程中产生的H2和O2气体的理论计算和实际测量函数曲线
2.3 Fe-MoS2的电解水测试
为了证明Fe-MoS2能更好地用于实际应用,实验还使用Fe-MoS250 mg催化剂构建了一个具有双电极设置的Fe-MoS2/C(阳极)∥Fe-MoS2/C(阴极)电极的电解系统,在1 mol/L KOH中进行电解水实验。图6a显示了Fe-MoS2/C的LSV曲线,当电压为1.77 V时,OER的电流密度可以达到 10 mA cm-2。且在10 h的长时间固定电流密度下的i-t测试中,催化性能没有明显下降(图6b所示)。电解水的原理为:电子从阳极直接转移到阴极,提供电能,在阴极产生H2,在阳极产生O2,从图6C中可以清楚地观察到H2和O2的产生。同时实验还测量了电解水过程中生成的O2和H2的量,其中记录的气体体积作为水分解时间的函数。如图5d所示,H2和O2分别表现出线性关系,斜率比值接近2∶1,和理论比率相一致[31-33]。
3 结 论
综上所述,成功地合成了一种高效的Fe掺杂MoS2纳米片的双功能催化剂,可直接用于电催化水分解。该材料展现出了良好的双功能电解水催化活性,在 pH 值为14的强碱溶液中,电流密度为10 mA cm-2时过电位为250 mV,并且能保持稳定达到10 h以上。同时在pH值为0的酸性溶液中测试其HER性能,电流密度为10 mA cm-2时过电位为220 mV。Fe-MoS2具有良好电解水催化性能的原因可归功于以下几点,首先从XRD与TEM图中可以发现在 Fe 掺杂后 MoS2的层间距扩大,有利于电子转移;其次从拉曼表征可以发现在 Fe 掺杂后 MoS2由2H 相转化为1T相,结合电化学阻抗图可以看出Fe的掺杂使得 MoS2的导电率提高;另外根据电化学表面积图的显示,Fe掺杂使得MoS2边缘OER活性点位增加,是使Fe-MoS2电解水催化性能提高的另一原因。值得注意的是,Fe-MoS2/C(阳极)∥Fe-MoS2/C(阴极)电极在1.77 V的电池电压下可达到电流密度为10 mA cm-2,实现了高性能的电催化水分解。该工作不仅为电解水制氢和制氧提供了具有吸引力的非贵金属催化剂,而且为通过掺杂过渡金属来构筑高性能电催化剂提供了新的方向。
致谢:陕西省千人计划青年项目;宝鸡市材料物理与功能器件重点实验室的大力支持。
