柚皮苷改善脂多糖诱导的小鼠抑郁样行为的作用研究
2022-12-19孔安琪谢汝欣李江辉范晓棠
吴 川,孔安琪,谢汝欣,李江辉,蔡 云,范晓棠
400038 重庆,陆军军医大学(第三军医大学):医学心理系军事认知心理学教研室
抑郁症是一种常见的、易复发的精神疾病。临床上,抑郁症的特点是情绪或者心境低落、快感缺乏、睡眠不足、食物摄入和运动活动减少,并增加对疼痛的敏感性[1]。目前有不同的治疗措施,包括选择三环类抗抑郁药、选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRIs)、单胺氧化酶抑制剂、电休克治疗、运动、锂等用于抗抑郁治疗[2]。临床效果和长期结果仍不理想,一些抗抑郁药会使患者行为躁动,甚至会诱发自杀意念[3]。随着世界范围内抑郁症患者数量的快速增长,寻找新的分子靶点和治疗策略变得愈发重要。
柚皮苷(naringin,Nar)是一种天然存在的生物类黄酮,分布于较多种类的水果和蔬菜中,如葡萄和其他柑橘类水果,并负责水果的酸味和苦味。药代动力学研究表明,柚皮苷通过α-鼠李糖苷酶和β-葡萄糖苷酶进行肠杆菌酶代谢,去掉接在柚皮苷的7碳上两个鼠李糖单元,产生神经活性代谢物柚皮素[4-6]。柚皮素是容易吸收的主要活性糖苷成分,与蛋白激酶C信号传导途径相互作用的能力穿越血脑屏障,并引起广泛的神经保护功能[4]。在实验模型小鼠中发现,单次给药柚皮苷具有抗焦虑、抗抑郁样和增强记忆的特性,然而其中枢作用的途径目前仍不清楚。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌的细胞壁成分。腹腔注射LPS引起中枢的神经炎症反应,包括白细胞介素-1(interleukin-1,IL-1),白细胞介素-6(IL-6)和肿瘤坏死因子α(tumor necrosis,TNF-α)在内的炎性细胞因子的升高,引起小鼠抑郁样行为和认知改变[7-8]。本研究采用LPS诱导的小鼠抑郁模型,检测Nar的抗抑郁作用。研究表明,柚皮苷具有很强的抗炎特性,能够抑制促炎细胞因子,如IL-6和TNF-α的表达[6, 8-9]。通过检测海马区域小胶质细胞数量和炎症相关因子的表达进一步探讨Nar对LPS诱导的抑郁样行为影响的途径。
1 材料与方法
1.1 材料
1.1.1 实验动物 本实验采用30只 8 周龄雄性健康 C57BL/6小鼠,SPF级,体质量 20~23 g,小鼠5只/笼饲养,自由饮水和食物,环境温度为21~24 ℃,相对湿度为50%~60%,并维持12 h光照/12 h 黑暗的昼夜交替节律。所有行为学实验在陆军军医大学认知心理学教研室动物行为学实验室进行。所有的实验步骤都是经陆军军医大学批准按照实验动物指南进行护理和使用(Amuwec2020155)。
1.1.2 试剂与仪器 本实验采用的柚皮苷购于上海阿拉丁生物科技有限公司;脂多糖购于美国Sigma公司;柚皮苷溶于0.9%的生理盐水(saline,Sal)中(8 mg/mL);脂多糖溶于0.9%的生理盐水中(0.1 mg/mL);RIPA裂解缓冲液(Beyotime,Shanghai,China);0.01M磷酸盐缓冲盐水(PBS,pH7.4);4%多聚甲醛(PFA);冷冻保护剂溶液(30%乙二醇,30%蔗糖溶于0.01M PBS);DAPI(1∶50 000)。
1.2 方法
1.2.1 分组及给药方式 小鼠被随机分成3组:对照组、Sal+LPS组、Nar+LPS组,每组10只。①对照组:腹腔注射生理盐水,1次/d,连续13 d。②Sal+LPS组:腹腔注射生理盐水,1次/d,连续8 d,之后腹腔注射LPS,1 mg/kg,1次/d,连续5 d。③Nar+LPS组:腹腔注射柚皮苷,80 mg/kg,1次/d,连续8 d[5],之后腹腔注射LPS,1 mg/kg,1次/d,连续5 d[10]。柚皮苷和LPS用药剂量参考既往研究[5,10]。
1.2.2 行为学实验 所有的行为测试都是在最后一次LPS注射12 h后开始测试的。使小鼠适应实验每次测试前至少要放置30 min。
1.2.3 旷场实验 将小鼠置于40 cm×40 cm大小的箱体内,将40 cm×40 cm划分成4×4个,共16块正方形区域,中间2×2的4块区域作为中心识别区,周围的12块区域作为非中心识别区,用摄像头记录小鼠活动轨迹30 min[10,14-15],用Ethovision XT11.5软件进行分析。
1.2.4 蔗糖偏好实验(sucrose preference test,SPT) 将每只小鼠单独放在一个笼子内,给予两瓶1%的蔗糖水12 h适应,之后给予两瓶纯水12 h适应,再禁食水24 h,接着给予小鼠1瓶糖水和1瓶纯水饮用12 h,期间将糖水瓶和纯水瓶交换位置,以消除水瓶位置对小鼠喝水偏好的影响[14-15]。记录糖水瓶和纯水瓶前后质量差,即为小鼠12 h饮用的量。蔗糖偏好计算方法:

1.2.5 明暗箱穿梭实验 明箱大小30 cm×30 cm,内有灯光;暗箱大小30 cm×15 cm,内无灯光。两个箱体相连,中间有洞连通;两个箱体间有活动隔板。实验时将小鼠置于暗箱,录像时将中间的隔板打开,让小鼠可以自由穿梭于两个箱体。用摄像头监测小鼠的活动10 min,记录小鼠穿梭次数和在明箱时间[30]。
1.2.6 十字高架迷宫实验 小鼠由于嗜暗性会倾向于在闭臂中活动,但好奇心和探究性又会在开臂中活动,在面对新奇刺激时,小鼠产生探究的冲动与恐惧,造成了探究与回避的冲突行为,从而产生焦虑心理。十字高架迷宫实验使用灰色亚克力材质制成,尺寸大小为臂长425 mm ×臂宽120 mm ×臂高225 mm。调整实验环境光照为50 lx。将观察区域划分为开臂、闭臂和中心区。每只小鼠从中心区域放入并允许其在高架中自由探索10 min,测试箱正上方的摄像机监测小鼠活动情况[10]。用Ethovision XT 11.5软件记录小鼠期间的活动轨迹和停留于开臂和闭臂区域时间。
1.2.7 强迫游泳实验 每只小鼠都被放置了单独放入圆筒中(高度:20 cm,直径:10 cm)6 min,加水至10 cm高,水温25 ℃,以避免与温度有关压力反应。测定小鼠不动时间,记录小鼠在水中停止挣扎,缓慢移动以保持头部高于水面漂浮的时间。录制视频6 min,取后4 min记录并分析不动时间[10-11]。不动时间增加表示无助水平升高。
1.2.8 悬尾实验 小鼠被一个在声音和视觉上都隔离的钩子吊着,钩子离地面50 cm。钩子放在离尾巴尖约1 cm的地方。将小鼠被悬挂6 min,录制视频6 min,取后4 min记录并分析不动时间[10-11]。不动时间增加表示无助水平升高。
1.2.9 免疫组织化学和免疫荧光 用异氟烷深度麻醉小鼠,并用0.01 M磷酸盐缓冲盐水(PBS,pH7.4)经心脏灌注4 min,然后用0.1 M磷酸盐缓冲液(PBS,pH7.4)和4%多聚甲醛(PFA)溶液灌注4 min。取出全脑,并在4℃下4%PFA固定剂中后固定2 d,然后在4 ℃下用30%蔗糖的4%PFA溶液固定3 d。在低温冰冻切片机器上切割连续的冠状脑切片(厚度30 μm)并在-20 ℃下在冷冻保护剂溶液(30%乙二醇,30%蔗糖溶于0.01 M PBS)中储存。首先将切片在0.01 M PBS中洗涤3×10 min以除去冷冻保护剂溶液,然后在37 ℃下在0.3%Triton X-100中处理2 h以增加膜的通透性,然后用0.01M PBS洗涤3×10 min。然后将切片与兔抗Iba1(1∶500,Wako,CA,USA)37 ℃孵育2 h,后4 ℃过夜。PBS洗涤后避光加兔抗Cy3(1∶500)二抗,37 ℃孵育2 h;之后PBS洗涤,加DAPI(1∶50 000)1 min,封片。最后,在配备有连接到Zeiss AxioVision 3.0系统的Zeiss Axiovert显微镜(Oberkochen,德国)下观察染色并拍照。每组有4只动物标本,每只动物至少取3张切片,取3次染色计数均值进行分析。
1.2.10 蛋白质印迹 分离海马样品并在冰冷的RIPA裂解缓冲液(Beyotime,Shanghai,China)中研磨匀浆。离心裂解物(15 000 r/min,4 ℃, 10 min)后,使用二辛可宁酸试剂盒(Beyotime Institute of Biotechnology,Shanghai,China)测定蛋白质浓度。将蛋白质样品(每泳道10 μL)在10%SDS-聚丙烯酰胺凝胶上于80 V分离120 min,然后以220 mA转移到聚偏二氟乙烯(PVDF)膜上120 min。在室温下用含有0.1%Tween 20和5%无脂牛奶的Tris缓冲盐水封闭3 h。然后将膜与针对NF-κB(1∶1 000,BD Biosciences)的兔抗体一起孵育,在4 ℃过夜,以及针对β-肌动蛋白的小鼠抗体(1∶2 000,Cell CWBIO,Beijing,China)。然后将膜在室温下与山羊抗小鼠免疫球蛋白G(IgG;1∶2 000,Santa Cruz Biotechnology)一起室温孵育3 h。所有蛋白质印迹数据代表至少3次独立实验。通过增强化学发光方法(Amersham,Piscataway,NJ,USA)使膜上的特定蛋白质条带可视化。每组3只动物用于分析。
1.2.11 荧光定量PCR检测(real-time quantitative PCR, RT-qPCR) 分离海马样品并在4 ℃的TRIzol Reagent中研磨匀浆。加入200 μL的氯仿,震荡15 s,离心裂解物(12 000 r/min,4 ℃, 10 min)后,取水相溶液加入200 μL的70%乙醇(无RNase水配置)混匀后加入吸附柱中。离心后用NanoDrop2000分光光度计测定RNA浓度。提取总mRNA(700 ng)并根据制造商的方案逆转录成cDNA。设计目的基因引物,配置反应体系,置于PCR仪反应。IL-1β引物序列:(F)5′-GGCAA-CTGTTCCTGAACTCAACTG-3′,(R)5′-CCATTGAGGT-GGAGAGCTTTCAGC-3′;TNF-α引物序列:(F)5-GTTTG-GCTTCCGGTGTGTTG-3′,(R) 5′-GCATTGTGGGTCTT-GTTCCC-3′;NF-κB引物序列:(F)5-ATGGCAGACG-ATGATCCCTAC-3′,(R)5′-CGGAATCGAAATCCCCTCT-GTT -3′。每组3只动物用于分析。
1.3 统计学分析

2 结果
2.1 柚皮苷的预处理可以减轻LPS对小鼠体质量的影响
LPS处理使得小鼠的体质量有明显的下降,而柚皮苷的预处理可以逆转LPS对小鼠体质量的影响。根据实验进程测4次体质量:实验开始前(实验第1天);注射8 d的生理盐水或者柚皮苷后(实验第8天);注射5 d的LPS或生理盐水后(实验第13天),行为学检测完(实验第18天)。3组小鼠为随机分组,每组小鼠的体质量进行组内前后对比。Sal+LPS组体质量前后比较,给药的第13天和第8天相比,出现明显下降,同时与对照组相比,出现显著的统计学差异(图1A,P<0.01);而Nar+LPS组体质量前后比较,给药的第13天和第8天相比,没有明显差异(P>0.05);对照组体质量前后比较,第13天和第8天相比,体质量明显升高(P<0.05)。
在实验第13天,3组小鼠的体质量有明显差异(图1B,F=38.287,P<0.001)。Sal+LPS组体质量和对照组相比,明显下降(P<0.001),Nar+LPS组体质量和对照组相比,明显下降(P<0.001),Sal+LPS组体质量和Nar+LPS组相比,明显下降(P<0.01)。说明LPS的处理可以明显降低小鼠的体质量,而Nar的预处理可以逆转LPS的影响。
2.2 柚皮苷和LPS不影响小鼠的探索行为和焦虑样行为
小鼠在OFT检测的总路程反映其探索行为,分时段路程统计显示3组小鼠无明显差异(图2A、B),3组小鼠在旷场总运路程亦无显著差异(图2C,F=0.049),提示LPS和柚皮苷对小鼠的探索行为无明显影响。OFT实验中心区域时间可以衡量小鼠焦虑程度,3组小鼠在旷场中心区域时间的差异不明显(图2D,F=0.737,P>0.05)。明暗箱实验和高架十字迷宫实验亦广泛用于评估小鼠的焦虑样行为,明暗箱实验结果显示3组小鼠在明暗箱穿梭次数(图2E,F=0.335,P>0.05)和明箱时间(图2F,F=0.699,P>0.05)差异均不显著;高架十字迷宫实验显示3组小鼠进入开臂次数百分比(图2G,F=1.735,P>0.05);开臂时间(图2H,F=1.540,P>0.05)差异均不显著。提示柚皮苷和LPS不影响小鼠的焦虑样行为。
2.3 柚皮苷减轻LPS诱导小鼠的抑郁样行为
糖水偏好实验结果显示,3组小鼠之间对糖水偏好程度有显著差异(图3A,F=3.936,P<0.05),与对照组小鼠相比较,Sal+LPS组小鼠对蔗糖的偏好减低(P<0.05),Nar处理可以改善LPS处理小鼠的蔗糖的偏好(P<0.05)。悬尾实验结果显示,3组小鼠之间在静止不动时间有显著差异(图3B,F=9.646,P<0.01),与对照组小鼠相比较,Sal+LPS组小鼠的静止不动时间显著增加(P<0.01),而Nar处理可以减少LPS处理小鼠的静止不动时间(P<0.05)。强迫游泳实验结果显示,3组小鼠之间在静止不动时间有显著差异(图3C,F=22.033,P<0.01),与对照组小鼠相比较,Sal+LPS组小鼠的静止不动时间显著增加(P<0.01),而Nar处理可以减少LPS处理小鼠的静止不动时间(P<0.01).以上结果提示柚皮苷减轻了LPS引起的小鼠抑郁样行为。
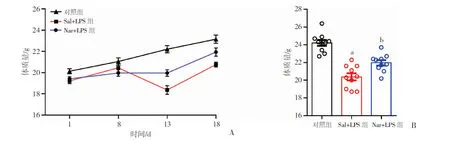
A:小鼠体质量变化情况;B:小鼠第13天的体质量情况 a:P<0.01,与对照组相比,b:P<0.01,与Sal+LPS组相比

A:旷场实验小鼠运动轨迹图;B:3组小鼠运动距离统计分析;C:3组小鼠总运动距离;D:小鼠中心区域时间变化;E:小鼠穿梭次数统计;F:3组小鼠明箱活动时间;G:3组小鼠进入开臂次数百分比;H:3组小鼠进入开臂时间统计

A:蔗糖偏好实验;B:悬尾实验;C:强迫游泳实验 a:P<0.01,与对照组相比,b:P<0.01,与Sal+LPS组相比
2.4 柚皮苷抑制LPS诱导的小鼠海马DG区和CA1区小胶质细胞的活化
3组小鼠海马DG区小胶质细胞的数量有显著差异(见图4A、B,F=52.164,P<0.01),与对照相小鼠相比,Sal+LPS组小鼠海马DG区小胶质细胞数量显著增加(P<0.01),高倍下观察到细胞的胞体较大、突起更粗,提示LPS处理活化DG区小胶质细胞;Nar处理抑制LPS引起的DG区小胶质细胞的数量增加及功能活化(P<0.01)。与DG区类似,3组小鼠海马CA1区小胶质细胞的数量有显著差异(见图4A、C,F=17.674,P<0.01),LPS处理显著增加CA1区小胶质细胞的数量及活化(P<0.01);而Nar处理显著抑制LPS对海马CA1区小胶质细胞的活化,并减少小胶质细胞的数量。

a:P<0.01,与对照组相比,b:P<0.01,与Sal+LPS组相比
2.5 柚皮苷降低LPS引起的小鼠海马内的炎症反应
Western blot检测3组小鼠海马内NF-κB的表达水平,结果显示3组小鼠存在显著差异 (图5A、B ,F=5.508,P<0.05)。与对照组小鼠相比,Sal+LPS组小鼠海马内NF-κB蛋白表达量升高(P=0.068),而Nar处理抑制LPS引起的小鼠海马内升高的NF-κB表达(P<0.05)。荧光定量PCR检测发现3组小鼠海马内NF-κB mRNA的表达水平亦存在显著差异(图5C,P<0.05,F=11.261)。与对照组小鼠相比,Sal+LPS组小鼠海马内NF-κB mRNA的表达水平显著升高(P<0.05);Nar处理抑制LPS引起的海马内升高的NF-κB mRNA表达量(P<0.01),表明Nar预处理可以抑制LPS引起的小鼠海马内NF-κB蛋白和mRNA的表达的表达。对海马内炎症因子的检测发现,3组小鼠海马内TNF-α mRNA(图5D,P<0.05,F=6.055)和IL-1β mRNA(图5E,F=4.073,P<0.05)的表达水平亦存在显著差异。与对照组小鼠相比,Sal+LPS组小鼠海马内IL-1β mRNA(P=0.056)和TNF-α mRNA的表达水平升高(P<0.05),而Nar处理抑制LPS引起的海马内升高的IL-1β mRNA(P<0.05) 和TNF-α mRNA(P<0.01)的表达水平,表明Nar预处理可以抑制LPS引起的小鼠海马内炎症因子TNF-α mRNA和IL-1β mRNA的表达。
3 讨论
近年研究显示,柚皮苷及其代谢物对代谢综合征、认知缺陷和胆碱能功能障碍、慢性支气管炎、缺血性脑损伤等疾病的预防有一定改善作用[5, 18-22]。结果表明,LPS增加了小鼠的抑郁样行为包括减少小鼠的糖水偏好,增加悬尾和强迫游泳的静止不动时间,连续8 d腹腔注射柚皮苷,则显著改善抑郁样行为。这些发现也证实了先前的报道,即柚皮苷可以改善皮质酮诱导的小鼠抑郁样行为[23]。抑郁样行为往往合并探索行为减退和焦虑样行为。矿场的总距离和分时段距离反映小鼠的探索行为,结果显示LPS和柚皮苷对小鼠的探索行为无显著影响。既往研究报道单次柚皮苷或低剂量柚皮苷处理可以改善焦虑样行为。我们采用矿场中央时间、黑白箱实验和高架十字迷宫实验检测小鼠的焦虑样行为,实验结果显示:LPS和柚皮苷对小鼠的焦虑样行为无显著影响。提示在本实验中检测到的柚皮苷的抗抑郁活性与焦虑及探索行为均无明显相关性。

A:小鼠海马内NF-κB的蛋白表达水平;B:海马中NF-κB表达量 b:P<0.05,与Sal+LPS组相比;C:小鼠海马中NF-κB mRNA的表达 a:P<0.05,与对照组比较;b:P<0.01,与Sal+LPS组比校;D:小鼠海马中TNF-α mRNA 的表达 a:P<0.05,与对照组比较;b:P<0.01,与Sal+LPS组比较;E:小鼠海马中IL-1β mRNA的表达 b:P<0.05,与Sal+LPS组比较
大量研究表明,抑郁与脑缺血、氧化应激、线粒体功能受损、自噬抑制、细胞坏死和凋亡、感染、炎症等疾病有关[24]。对动物模型的多项研究支持抑郁的发生发展是由炎症引起的。此外,LPS引起动物出现抑郁样行为和大脑中促炎细胞因子浓度增加高度相关[25-26]。海马体包含多种受体,是控制行为、调节情绪和认知的重要大脑区域,容易受到应激损伤,其病理特征是抑郁的发病机制和维持的重要因素。小胶质细胞是中枢神经系统中的常驻免疫细胞,具有免疫监视和清除病原微生物、损伤坏死细胞的功能,参与改变基础神经免疫环境和对传入炎症信号的反应[27]。对小鼠海马进行Iba1染色,结果显示LPS引起小鼠海马DG和CA1区小胶质细胞数量增加,并呈现明显活化,而柚皮苷预处理则显著抑制LPS引起的小鼠海马内小胶质细胞活化效应。提示柚皮苷可以显著抑制海马内的神经炎症反应。
然而,小胶质细胞的过度活化可激活炎症通路导致IL-1β、TNFα、iNOS等炎症细胞因子的增加,促发脑功能受损[25]。NF-κB通路是炎症通路的主要介质之一,在LPS作用下被激活后,NF-κBp65亚基就会转移到细胞核中,参与了促炎细胞因子的表达[29]。课题组前期研究证实LPS引起的小鼠抑郁样行为与激活海马中的NF-κB相关,而采用白藜芦醇进行干预在抑制NF-κB的同时亦明显改善小鼠的抑郁样行为[10]。本研究中也有类似的观察结果,表明LPS处理导致海马内小胶质细胞激活,NF-κB水平升高,柚皮苷预处理可降低这些作用。实验和临床研究表明,促炎细胞因子,包括IL-1β与和TNF-α在抑郁症的病理生理学中起着关键作用,并且与抑郁症状呈正相关。过量的IL-1β过度表达可过度激活下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal axis, HPA)轴。升高的TNF-α水平可以激活5-HT转运蛋白并促进5-HT的突触前再摄取,这导致突触中5-HT水平降低引起的抑郁[25]。我们通过荧光定量PCR 检测小鼠海马内IL-1β和TNF-α的mRNA表达水平,发现柚皮苷预处理显著抑制LPS引起的小鼠海马内IL-1β和TNF-α的mRNA水平升高。表明Nar通过抑制海马内IL-1β和TNF-α的表达而抑制HPA轴过度激活,这也可能Nar是抗抑郁的作用机制之一。
综上所述,LPS引起的小鼠抑郁样行为与海马内小胶质细胞活化。NF-κB通路激活及炎症因子的释放高度相关,而柚皮苷预处理通过抑制海马内的炎症反应而改善小鼠的抑郁样行为。柚皮苷具有高剂量下的长期安全性,为临床上有效防治抑郁症提供了新的治疗策略。
