中国内地首例猴痘病毒样本的核酸PCR正交试验比对分析
2022-12-19李彩云罗青梅王梦佳
宗 华,孙 巧,李彩云,殷 静,罗青梅,王梦佳
400067 重庆,重庆市南岸区疾病预防控制中心微生物检验科1; 400016 重庆,重庆医科大学公共卫生学院2
猴痘是由猴痘病毒感染所致的一种病毒性人兽共患病,病毒经黏膜和破损皮肤侵入人体,临床表现主要为发热、皮疹、淋巴结肿大,部分患者可出现并发症,包括皮损部位继发细菌感染、脑炎等[1-3]。猴痘被称为一种发疹综合征,与天花几乎没有区别,天花是一种在 1970 年代后期通过疫苗接种根除的疾病,猴痘则是由另一种正痘病毒引起[4-5]。猴痘最近被世界卫生组织列为国际关注的突发公共卫生事件,虽然目前大多数病例是与男男性行为者[6],但疾病蔓延到一般人群的威胁更大。2022年1月1日至2022年7月20日期间,在世卫组织所有6个区域,共有72个国家向世卫组织报告了14 533例可能病例和实验室确诊病例(包括尼日利亚的3例死亡和中非共和国的2例死亡)[7-8]。作为一种DNA病毒,MPX病毒的遗传结构不太可能发生重大和频繁的变化[9]。PCR技术由于特异性高、灵敏度强等诸多优点,已经成为分子生物学中的常规技术,RT-qPCR技术是通过荧光信号对PCR进程进行实时监测,并对未知模板进行定量分析的一种方法,如今RT-qPCR检测越来越多地运用到食品工业、医学诊断、病毒检测、病原学追踪等方面,并取得显著效果[10-13]。2022年9月14日重庆市检出中国大陆第一例猴痘病毒,本文旨在从试验室检测技术角度出发,利用现有的提取试剂、扩增试剂以及使用的RT-qPCR仪使用正交试验方案开展检测,目的在于对新发传染病的检测效率做一次比对分析。为实验室检测猴痘病毒时选择试剂仪器提供参考意见,为后续国内的猴痘的流行病学调查与处置提供数据支撑。
1 资料与方法
1.1 患者流行病学史
2022年8月24~31日,患者在国内活动。9月1~13日,在欧洲旅居。9月3日在欧洲某国发生一次高风险暴露行为,潜伏期约为6 d。9月13日乘飞机回国,9月14日到达重庆后转入某区集中隔离点,当日出现咽喉干痒、皮疹(图1)等身体不适。隔离点医疗组核实后立即向该区疾病预防控制中心报告,经重庆市疾病预防控制中心复核猴痘病毒核酸检测结果后立即转入重庆市公卫中心进行诊疗。
本研究经重庆市南岸区疾病预防控制中心伦理委员会审查批准[2022年伦审(009)号]。
1.2 样本来源
隔离点对该病例进行采样,送区疾病预防控制中心开展猴痘病毒检测,口咽拭子和鼻咽拭子混合样(Ct值:31.37,卓诚惠生)、疱疹液(Ct值:31.64,卓诚惠生)的核酸结果均为猴痘病毒阳性,当天再次采集样本送重庆市疾病预防控制中心检测为阳性,阳性样本送至中国疾病预防控制中心复核为猴痘病毒阳性,重庆市疾病预防控制中心经基因测序,确认该猴痘病毒属于西非系B.1分支。由于首例样本,标本量有限,本次试验选择采集的口咽拭子和鼻咽拭子混合样本作为研究对象,按照设计的正交试验方案,开展样品核酸检测。
1.3 仪器与试剂
两种提取试剂分别是重庆中元和江苏硕世DNA提取试剂盒(后续表格中分别用A、B表示)、4种扩增试剂分别是北京卓诚、江苏硕世、广州达安和深圳生科原猴痘病毒核酸扩增试剂盒(后续表格中分别用A、B、C、D表示),两种RT-qPCR仪分别是美国伯乐(型号:CTX96TM)和杭州博日(型号:FQD-96A)(后续表格中分别用A、B表示)。
1.4 实验方法
根据中国疾控中心下发的猴痘防控技术指南(2022版)附件3猴痘病毒试验室检测技术指南[14]的要求,按照《人间传染的病原微生物名录》[15]中的有关规定,灭活的猴痘病毒样本在生物安全二级试验室进行核酸提取和扩增。试验室设计了本次试验的方案(见表1),按照此方案进行重复3次检测。
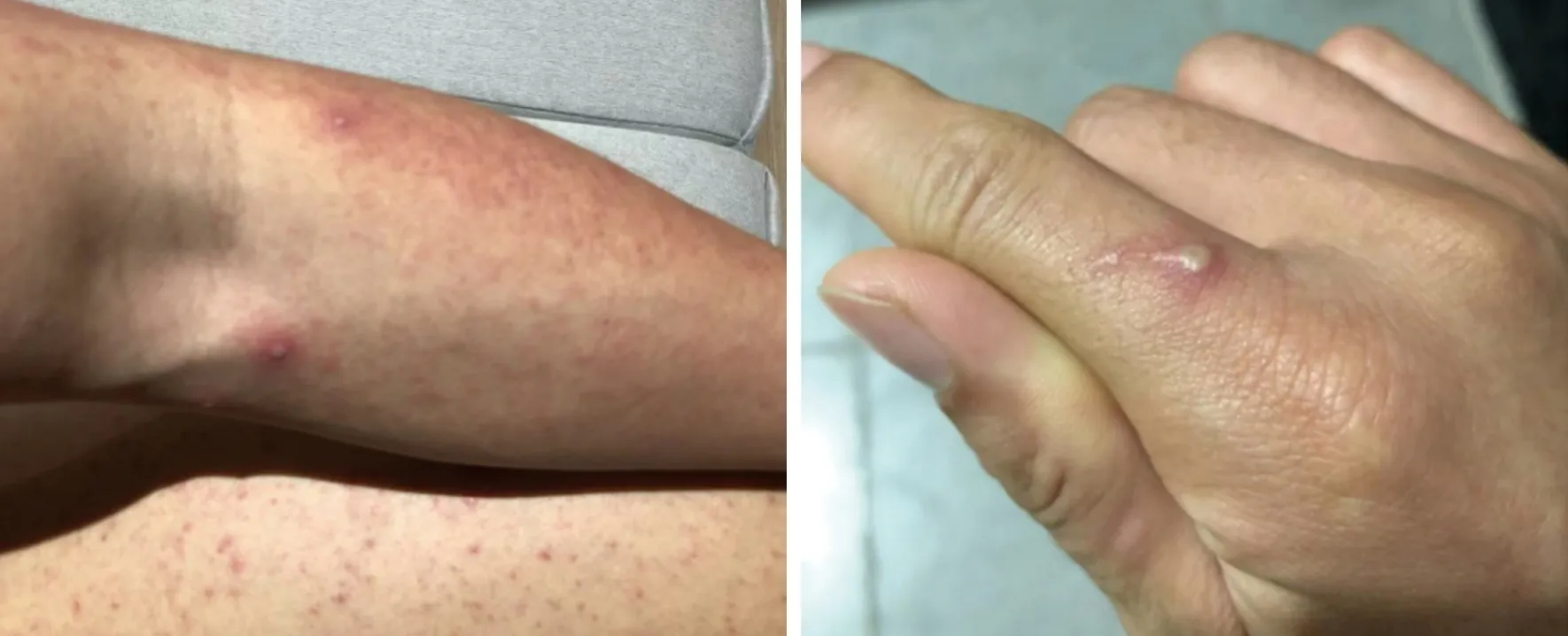
图1 猴痘病例的皮疹(A)和脓疱(B)(患者成年男性,于2022年9月14日在重庆市公共卫生中心诊疗)

表1 猴痘病毒样本的核酸PCR正交试验设计方案
1.5 结果判断
按照4种扩增试剂盒说明书对结果进行判读。具体如下:卓诚扩增试剂Ct值≤36,阳性,最低检出限:1 000 copies/mL。硕世扩增试剂Ct值≤37,阳性,最低检出限:1 000 copies/mL。达安扩增试剂Ct值≤40,阳性,最低检出限:200 copies/mL。生科原扩增试剂Ct值≤35.5,阳性,最低检出限:500 copies/mL。
1.6 统计分析
猴痘病毒样本的核酸PCR检测结果Ct值,使用SPSS 26.0版本对正交试验结果进行多因素极差分析和多因素方差分析,对验证试验结果进行t检验。
1.7 实验的质量控制
核酸检测试验室质控是一系列措施的集合[16]。RT-qPCR技术具有灵敏度高、重复性好等特点,整个检测过程受样本采集、人员操作、试剂、环境等因素影响。本次试验用试剂盒自带的阴阳对照以及内标进行样本质控,检测人员具备核酸检测培训及岗位授权,同时按照《医学试验室质量和能力认可准则》的要求,每年至少参加了1次国家级或省级的能力验证考核,试剂耗材、仪器设备经过了试剂验收、性能验证等措施后用于本次检测。
2 结果
2.1 正交试验检测结果
正交试验检测结果取样本按正交试验设计方案开展试验,3次试验阴性、阳性质控均正常,核酸检测结果见表2,可见从提取到扩增均能准确检出核酸样本,但不同试剂和仪器间的组合的确存在差异。

表2 猴痘病毒样本的核酸PCR正交试验3次检测(Ct值)结果
2.2 不同稀释浓度检测结果
不同稀释浓度检测结果按正交试验方案,对其中一次提取的核酸进行10倍和100倍稀释,核酸检测结果见表3,可见低拷贝浓度下,用于本次扩增的4种核酸检测试剂盒均能检出不同浓度的核酸样本。
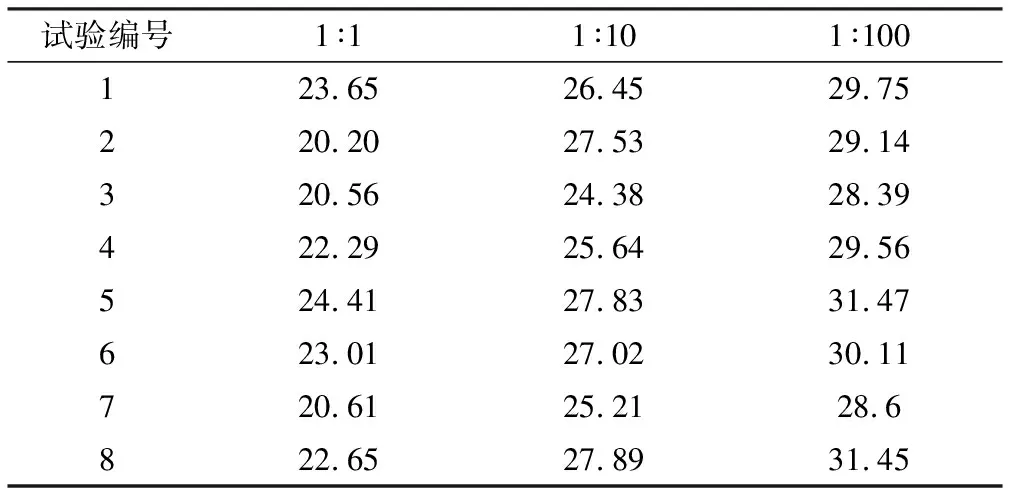
表3 猴痘病毒样本的核酸PCR不同稀释浓度核酸检测(Ct值)结果
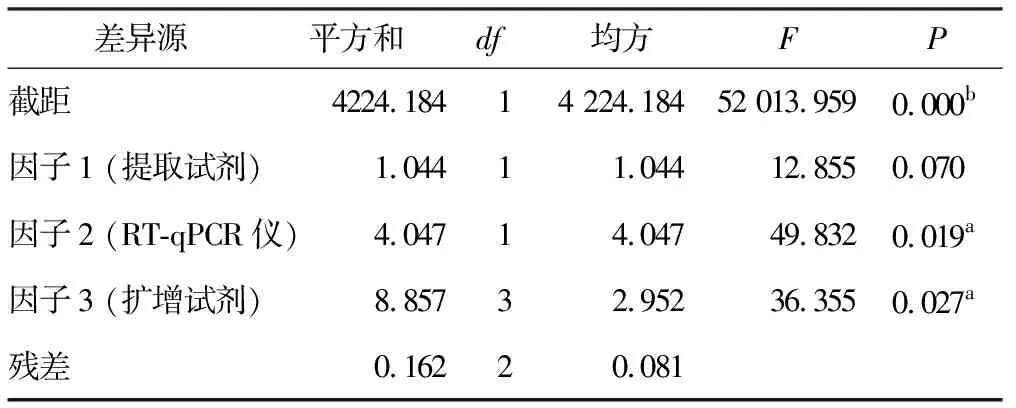
2.3 正交试验结果分析
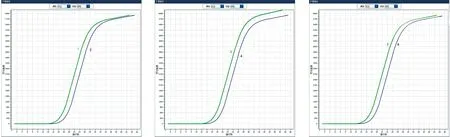
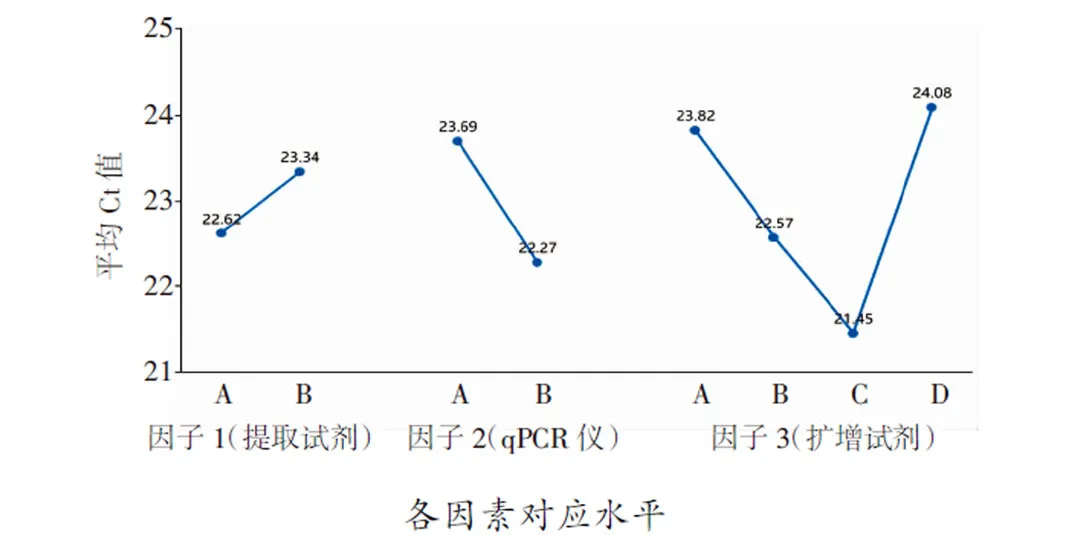
统计分析显示,RT-qPCR仪检测中循环数(即Ct值)与扩增效率成负相关。多因素极差分析结果显示3种试验因子中RT-qPCR仪对试验结果的影响最大,提取试剂对比A 表4 猴痘病毒样本的核酸PCR多因素极差分析结果 K值:某因素某水平时试验数据求和;Kavg值:对应的平均值;最佳水平:某因子时最佳Kavg值对应的水平编号;R:因素的极差值,该值=某因素时,Kavg最大值减去Kavg最小值,可结合因素极差值对比各因素的优劣;水平数量:某因素的水平数;每水平重复数r:水平的平均试验重复次数;混合型正交表则提供折算系数d(结合水平数量在折算系数表中找到)和R’值 多因素方差分析显示,因子1 (提取试剂)并不会对结果(Ct值)产生差异关系(P>0.05),因子2 (PCR仪器)、因子3 (扩增试剂)会对结果(Ct值)产生显著性差异关系(P<0.05,表5)。 表5 猴痘病毒样本的核酸PCR多因素方差分析结果 各因素对应水平 将上述统计学处理的结果进行组合,选取提取试剂A、RT-qPCR仪B、扩增试剂C作为最优组合,与比对组(提取试剂A、RT-qPCR仪B、扩增试剂B)的组合进行验证试验,由于提取试剂无统计学意义,试验编号3的组合是8次正交试验中Ct值最低的组合之一,所以选择该组合作为比对组来开展检测,每次检测均带入水痘-带状疱疹病毒阳性样本的核酸进行试验,作为试验避免假阳性的质控方式。 验证试验利用t检验分析,最优组和比对组对于Ct值全部均呈现出显著性差异关系(P<0.05)。图3A中曲线1Ct值(19.70,最优组)小于曲线2(21.09,比对组);图3B中曲线3Ct值(19.93,最优组)小于曲线4(21.18,比对组);图3C中曲线5Ct值(19.83,最优组)小于曲线6(21.11,比对组),可见最优组的检测效率高于比对组。本次试验带入水痘-带状疱疹病毒阳性样本,用猴痘试剂盒检测结果全为阴性,说明质控手段和数据结果真实有效。 疾病预防控制中心在处理流感、诺如病毒引起的聚集性疫情以及应对新冠、猴痘病毒等新发传染病时首选RT-qPCR技术,其发挥了重要作用。本次试验对提取的核酸进行10倍和100倍稀释,循环数增加3.3个循环左右[17-18],运用RT-qPCR技术进行检测,试验结果较为吻合。同时在稀释到低拷贝浓度的情况下,检测试剂对猴痘病毒的核酸检出效率较为稳定,质控对照均正常,目前国内上述的DNA提取试剂和猴痘扩增试剂的质量准确可靠。 鉴于该猴痘病例为中国内地首例发现,可能对新发传染病认识还不足,对病原体检测还存在不确定性,我们设计了正交试验方案开展试验。正交试验设计是研究多因素多水平的重要数理方法,也是对试验因素作合理的、有效的安排,最大限度地减少试验误差,是一种高效率、快速、经济的试验设计方法[19-21]。从本次试验结果看,提取试剂提取效率存在差异,但比对结果无统计学意义。扩增试剂盒检测循环数、 PCR仪器 A:第1次验证试验;B:第2次验证试验;第3次验证试验 在对荧光信号的捕捉上差异具有统计学意义,提示我们在新发传染病的检测中需要对检测试剂和仪器进行验证,是提高检测效率很重要的手段。根据极差分析结果,PCR仪器的荧光捕捉信号的差异在本次试验的多因素中最为关键,不同品牌PCR 仪在荧光捕捉方式,使用者对仪器的定期维护保养,使用过程中对仪器的熟练程度等都直接关系到检测结果的准确性和有效性,提升仪器的使用管理水平也是检测过程的重要环节。 检测阈值是探针设计过程中对该试剂相对稳定的检测临界值体现,各品牌试剂的检测Ct值和最低检出限存在差异,对高浓度核酸标的物进行检测并无太大影响。检测时需注意弱阳性样本的检测质量。此次病例标本量较少,对提取试剂、扩增试剂以及RT-qPCR仪的比对结果还缺少一定的数据支撑,下一步工作我们收集到一定数量的样本可运用ROC曲线深入分析各试剂盒的灵敏度和特异性。 在应对新发传染病检测中,RT-qPCR技术快速灵敏,应注意试剂和仪器的选择及检测流程的质量把控,力求试验结果精准有效。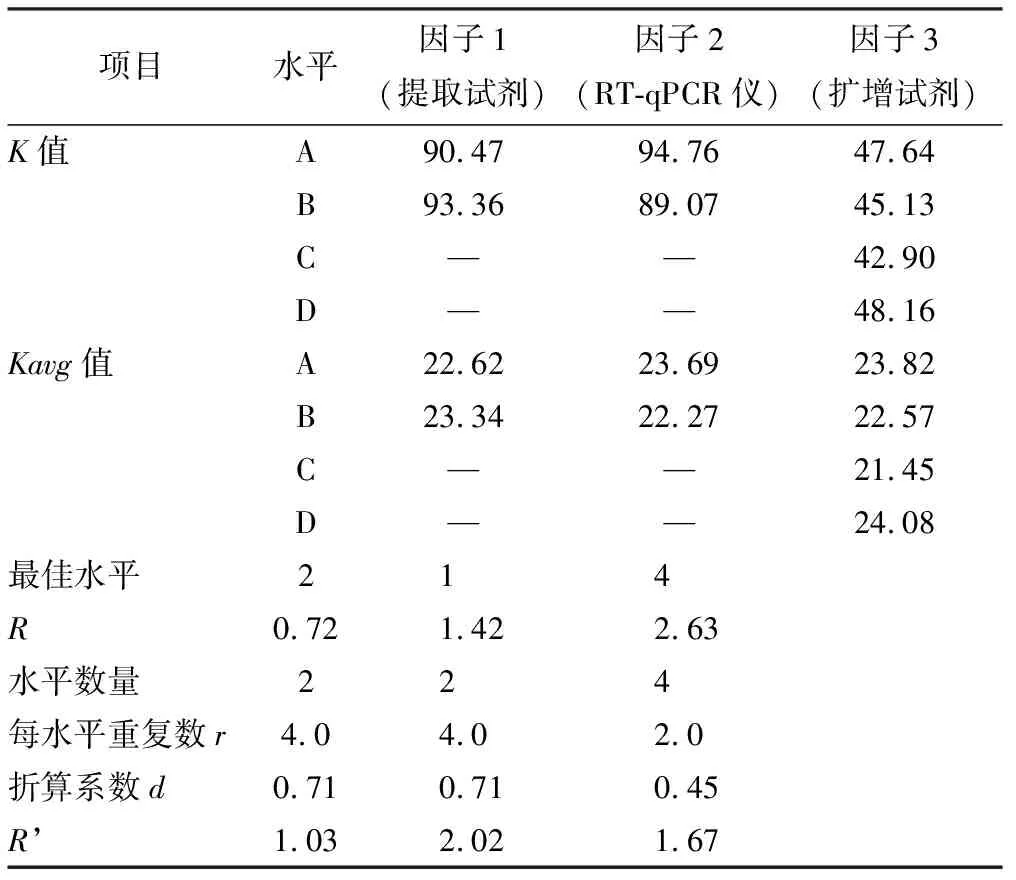
2.4 验证试验比对结果
3 讨论