圈套器冷切除术与热切除术在治疗结直肠小息肉安全性与有效性的回顾性对比研究
2022-12-19何金龙冯晓峰段丽霞房殿春
何金龙,陈 磊,陈 静,冯晓峰,陈 瑶,段丽霞,房殿春,吉 清
400038 重庆,陆军军医大学(第三军医大学)第一附属医院消化内科
结直肠癌是最常见的恶性肿瘤之一,随着我国生活方式及饮食结构的西化,结直肠癌发病率总体呈现上升趋势,已成为我国消化系统发病率第2位、患病率第1位的恶性肿瘤[1]。绝大部分结直肠癌由息肉发展而来,有效地切除结直肠息肉可显著降低结直肠癌发生率和病死率。近年来,随着结肠镜技术和内镜器械的发展,许多原本需要外科手段治疗的病变可通过内镜下处理。治疗过程中具体选择何种方式需要根据息肉的大小、形态、部位及操作者个人习惯综合决定。对于直径4~9 mm的息肉,可采用圈套器热切除术(hot snare polypectomy,HSP)或圈套器冷切除术(cold snare polypectomy,CSP),究竟何种方式为最佳选择,尚存在争议。2014年发布的《中国早期结直肠癌及癌前病变筛查与诊治共识》[2]推荐隆起型息肉采用圈套器套住息肉后通电切除,即HSP,而2018年欧洲胃肠道内窥镜学会(ESGE)发布指南推荐应用CSP治疗1~9 mm结直肠息肉[3]。HSP术中可对残留的息肉组织进行烧灼,降低残留率,同时对血管残端进行凝固,达到术中及时止血效果,但会产生热辐射损伤,可能增加迟发性出血和穿孔等术后并发症的发生风险。同时HSP操作过程中需要高频电切仪,操作过程相对繁琐,不利于基层医院开展。CSP仅需一副圈套器,无需黏膜下注射及通电,操作简单,可以避免粘膜下血管组织相关的电凝损伤,显著降低迟发性出血及穿孔发生率,术后患者的活动及饮食几乎无限制。但由于其缺乏电凝作用,可能存在不完整切除情况。国外有关CSP的研究相对较多,临床应用较常见,而国内研究较少,目前在我国尚未广泛应用,对于国人而言,其安全性及有效性有待进一步证实。本研究对大样本结直肠小息肉患者的临床资料进行回顾性对比分析,旨在评估CSP与HSP的安全性与有效性,以期为临床选择最佳的治疗方式提供理论依据。
1 对象与方法
1.1 研究对象
收集2020年1月1日到2021年8月31日在陆军军医大学第一附属医院行结直肠小息肉内镜下治疗患者的临床资料,严格按照纳入与排除标准,共3 750例纳入研究,其中CSP组1 796例,HSP组1 954例。纳入标准:①年龄18~80岁,性别不限;②结肠镜检查过程中发现至少有1枚大小为4~9 mm息肉;③患者签署内镜下治疗知情同意书;④治疗方式为CSP或HSP。排除标准:①术前一周内使用阿司匹林等抗血小板药物或华法林等抗凝药物;②合并P-J综合征、炎症性肠病或胃肠息肉病;③合并恶性肿瘤;④患有严重心、肺功能障碍者。本研究于2021年9月获得中国人民解放军陆军军医大学第一附属医院伦理委员会批准,批件号:(B)KY2021127。并获得科技部中国人类遗传资源采集审批同意,受理编号:2022SLCJ0730。
1.2 方法
器械准备:德国ERBE VIO 200D高频电切仪,日本Olympus GIF-260、HQ290I、H290ZI电子结肠镜,浙江安瑞圈套器、浙江安杰思钛夹及Olympus注射针。
肠道准备:术前1天清流质饮食。采用复方聚乙二醇电解质散(和爽)或磷酸钠盐口服溶液(三风友)进行肠道准备。和爽推荐3L分次剂量服用方案,即肠镜检查前1天晚上8点服用1 L,检查当天检查前4~6 h服用2 L,每10~15分钟匀速服用250 mL。三风友分两次服用,每次将45 mL加入750 mL温凉水中稀释后服用,分别于检查前1天晚上7点及当天操作前4 h服用,每次服完后建议患者再次饮用清水750~1 000 mL。泻药服用完毕后立即口服1瓶二甲基硅油散共25 mL用于消泡处理。
麻醉方式:采用丙泊酚乳状注射液1.5~2.5 mg/kg(静安,20 mL∶0.2 g)进行静脉全麻,每10秒静滴约20~40 mg,根据患者全身况状及术中反应适当增减丙泊酚用量。常规给予鼻导管3~5 L/min吸氧维持血氧饱和度95%以上,同时监测呼吸频率、心率、血压等生命体征。
治疗过程:所有操作均由具有丰富经验的高年资医生及护士完成。CSP操作过程:镜下发现息肉后,准确记录息肉的部位、大小(以圈套器外套管直径2.4 mm为参考标准)、形态、数量,旋转镜身使息肉位于6点钟方向左右,打开圈套器置于息肉边缘以外1~2 mm 处的正常黏膜,匀速收紧圈套器后轻轻提起,防止圈套器套住固有肌层并确认圈套器完全套住息肉,然后收紧圈套器切除息肉,根据息肉大小通过结肠镜吸引通道或直接使用圈套器套出回收组织样本送病理检查,冲洗创面后窄带成像技术(NBI)观察边缘是否残留,并观察是否有活动性渗血,创面较大者需钛夹封闭创面(图1)。HSP操作过程:之前操作过程同CSP,旋转镜身使息肉位于6点方向左右,粘膜下注射后或直接将圈套器置于息肉边缘,匀速收紧圈套器后轻轻提起,然后采用结肠镜电切模式(爱尔博200 D,30 W),通电数秒直至切掉息肉,回收组织样本送病理检查,创面较大或较深者需钛夹封闭创面(图2)。术后当天禁食,第2~3天流质饮食,后逐渐过渡到正常饮食,注意观察有无腹部不适、发热、腹痛、便血等临床表现。
1.3 观察指标
两组患者的一般临床特征(年龄、性别、BMI、是否合并基础疾病、息肉数量、大小、部位、形态、病理类型);两组患者疗效与安全评价指标,包括主要观察指标(完整切除率、迟发性出血率、穿孔率)和次要观察指标(钛夹使用数量及使用率、标本回收率、腹部不适发生率)。
1.4 统计学分析
数据录入采用Microsoft Excel 2003统计软件进行,采用SPSS 20.0统计软件进行数据分析。正态分布计量资料采用Mean±SD描述,组间差异的比较用t检验。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
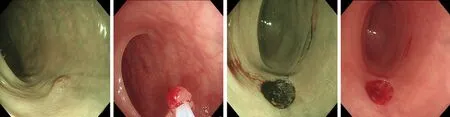
A:发现息肉后记录大小、部位、形态及JNET分型;B:圈套器套住息肉边缘1~2mm收紧切除;C:NBI观察创面周围未见息肉残留;D:创面未见活动性出血
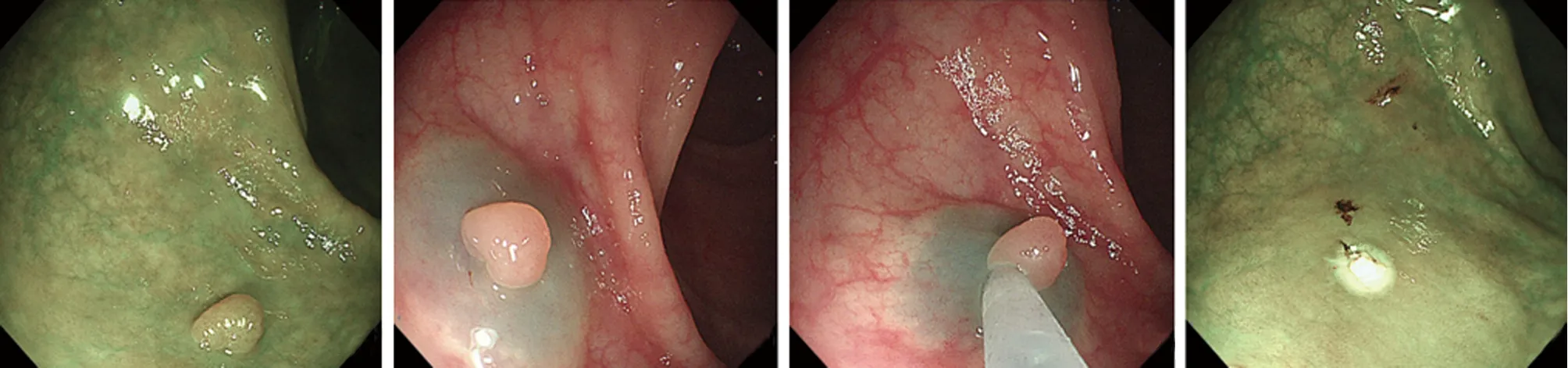
A:发现息肉后记录大小、部位、形态及JNET分型;B:黏膜下注射含美蓝的甘油果糖将息肉抬起;C:调整息肉至6点位,圈套器套住息肉正常边缘后通电切除;D:NBI观察创面周围未见息肉残留及出血
2 结果
2.1 两组患者的一般临床特征
CSP组身高(161.01±6.42)cm,体重(58.48±7.89)kg;HSP组身高(161.05±6.35)cm,体重(58.90±7.77)kg。两组患者一般资料(年龄、性别、BMI、息肉数量、大小、部位、形态、病理类型)比较差异均无统计学意义(P>0.05),两组患者合并基础疾病(高血压、糖尿病)分布情况比较差异均无统计学意义(P>0.05),具有可比性。详见表1。
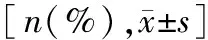
表1 两组患者一般资料
2.2 两组患者疗效与安全评价指标
CSP组共使用钛夹281枚,HSP组使用531枚,CSP组钛夹使用率及平均使用数量均显著低于HSP组[11.19%vs19.55%;(0.16±0.49vs0.27±0.63)枚],差异具有统计学意义(P<0.001;P<0.001)。CSP组完整切除率与HSP组差异无统计学意义(93.99%vs95.04%,P=0.158)。CSP组标本回收率优于HSP组(99.55%vs98.26%,P<0.001)。CSP组迟发性出血发生率明显低于HSP组(0.06%vs0.46%,P=0.037)。CSP组未出现穿孔,HSP组发生1例(0.05%),二者差异无统计学意义(P=0.521)。CSP组腹部不适发生率明显低于HSP组(4.18%vs9.31%,P<0.001)。详见表2。
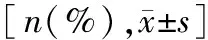
表2 两组患者疗效与安全指标对比
3 讨论
结直肠癌多数系由腺瘤-腺癌途径演变而来[4],结直肠息肉大部分为腺瘤性,内镜下息肉切除是降低结直肠癌发病率和死亡率的最有效治疗手段。常见的内镜下治疗方法包括氩离子凝固术、热活检钳钳除术、冷活检钳钳除术、CSP、HSP、内镜下粘膜切除术(EMR)、内镜下分片粘膜切除术和内镜粘膜下剥离术。对国人而言,CSP的安全性及有效性有待进一步证实,故本研究对3 750例在我中心行结直肠小息肉内镜下治疗的患者资料进行了回顾性分析,比较了CSP与HSP的安全性与有效性,可以更好的指导内镜医生选择最佳的治疗方法。
尽管在西方国家ESGE[3]不推荐常规内镜下预防性使用钛夹来防止无蒂息肉的延迟出血。但息肉术后出血可能与息肉大小、形态、位置、年龄、基础疾病、是否使用抗凝药物等因素有关,若合并以上危险因素,预防性使用钛夹可能获益。同时ESGE[3]建议术中若发现存在穿孔的特征或危险因素,也应预防性使用钛夹防止穿孔。基于以上因素及中国实际国情,大部分医生会更热衷于使用钛夹来降低出血、穿孔发生率。本研究发现,CSP迟发性出血率低于HSP,穿孔发生率与HSP无差异,但钛夹使用率及平均使用数量均显著低于HSP[11.19%vs19.55%;(0.16±0.49)vs(0.27±0.63)枚],表明CSP在保证治疗安全性的同时,可一定程度降低治疗费用,有利于目前按病种付费的新医保支付模式的推广。息肉切除过程中尽量达到完整切除对于预防间期癌的发生具有重要的临床意义。由于CSP缺少对息肉周边组织的电凝烧灼作用,理论上存在息肉切除后残留率更高的可能。本研究显示,CSP组完整切除率与HSP组差异无统计学意义(93.99%vs95.04%),与KAWAMURA等[5-6]研究结论一致。HORIUCHI等[7]研究发现,使用专用的冷圈套器比普通圈套器完整切除率更高,而本研究中两组患者采用的是相同型号的普通圈套器,因此可以避免圈套器类型对结果的干扰,本研究发现两组患者完整切除率无差异,试验结果较可靠。息肉切除后监测随访策略是以息肉病理类型为基础,尽管小息肉高级别上皮内瘤变发生率不高,但ESGE[3]仍建议对所有切除的息肉进行组织病理学检查,以获取准确的病理性质。本研究发现CSP组标本回收率优于HSP组(99.55%vs98.26%)。一般来说,由于CSP无需通电,对切除的组织无电灼伤,同时一般需切除病灶周围1~2 mm正常的粘膜,故有利于标本回收。HSP通电后对切除的标本产生电烧灼,使标本回缩,回收难度更大。但TAKEUCHI等[8]研究发现CSP组的标本回收成功率明显低于HSP组(97%vs99.3%,P<0.01),与本研究结论存在差异。标本回收率不仅与切除方法相关,息肉的位置、是否有蒂、息肉大小同样可影响标本的回收,推测可能是以上因素不同造成研究结果存在差异。
出血是息肉切除后常见的并发症,包括即刻出血及迟发性出血,HORIUCHI等[9]报道传统切除方法与CSP即刻出血率分别为23%和5.7%。即刻出血在临床中意义不大,一般数分钟后可自行停止,即使不能自行停止,术中也可以通过局部喷洒止血药物、电凝或使用钛夹等多种方法及时有效止血。迟发性出血常发生在病人离院后恢复过程中,若不及时干预,可能造成较严重的后果。本研究发现CSP组迟发性出血发生率明显低于HSP组(0.06%vs0.46%,P=0.037),与其他[9-10]研究结论一致。很多报道[8-10]均证实CSP迟发性出血率低,是结直肠小息肉(<10 mm)安全有效的治疗措施,尤其适用于因存在高危因素而无法停用抗凝或抗血小板药物的患者。考虑与CSP损伤范围仅限于粘膜下层浅层而HSP常累及到粘膜下层深层甚至固有肌层有关[11]。穿孔是息肉切除术较严重的并发症,一旦发生穿孔,若内镜下无法干预,往往需要外科手术,增加住院费用的同时甚至可能危及患者生命,尽量避免穿孔的发生是内镜医生操作的首要目标。本研究显示,CSP组未出现穿孔,HSP组发生1例(0.05%),但两者无统计学差异,考虑与本内镜中心穿孔率发生低尚未达到有效的检验效能有关。ORTIGO等[12]对十余项研究进行综述分析,发现CSP无穿孔病例发生,HSP穿孔率在1.2%~1.8%,HSP穿孔发生率显著高于CSP。本研究中HSP穿孔发生率显著低于曹婷婷等[13]报道的0.42%及YAMASHINA等[10]报道1.8%,考虑与本内镜中心内镜医生具有较丰富的操作经验有关,他们每年总计会完成几千例息肉切除术。CSP在确保完整切除的同时,粘膜下及固有肌层基本不会受到损伤,故几乎没有发生穿孔的风险,HSP由于电凝损伤造成切缘附近的黏膜组织发生了坏死并向周围扩散,周围组织损伤较多,易发生穿孔。操作时间决定了肠道充气量,较多的肠道气体是造成患者术后不适感的主要因素。本研究显示CSP组腹部不适发生率明显低于HSP组(4.18%vs9.31%)。由于本研究为回顾性研究,未记录操作时间,QU等[14]进行的一项Meta分析显示CSP操作时间显著低于HSP,有理由相信CSP由于操作程序相对更简单,用时更少使患者术后体验感更好。
由于本研究为回顾性,仍存在一定局限性,采用色素内镜观察切缘评估息肉是否完整切除准确性可能不及息肉切除后对切缘行活组织检查或追加EMR,但本内镜中心操作医生均具有丰富的色素内镜操作经验,术中均对创面进行充分冲洗后详细观察,一定程度上缩小了临床误差。同时本研究为单中心,一定程度上存在选择偏倚。
综上所述,CSP完整切除率不劣于HSP,但标本回收率更高,迟发性出血、钛夹使用率、腹部不适发生率更低,且冷切除未发生穿孔。CSP在切除结直肠小息肉中可以和HSP达到相似的治疗效果,但并发症发生率更低,是一种安全且有效的治疗方式,值得在临床中推广应用。
