CRIP1参与子宫内膜癌细胞增殖、侵袭、迁移及EMT的作用
2022-12-19淳彩璞崔晓宾胡建明吕新玲李美峰吴小双
淳彩璞,崔晓宾,胡建明,贾 薇,吕新玲,李美峰,吴小双
843000 新疆 阿克苏,新疆石河子大学医学院第四附属医院病理科1;832000 新疆 石河子,新疆石河子大学医学院第一附属医院病理科2;833200 新疆 奎屯,新疆伊犁州奎屯医院病理科3
子宫内膜癌(endometrial cancer, EC)为多见于女性生殖系统的恶性肿瘤,处于绝经期前后的女性属于其高危人群[1]。据报道,2008-2018年EC死亡率每年上升约1.4%[2]。常见的致病因素包括肥胖、雌激素过多、高血压和糖尿病等[3]。目前,临床常用的主要治疗方法仍是手术[4]。尽管针对晚期EC患者的治疗已取得了重大突破和进步,但肿瘤的侵袭性和转移性仍易导致肿瘤复发,严重影响患者预后[5- 6]。因此,探究EC细胞增殖和转移相关的分子基础及调控机制可为EC治疗提供重要的理论依据。
半胱氨酸丰富蛋白1(cysteine rich protein 1, CRIP1)属于LIM/双锌指蛋白家族,拥有独特的双锌指结构,并由此发挥其在多种疾病中的重要作用[7]。最早发现CRIP1主要在肠道中分布,除肠道外,CRIP1同样广泛存在于结肠、肺、脾、胸腺和脑等其他器官中[8-9]。深入研究揭示,CRIP1在锌离子吸收转运、维持管腔结构、炎症免疫应答方面发挥重要作用[10]。近年来,CRIP1 在几种癌症中的异常表达引起了越来越多的关注。研究发现,CRIP1在多种恶性肿瘤中充当促癌基因,如卵巢癌[11]、宫颈癌[12]、甲状腺癌[13]、乳腺癌[14]、肝细胞癌[15]、结直肠癌[16]等。这些结果表明CRIP1可能是恶性肿瘤的潜在治疗靶点,尤其是癌症的侵袭和转移。现有研究表明,EC组织中呈现出较高的CRIP1表达,且与患者的不良预后有紧密关联[17]。因此,我们猜测CRIP1的异常表达可能与EC进展有关并予以探讨。
糖酵解是指葡萄糖和糖原分解为丙酮酸并同时生成三磷酸腺苷(adenosine triphosphate,ATP)的过程[18]。2020年NIE等[19]研究发现,糖酵解激酶磷酸甘油酸激酶1(phosphoglycerate kinase 1,PGK1)通过直接或间接增强糖酵解活性从而推动癌细胞生长。研究表明,EC组织中呈现出较高的PGK1表达,且与不良预后及肿瘤的生长浸润行为紧密相关[20-21]。但PGK1在EC中的具体作用尚不清楚。因此,本研究重点探讨CRIP1对EC细胞恶性行为表型的具体影响并阐明CRIP1与PGK1两者间的相互关系。
1 材料与方法
1.1 临床样本
收集2019年2月至2020年12月于新疆石河子大学医学院第四附属医院(新疆生产建设兵团第一师医院)行手术治疗的20例EC患者的肿瘤组织标本作为肿瘤组,年龄30~65(50.95±6.98)岁,所有患者手术前未进行放疗或化疗。肿瘤的分期根据国际妇产科联合会(FIGO)分期系统标准确定。另外选取距离肿瘤>5 cm的癌旁组织标本作为正常组。患者及家属均签署知情同意书,本研究经新疆生产建设兵团第一师医院伦理委员会批准(2022年5月)。
1.2 材料
人子宫内膜基质细胞系SHT290购自北京科瑞思搏生物科技有限公司;人EC细胞Ishikawa购自深圳市豪地华拓生物科技有限公司;KLE、RL95-2、HEC-1-A子宫内膜癌细胞均由美国菌种保藏中心(ATCC)提供;RPMI-1640、DMEM、EMEM和McCoy’s 5A培养基均购自美国GIBCO公司;FBS胎牛血清和Trizol提取试剂购自美国生命技术公司;Lipofectamine 2000转染试剂购自日本Takara公司;shRNA-CRIP1-1/2重组慢病毒和阴性对照shRNA-NC慢病毒由天根生化科技(北京)有限公司构建;Ov-PGK1和Ov-NC质粒由上海吉玛公司提供; QuantiTect 逆转录试剂盒由德国凯杰生物公司提供;SYBR® Green PCR master mix试剂盒和BCA试剂盒购自美国伯乐公司;实时荧光定量PCR系统购自美国MJ Research公司;CCK-8试剂购自北京全式金生物技术有限公司;EdU和Protein A Agrose购自赛默飞世尔科技(中国)有限公司;基质胶和transwell小室购自美国BD公司;多聚甲醛、结晶紫和RIPA裂解液由美国Sigma公司提供;兔源CRIP1、基质金属蛋白酶2(MMP2)、基质金属蛋白酶9(MMP9)、E-钙粘素(E-cadherin)、N-钙粘素(N-cadherin)、波形蛋白(Vimentin)、Snai、Slug、PGK1抗体和山羊抗兔IgG-FITC均购自美国Abcam;ECL发光试剂盒购自南京诺唯赞生物科技股份有限公司;Image J软件购自美国国立卫生研究院;荧光显微镜购自德国欧蒙医学诊断有限公司;倒置显微镜购自奥林巴斯;激光共聚焦显微镜购自德国徕卡公司;SPSS 22.0软件购自美国IBM公司。
1.3 方法
1.3.1 生物信息学分析 利用NCBI在线数据库,选择GSE63678数据集(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE63678)分析CRIP1在7例EC肿瘤组织和5例正常组织中的表达;利用Biogrid(https://thebiogrid.org/)预测CRIP1和PGK1两者间的结合关系。
1.3.2 细胞培养 人子宫内膜基质细胞系SHT290常规培养于RPMI 1640培养基中;人EC细胞KLE,RL95-2均用DMEM培养基进行培养;Ishikawa细胞用EMEM培养基进行培养;而HEC-1-A细胞常规培养于McCoy’s 5A Medium培养基中。所有培养基含有10% FBS,放置在37℃、5%CO2的孵育箱中。
1.3.3 细胞转染 细胞于6孔板中(5×104/孔)接种培养,当细胞达到60%~70%融合度时,严格按照Lipofectamine 2000转染试剂说明将shRNA-CRIP1-1/2、shRNA-NC、Ov-PGK1和Ov-NC瞬时转染至各组细胞中,48 h后转染完成。
1.3.4 实时荧光定量PCR(RT-qPCR)检测CRIP1和PGK1在子宫内膜癌细胞内表达 首先,加入Trizol试剂对RNA进行分离,并按照QuantiTect 逆转录试剂盒说明书进行cDNA合成。以cDNA为模板,加入SYBR® Green PCR master mix试剂盒和7500实时荧光定量PCR系统进行PCR扩增反应。以GAPDH为内参,采用2-ΔΔCt法进行数据分析。
1.3.5 CCK-8法检测细胞活性 质粒转染后,细胞种植于96孔板中进行培养(5×103/孔),分别于24、48、72 h后,添加体积分数为10%的CCK-8试剂,酶标仪于2 h后在490 nm处检测光密度值[D(490)],绘制增殖曲线。
1.3.6 EdU染色检测细胞增殖 细胞转染处理同1.3.5,每孔加入20 μmol/L EdU 37℃下孵育2 h。随后,使用4%多聚甲醛和0.5% Triton X-100分别对细胞进行固定和透化处理。经DAPI染色后,于荧光显微镜下检测EdU阳性细胞。
1.3.7 划痕实验检测细胞迁移 在6孔板中加入处于生长对数期的Ishikawa细胞,细胞达到90%融合度时,使用200 μL无菌枪头划一条线,PBS洗涤3次后加入无血清培养基。在倒置显微镜下测量0、48 h的伤口宽度,计算细胞迁移数。
1.3.8 Transwell实验检测细胞侵袭 将转染后的Ishikawa细胞接种于含有基质胶的transwell上室内,transwell下室加入500 μL含10% FBS的EMEM培养基。24 h后,表层细胞被棉签擦去,细胞经多聚甲醛和结晶紫分别固定和染色处理后,于显微镜下对细胞进行计数。
1.3.9 免疫印迹法(Western blot)检测 采用BCA试剂盒对RIPA裂解液提取的蛋白浓度进行检测。将行10% SDS-PAGE电泳的等量蛋白质转移至PVDF膜并在5%脱脂牛奶中进行室温封闭,加入一抗和HPR标记的羊抗兔二抗,分别于4 ℃和室温下孵育。加入ECL发光试剂盒对蛋白条带进行显影,利用Image J软件记录灰度值。
1.3.10 免疫荧光(immunofluorescence, IF)检测Vimentin表达 用4%多聚甲醛和0.2% TritonX-100分别对转染后的Ishikawa细胞进行固定和透化处理,并用2% BSA进行封闭,4 ℃下与稀释的兔源Vimentin抗体孵育过夜,并在37 ℃下与山羊抗兔IgG-FITC孵育1 h,50%甘油封片,最后利用激光共聚焦显微镜拍照和荧光定量分析。
1.3.11 免疫共沉淀(Co-immunoprecipitation, Co-IP) 常规收集并裂解细胞后,加入2 μg兔抗CRIP1和PGK1单克隆抗体,4 ℃下孵育过夜,加入Protein A Agrose,继续混合过夜,离心后收集沉淀物,经SDS-PAGE分离后,Western blot对免疫沉淀物进行分析。
1.4 统计学分析
2 结果
2.1 CRIP1在EC肿瘤组织和细胞中表达上调
RT-qPCR和Western blot印迹结果表明,CRIP1的表达在EC肿瘤组织中的表达较癌旁组织增加(P<0.01,图1A、B)。同样,生物信息学NCBI数据库(GSE63678芯片)分析数据显示,与正常组织相较,EC肿瘤组织中表现出较高的CRIP1表达(P<0.01,图1C)。此外,与人子宫内膜基质细胞系SHT-290相比,CRIP1在人EC细胞(Ishikawa、KLE、RL95-2和HEC-1-A)中的表达水平明显增加,且CRIP1在Ishikawa细胞中呈现最高表达水平(P<0.01),同时CRIP1在RL95-2细胞中的蛋白水平较SHT-290细胞相比无显著性差异(P>0.05,图1D、E),提示CRIP1在EC组织和细胞中广泛表达。因此,选择CRIP1相对表达量最高的Ishikawa细胞进行后续实验。
2.2 敲低CRIP1对EC细胞增殖的影响
为进一步明确CRIP1在EC发展过程中的作用,首先利用shRNA慢病毒对CRIP1基因进行干扰。转染shRNA-CRIP1-1和shRNA-CRIP1-2后,CRIP1表达水平显著降低,且CRIP1干扰组-1中呈现较高的干扰效率,因此选择CRIP1干扰组-1用于后续实验(P<0.01,图2A、B)。CCK-8法表明,与干扰对照组比较,CRIP1干扰组-1中细胞在24、48、72 h时活性显著减弱(P<0.01,图2C)。EdU染色同样表明,CRIP1干扰组-1较干扰对照组EdU阳性细胞比例明显下降(P<0.01,图2D)。

a: P<0.01,与正常组或SHT290比较
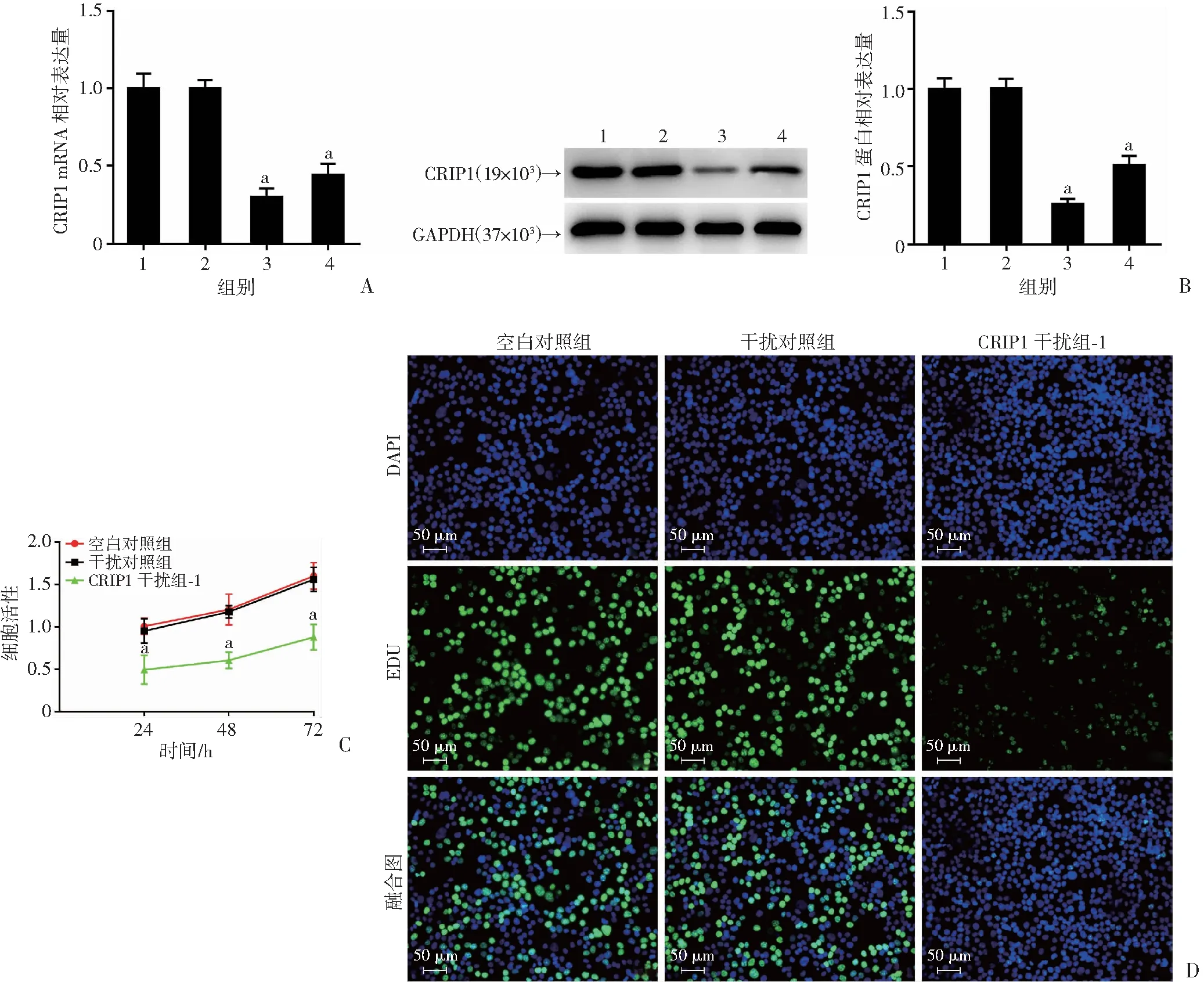
1:空白对照组;2:干扰对照组;3:CRIP1干扰组-1;4:CRIP1干扰组-2;a: P<0.01,与干扰对照组比较
2.3 干扰CRIP1对EC细胞迁移、侵袭及EMT的影响
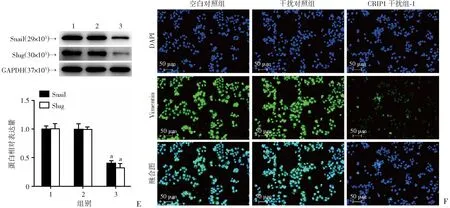
划痕实验证实,CRIP1干扰组-1较干扰对照组划痕相对愈合率明显降低,迁移细胞明显下降(P<0.01,图3A)。Transwell实验证明,与干扰对照组相比,CRIP1干扰组-1中侵袭细胞数目显著降低(P<0.01,图3B)。Western印迹结果表明,CRIP1干扰组-1较干扰对照组MMP2、MMP9、N-cadherin、Vimentin、Snail和Slug蛋白水平明显下降,而E-cadherin蛋白水平明显增加(P<0.01,图3C-E)。IF实验同样检测到,与干扰对照组相比,CRIP1干扰组-1中Vimentin表达降低(P<0.01,图3F)。
2.4 CRIP1与PGK1蛋白在EC细胞中相结合
经Biogrid网站进行生物信息学预测后发现,CRIP1可能与PGK1相结合。与人子宫内膜基质细胞系SHT-290相比,PGK1在人EC细胞(Ishikawa、KLE、RL95-2和HEC-1-A)中的表达水平明显增加,且在Ishikawa细胞中呈现最高表达水平(P<0.01)(图4A-B)。Co-IP实验结果发现,在CRIP1相互作用蛋白复合物中发现CRIP1和PGK1的存在;同时在PGK1相互作用蛋白复合物中也检测到PGK1和CRIP1的富集,表明CRIP1与PGK1两者间存在相互作用(图4C、D)。此外,CRIP1干扰组-1较干扰对照组PGK1蛋白水平显著降低(P<0.01,图4E)。

1:空白对照组;2:干扰对照组;3:CRIP1干扰组-1;a: P<0.01,与干扰对照组比较
(图3E、F续下页)
1:空白对照组;2:干扰对照组;3:CRIP1干扰组-1;a: P<0.01,与干扰对照组比较

a: P<0.01,与SHT290或干扰对照组比较
2.5 过表达PGK1对CRIP1敲低的EC细胞增殖能力的影响
为了进一步验证CRIP1是否通过与PGK1蛋白结合从而调控EC发展,我们首先利用Ov-PGK1质粒对Ishikawa细胞进行转染。PGK1过表达组中PGK1表达水平显著升高(P<0.01,图5A、B)。CCK-8和EdU实验结果显示,与空白对照组相比,CRIP1沉默导致Ishikawa细胞增殖能力明显减弱;而与CRIP1干扰组+过表达对照组相比,CRIP1干扰组+PGK1过表达组中细胞增殖能力再次增强(P<0.01,图5C、D)。
2.6 过表达PGK1对CRIP1敲低的EC细胞迁移、侵袭及EMT能力的影响
与空白对照组相比,CRIP1干扰组中迁移细胞数和侵袭细胞数明显下降;而CRIP1干扰组+PGK1过表达组较CRIP1干扰组+过表达对照组转移和侵袭细胞数再次上升(P<0.05,P<0.01,图6A、B)。此外,与空白对照组相比,CRIP1干扰组中MMP2、MMP9、N-cadherin、Vimentin、Snail和Slug蛋白水平明显下降,而E-cadherin蛋白水平明显增加;而与CRIP1干扰组+过表达对照组相比,CRIP1干扰组+PGK1过表达组中MMP2、MMP9、N-cadherin、Vimentin、Snail和Slug蛋白水平升高,而E-cadherin蛋白水平下降(P<0.01,图6C-E)。IF实验也表明,CRIP1不足导致Vimentin表达下降;而转染Ov-PGK1过表达质粒后,Vimentin水平再次上升(图6F)。

a: P<0.01,与过表达对照组或空白对照组比较;b: P<0.01,与CRIP1干扰组+过表达对照组比较

1:空白对照组;2:过表达对照组;3:GRIP1干扰组+过表达对照组;4:GRIP1干扰组+PGK1过表达组;a: P<0.01,与空白对照组比较;b: P<0.05,与CRIP1干扰组+过表达对照组比较
(图6E、F续下页)

1:空白对照组;2:过表达对照组;3:GRIP1干扰组+过表达对照组;4:GRIP1干扰组+PGK1过表达组;a: P<0.01,与空白对照组比较;b: P<0.05,与CRIP1干扰组+过表达对照组比较
3 讨论
EC是常见的妇科恶性肿瘤,是导致全世界女性癌症死亡的常见因素[22]。尽管随着治疗手段的不断进步已有效提高了EC患者的治疗效果,但由于EC细胞增殖、迁移和侵袭能力较强,易发生远处转移,患者目前的生存率仍令人担忧[5-6]。当前证据表明,肿瘤侵袭及远处转移与EMT事件密切相关[23-24]。此外,多种证据表明,EC的发生与发展是多种基因与通路相互调控的结果[25]。因此,本研究重点探讨EC细胞的增殖、迁移、侵袭及EMT能力,从而深入揭露EC的发病机制,并寻找潜在的干预分子靶标。
目前LIM蛋白家族成员CRIP1在肿瘤方面的作用日益成为人们关注的焦点。有研究发现,宫颈癌组织和细胞中CRIP1表达增加,且在细胞迁移、侵袭和EMT中起推动作用[12];LIU等[26]研究证实,敲低CRIP1可有效抑制卵巢上皮癌细胞迁移、侵袭及EMT。CRIP1表达上调是EC患者不良预后的独立风险因素[17]。本研究通过RT-qPCR、Western blot及NCBI数据库分析发现,与正常组织和细胞比较,EC组织和细胞中CRIP1表达升高。功能丧失实验结果表明,CRIP1丢失可明显减弱Ishikawa细胞的增殖、迁移和侵袭能力。先前研究发现,蛋白水解酶家族成员MMP2和MMP9在EC发展过程中表达增加[27]。同样,敲低CRIP1可导致MMP2和MMP9蛋白表达降低。EMT过程中,E-cadherin蛋白表达缺失,而N-cadherin、Vimentin、Snail和Slug蛋白表达增多[28]。本研究结果表明,CRIP1表达下调后,E-cadherin表达增加,而N-cadherin、Vimentin、Snail和Slug蛋白表达减少。
对于肿瘤细胞而言,有氧糖酵解是肿瘤细胞为自身提供能量、实现快速迁移和侵袭的主要方式[18, 29]。因此,糖代谢与肿瘤的发生与发展有紧密关联,是恶性肿瘤的重要特征。甲基化、乙酰化等翻译后修饰行为都可以激活糖酵解相关酶PGK1,促使肿瘤细胞糖代谢的异常,从而影响癌细胞的恶性表型[30]。近年关于PGK1的研究强调了其在EC中的作用:EC组织和细胞中PGK1呈高表达,PGK1与EC进展和EC患者不良预后相关[20-21, 31-32]。此外,有研究报道HOXA9与CRIP家族成员CRIP2互相作用抑制HIF-1α介导的糖酵解从而抑制皮肤鳞癌发生发展[33]。更重要的是,CRIP1可通过与GAL-3蛋白相互作用从而在EC进展中发挥重要作用[17]。然而,CRIP1对糖酵解的作用以及与糖酵解相关酶PGK1间的相互关系仍未可知。本研究通过Biogrid数据库和Co-IP实验分别预测并验证了CRIP1与PGK1在EC细胞中的结合关系。此外,EC细胞中PGK1水平增加,且CRIP1沉默可抑制PGK1蛋白表达,揭示了CRIP1对PGK1的正向调控关系,表明CRIP1可通过与PGK1蛋白结合从而参与EC进展。共转染CRIP1干扰序列和PGK1过表达质粒至Ishikawa细胞后,拯救实验结果进一步表明,沉默CRIP1对EC细胞增殖、迁移、侵袭和EMT能力的抑制作用均被PGK1所拯救。以上实验结果表明,PGK1过表达可实现对CRIP1干扰抑制EC发展的拮抗作用。
综上所述,EC组织和细胞中CRIP1表达升高,且与EC的发生发展有紧密关联。敲低CRIP1可减弱EC细胞的增殖、迁移、侵袭及EMT能力,其机制可能通过与PGK1蛋白结合有关。本研究初步明确了CRIP1在EC中的促癌作用,为深入探究CRIP1的作用以及挖掘EC的潜在治疗靶点提供了宝贵的实验依据和理论支持。但本研究仍具有一些缺陷:首先,未涉及CRIP1表达与EC患者生存率、预后等相关性分析;其次,缺乏体内动物实验以进一步验证CRIP1在EC发展过程中的作用;最后,近期研究表明CRIP1与Ras、Wnt/β-catenin信号通路的异常激活有关[12, 15],然而本研究未探讨CRIP1相关的信号通路对EC发展的影响。
