一种人B淋巴细胞表面抗原的重组表达和纯化
2022-12-18俞敏达李文奇
常 卿, 俞敏达, 李文奇
(1. 清华大学 生命科学学院 蛋白质研究技术中心, 北京 100084; 2. 清华大学 结构生物学高精尖创新中心, 北京 100084; 3. 北京市第四中学国际校区, 北京 100031)
CD20作为B淋巴细胞表面特异性分子,在1980年作为第一个B细胞表面特异标记物被报道,最初被命名为B1[1]。它与B淋巴细胞Ca2+的跨膜传导密切相关,对B淋巴细胞的增殖和分化具有调节作用[2]。研究证明,CD20分子在B细胞淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤等疾病中的表达量异常增高[3]。因此CD20可作为B淋巴细胞瘤治疗的有效治疗靶点,并已经通过临床验证[4]。CD20分子是多次跨膜蛋白,属于4次跨膜A家族(MS4A family)成员,分为胞外区、跨膜区和胞内区等3个部分[5-6]。目前已报道的抗CD20的单克隆抗体,包括利妥昔单抗(Rituximab)、奥法木单抗(Ofatumumab)和奥妥珠单抗(Obinutuzumab)等都识别CD20胞外区的抗原表位[7-11]。通过体外重组表达CD20分子的胞外区并进行纯化获得大量纯度较高的重组多肽,一方面可以利用其作为抗原筛选人源单链抗体可变区(scFv)的酵母表面展示库,获得的scFv可用于构建嵌合抗原受体修饰的T细胞(chimeric antigen receptor t-cell immunotherapy,CAR-T)的关键CAR结构;另一方面也可以作为抗原对小鼠进行免疫用于进一步制备检测用的单克隆抗体和治疗用的中和抗体。采用串联的方法,将CD20胞外区片段以特定长度的连接区(linker)串联连接并插入表达载体中,在大肠杆菌中进行表达和纯化条件的优化,通过对包涵体的变复性条件摸索,建立在大肠杆菌表达系统规模化量产CD20胞外区多肽的方法,并最终制备较高纯度和产量的目的产物,可以用于后续的功能性实验和抗体的筛选制备,为基于靶向CD20的B淋巴细胞瘤CAR-T细胞治疗打下良好的基础。
1 材料与方法
1.1 材料
1.1.1 模板、质粒和菌株
人cDNA文库、pET28a质粒由清华大学林欣实验室提供;大肠杆菌E.coliDH5α感受态细胞、Transetta(DE3) 感受态细胞购自全式金公司。
1.1.2 主要试剂
PCR预混反应体系(2×EasyPfu PCR SuperMix),PCR产物回收试剂盒(EasyPure®PCR Purification Kit)、快速胶回收试剂盒(EasyPure®Quick Gel Extraction Kit)、DNA分子量标准(100 bp DNA Ladder)和质粒小提试剂盒(EasyPure®Plasmid MiniPrep Kit)购自全式金公司;预染蛋白Marker,ECL显色试剂盒购自Thermo-Fisher公司;T4 DNA连接酶、NcoI、BamH I、Hind Ⅲ和XhoI限制性内切酶购自NEB公司;引物由英潍捷基(上海)贸易有限公司合成;胰蛋白胨、酵母提取物购自Oxiod公司;咪唑、盐酸胍、异丙基硫代半乳糖苷(IPTG)、Tris、L-精氨酸(Arginine)、氧化型谷胱甘肽(GSSG)、还原型谷胱甘肽(GSH)、氯化钠(NaCl)和TritonX-100购自美国Amresco公司;兔抗人CD20多克隆抗体由林欣实验室制备;鼠抗兔IgG-HRP购自CST公司;其他试剂均为国产分析纯级别。
1.2 方法
1.2.1 基因克隆和表达载体构建
通过引物设计PCR引物序列见表1。以人cDNA文库为模板,获得带有不同酶切位点的CD20胞外区PCR产物exCD20-NB、exCD20-BH。将PCR产物通过限制性内切酶和连接转化按顺序插入pET28a表达载体的NcoI/BamH I、BamH I/Hind Ⅲ位点,获得的表达载体命名为pET28a-Bi20,经测序验证表达载体构建的正确性。

表1 PCR引物序列
1.2.2 小试表达条件优化
将测序正确的表达载体转入表达菌株Transetta(DE3),涂布含有卡那霉素和氯霉素双抗性的固体LB平板。从平板上挑取单个菌落接种于3 mL含有卡那霉素和氯霉素双抗性的LB培养基,37 ℃恒温摇床220 r/min摇菌过夜。将过夜菌按1∶100的比例接种于5 mL含有卡那霉素抗性的LB培养基,37 ℃ 220 r/min摇菌2~3 h,至OD600=0.4~0.6,在加入IPTG诱导剂之前取1 mL菌液离心制备诱导前电泳样。诱导时间优化:向菌液中加入IPTG至终浓度为1 mmol/L,37 ℃、220 r/min摇菌,在3、5、9和12 h分别取样并制备电泳样。IPTG浓度优化方法:同时接种过夜菌到5个3 mL含有卡那霉素抗性的LB培养基,在OD600=0.6时,加入IPTG至终浓度分别为0、0.1、0.3、0.5 和1 mmol/L,37 ℃、220 r/min转速摇菌,在5 h时收菌并制备电泳样。诱导温度优化方法:接种过夜菌到2个3 mL菌液,在OD600=0.6时,加入IPTG至终浓度为1 mmol/L,分别放置于37 ℃、220 r/min摇菌5 h,20 ℃、220 r/min摇菌16 h,收菌并制备电泳样。检测手段为SDS-PAGE。
1.2.3 Bi20的表达
取过夜菌接种于100 mL含有卡那霉素抗性的LB培养基,37 ℃恒温摇床 220 r/min振荡培养3 h,按1∶100比例接种到6 L 含有卡那霉素抗性的2×YT培养基中,37 ℃、220 r/min培养至OD600=0.6~0.8时,加入终浓度1 mmol/L IPTG,37 ℃诱导5 h。培养物于16 ℃、4 000 r/min离心30 min,弃上清液,收集菌体-80 ℃保存。
1.2.4 Bi20包涵体的洗涤、纯化及变复性
取冻存菌体,按25 mL每1 L培养物的比例在菌块中加入裂解缓冲液A(50 mmol/L Tris,pH 7.0,0.5 mol/L NaCl),混匀后在冰水浴中进行超声破碎,条件是6 s间隔,4 s超声(功率40%),总时长为10 min。4 000 r/min低速离心30 min,收集沉淀。以洗涤缓冲液B(50 mmol/L Tris,pH 7.0,0.5 mol/L NaCl,0.5% TritonX-100,2 mol/L 尿素)超声洗涤沉淀2次,再以不含TritonX-100的洗涤缓冲液C超声洗涤沉淀2次。将沉淀置于变性缓冲液D(8 mol/L尿素,100 mmol/L Tris,pH 7.0)中充分溶解,4 ℃过夜搅拌,14 000 r/min高速离心60 min,取上清液。
将上清液上样到已用缓冲液D平衡过的Ni-NTA层析柱,降低流速,使其充分挂柱,缓冲液D添加不同浓度咪唑(20、50、100和300 mmol/L)进行梯度洗脱,当核酸蛋白检测仪示数升高时收集流穿液,每步取样进行SDS-PAGE检测。
收集含有目的蛋白的洗脱液加入透析袋(截留分子质量7 ku)中,同时加入终浓度1 mmol/L GSH和0.1 mmol/L GSSG,4 ℃搅拌透析过夜。依次用含有8 mol/L、4 mol/L、2 mol/L尿素,0.1 mol/L Tris,pH 7.0,0.4 mol/L L-精氨酸的复性缓冲液进行透析。将透析后的蛋白溶液放入10 ku截流分子质量的浓缩管中进行浓缩,测定浓度,分装冻于-80 ℃冰箱。纯度通过SDS-PAGE进行估算。
1.2.5 浓度测定
采用Bradford法测定。用BSA标准品分别配置浓度为0、0.2、0.4、0.6、0.8、1.0 mg/mL的蛋白样品,与蛋白染液进行混合,5 min后用比色皿测定OD595,制作蛋白浓度标准曲线。根据曲线的测定范围,取复性后浓缩的样品稀释10倍,与蛋白染液混合,5 min后测定OD595,与标准曲线对应,从而测出相应的蛋白浓度。
1.2.6 Western Blot检测
先将纯化后样品进行SDS-PAGE电泳,半干法电转至PVDF膜;用封闭液(5%脱脂奶粉)室温下封闭1 h,TBST洗3次每次10 min,使用一抗兔抗人CD20多克隆抗体(1∶1 000)4 ℃孵育过夜;TBST洗3次,每次10 min。室温孵育二抗鼠抗兔IgG-HRP(1∶5 000)1 h,TBST洗3次,每次10 min。配置显影液均匀滴加在PVDF膜上,1 min后使用成像仪曝光成像。
1.2.7 ELISA检测
用纯化好的目的蛋白Bi20和阴性对照蛋白包被96孔酶标板,100 ng/100 μL,3个复孔,4 ℃过夜;30 g/L BSA封闭,300 μL/孔,37 ℃,孵育2 h;PBST洗3次,加入稀释(1∶100)的杂交瘤细胞上清液,100 μL/孔,37 ℃,孵育1 h;PBST洗3次,加入Anti-mouse IgG-HRP二抗(1∶5 000稀释),100 μL/孔,37 ℃,孵育1 h,PBST洗5次,加入TMB显色(100 μL/孔)20 min,加1 mol/L硫酸终止显色。检测OD450。
2 结果与分析
2.1 分子克隆和载体构建
选取的CD20胞外区(K142-L189)只有48个氨基酸残基,分子质量约5.5 ku,在大肠杆菌中表达这种小分子质量的蛋白容易发生降解并且不易于检测和后续纯化,因此采用串联CD20胞外区的策略,将两个CD20胞外区作为一个整体表达,中间通过8个氨基酸长度的-GSSGGSSG-作为Linker连接,保证两者间有一定的柔性空间。CD20胞外区的PCR结果见图1。

M:DNA Ladder;1:exCD20-NB;2:exCD20-BH。图1 CD20胞外区的PCR结果Figure 1 PCR result of the CD20 extracellular domain
将exCD20-NB片段插入到pET28a载体的NcoI和BamH I酶切位点后,通过测序验证后在BamH I和Hind III酶切位点插入exCD20-BH片段,最终测序验证表达载体pET28a-Bi20构建的正确性。
2.2 小试表达
表达产物由两个CD20胞外区组成,分子质量约13.7 ku。由于采用原核表达系统且重组序列来自人源,因此采用Transetta(DE3)菌株,补充大肠杆菌缺乏的6 种稀有密码子 (AUA、AGG、AGA、CUA、CCC、GGA)对应的tRNA,提高外源基因的表达水平。表达条件优化从诱导剂浓度、诱导温度和时间等方面入手,通过降低起始诱导的OD600,降低诱导温度等尝试获得可溶上清液表达,但目的蛋白始终是以包涵体的形式表达。最终确定在OD600为0.6~0.8时,以IPTG终浓度1 mmol/L,37 ℃诱导5 h作为最终大量表达的条件。不同优化条件的诱导前后的全菌总蛋白和上清液以及沉淀的表达结果对比图(图2)。目的蛋白在上清液中没有可溶形式的表达,主要以包涵体形式分布在沉淀中。CD20的胞外区序列含有2个半胱氨酸,在正确的折叠形式下会形成一对二硫键。大肠杆菌本身不能提供氧化还原的折叠环境,所以很可能形成一些分子间或分子内等错误配对的二硫键,导致蛋白以包涵体的沉淀形式表达。

M:蛋白质分子量Marker;1:37 ℃诱导前全菌;2:37 ℃诱导5 h后全菌;3:37 ℃诱导5 h后裂解上清液;4:37 ℃诱导5 h后裂解沉淀;5:37 ℃过夜诱导全菌液;6:37 ℃过夜诱导裂解上清液;7:37 ℃过夜诱导裂解沉淀;8:诱导前全菌;9:20 ℃过夜诱导全菌;10:20 ℃过夜诱导裂解上清液;11:20 ℃过夜诱导裂解沉淀。图2 重组表达产物的小试表达(SDS-PAGE)Figure 2 SDS-PAGE analysis of small-scale expression ofrecombinant product
2.3 大量表达及包涵体纯化和变复性
重组表达产物是以包涵体形式表达且表达量较高,目的蛋白约占菌体总蛋白量的40%。经过超声破碎处理菌体后,离心收集包涵体沉淀。包涵体洗涤条件摸索了1、2 和4 mol/L尿素和0.5% TritonX-100的洗涤步骤后,Bi20在经4 mol/L尿素洗涤过程中除了杂蛋白以外还会有部分目的蛋白溶解,因此最终选择2 mol/L尿素作为包涵体洗涤的最终条件(图3)。洗涤后的包涵体经8 mol/L尿素的充分变性溶解,进一步采用Ni亲和层析的方法对样品进行纯化。利用本实验室搭建的纯化平台(包括自装Ni-NTA层析柱、蠕动泵、核酸蛋白检测仪和信号记录仪)来实现亲和层析纯化。通过50、100 和300 mmol/L不同浓度的咪唑梯度洗脱,进一步去除杂蛋白。经SDS-PAGE鉴定(图3),在变性条件下的亲和层析经不同浓度咪唑洗脱,每步都有目的蛋白被洗脱,其中100 mmol/L咪唑洗脱峰的杂带较少,纯度较高。50和300 mmol/L洗脱峰分别在高分子质量和低分子质量区有不同程度的杂蛋白被共同洗脱下来。
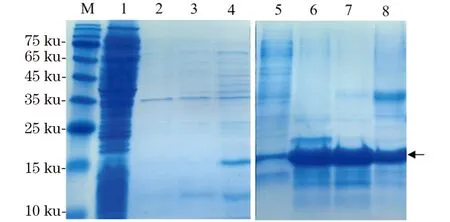
M:蛋白质分子量Marker;1:裂解后上清液;2:包涵体经1 mol/L尿素洗涤后上清液;3:包涵体经2 mol/L尿素洗涤后上清液;4:包涵体经4 mol/L尿素洗涤后上清液;5:亲和层析穿透峰;6:50 mmol/L咪唑洗脱峰;7:100 mmol/L咪唑洗脱峰;8:300 mmol/L咪唑洗脱峰。图3 包涵体洗涤结果和在变性条件下Ni亲和层析纯化结果(SDS-PAGE)Figure 3 SDS-PAGE analysis of the inclusion-body purification and Ni-NTA column purification under denatured condition
包涵体的复性采用透析逐步稀释变性剂的方法。经序列分析CD20胞外区含有2个半胱氨酸,理论上应形成1对二硫键。对含有二硫键的蛋白质,在复性过程中应尽可能促进正确二硫键的形成。复性缓冲液中的氧化还原环境对二硫键有较大影响[12-13],其中氧化剂能够促进二硫键的形成,而还原剂能够促使错误配对的二硫键进行重排。二者浓度及比例需要通过实验摸索确定合适的范围。当复性缓冲液还原性太强时,二硫键将难以形成;而氧化性太强时,则不利于二硫键的正确配对。通常采用的氧化还原对为氧化型谷胱甘肽(GSSG)和还原型谷胱甘肽(GSH),采用的比例有1∶10、4∶6和5∶5。经过实验摸索最终确定氧化还原对以1∶10的比例,终浓度(0.1 mmol/L GSSG + 1 mmol/L GSH)来进行Bi20的复性。
除了氧化还原环境以外,还有一些因素会影响蛋白质的溶解性,包括环境pH值,离子强度,还有一些抑制蛋白聚集体产生的添加剂,如L-精氨酸,是通过改变蛋白之间的疏水相互作用来改善聚集状态增加溶解性[14]。经过实验摸索最终确定复性液中添加终浓度0.4 mol/L L-精氨酸可以提高包涵体的复性率,增加溶解度。
2.4 产物浓度和纯度
复性后目的产物经SDS-PAGE电泳图分析纯度可达95%以上(图4),经Bradford法测定浓度约为2.5 mg/mL。

M:蛋白质分子量Marker;1:纯化后目的条带(黑色箭头所指)。图4 重组多肽最终纯化结果(SDS-PAGE)Figure 4 SDS-PAGE result of purified recombinant product
2.5 Western Blot和ELISA检测
目的产物经特异性的抗人CD20多克隆抗体可以检测到分子质量与预期大小一致的特异性条带,见图5(a),说明纯化复性后的目的蛋白具有与特异性抗体结合的能力。
以复性后的目的蛋白作为抗原免疫小鼠,制备单克隆杂交瘤细胞株,其培养上清液经ELISA方法检测具有和CD20的识别和结合能力,见图5(b),纯化复性后的产物具有很好的特异性和抗原活性。可以为后续的人源scFv筛选及构建CAR-T细胞的功能性验证提供良好的前提和基础。

(a) Western Blot结果;(b) ELISA结果(NC:阴性对照;1:纯化后目的条带Bi20)。图5 Bi20纯化产物的Western Blot和ELISA检测结果Figure 5 Western Blot and ELISA assay of the recombinant Bi20 protein
3 讨论与结论
本研究通过将4次跨膜蛋白CD20位于第三和第四跨膜区之间的胞外部分以串联的方式在大肠杆菌中进行表达和包涵体变复性纯化,获得具有生物学活性的CD20胞外区二体多肽Bi20,建立了经济大肠杆菌表达系统规模化量产CD20胞外区多肽的方法。
目前细胞免疫治疗领域以嵌合抗原受体修饰的 T 细胞免疫疗法(CAR-T)疗效最为显著,而针对适应症集中在血液肿瘤,可以利用非限制性的形式特异识别和杀伤表达特定抗原的癌细胞。CAR主要由3部分构成:抗原结合域、跨膜区及胞内信号转导区[15-16]。其中单链抗体可变区scFv作为抗原识别区段起到识别肿瘤细胞的关键定位导航作用。因此对scFv的筛选需要有效的肿瘤细胞表面抗原作为靶标。CD20是除CD19之外的B细胞恶性肿瘤的热门靶点,但是CD20是4次跨膜蛋白,其暴露于细胞表面的胞外区较短,前人多采用较大的融合标签进行融合表达[17],会影响其作为抗原的特异性和免疫原性。Rougé等[11]解析出CD20与利妥昔单抗(RTX)的复合物结构,揭示CD20是以紧密的双桶二聚体形式发挥作用,并且每个CD20单体的胞外段结合1个RTX抗原结合片段(Fab)。
针对CD20的胞外区,采取串联组合的方式,只在C端引入较小的6个组氨酸的亲和标签,成功在大肠杆菌中表达了由CD20胞外区片段串联组成的重组蛋白,通过一定长度的Linker连接区,人为构建CD20胞外区的同源二体,并通过摸索包涵体的洗涤条件,在变性条件下进行亲和纯化,摸索包涵体的复性条件等,成功对该重组蛋白进行纯化。在复性过程中考虑到二硫键的形成对多肽结构稳定的重要性,我们对复性缓冲液中氧化还原对提供的折叠环境进行不同比例条件的摸索。除了氧化还原环境外,通过添加一些增溶剂改变蛋白之间疏水的相互作用来改善聚集状态,抑制蛋白聚集体产生。最终获得较高纯度较高产量的重组蛋白,经过后期的功能性试验证明其具有良好的特异性和抗原活性,并以此为基础进行人源scFv的酵母表面展示库筛选,取得了阶段性的成果,可以用于后续CAR结构的构建。为基于靶向CD20的B淋巴细胞瘤CAR-T细胞治疗打下良好的基础。
