干扰VDR对肝癌HepG2细胞增殖的作用
2022-12-18姬正伟仵西凤路宏朝
程 佳, 姬正伟, 仵西凤, 路宏朝, 张 涛
(陕西理工大学 生物科学与工程学院, 汉中 723000)
维生素D受体(vitamin D receptor,VDR)作为类固醇激素/甲状腺激素受体超家族的成员之一[1],既能参与维持体内矿物质动态平衡、骨代谢,还能在多种组织细胞的生长分化和免疫调节方面发挥重要作用[2]。VDR在人体各组织细胞中广泛存在,通过调节靶基因转录而调控相应蛋白质的合成进而发挥转录因子的作用。研究表明,vitamin D的抗肿瘤效果与肿瘤组织内VDR表达水平有关,而在不同的癌组织中VDR的表达量有所差异,如大肠癌中VDR表达量仅占32%,但在胃癌、乳腺癌中VDR表达量高达80%~90%[3],这说明VDR的表达存在较大的组织差异性。VDR可以通过多种途径作用于癌细胞的增殖[4-6]。同时,VDR的功能受到多种共调节子的影响,而调节蛋白发挥作用的方式并不是一成不变的。对肿瘤基质细胞的研究显示,VDR与共抑制子或共激活子的结合也具有明显的组织特异性或分化阶段特异性[7-8]。由此可知,在不同癌症发生发展过程中,VDR作为重要的调控因子直接或间接地参与调控癌细胞的增殖过程。由于肝癌组织与正常肝脏组织相比VDR表达增加,说明VDR的表达与肝癌肿瘤细胞的增殖具有相关性,但VDR作用于肝癌细胞增殖过程仍有待研究。
VDR作为核转录因子调控基因的转录与表达是通过识别靶基因序列中的维生素D应答元件(vitamin D response element,VDRE)实现的,并且VDRE的数量与VDR引发转录的反应强弱有关[9]。生物信息学预测发现,在视黄醇结合蛋白4(retinol binding protein,RBP4)基因上游存在VDRE[10]。而RBP4是体内负责视黄醇转运的蛋白,主要在肝脏中表达。自Yang等[11]发现RBP4与胰岛素抵抗(insulin resistance,IR)和2型糖尿病(Type 2 diabetes,T2DM)密切相关之后,国内外大量研究证实RBP4在慢性炎症[12]、脂代谢紊乱[13]、血管病变[14-15]等病理过程中发挥着重要作用,但RBP4促使相关疾病发生发展的分子机制仍在持续探索中。
基于此,我们假设VDR可能会调节RBP4的表达,从而在一定程度上对肝癌细胞的生长产生影响。为此,利用RNAi技术抑制HepG2细胞中VDR的表达,以期在转录水平与蛋白水平验证VDR对HepG2细胞增殖的影响,同时探究VDR对RBP4的调控作用是否参与了HepG2细胞的增殖过程。
1 材料与方法
1.1 材料
VDR敲除型(VDR knockout,VDR-KO)小鼠及野生型(wild type,WT)小鼠的实验样品由张涛教授提供[16]。
高糖DMEM(1×)培养基(Life Technology);0.25%胰蛋白酶-0.02% EDTA消化液,胎牛血清和Opti-MEM(美国Gibco);UltraSYBR Mixture(High ROX)(康为世纪);cDNA第一链合成试剂盒 (北京全式金);细胞活力检测试剂盒、EdU-555细胞增殖检测试剂盒、双萤光素酶报告基因检测试剂盒 (碧云天);TRIzol RNA 分离试剂(ThermoFisher);RBP4 Rabbit Polyclonal antibody、Coralite594-conjugated Goat Anti-RabbitlgG (H+L) (proteintech);DAPI(武汉博士德);siRNA干扰片段(吉玛基因);甲醇、氯仿等其他试剂均为国产分析纯。
1.2 方法
1.2.1 siRNA转染细胞培养及转染
肝癌HepG2细胞在5% CO2和37 ℃条件下于含10%胎牛血清的DMEM培养基中培养,取已达到对数生长期的HepG2细胞,胰酶消化后将细胞接种到6孔板中,待细胞密度达到80%以上,更换无血清的培养基,采用LipofectamineTM2000进行转染。
1.2.2 Western Blot (WB)
将提取的蛋白经SDS-PAGE胶分离,120 V,2 h;加冰120 V,2 h转PVDF膜。4 ℃封闭过夜。按照各抗体稀释比例进行室温孵育3 h。TBST洗膜,二抗孵育2 h,TBST洗膜。使用化学发光剂进行曝光。
1.2.3 Real-time quantitative PCR(qPCR)
收集各组细胞提取总RNA,经逆转录反应合成cDNA。qPCR反应程序:95 ℃ 预变性30 s;95 ℃变性5 s,60 ℃ 退火30 s,40个循环,用2-ΔΔCt法计算基因相对表达水平。实验重复3次。引物序列如表1所示。

表1 qPCR引物列表
1.2.4 免疫荧光染色
组织冰冻切片或转染的细胞,分别在预冷的丙酮和4%多聚甲醛中冰上固定;之后用1% Triton X-100室温通透15 min;5%山羊血清,37 ℃封闭30 min;滴加RBP4一抗,室温孵育2 h;山羊抗兔二抗避光孵育1 h;DAPI对细胞进行避光染核。在倒置荧光显微镜下观察染色结果。
1.2.5 细胞活力检测 (CellTiter-LumiTM发光法)
CellTiter-LumiTM发光法是一种通过化学发光法测定细胞内ATP含量从而用于高灵敏度、宽线性范围定量检测活细胞数目的方法。HepG2细胞在室温平衡10 min,96孔板每孔加入100 μL CellTiter-Lumi发光检测试剂,室温振荡2 min后,于25 ℃孵育10 min,用多功能酶标仪进行化学发光检测。最后,根据化学发光(Luminescence)读数直接显示细胞的相对活力RLU(relative light unit)。
1.2.6 EdU细胞增殖检测
将转染处理的HepG2细胞按照EdU-555细胞增殖检测试剂盒的方法进行处理。EdU为5-乙炔基-2′-脱氧尿苷,是一种新型胸腺嘧啶脱氧核苷类似物,可以在DNA合成过程中替代胸苷掺入到新合成的DNA中,通过荧光探针Alexa Fluor 555以标记增殖分化的细胞。
1.2.7 双荧光素酶活性检测
将VDRsiRNA与RBP4启动子缺失片段荧光素酶报告基因重组载体,分别是pGL3-(-1967/+98)、pGL3-(-1794/+98)、pGL3-(-1366/+98)、pGL3-(-720/+98)、pGL3-(-415/+98)、pGL3-(-209/+98)和pGL3-(-91/+98),pGL3-Basic以及内参pTK质粒共转染HepG2细胞,转染48 h后收集细胞。按照双荧光素酶报告基因检测试剂盒进行荧光素酶活性检测。
1.3 统计学方法

2 结果与分析
2.1 siRNA降低HepG2细胞中VDR表达水平
利用qPCR检测siRNA对HepG2细胞中VDR基因mRNA 表达的影响。结果显示,与对照组比,VDRsiRNA-507对VDR基因mRNA表达的抑制作用最为显著(P<0.01),见图1(a),对VDR蛋白水平的抑制效率达到40%以上[图1(c)(d)]。说明VDR siRNA-507靶向序列具有较高的沉默效率,基因干扰实验符合预期。

(a)VDRsiRNA片段对HepG2细胞内VDR的mRNA表达影响;(b)VDRsiRNA影响HepG2细胞增殖;(c)VDRsiRNA片段对HepG2细胞内VDR蛋白表达的影响;(d)VDR/GAPDH的灰度值分析。* 为P<0.05;** 为P<0.01。图1 VDRsiRNA干扰效率及对细胞增殖影响Figure 1 The VDR siRNA interference efficiency and effect on cell proliferation
随后对转染后的细胞进行CellTiter-LumiTM发光检测,在相同底物浓度下RLU值越高表明其活细胞越多。结果显示,在转染后48 h,VDR siRNA-507的发光值最强[图1(b)],表明在干扰VDR的情况下,HepG2细胞明显增多。由此推断,VDR通过负调控作用的方式参与HepG2细胞的增殖过程。为了进一步验证该假设,以VDRsiRNA为实验处理,采用细胞集落形成和EdU染色检测HepG2细胞的增殖情况。
2.2 干扰VDR显著促进HepG2细胞的增殖
细胞集落形成实验结果表明,与对照组比,VDR siRNA处理组的细胞数目显著增加(P<0.01),见图2(b),说明在干扰VDR的情况下促进了HepG2细胞的增殖。EdU检测结果显示,与对照组比,VDRsiRNA处理组的新增细胞数目显著增加(P<0.01),见图2(c)和(d),与细胞集落实验结果一致。结果显示,干扰VDR后的HepG2细胞增殖能力有所增加。

(a)VDRsiRNA转染HepG2细胞集落形成的结晶紫染色;(b)染色细胞面积统计图;(c)VDRsiRNA转染HepG2细胞的EdU染色结果;(d)EdU染色细胞增殖统计图。* 为P<0.05;** 为P<0.01。图2 干扰VDR促进HepG2细胞的增殖Figure 2 The proliferation of HepG2 was promoted with VDRsiRNA
2.3 敲低VDR并未通过调控RBP4影响HepG2细胞的增殖
相对WT小鼠,VDR-KO小鼠肝脏RBP4的mRNA水平显著增加,而在肾脏和脂肪组织中RBP4表达变化不显著[图3(a)]。随后,VDR-KO小鼠的肝脏冰冻切片的免疫荧光染色结果显示,其RBP4蛋白表达略有增加,但未达到统计学的显著水平[图3(b)和(c)]。
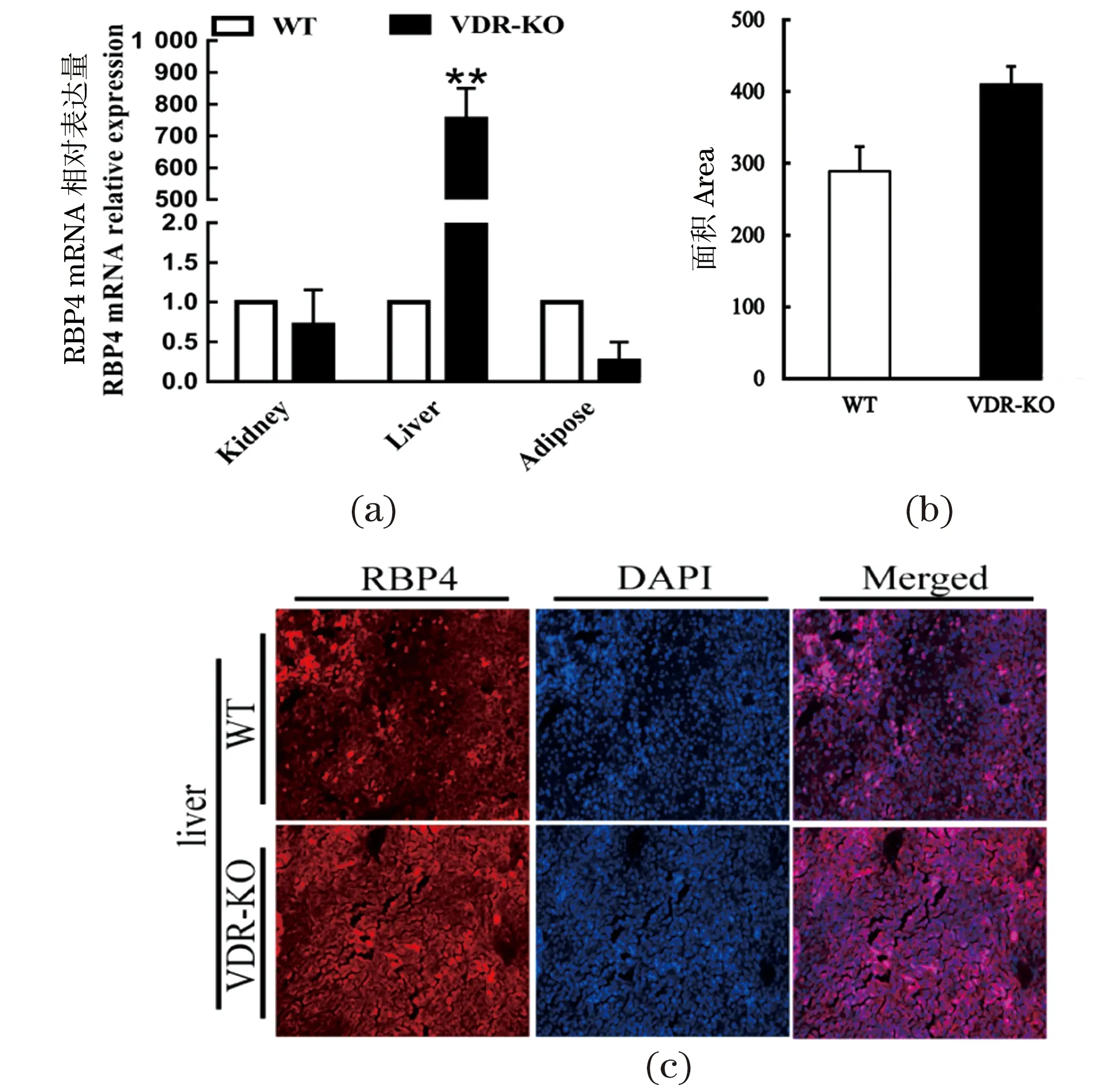
(a)RBP4 mRNA水平;(b)RBP4免疫荧光的定量分析;(c)RBP4的免疫荧光染色。* 为P<0.05,** 为P<0.01。图3 VDR敲除鼠肝脏组织中RBP4表达水平Figure 3 RBP4 expression levels in liver of VDR knockout mice
在细胞水平上验证的结果显示,VDRsiRNA上调了RBP4的mRNA表达水平(P<0.01),同时激活了BRP4的细胞膜受体STRA6(stimulated by retinoic acid gene 6)的表达(P<0.01),但VDR的下游靶基因,即细胞色素P450(Cytochrome P450,CYP450)家族成员CYP24a1的表达并未发生显著性变化,而下调了另一个靶基因CYP27b1的表达(P<0.05),见图4(a)。与组织学的结果相似,VDR的降低对RBP4蛋白的表达无显著性影响[图4(c)和(d)]。同时,由双荧光素酶分析的结果可知,尽管RBP4启动子区域中存在VDRE,但干扰VDR并没有对RBP4启动子的转录活性产生显著影响[图4(b)]。
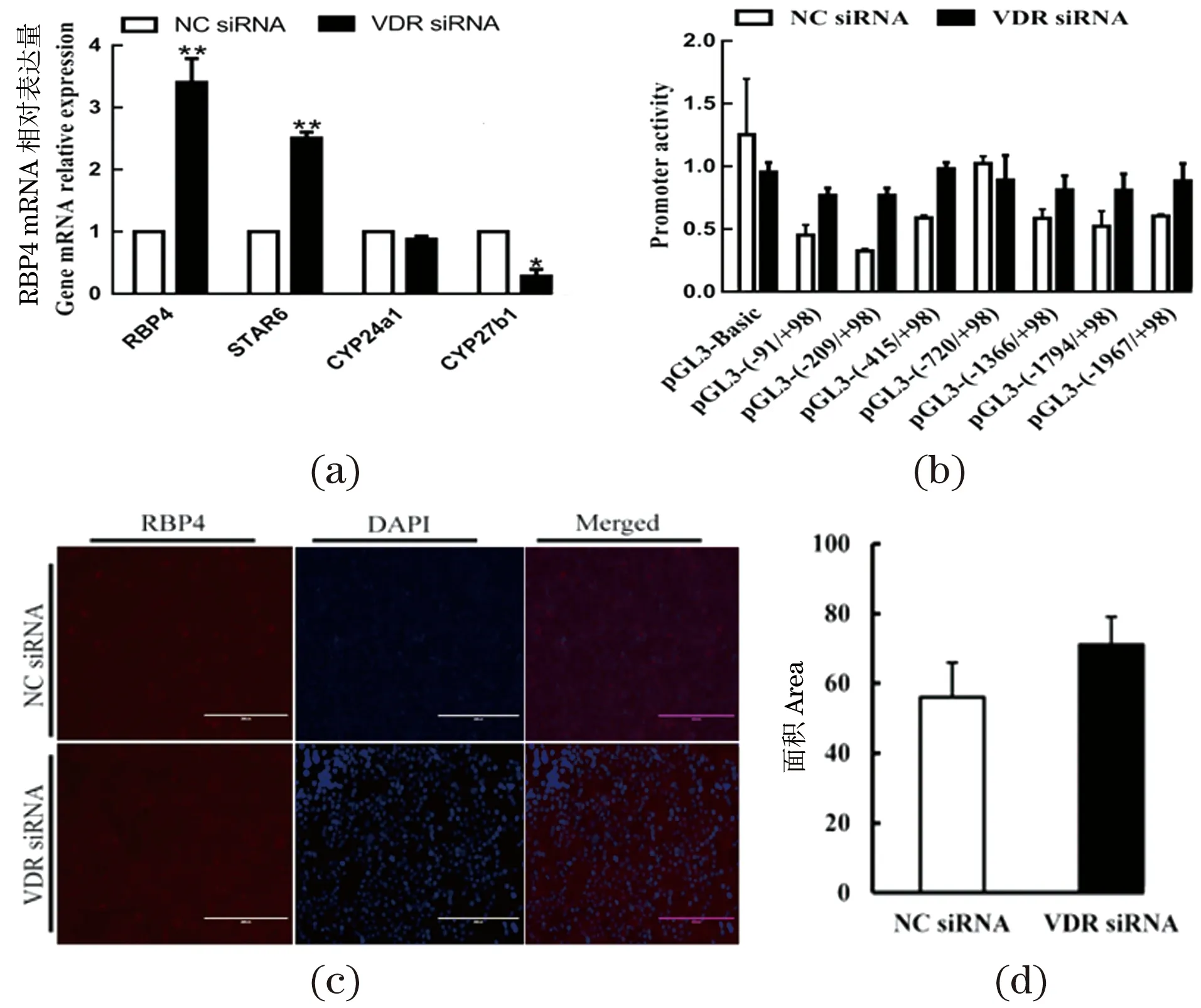
(a)VDRsiRNA对RBP4 mRNA表达的检测;(b)VDRsiRNA对RBP4启动子活性的影响;(c)VDRsiRNA对RBP4蛋白表达的影响;(d)RBP4免疫荧光染色定量分析。* 为P<0.05,** 为P<0.01。图4 干扰VDR对RBP4表达及其启动子活性的影响Figure 4 VDRsiRNA effects on RBP4 expression and its promoteractivity
3 讨论
VDR可通过调控新型钙离子通道蛋白(transient receptor potential vanilloid subfamily 5,TRPV5)的转录表达来抑制肾细胞癌(renal cell carcinoma,RCC)的增殖[5]。采用siRNA沉默VDR表达后,胃癌细胞增殖能力显著增加,相反VDR过度表达的胃癌细胞则失去了增殖能力,经证实VDR是通过调控β-连环蛋白(β-catenin)水平影响胃癌细胞增殖能力的[6]。VDR还可直接调控细胞周期蛋白表达,将肝癌细胞抑制在DNA合成前期,抑制肝癌细胞增殖[7]。研究表明,VDR在癌细胞的增殖过程中主要发挥抑制作用。实验结果发现,在降低HepG2细胞中VDR基因及蛋白表达的情况下,显著促进了HepG2细胞的增殖,也说明VDR在肝癌HepG2细胞增殖过程中发挥抑制作用。
此外,研究结果证实与WT小鼠相比,VDR-KO小鼠脂肪组织的发育受损从而阻碍了瘦素(Leptin)蛋白的分泌[17],并且在MC3T3-E1细胞的Leptin基因启动子上游-28 kb处存在强烈的VDRE信号[18]。同时,VDR-KO小鼠体内的成纤维生长因子23(fibroblast growth factor,FGF23)的水平显著下降[19]。随后,在FGF23基因下游和近端启动子-1 156 bp处发现了VDRE[20],并进一步证实了VDR对FGF23启动子转录具有重要调控作用[21]。在RBP4启动子区存在VDRE,并证实超表达VDR在HEK293T细胞中能够改变RBP4的启动子活性[10]。更关键的是,RBP4能够通过激活MAPK信号通路使血管平滑肌细胞(vascular smooth muscle cells,VSMCs)过度增生[22]。VDR-KO小鼠肝脏中的RBP4表达受到了不同程度的影响。在此基础上,实验假设VDR的缺失可能会通过调节RBP4的转录表达而对肝癌细胞的增殖产生影响。然而,不论是组织水平还是细胞水平,VDR的缺失仅仅上调了RBP4转录水平,而在蛋白表达上的改变不显著。因此,又进一步检测了VDR siRNA对RBP4基因启动子转录的作用。意外的是,VDR siRNA对RBP4基因启动子活性的影响均不显著。有研究显示,vitamin D可以促进转录共激活子与VDR形成复合物,但分子伴侣热应激蛋白(heat shock proteins)Hsp90和p23可抑制该复合物识别VDRE,以阻断配体激活的转录[23]。这说明VDR参与调节基因的顺序表达是多种转录因子协同作用的结果。而在RBP4基因启动子上不仅存在重要的顺式作用元件TATA盒(TATATAAA),还存在反应元件结合蛋白(cAMP response element binding protein,CREBP)、过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)、维甲类X受体(retinoid X receptor,RXR)、信号传导和转录激活因子(signal transducer and activator of transcription,STAT)等转录因子的结合位点[24]。这些转录元件的存在可能会在一定程度上削弱VDR对RBP4启动子的调控作用。此外,siRNA的转染效率也可能会导致VDR无法对RBP4蛋白表达产生显著性作用。由此推断,VDRsiRNA对HepG2细胞增殖作用并非通过调控RBP4的表达实现的。
诚然,VDR抑制癌细胞增殖能够通过多种途径实现。例如,在vitamin D激活恶性前列腺上皮细胞中的VDR后,通过上调p21和p27的表达抑制周期蛋白依赖性激酶(cyclin dependent kinase,CDK)活性,从而抑制细胞增殖作用[25]。而对细胞周期相关的基因进行qPCR检测发现,干扰VDR对HepG2细胞中的CDK抑制因子p21和p27的表达无明显影响,而细胞周期蛋白D1(cyclin D)基因表达量明显低于NCsiRNA组(P<0.05)(结果未显示)。因此,VDR siRNA促进HepG2细胞增殖过程与细胞周期性调控更为相关,而具体的结果还有待进一步验证。
4 结论
干扰VDR表达会促进HepG2细胞的增殖。对肝癌细胞HepG2而言,VDR发挥重要的负调控作用,而VDR的降低对肝癌细胞增殖的促进作用并非通过RBP4实现。
