运用新一代测序和生物信息学探求三阴性乳腺癌CHD4信号通路及潜在预后标志物的研究*
2022-12-17周志兵魏文嵩吴晓波金玉梁周新华江期华
周志兵 魏文嵩 吴晓波 骆 萍 金玉梁 周新华 江期华
江西省南昌市第三医院 330009
乳腺癌是全世界妇女死亡的主要原因之一,2018年全球女性乳腺癌发病率46.3/105,死亡率13.0/105,均呈上升趋势[1],也是我国女性最常见的癌症。临床上,大多数乳腺癌亚型表达雌激素受体、孕激素受体和人表皮生长因子受体2,是乳腺癌分型和药物选择的常用生物标志物[2]。然而,三阴性乳腺癌(TNBC)缺乏生物标记物表达,占所有乳腺癌的15%~20%[3]。研究表明,TNBC比其他亚型更具攻击性,对化疗/放疗更具抵抗力,有更高的转移率和复发率,总体生存期更短[4]。因此,TNBC患者需要新的治疗策略。最近研究表明,表观遗传因子在染色质水平上通过介导转化,参与调控肿瘤细胞的免疫原性、可塑性和异质性[5]。研究这些表观遗传调控因子或识别由其介导的相关分子和信号通路,可能为开发新一代抗癌药物另辟蹊径。CHD4是核小体重构和组蛋白脱乙酰酶复合物的最大亚单位,在控制同源重组修复以维持基因组稳定性方面不可或缺。研究显示,CHD4还与多种致癌作用有关,包括诱导异常干细胞更新、减缓分化和改变细胞周期的控制[6],CHD4可介导TNBC细胞的转移,也可能是TNBC患者的预后生物标记物[7]。然而,目前尚未发现直接靶向CHD4的药物,CHD4介导的下游基因及相关信号通路尚不清楚。本研究利用新一代测序(NGS)和生物信息学工具,探索CHD4激活的下游基因和新的信号通路,可有助于研发针对CHD4高表达TNBC患者的靶向药物。
1 材料和方法
1.1 数据库数据分析
1.1.1 从GEPIA2(Gene Expression Profiling Interactive Analysis)数据库提取数据:GEPIA2具有198 619种亚型和84种癌症亚型,从基因水平扩展到转录本水平将基因表达量化,支持对特定癌症亚型的分析和亚型之间的比较。GEPIA2整合了来自(The Cancer Genome Atlas,TCGA)和GTEx项目中的基因表达谱数据,提供了多种数据分析和可视化功能(见图1)。
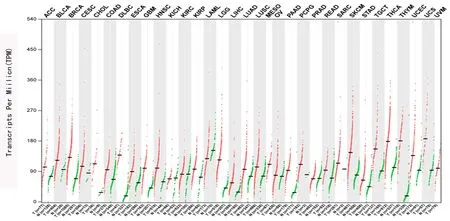
图1 GEPIA2 数据库中CHD4基因在不同癌症组织中的表达情况
1.1.2 Human Protein Atlas 数据库分析蛋白表达水平:HPA(Human Protein Atlas)数据库是基于蛋白组学,转录组学以及系统生物学数据,提供了26 000种人类蛋白质的组织和细胞分布信息。不仅收录了肿瘤组织,也涵盖了正常组织的蛋白表达情况,而且还可以查阅肿瘤患者的生存曲线。该数据库整合了肿瘤基因图谱,可以看到TCGA表达情况(见图2)。

图2 CHD4在乳腺组织细胞类型分布
1.2 细胞培养 本研究以丙二醛-MB-231、丙二醛-MB-468、Hs578T和4T-1三阴性乳腺癌细胞系(ATCC,马纳萨斯,弗吉尼亚州,美国)为研究对象。细胞在杜尔贝科改良的Eagle 中型培养基(Thermo Fisher科学公司,沃尔瑟姆市,马萨诸塞州,美国)中培养。RNA提取,全基因组转录组鉴定,RNA测序表达谱分析。用Trizol试剂(Invitrogen,Carlsbad,CA,USA)按制造商的方案从亲代稳定敲除CHD4(shCHD4)4T-1细胞中提取总RNA,后由Genewiz公司进行后续分析。双亲细胞和shCHD4细胞的mRNA在倍变>2.0和每千个碱基的转录每百万映射读取的片段数(FPKM)>0.2时有差异表达。
1.3 创新路径分析(IPA) IPA(Ingenuity Systems,Inc.,Redwood City,CA,USA)是一款基于多种类型文献的网络软件,由专家评审和更新,可用于“组学实验”数据的分析、集成和解释,可获得功能分析、典型路径、上游分析和网络[8]。IPA软件还提供了因果分析,帮助用户根据基因数据集和数据比较的结果生成假设的信号通路。
1.4 RNA干扰转染 人类CHD4、β1整合素和阴性对照的短链RNA(siRNA)均购自美国达摩康公司。根据制造商的说明,使用Lipofectamine 2000和Opti-MEM(Invitrogen)将非靶向或特异性siRNA转染细胞。
1.5 定量即时聚合酶链式反应(q-PCR) 用三唑试剂提取总RNA,并根据制造商的Ⅲ逆转录酶进行反转录合成cDNA,用作PCR扩增的模板,引物包括人CHD4、人β1整合素、人GAPDH、小鼠CHD4、小鼠β1整合素和小鼠GAPDH。采用罗氏LightCycler 480Ⅱ系统标准协议,进行全滴定实时PCR。抗体 β1整合素(#9699)和GAPDH(#2118)购自细胞信号技术(Danvers,MA,USA)。CHD4(GTX124186)和β1整合素(GTX128839)购自特克斯基因国际公司。
1.6 蛋白印迹法 用M-PERTM哺乳动物蛋白提取缓冲液,对细胞裂解,离心,去碎片。提取的蛋白质定量,变性,用十二烷基硫酸钠—聚丙烯酰胺凝胶电泳分离,转移到硝酸纤维素膜上,用所示抗体免疫印迹。
1.7 人体标本 收集南昌市第三医院病理科102例TNBC患者的福尔马林固定石蜡包埋组织块,均经医院研究伦理委员会批准使用这些组织。数据匿名分析,故无须额外知情同意。所有操作方法均取得南昌市第三医院认可。
1.8 免疫组织化学染色及评分 石蜡包埋组织块切片,脱蜡并重新水合,浸入pH 6.0回收溶液,并在121℃高压灭菌,提取抗原。在3%过氧化氢中孵育,样品在室温下与初级抗体孵育1h,然后应用DAKO RealTMEnvivonTM检测体系1h。最后,将切片与3’,3-二氨基联苯胺孵育,用迈尔苏木素复染,固封,分析。根据信号强度(0,1+,2+,3+)和阳性细胞比例(0:≤10%,1:>10%且≤25%,2:>25%且≤50%,3:>50%)对样本进行评分。分数≤4和≥6分别定义为低表达和高表达。
1.9 统计学方法 运用SPSS26.0软件进行统计分析。IHC染色法测定TNBC患者CHD4和β1整合素的表达,用χ2检验比较。采用Kaplan-Meier法分析生存曲线,评价这些蛋白表达作为TNBC患者预后指标的可行性。Cox比例风险模型评估整体生存率与临床病理变量的单变量和多变量比较。采用独立样本t检验比较各组间差异。P值<0.05表明两组间差异有统主进意义。
2 结果
2.1 正常4T-1肿瘤细胞和shCHD4 4T-1肿瘤细胞基因表达差异性 亲代和shCHD4 4T-1细胞中的差异表达基因在图3中显示为火山图。cuff-diff分析结果显示540个显著差异表达基因。shCHD4 4T-1细胞中有283个基因上调,257个基因下调。
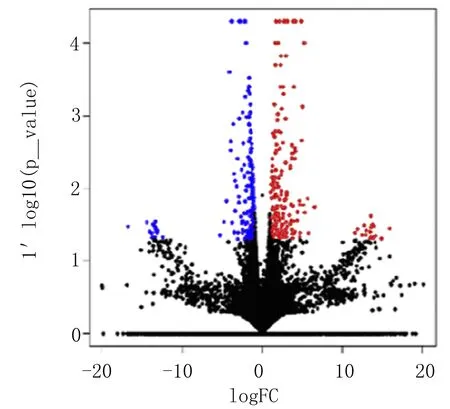
图3 亲代和shCHD4 4T-1细胞中的差异表达基因
2.2 CHD4障碍的信号传导通路失调与整合素信号传导通路有关 应用IPA方法对shCHD4t-1细胞中257个下调基因分析,有500多条信号通路参与了CHD4的相关通路。受CHD4抑制影响的前10个信号通路包括Snail1、Notch1、SMARCA4、JUN、VCAM1、BRD4、CD4、IL-4、MYC和Snail2。因此,笔者关注CHD4在整合素信号通路中的作用。
2.3 CHD4基因敲除降低小鼠和人TNBC细胞β1整合素基因和蛋白表达 q-PCR结果显示,CHD4基因敲除后,TNBC细胞β1整合素基因表达下降。然而,β1整合素的敲除并不影响CHD4基因的表达。此外,在其他人TNBC细胞中也观察到CHD4基因敲除导致β1整合素蛋白表达减少。因此,CHD4可能是β1整合素的上游介质,β1整合素蛋白表达下调可能是CHD4基因调控的结果。
2.4 β1整合素是CHD4调控小鼠TNBC细胞的重要分子 本文NGS数据中,β1整合素不仅参与了整合素信号传导,而且参与了其他几种受到CHD4调节的途径。此外,系统分析表明CHD4通过与候选蛋白Snail1、Notch1、SMARCA4、JUN、VCAM1、BRD4、CD4、IL-4、MYC和Snail2相互作用,上调β1整合素的表达。这些数据表明CHD4在调节β1整合素基因表达中起转录激活作用。
2.5 TNBC患者CHD4、β1整合素与若干临床病理指标的关系 本研究中,NGS和体外数据表明β1整合素由CHD4介导,然而,CHD4-β1整合素轴在TNBC患者中是否重要尚不清楚。采用IHC染色法研究TNBC患者CHD4、β1整合素及两者共表达与其他临床病理参数的关系。102例TNBC患者CHD4与β1整合素呈正相关(P=0.006),见表1。
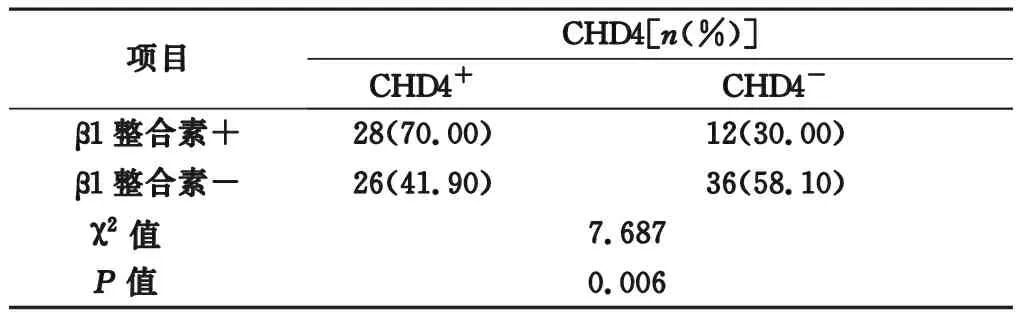
表1 TNBC组织中CHD4和β1整合素表达相关性
CHD4、β1整合素、CHD4和β1整合素的表达与转移、复发和死亡显著相关。Kaplan-Meier分析也显示CHD4和β1整合素共表达患者的平均总生存期为(28.7±13.2)个月,此值明显低于其他组平均生存期为(46.5±29.3)个月。CHD4和β1整合素的共表达在各组间生存时间最短。单因素和多因素Cox回归分析显示,患者的总生存率与CHD4和β1整合素的共表达显著相关。通过ROC曲线分析,CHD4和β1整合素的共表达与生存率的正相关性显著高于CHD4和β1整合素(AUC分别为0.74、0.73、0.72),见图4。
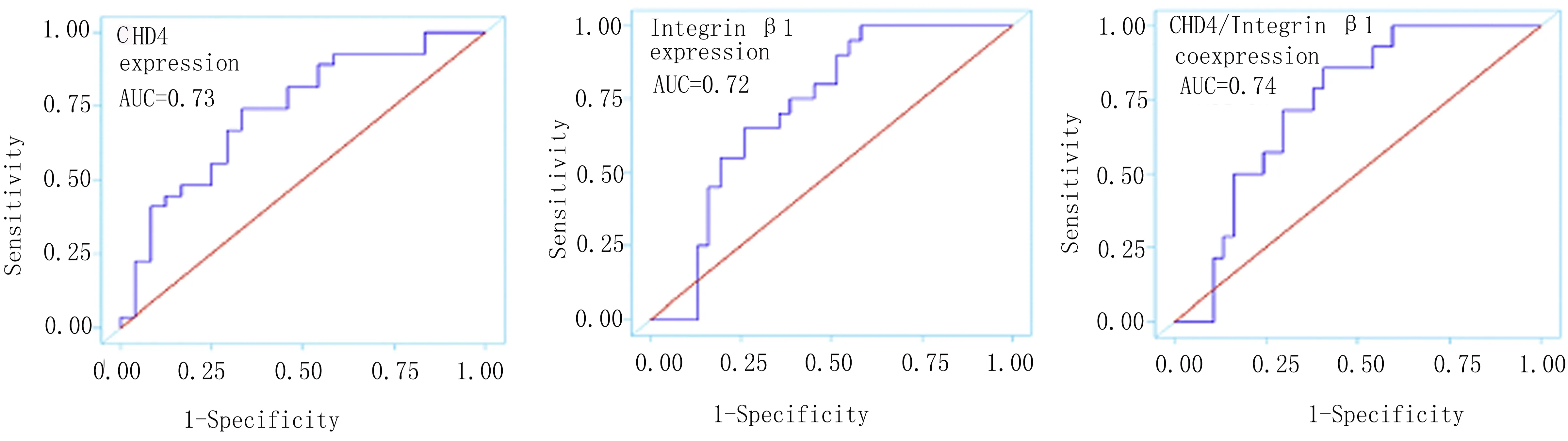
图4 CHD4、β1整合素以及CHD4和β1整合素的共同表达的ROC曲线分析
综合以上数据表明CHD4和β1整合素的共同表达是TNBC患者总生存率的重要独立预测因子。
3 讨论
TNBC缺乏特异性生物标记物、治疗方案少、新型抗癌药物开发缓慢,导致TNBC患者生存率低。因此,寻找新的诊断、预后和药物开发的靶点是治疗TNBC的重要问题。先前的研究表明,CHD4与许多癌症的致癌作用有关[6]。此外,CHD4在生理功能上与核小体重塑的其他核心亚单位和组蛋白dea-乙酰化酶复合物相互作用,维持抑癌基因表达[9]。以前的研究也表明CHD4介导的p21和E-cadherin抑制可诱导乳腺癌的化疗耐药性和转移[7]。然而,迄今为止还没有开发出针对CHD4的抗癌药物。因此,迫切需要寻找其他可能引起类似CHD4缺乏症的下游分子或临床前药物。
在对CHD4介导的分子或通路的研究中,发现整合素信号通路受CHD4基因敲除的影响。β1整合素不仅参与CHD4调控基因的整合素信号转导,而且参与CHD4调控基因的许多其他途径,表明β1整合素可能是一个重要的表观遗传调控因子介导的分子。当β1整合素基因敲除时,CHD4抑制基因敲除和β1整合素蛋白表达,并不影响CHD4蛋白表达,提示CHD4是β1整合素的上游介质。通过IPA数据分析发现10种可能的介质参与了CHD4对β1整合素的调节。以往的研究表明,Snail、BRD4、Notch和Myc等介导因子可以直接或间接地与CHD4结合,使多种抑癌基因表达,调节肿瘤功能。一些研究表明β1整合素也可以被这些分子调节[10]。然而,TNBC中CHD4-β1整合素轴介导的主要介质和确切机制尚需进一步分析。CHD4还可以通过多种免疫应答因子调节β1整合素。因此,这种信号转导可能应用于癌症治疗中的免疫治疗[11]。
以往的研究中,β1整合素及其相关的信号转导影响细胞的增殖、迁移、侵袭、存活和耐药等。此外,β1整合素的高表达与几种癌症的不良预后相关[12]。β1整合素的破坏可能抑制肿瘤细胞的转移、浸润和非依赖性生长。研究表明,β1整合素是TNBC中潜在的预后生物标记物[10],一些临床前试验支持β1整合素拮抗剂可能是抑制肿瘤生长和转移的化疗药物[11]。然而,β1整合素拮抗剂能否进一步应用于高表达CHD4的TNBC患者尚不清楚。因此,我们探讨了CHD4与β1整合素的共表达与多种临床病理因素的关系。本文数据表明CHD4与β1整合素呈正相关。先前的研究也表明CHD4和β1整合素可能是TNBC患者的预后标志物[7]。因此,CHD4和β1整合素在TNBC中的作用应比乳腺癌其他亚型更为重要。CHD4和β1整合素的联合表达与转移、复发和死亡显著相关,可能是总生存率的重要预测因子。此外,ROC曲线分析,CHD4和β1整合素的共表达与生存率的正相关显著高于CHD4和β1整合素。因此,CHD4-β1整合素在TNBC患者中具有临床病理和预后意义,提示β1整合素拮抗剂可进一步应用于高CHD4表达的TNBC患者。
综上所述,CHD4-β1整合素可能是TNBC患者的一个预后标志物,β1整合素抑制剂的使用可能是CHD4高表达TNBC患者的治疗选择。
