补骨脂素在2D/3D肝细胞模型上的毒性比较及对线粒体融合分裂的影响
2022-12-16苏世家王嘉瑞于英莉
赵 琳,苏世家,王嘉瑞,于英莉,2,周 昆,2
(1. 天津中医药大学中医药研究院, 2. 省部共建组分中药国家重点实验室,天津 301617)
补骨脂是豆科植物补骨脂(PsoraleacorylifoliaL)的干燥成熟果实,归肾、脾经,具有温肾助阳,纳气平喘,温脾止泻的功效,是二神丸、青娥丸等经典方剂的重要组成成分,已被广泛用于治疗白癜风、骨折、骨质疏松症等[1]多种疾病。随着在临床上的广泛应用,越来越多的临床报告表明补骨脂具有潜在的肝毒性[2],引发了学者对于补骨脂中毒性成分的关注。补骨脂素是补骨脂水煎液体内吸收的主要活性成分之一,其含量是补骨脂药材质量控制的限定标准。现代药理研究表明,补骨脂素具有抗骨质疏松、抗肿瘤、神经保护、抗炎等药理作用[3]。补骨脂素在长期或大剂量给药情况下可引起大鼠、小鼠、斑马鱼等动物严重肝损伤,其毒性机制与胆汁酸代谢,细胞色素P450代谢以及内质网应激等引起的氧化应激、线粒体毒性、肝细胞凋亡等密切相关[3]。
人肝癌细胞(human hepatocellular carcinomas,HepG2)是分离自人类肝癌组织的细胞系,在培养中相对容易维持,具有许多正常肝细胞特征,也是目前用于肝毒性评估最常用的人类细胞模型之一[4]。然而,在传统的2D单层培养中,HepG2细胞中细胞色素P450(CYP450)酶[5]表达水平较低,而CYP450酶的活性和诱导性是预测药物体内过程和毒性不良反应的关键指标[6]。因此,在药物开发和肝毒性研究中,细胞体外三维类(3D)组织聚球体培养成为近年来的研究热点之一。相比传统2D细胞培养,3D培养可以更好地模拟细胞和组织功能,具有更好的建模效果。其最大特点是增强了细胞-细胞、细胞-基质的相互作用并提高了肝脏特异性功能的表达,从而在体内提供了生理上更相关的模型[7]。但体外肝脏3D模型在中药毒性评价方面的应用仍处于初级阶段,有待进行更多的验证和探索。
本研究首先利用低吸附U形底多孔板法构建HepG2细胞的3D多细胞聚球体模型,并对该模型进行肝脏特异性功能检测;分别使用2D和3D培养的HepG2细胞模型评价补骨脂素的毒性并比较其差异性,进一步探讨补骨脂素的肝毒性作用机制。
1 材料与方法
1.1 药物与试剂补骨脂素(≥98%,19101703)购自成都普菲德生物技术有限公司;DMEM高糖培基(2053260)购自以色列BI公司;胎牛血清(fetal bovine serum,FBS,1922693)购自以色列BI公司;青链霉素(MA0110)购自大连美仑生物有限公司;CCK-8(59122500)购自Biosharp;总RNA小量抽提试剂盒(P10301),TRANZOL UP(P10301),Trans Script First-Strand CDNA Synthesis Super Mix(P20610)均来自北京全式金生物技术有限公司;Ultra SYBR Mixture(33620)购自北京康为世纪生物科技有限公司;四甲基罗丹明甲酯(tetramethylrhodamine methyl ester,TMRM,43818)购自美国Med Chem Express;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI,4083S)购自美国Cell Signaling Technology;白蛋白(Albumin,ALB,200921)试剂盒和尿素氮(Urea nitrogen,BUN,201041)试剂盒均购自中生北控生物科技股份有限公司;乳酸脱氢酶(Lactate dehydrogenase,LDH,LE647)试剂盒购自日本Dojindo Laboratories。
1.2 仪器荧光定量PCR仪购自美国Bio-Rad公司;高内涵筛选仪(INcell Analyzer 2500 HS)购自美国GE公司;NanoDrop One超微量分光光度计购自美国Thermo公司;全自动血清生化仪购自日本Hitachi公司;酶标仪(SPARK)来自瑞士THCAN公司。
1.3 细胞培养HepG2细胞系取自中国科学院(上海)细胞库,将HepG2细胞接种于25 mL培养瓶内,使用含FBS(10%)、青霉素(100 kU·L-1)和链霉素(100 kU·L-1)1% DMEM,于37 ℃、5% CO2条件下进行单层培养。培养基隔天更换,细胞贴壁生长覆盖瓶底80%~90%时可传代。
1.4 3D细胞模型的构建本研究使用低吸附U形底多孔板法构建3D细胞模型[8]。以每孔1 500、4 500和7 500个细胞接种于超低吸附U型底96孔板(购自美国Corning公司)中,每孔100 μL悬液,在超净台中放置5 min,使用显微镜观察细胞,放于37 ℃,5% CO2培养箱中继续培养,隔天进行半换液;于接种后d 1~4,6、8、10进行显微镜观察,用显微镜拍照记录不同接种密度的3D HepG2聚球体的聚集形态。
1.5 肝功能评价将细胞分别进行2D和3D细胞模型培养。通过全自动血清生化检测仪检测3D培养条件下HepG2细胞聚球体在d 2、4、6、8、10中,以及2D培养条件下细胞d 2的ALB和BUN分泌的含量。
1.6 Q-PCR检测将HepG2细胞分别进行2D和3D细胞模型培养,取2D培养2 d,以及3D条件下培养4 d和10 d的细胞聚球体为样本,通过实时定量聚合酶链锁反应(quantitative real time polymerase chain reaction,Q-PCR)测定其CYP1A2、CYP2E1、CYP3A4以及UGT1A1的mRNA表达水平。另取3D条件下培养4 d,不同浓度补骨脂素给药24 h的细胞聚球体为样本,通过Q-PCR测定其线粒体动力相关蛋白 1(dynamin-related protein 1,DRP1)、线粒体融合蛋白2(mitofusin 2,Mfn-2)以及视神经萎缩蛋白 1(optic atrophy 1,OPA1)的mRNA转录水平。其引物由上海生工生物科技有限公司合成。采用通用型总RNA提取试剂盒进行样本RNA提取,使用NanoDrop ND-2000超微量分光光度计测定所提取的细胞中RNA的浓度和纯度。随后采用TransScript First-Strand CDNA Synthesis Super Mix进行CDNA反转录,将配置完成的反应体系充分混匀后放入Q-PCR仪上进行PCR反应。设置反应程序:95 ℃,10 min;95 ℃,15 s;60 ℃,1 min(收集荧光);40个PCR循环。Q-PCR所用引物见Tab 1,为了建立PCR产物的熔解曲线,扩增反应结束后,从60 ℃缓慢加热到90 ℃。以GAPDH为内参,采用Livak(2-ΔΔCt)法进行相对基因表达分析。

Tab 1 Q-PCR target gene primer sequences
1.7 2D细胞模型评价补骨脂素毒性补骨脂素分为5个剂量组,分别为对照组、50、100、200和400 μmol·L-1组。2D细胞模型以4.5×103个/孔的密度接种于普通96孔板,培养24 h后,弃去全部的旧培养基,再给予100 μL药物进行处理。24 h后换成100 μL含CCK-8试剂的培养基,在37 ℃下孵育2 h后,使用酶标仪450 nm测光密度(optical density,OD)值,检测细胞存活率。
1.8 3D细胞模型评价补骨脂素毒性补骨脂素分为5个剂量组,分别为对照组、50、100、200和400 μmol·L-1组。3D聚球体细胞模型以4.5×103个/孔的密度接种于低吸附U型底96孔板,培养4 d后,弃去全部的旧培养基,再给予100 μL药物进行处理。24 h后换成100 μL含CCK-8试剂的培养基,在37 ℃下孵育4.5 h后,使用酶标仪450 nm测OD值,检测细胞存活率。
1.9 LDH漏出量测定移取“1.7”“1.8”中2D单层细胞,3D HepG2聚球体给药24 h后的上清液50 μL在普通96孔板中,按照日本都津道分子技术公司的活性/细胞毒性复合检测试剂盒的说明进行LDH漏出水平的测定。每孔加入50 μL工作液,室温黑暗孵育25 min。每孔加入25 μL的stop溶液,用酶标仪记录490 nm处的OD值,检测LDH漏出量。
1.10 线粒体膜电位水平2D/3D细胞模型的培养及给药方式如“1.7”“1.8”所示,给药24 h后,使用TMRM和DAPI对细胞进行染色,分别用高内涵筛选仪的2D和3D模式,以548 nm的激发波长、570 nm的发射波长检测TMRM和以350 nm的激发波长、460 nm的发射波长检测DAPI的荧光强度并进行图像分析,通过高内涵分析软件计算平均荧光强度。
2 结果
2.1 3D培养模型的建立和评价
2.1.1细胞聚球体的形成 由形态观察可见,3D条件下,微球直径随着培养时间及初始接种密度的增加而增大,连续培养3 d细胞自发聚集形成致密稳定的球形,以1 500、4 500、7 500个/孔的接种密度分别进行接种,如Fig 1A,B所示,对比3种接种密度的球体增长情况来看,1 500个/孔HepG2球体的初始直径较小,球体体积总体较小。4 500个/孔的HepG2细胞聚球体生长速度明显快于7 500个/孔细胞聚球体,体积变化幅度大,且符合在细胞球直径为200 μm左右时活性较高,且不会出现大量的核坏死的条件[9]。因此选择4 500个/孔的密度种板进行后续实验。
2.1.23D模型具有较高的ALB和BUN分泌水平以及肝药酶活性 通过不同的培养方式,在细胞培养的不同时间点,收集细胞培养上清液,分别对ALB和BUN含量进行检测。如Fig 2A,B示,3D培养2 d后,白蛋白和尿素氮分泌都达到较高水平,且均显著性高于2D培养水平。该水平一直维持到培养10 d后。该结果表明,3D模型可以长时间保持高水平ALB和BUN分泌,维持其肝脏功能。
肝药酶活性是影响药物肝毒性的重要因素。为检测3D模型培养下细胞的代谢能力,通过Q-PCR测定重要的CYP450酶的活性,评价细胞模型的代谢功能,并与2D细胞进行比较。如Fig 2C所示,3D细胞培养至d 4和d 10时,CYP1A2、CYP2E1、CYP3A4和UGT1A1的mRNA表达与2D细胞相比均升高,其中3D细胞培养至d 4时CYP1A2、CYP2E1、CYP3A4和UGT1A1 mRNA的表达分别为2D细胞的2.49、6.44、4.17和3.78倍。
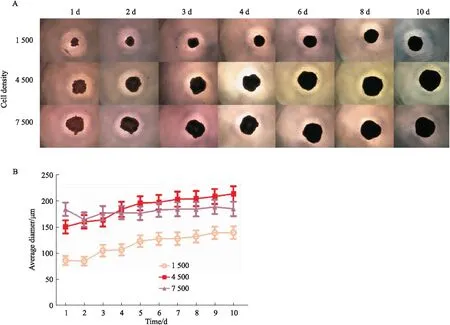
Fig 1 Formation of 3D HepG2 cell
2.2 比较补骨脂素对2D/3D培养HepG2细胞的肝毒性差异在2D和3D细胞模型中,补骨脂素均明显降低细胞存活率。在2D细胞培养模型中,与对照组相比,400 μmol·L-1的补骨脂素处理后,细胞的存活率下降到86.78%(Fig 3A),而LDH漏出量增加至115.33%(Fig 3B)。3D细胞模型相比于2D细胞,在更低的剂量下表现出细胞毒性,与对照组相比,100、200和400 μmol·L-1的补骨脂素处理后,细胞的存活率分别下降到83.97%、79.02%和72.45%(Fig 3C)。LDH漏出量也从100 μmol·L-1开始出现明显增加,分别增加至111.21%、127.28%和137.60%(Fig 3D)。因此,结果显示3D 细胞培养模型对补骨脂素的反应更为敏感。
2.3 比较补骨脂素对2D/3D培养HepG2细胞的线粒体损伤差异线粒体膜电位(mitochondrial membrane potential,MMP)是评估线粒体功能的关键参数,细胞在发生凋亡时多伴有MMP的下降。使用荧光染料TMRM染色线粒体,一旦MMP丧失,TMRM积累将停止,信号变暗或消失。如Fig 4C,D所示,3D条件培养的细胞聚球体TMRM荧光强度明显低于对照组。当补骨脂素为100、200和400 μmol·L-1时,3D聚球体的TMRM荧光强度明显降低,分别为对照组的52.80%、55.54%和34.85%(Fig 4C)。相反,如Fig 4A,B所示,2D细胞模型与对照组相比,仅在400 μmol·L-1时,TMRM荧光强度明显下降至88.23%。
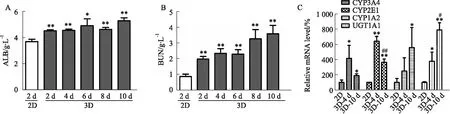
Fig 2 3D model with higher levels of albumin and urea secretion and liver drug enzymatic
Levels of (A)albumin and (B)urea secretion in 2D/3D cell models; C:CYP3A4,CYP2E1,CYP1A2 and UGT1A1 mRNA level.*P<0. 05,**P<0. 01vs2D;#P<0. 05,##P<0.01vs3D-4 d.
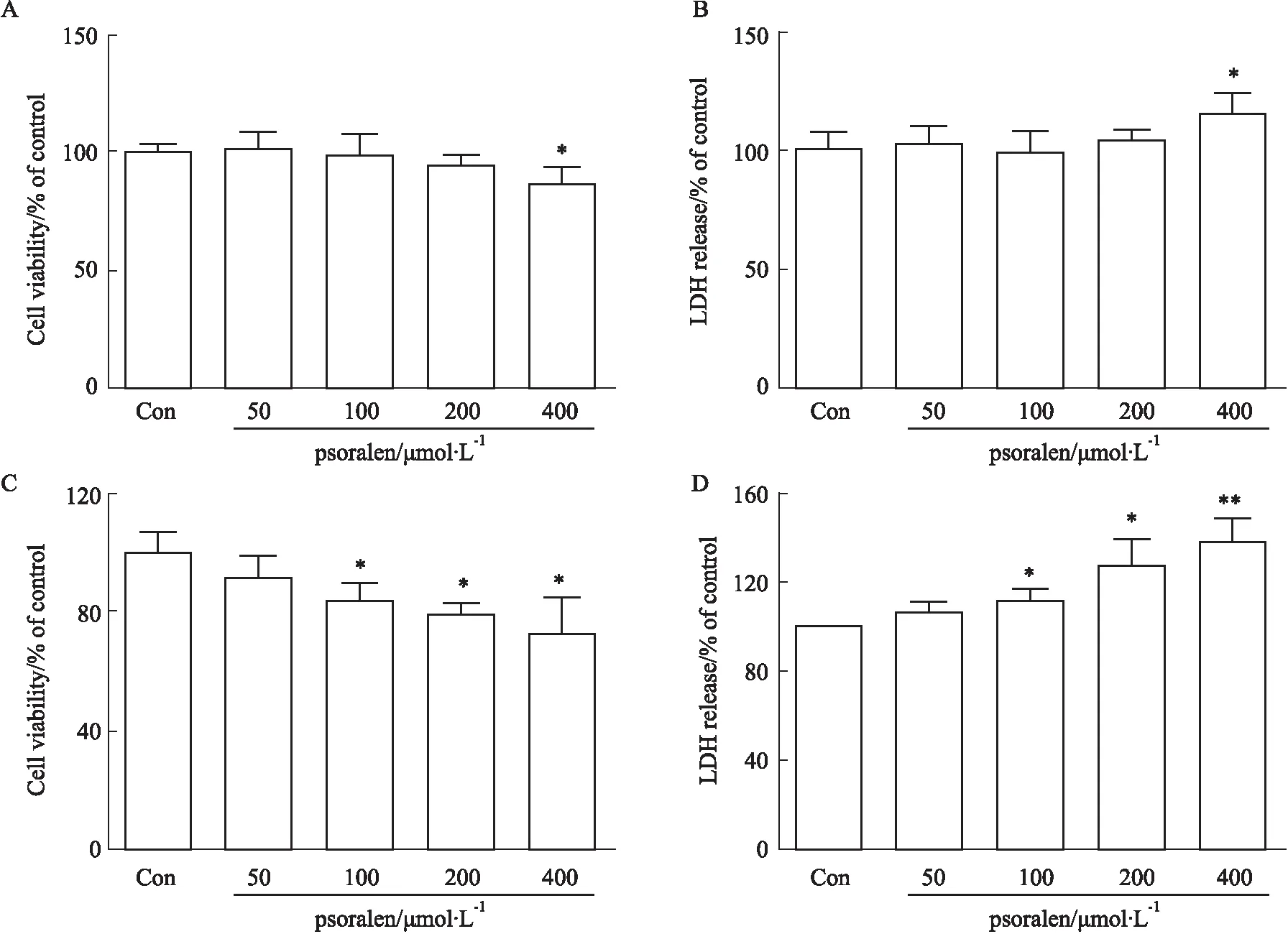
Fig 3 Comparison of hepatotoxicity of psoralen in 2D/3D HepG2 cell
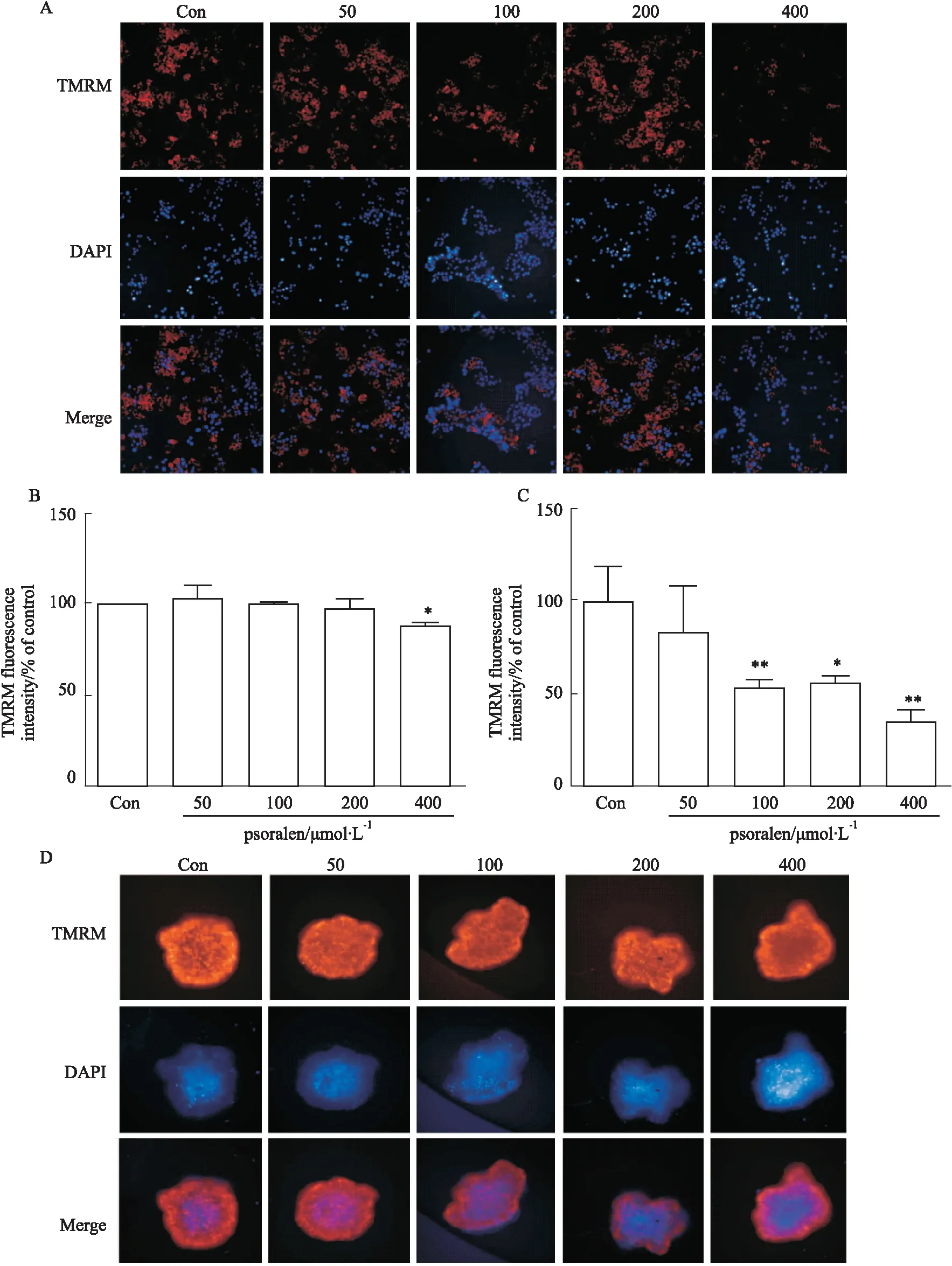
Fig 4 Psoralen induced mitochondrial membrane potential reduction in 2D/3D HepG2
2.4 补骨脂素诱导线粒体融合分裂失衡DRP1是介导线粒体分裂的主要蛋白之一。线粒体外膜之间的融合是由线粒体融合蛋白Mfn-1和Mfn-2介导的,而线粒体内膜之间的融合是由OPA1介导。如Fig 5所示,Q-PCR检测了3D HepG2细胞膜型中线粒体分裂-融合动态的关键指标,比照对照组,DRP1的表达明显增加至162.84%;而线粒体融合相关蛋白Mfn-2未有显著性差异,OPA1表达明显降低,为对照组的82.99%。提示补骨脂素诱导了线粒体分裂。

Fig 5 Effect of psoralen on expression of mitochondrial fusion and fission-related genes in 3D HepG2 cell model *P<0. 05 vs control
3 讨论
由于传统的2D细胞模型的局限性,建立合适的模型对于临床前药物开发和疾病研究非常迫切。与传统的2D细胞培养相比,3D细胞培养通过模拟细胞-细胞和细胞-基质相互作用,以及多种新技术提供类似体内的生物物理环境[10]。低吸附U形底多孔板法构建的3D HepG2细胞聚球体模型,操作简单,成本相对较低,可大量快速进行肝细胞类组织球体构建,模型功能表现突出,并能实现长期培养[11],可进行常规的药物安全性评估,直接应用于高通量高内涵等相关检测设备,方便快捷。与2D模型相比,该模型可以长期培养,且能够保持较高的白蛋白和尿素氮分泌水平和肝药酶活性。
通过对细胞存活率以及LDH漏出量的检测,结果表明补骨脂素对于3D培养的细胞损伤更为严重,而且更低浓度的补骨脂素即可造成细胞明显损伤,提示3D细胞模型对补骨脂素的肝毒性更为敏感。3D培养模型中药物代谢酶活性较高与人肝细胞代谢能力强的特征较为符合,这可能是2D/3D培养条件下同种细胞作用于相同化合物出现毒性差异的原因之一。3D细胞模型在评价药物代谢后的肝脏毒性方面具有独特优势。
线粒体在药物性肝损伤中起着中心作用[12]。有研究显示,补骨脂素能够破坏肝细胞线粒体膜完整性,引起ATP合成障碍[13]。因此,明确补骨脂素对线粒体的影响尤为重要。正常的MMP是维持氧化磷酸化和产生 ATP 的先决条件,MMP下降是细胞凋亡的一个早期标志[14]。补骨脂素在3D HepG2聚球体上以更低的药物浓度就可以诱导HepG2细胞MMP降低,表现出线粒体毒性。正常情况下,线粒体分裂和融合是动态平衡的,线粒体形态改变受线粒体融合分裂蛋白控制。线粒体动态平衡是保证膜结构完整的重要条件,也是维持正常膜电位的重要机制,在维持线粒体功能方面起着关键作用,是保证细胞正常活动的重要基础[15-16]。补骨脂素给药后,3D HepG2细胞膜型中线粒体分裂蛋白DRP1表达明显升高,而线粒体融合蛋白OPA1表达明显降低,提示线粒体分裂增加、融合减少。过度的线粒体裂变会破坏线粒体网状结构的稳定,导致线粒体功能障碍并伴随MMP的降低,激活线粒体途径的细胞凋亡[17-18]。
综上所述,由低吸附U形底多孔板法构建的3D HepG2细胞模型与2D细胞相比,有更好的代谢特征。补骨脂素对3D细胞模型造成的细胞毒性和线粒体损伤作用强于2D模型。补骨脂素造成线粒体过度分裂,可能是其诱导线粒体功能失常、细胞凋亡的关键性因素,但补骨脂素如何导致线粒体DRP1和OPA1的具体机制还有待进一步研究。