丁香酚对2型糖尿病小鼠的降血糖作用及肝脏糖脂代谢信号转导通路调控
2022-12-16张金山金国范张立会权海燕
张金山,金国范,刘 艳,张立会,权海燕
(1.延边大学附属医院中心实验室,2.延吉市依兰镇中心卫生院药局,吉林 延吉 133000)
糖尿病(diabetes mellitus, DM)是一种由胰岛素分泌缺陷及(或)胰岛素抵抗引起的以高血糖为特征的慢性、全身性代谢性疾病,临床分型主要为1型糖尿病(type 1 diabetes mellitus, T1DM)和2型糖尿病(type 2 diabetes mellitus, T2DM),其中T2DM占90%~95%。据国际糖尿病联合会最新发布的全球糖尿病地图显示, 2019年全球糖尿病患病率约为9.3%(4.63亿人),预计到2030年将增加25%升至10.2%(5.78亿人),到2045年将增加51%升至10.9%(7亿人),其中50.1%的糖尿病患者未知自己患有糖尿病[1]。已知,T2DM与遗传因素、自身免疫以及肠道菌群等密切相关,但其病因及发病机制仍未完全阐明。此外,T2DM患病人群年轻化及其并发症导致的高死亡率使其已然成为危害公众健康的严重疾病之一[2],因此,寻找能够改善T2DM的药物也成了研究的热点。
肝脏作为调控机体糖脂代谢平衡的重要器官,是胰岛素调控血糖平衡的主要靶器官之一,在胰岛素抵抗的发生发展中起重要作用。研究发现,机体内糖脂代谢及胰岛素稳态受众多共同信号通路以及交错形成的复杂网络的调控[3]。肝脏脂肪变性导致胰岛素抵抗,使外周组织和靶器官对葡萄糖的利用障碍,导致血糖水平升高。因此,通过调控肝脏糖脂代谢紊乱可抑制胰岛素抵抗,进而改善T2DM。
丁香酚(eugenol)是丁香挥发油的主要挥发性成分,存在于丁香、肉桂、罗勒、肉豆蔻等芳香植物种。目前,有报道称丁香酚具有抗炎、抗氧化、抗病毒和抗癌等多种药理活性[4-5]。其中,丁香酚对炎症和氧化应激的实验研究相对较多,但是其对T2DM及肝脏糖脂代谢等代谢性疾病的药理作用尚不清楚。本研究以高脂饲料诱导C57BL/6小鼠的T2DM模型为实验对象,探讨丁香酚能否改善T2DM及肝脏糖脂代谢紊乱及其作用机制。
1 材料与方法
1.1 实验动物5周龄的SPF级C57BL/6雄性小鼠通过延边大学购买,许可证号SCXK(辽)2015-0001,饲养条件为(22±2)℃、湿度(50±5)%,12 h/12 h光照黑暗循环,自由摄食饮水,适应环境1周后进行实验。
1.2 药物、试剂及实验仪器丁香酚、二甲双胍、苏木素染液(sigma公司)。抗体SHP、pFOXO1、pCREB、PEPCK、G6Pase购自Cell Signaling Technology;内参actin购自Santa Cruz Biotechnology;血糖(plasma glucose, PG)、胰岛素(insulin, RI)、甘油三酯(triglyceride, TG)、胆固醇(cholesterol, CT)、丙氨酸转氨酶(aspartate transaminase, ALT)、天冬氨酸转氨酶(alanine aminotransferase, AST)、抵抗素(resistin, RP)、瘦素(leptin, LP)、胃饥饿素(ghrelin, GHRP)、胰高血糖素(glucagon, GC)、血浆纤溶酶原激活抑制剂-1(Plasma plasminogen activator inhibitor-1, PAI-1)试剂盒购自Stanbio Laboratory;蛋白提取试剂盒购自北京索莱宝公司。台式离心机(美国Beckman Coulter公司);凝胶成像仪(美国protein Simple公司);显微镜(日本OLYMPUS公司)。
1.3 实验方法
1.3.1高脂饲料诱导小鼠2型糖尿病模型的建立、分组及给药 C57BL/6小鼠高脂饲料饲养, 试验饲料的成分(Tab 1)。以上述饲料饲养8周后,尾尖采血测定空腹血糖(fasting blood glucose, FBG),选取11.1 mmol·L-1≤FBG≤33.3 mmol·L-1者纳入实验。小鼠分为普通饲料组(RD)、高脂饲料组(HFD)、丁香酚给药组(40 mg·kg-1·d-1)及二甲双胍给药组(200 mg·kg-1·d-1),RD组及HFD组给予等量蒸馏水。以上各组均为灌胃给药,每周测定1次血糖和体质量,连续给药6周。6周后,采血分离血清待测,取出肝脏组织称质量、-80 ℃保存,部分用4%多聚甲醛固定。
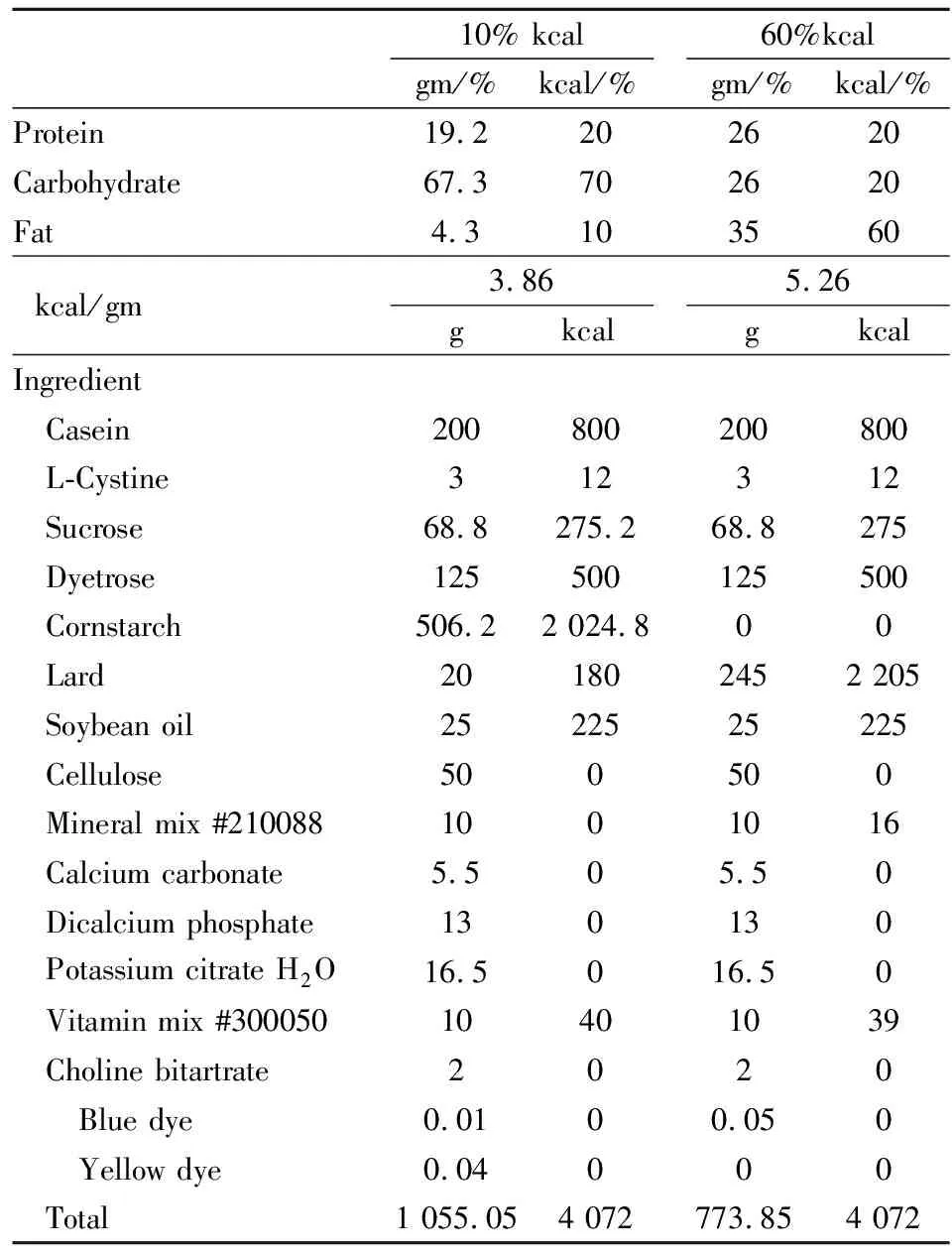
Tab 1 Composition of experimental diets
1.3.2肝指数测定 取各组小鼠肝脏,称质量并计算肝指数,肝指数=肝质量/体质量。肝组织中脂质含量、TC、AST、ALT是利用试剂盒(Stanbio Laboratory, Boerne, TX, USA)和全自动分析仪(SMARTLAB, Mannheim, Germany)检测。
1.3.3口服糖耐量试验(OGTT)测定 给药6周后测OGTT,小鼠禁食不禁水12 h后,测定0 h血糖,然后灌胃葡萄糖溶液(2 g·kg-1),分别在30、60、90、120 min测量血糖。计算葡萄糖曲线下面积(arae under curve,AUC)。AUC=1/4×FBG值+1/2×0.5 h血糖值+3/4×1 h血糖值+1/2×2 h血糖值。
1.3.4生化指标 血清中PG、RI、TG、TC、RP、LP、GHRP、GC、PAI-1是利用试剂盒(Stanbio Laboratory, Boerne, TX, USA)和全自动分析仪(SMARTLAB, Mannheim, Germany)检测。
1.3.5肝脏组织HE染色 肝组织用4%多聚甲醛固定、梯度乙醇脱水、石蜡包埋、切片,HE染色、二甲苯透明,做形态学观察。
1.3.6Western blot检测 采用RIPA裂解液提取小鼠肝脏组织总蛋白,BCA试剂盒测定蛋白浓度,调等浓度后,加上样缓冲液使蛋白变性。80 V恒压电泳30 min,转100 V恒压电泳1 h,100 V恒压转膜120 min,用5% BSA溶液封闭90 min,加入一抗SHP(1 ∶1 000)、pFOXO1(1 ∶1 000)、pCREB(1 ∶1 000)、PEPCK(1 ∶1 000)、G6Pase(1 ∶1 000)和内参β-actin(1 ∶2 500)4 ℃孵育过夜,洗膜3次,10 min/次,加入二抗HRP(1 ∶5 000)孵育90 min, 再次洗膜后在显影成像仪中显色曝光,条带用Image Lab 6.0软件进行分析。
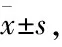
2 结果
2.1 丁香酚对T2DM小鼠体重及肝脏的影响与RD组相比,HFD组小鼠体质量明显增加(P<0.01),形态明显臃肿,肝脏体积增大,脂肪变性,表面呈淡红色。与HFD组相比,MET200组和E40组小鼠体质量降低差异无统计学意义,肝脏体积减小,颜色接近于健康的暗红色,见Fig 1。
2.2 丁香酚对T2DM小鼠肝指数、脂代谢及肝功能的影响与RD组相比,HFD组小鼠肝质量、肝指数、脂质含量、肝甘油三酯、ALT、AST升高2.3倍、1.3倍、3.2倍、1.5倍、6.2倍、7.8倍;与HFD组相比,MET200组和E40组小鼠肝质量降低41.2%和18.37%、肝指数降低35.4%和12.3%、脂质含量降低52.9%和28.9%、肝甘油三酯53.4%和46.2%、AST降低69.8%和47.2%、ALT降低47.1%和37.2%,见Fig 2。
2.3 丁香酚对T2DM小鼠OGTT的影OG-TT结果显示,各组小鼠血糖值在30 min时间点到达顶峰后逐渐降低。与RD组比较,HFD组小鼠不同时间点的血糖值均明显升高(P<0.01);与HFD组比较,MET200组小鼠在不同时间点的血糖值均降低(P<0.05),而E40组小鼠在120 min时间点的血糖值差异无统计学意义。根据AUC表明,与RD组相比,HFD组小鼠AUC增加1.8倍;与HFD组相比,MET200组和E40组小鼠AUC降低26.6%和12.7%,见Fig 3。

Fig 1 Effects of eugenol on body weight and liver
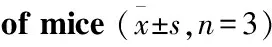
##P<0.01 vs RD group.
2.4 丁香酚对T2DM小鼠血清各项指标的影响与RD组相比,HFD组小鼠血清中血糖、胆固醇、抵抗素、瘦素、胰高血糖素、纤溶酶原激活物抑制剂-1水平分别升高1.9倍、1.8倍、2.4倍、33.1倍、3.6倍、2.1倍,胃饥饿素降低2.5倍,其中胰岛素水平明显升高(P<0.01)。与HFD组相比,MET200组和E40组小鼠血清中血糖降低16.6%和24.6%、胰岛素降低83.0%和68.9%、瘦素降低25.7%和28.9%、胰高血糖素降低27.8%和54.5%、纤溶酶原激活物抑制剂-1水平降低24.3%和57.0%。与MET200组相比,E40组小鼠血清中抵抗素、胰高血糖素、纤溶酶原激活物抑制剂-1水平降低,见Fig 4。
2.5 丁香酚对T2DM小鼠肝组织病理学改变的影响HE染色结果显示,RD组小鼠肝细胞大小均一、排列整齐、无细胞坏死与脂肪变性;HFD组小鼠肝细胞明显肿胀、脂肪变性、胞质内可见脂滴空泡。

Fig 2 Effects of eugenol on liver index, lipid metabolism and liver function of mice

Fig 3 Effect of eugenol on OGTT in mice
与HFD组比较,MET200组和E40组小鼠细胞排列整齐,肝细胞脂肪变性及炎症浸润减轻,见Fig 5。
2.6 丁香酚对T2DM病小鼠肝组织中SHP/pFOXO1/pCREB/PEPCK/G6Pase信号通路相关蛋白表达的影响Western blot结果示,与RD组相比,HFD组小鼠肝组织中SHP蛋白表达下调(P<0.05),PEPCK、G6Pase蛋白表达明显上调(P<0.01)。与HFD组相比,MET200组和E40组SHP、pFOXO1、pCREB蛋白表达上调(P<0.05),PEPCK、G6Pase蛋白表达明显下调(P<0.01)。与MET200组相比,E40组小鼠肝组织中SHP、pFOXO1、pCREB蛋白表达上调,见Fig 6。
3 讨论
近年来,人们对T2DM的病因及发病机制有了深入的研究,有报道称β细胞功能障碍和胰岛素抵抗[6]、外周组织和靶器官对葡萄糖的利用障碍[7]、脂质代谢紊乱[8]、氧化应激、炎症反应[9]以及肠道菌群失调[10]等与T2DM的发生发展密切相关。因此,寻找和研究能够改善上述病因及发病机制的中草药已成为研究热点,其中,丁香酚以其所特有的抗炎、抗氧化作用而备受关注。有研究表明,丁香酚通过调节GLUT4/AMPK信号通路,增强胰岛素敏感性和外周组织和靶器官对葡萄糖的利用、抑制氧化应激与炎症反应进而延缓T2DM的发展进程[11]。另有实验研究指出,丁香酚通过调控肝功能标记酶和PEPCK、G6Pase等糖代谢关键酶活性,降低T2DM大鼠的体质量和肝糖原含量,提高血浆胰岛素水平,从而改善T2DM[12]。本研究结果提示,丁香酚在降低T2DM血糖水平及肝脏糖脂代谢紊乱方面具有一定的疗效作用。

Fig 4 Effect of eugenol on various indexes in mouse serum
1:RD; 2:HFD; 3:HFD+MET200; 4:HFD-E40.##P<0.01vsRD group;*P<0.05,**P<0.01vsHFD group

Fig 5 The histopathological changes of mouse liver (HE,100×)
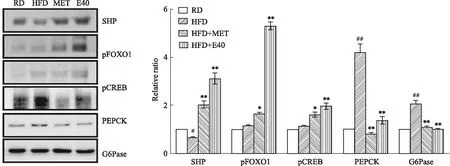
Fig 6 Effects of eugenol on expression of SHP, pFOXO1, pCREB, PEPCK and G6Pase in mouse liver
#P<0.05,##P<0.01vsRD group;*P<0.05,**P<0.01vsHFD group.
2002年,McGarry在美国糖尿病协会上提出了“糖尿病是糖脂病”, 这一概念的提出使人们对T2DM发病机制的认识逐渐从早期的胰素抵抗/血糖中心论逐渐转向脂质代谢紊乱为中心[13]。肝脏作为机体重要的能量代谢器官,其糖原合成和糖异生在糖脂代谢紊乱及胰岛素抵抗中起重要作用,因此,调控肝脏糖脂代谢可以改善T2DM[14]。本研究结果显示,与HFD组相比,MET200组和E40组小鼠体重降低,肝脏体积减小且呈现健康的暗红色。MET200组和E40组较HFD组肝指数、肝脏脂质代谢及肝功能指标降低。OGTT试验显示,MET200组和E40组较HFD组葡萄糖耐量增强,曲线下面积显著降低,胰岛β细胞功能正常。相较于HFD组,MET200组和E40组血清中血糖、胰岛素、甘油三酯、抵抗素、瘦素、胰高血糖素以及纤溶酶原激活物抑制剂-1水平降低。HE染色显示,HFD组肝细胞明显增大并伴有大泡性脂肪变性,MET200组和E40组明显改善肝细胞脂肪变性及肝脏病理状态。此外,与MET200组相比,E40组小鼠血清中血糖、抵抗素、胰高血糖素、纤溶酶原激活物抑制剂-1降低水平及肝细胞脂肪变性改善更加明显。上述研究结果显示,丁香酚可以降低小鼠体重及肝指数、调节肝脏糖脂代谢紊乱、改善肝功能和肝细胞脂肪变性、抑制胰岛素抵抗进而改善T2DM。
小异二聚体伴侣(small heterodimer partner, SHP)是核激素受体超家族的孤核成员,是一种关键的代谢传感器,其作为一种转录共抑制因子与多种核受体及转录因子相互作用形成调节网络,参与调节肝脏糖质代谢、胰岛素抵抗和β细胞功能障碍,与肥胖和T2DM切相关[15]。SHP的下游靶标叉形头转录因子1(forkhead transcription factor 1, FOXO1)和环磷腺苷反应元件结合蛋白B(cAMP-response element binding protein, CREB)分别在氧化应激和胰岛素抵抗、肝脏糖异生和脂质代谢中起关键作用[16]。在肝脏中,活化的SHP通过直接磷酸化其下游靶标FOXO1和CREB[17],进而调节磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)和葡萄糖-6-磷酸酶(glucose-6-phosphatase, G6Pase)等糖异生关键酶的蛋白表达[18]。与HFD组相比,MET200组和E40组小鼠肝组织中SHP、pFOXO1、pCREB蛋白表达上调,PEPCK、G6Pase蛋白表达明显下调。与MET200组相比,E40组小鼠肝组织中SHP、pFOXO1、pCREB蛋白表达明显增加。本研究结果显示,丁香酚能够明显活化SHP,激活其下游靶点FOXO1和CREB的磷酸化,抑制PEPCK、G6Pase的表达,从而调控肝脏糖脂代谢紊乱和抑制胰岛素抵抗,改善T2DM。
综上所述,丁香酚可能通过上调SHP的蛋白表达、FOXO1与CREB的磷酸化,下调PEPCK和G6Pase的蛋白表达来调控肝脏糖脂代谢和抑制胰岛素抵抗,降低血糖水平,进而为T2DM及肝脏糖脂代谢紊乱等代谢性疾病开辟新的潜在的治疗途径。