转录组学结合蛋白质组学筛选罗汉果皂苷V缓解OVA诱导哮喘小鼠的关键通路
2022-12-16刘以撒贾建钢
窦 童,王 娟,刘以撒,贾建钢,陈 旭
(桂林医学院药学院生药学重点实验室,广西 桂林 541100)
哮喘是一种复杂的肺部炎症性疾病,发病受到遗传因素和环境因素的双重影响[1]。在2015年,全球大约有3.58亿人患有哮喘,比1990年的1.83亿有了大幅度的增长[2]。哮喘的发病率从19世纪60年代开始显著增加[3],已经成为了全球范围公共卫生领域的重要问题。哮喘包括过敏性哮喘、非过敏性哮喘及内因性哮喘,其中过敏性哮喘最为常见[4]。哮喘患者肺部最主要的病理改变包括,肺组织炎症细胞浸润,如大量淋巴细胞和嗜酸性粒细胞浸润、杯状细胞黏液分泌过多,以及2型辅助性T细胞(type 2 helper T cell,Th2)型细胞因子,如白介素(interleukin,IL)-4、IL-5、和IL-13的过量表达[5]。Th2型细胞因子在过敏性哮喘中发挥了重要的作用,它能够促进免疫球蛋白E(immunoglobulin, IgE)以及大量炎症介质的生成,并诱导产生嗜酸性粒细胞性气道炎症[6]。虽然已经研发了各种有效的治疗方法,但过去十年中,过敏性哮喘的发病率及其并发症的发生率急剧增加,使其成为呼吸系统疾病最常见形式之一。
罗汉果[Siraitiagrosvenorii(Swingle) C. Jeffrey]是葫芦科一种多年生藤本植物的果实,是国家首批批准的药用、食用药材之一,其主要成分罗汉果皂苷V普遍具有镇咳、祛痰、平喘的作用[7],常用于治疗痰热咳嗽、咽喉疼痛。有研究表明,罗汉果皂苷V有止咳祛痰、润肺止咳的作用[8],这也是罗汉果被用于止咳糖浆、止咳片等药物的主要原因。中药普遍具有多成分、多靶点协同作用的特点,很难从整体到组织器官、细胞和分子水平进行全面系统的研究,导致药物作用靶点与机制不能明确[9]。而转录组和蛋白质组分别代表的是在mRNA水平和蛋白质水平的表达情况,通过转录组学和蛋白质组学研究能比较药物作用靶器官或组织前后基因、蛋白质表达的变化——从蛋白质数量、种类改变到基因数量、种类改变,而探知药物有效成分作用靶点,揭示药物与机体间的相互作用机制,便于对药物作用机制进行科学解释[10]。该技术为探究罗汉果润肺止咳作用机制提供了新方法,为罗汉果的深度研发提供实验室依据。
本研究旨在讨论罗汉果皂苷V改善卵清蛋白(ovalbumin, OVA)诱导的小鼠肺部炎症的作用机制,我们通过整合转录组学和蛋白质组学数据,揭示数据所反映的内涵和规律,进而揭示哮喘的实质和罗汉果皂苷V发挥“润肺止咳”功效的作用机制。
1 材料与方法
1.1 材料
1.1.1动物及药品 罗汉果皂苷V(货号PS0169-0500MG)购自成都普思生物科技股份有限公司,OVA(货号S25067-25 g)购自上海源叶生物科技有限公司,6周龄BALB/C 雌性小鼠24只(20 ± 2)g来自斯莱克景达实验动物有限公司(批号GLMC202005026)。动物被饲养在温度(20 ± 2)℃、湿度50%± 10%可控的环境中,并进行12/12 h的光/暗循环,饲料和水可自由供应。
1.1.2主要试剂 苏木精和1%伊红醇溶液染色试剂盒(货号G1120)购自北京索莱宝物科技有限公司;RNAzol(货号G1120)购自北京天根生化科技有限公司;文库质检试剂盒(货号5067-4626)购自美国Agilent Technologies公司;RNA Nano6000试剂盒(货号5067-1511)购自美国Agilent Technologies公司;NEBNext®UltraTMRNA Library Prep Kit for Illumina®(货号E7530)购自美国New England Biolabs公司;逆转录试剂盒(货号A276A、A2781、A277A)购自美国Promega公司;SYBR Green PCR Master Mix(货号GK10002)购自美国Glpbio公司;BCA蛋白浓度测定试剂盒(货号P0010)购自上海碧云天生物技术有限公司;尿素Urea(货号U6504-1KG)购自德国Sigma公司;皮尔斯定量比色肽测定试剂盒(货号23275)购自美国Thermofishe公司;ACN(货号LC015-1HC)购自美国Honeywell公司;氨水(货号32014-5)购自德国SIGMA公司;Trypsin酶(货号V5117)购自美国Promega公司;RIPA高效组织裂解液(货号R0010)购自北京索莱宝科技有限公司;NuPAGETM 10% Bis-Tris Protein Gels,1.0 mm, 12-well(货号NP0302BOX)购自美国Thermo Fisher公司;NuPAGE MOPS SDS Running Buffer (20X)(货号NP0001)购自美国Thermo Fisher公司;PI3K Rabbit mAb抗体(货号ab133595)购自美国Abcam公司;Akt Rabbit mAb抗体(货号ab179463)购自美国Abcam公司;p-PI3K Rabbit mAb(货号CST4228T)购自美国Cell Signaling Technology公司,p-Akt Rabbit mAb(货号WLP001a)购自沈阳万类生物科技有限公司;β-actin mous mAb抗体(货号TA-09)购自北京中杉金桥生物技术有限公司;山羊抗兔IgG(货号M21002S),山羊抗小鼠IgG(货号M21001XS)均购自上海Abmart生物医药有限公司。
1.1.3主要仪器 FastPrep-24 5G高通量组织破碎仪(美国MP Biomedicals公司);超声波细胞破碎仪(美国Thermo Fisher公司);Sorvall Biofuge Stratatos冷冻离心机(美国Thermo Fisher公司);Nanodrop 2000微量分光光度计(美国Thermo Fisher公司);Eppendorf concentrator Plus真空干燥设备(德国Eppendorf公司);SAVANT SPD1010真空离心浓缩仪(美国Thermo Fisher公司);2100生物分析仪(美国Agilent 公司);Novaseq 6000测序平台(美国Illumina公司);UltiMate 3000高效液相色谱仪(美国Thermo Fisher公司);EASY-nLC 1200液相色谱仪(美国Thermo Fisher公司);XBridge C18 column 4.6 mm×250 mm, 5 μm(美国Waters公司);Orbitrap Fusion Lumos质谱仪(美国Thermo Fisher公司);Nanodrop One核酸微量监测仪(美国Thermo Fisher公司);T100 Thermal Cycler PCR仪(美国Bio Rad公司);Infinite M200 Pro NanoQuant酶标仪(瑞士TECAN公司);7500 Fast快速实时荧光定量PCR系统(美国Thermo Fisher公司);电泳仪(美国Bio Rad公司);ChemiDoc XRS+化学发光成像系统(美国Bio Rad公司)
1.2 方法
1.2.1造模与给药 用OVA和Al(OH)3诱导小鼠过敏性哮喘模型[11]。将24只小鼠分为3组:空白组(K)、模型组(C)和罗汉果皂苷V(V)给药组,每组8只。模型组和罗汉果皂苷V给药组小鼠分别于d 0、7和14腹腔注射0.1 mL致敏溶液(0.2 mg OVA和1 mg AL (OH)3),空白组小鼠腹腔注射磷酸盐缓冲生理盐水(phosphate buffered saline, PBS)。模型组和罗汉果皂苷V给药组小鼠分别于d 21~27每天用402AI超声雾化器给予1% OVA喷雾,每组10 mL,每次40 min,空白组小鼠用PBS溶液喷雾,1% OVA喷药30 min前,以50 mg·kg-1罗汉果皂苷V给予罗汉果皂苷V给药组小鼠灌胃处理,空白组和模型组小鼠以PBS溶液灌胃处理。d 28~33给予给药组50 mg·kg-1罗汉果皂苷V灌胃处理,空白组和模型组同样以PBS灌胃处理。最后1次口服罗汉果皂苷V和PBS溶液24 h后处死小鼠。采集各组小鼠肺组织和血液。对小鼠肺组织进行组织形态学和病理学观察,以判定是否造模成功,药物干预是否有效。
1.2.2肺组织形态学及病理学 为了确定模型是否成功建立,对小鼠肺组织进形态学及病理学观察。肺组织在10%中性缓冲福尔马林溶液中固定48 h后,石蜡包埋,切片4 μm,供组织学检查。切片用苏木精和1%伊红醇溶液(hematoxylin-eosin staining,HE)染色。肺切片在显微镜下进行观察,拍照,评估肺部炎性细胞的浸润。
1.2.3转录组学分析 通过RNA测序(RNA-seq),从空白组、模型组和罗汉果皂苷V给药组每组分别选择3个肺组织样本进行转录组分析。使用TRIzol试剂盒提取总RNA,用无RNA的DNase I去除污染的DNA,在Agilent 2100生物分析仪上评估RNA质量,RNA的完整性由Bioanalyzer 2100系统上的RNA Nano6000检测试剂盒检测。使用NEBNext® UltraTMRNA Library Prep Kit for Illumina®,以RNA完整性数(RNA Integrity Number, RIN)值大于7的样本构建测序文库,然后将这些文库在Illumina Novaseq 6000测序平台上测序,原始的Illumina测序数据已经保存在NCBI短读存档(NCBI BioProjec: PRJNA777046)。
组与组之间的差异表达基因(differentially expressed genes, DEGs)筛选条件如下,对于每个转录区域,使用Stringtie(版本1.3.4)软件计算每千碱基转录每百万映射读取的片段(fragments per kilobase million, FPKM),以量化转录表达丰度和变化。以错误发现率(false discovery rate, FDR)值<0.05和|log2差异倍数(fold change, FC)|>1为表达差异显著的阈值筛选DEGs,通过聚类分析来探讨转录表达模式。
1.2.4蛋白质组学分析 给每组小鼠肺组织(每组3只作为生物学重复)样品分别加入裂解液(1% SDS、8 mol·L-1尿素、1 g·L-1蛋白酶抑制剂混合物),使用超声细胞破碎仪均质3 min,离心后收集上清。使用BCA蛋白测定试剂盒对上清中的总蛋白进行定量,加入序列级修饰胰蛋白酶溶液(蛋白/胰酶比1 ∶50),37 ℃,16 h将蛋白消化为肽段,并选用皮尔斯定量比色肽测定试剂盒对肽段进行定量。
肽段混合物用Ultimate 3000系统连接XBridge C18反向柱,进行脱盐。除盐冻干后的多肽在0.1%甲酸水溶液中重新溶解后,通过在线nanoospray LC-MS/MS对Orbitrap Fusion Lumos质谱仪耦合到EASY-nLC 1200系统进行分析,生成质谱检测原始数据(ProteomeXchange ID: PXD029664)。分析柱为Acclaim PepMap C18, 75 μm×15 cm;以120 min梯度分离:5% B至35% B(B: 0.1%甲酸ACN溶液);柱流量维持在200 nL·min-1,电喷雾电压为2 kV。
使用Spectronaut X对DIA的原始数据进行处理和分析。归一化处理蛋白质组学数据,数据在肽水平和蛋白水平上进行log2转化和分析,观察到的倍变率的统计学意义通过单样本t检验来确定。差异表达蛋白(differentially expressed protein, DEPs)的选取以|log2FC|>1.5进行,差异有统计学意义(P<0.05)。
1.2.5差异基因和差异蛋白的趋势分析及通路富集分析 对空白、模型及给药3组样本的基因表达上下调模式进行聚类,聚类结果可得到多种符合一定生物学特性(如KC相比上调CV相比下调)的基因集。通过ShortTime-series Expression Miner[12]软件,输入所有差异基因的表达量(按生物学逻辑将样品顺序排好)的文件,然后选择参数(genome: -pro 20 -ratio 1.000 0 [log2(2)=1, log2(1.5)=0.584 962 5, log2(1.2)=0.263 034 4]; proteome: -pro 20 -ratio 0.585 0 [log2(2)=1, log2(1.5) =0.584 962 5, log2(1.2)=0.263 034 4])进行趋势分析。然后对各个趋势中的基因进行KEGG功能富集分析,并通过假设检验计算得到Pvalue。得到的Pvalue通过FDR校正之后,以Qvalue ≤ 0.05为阈值,满足此条件的Pathway定义为在该趋势中明显富集的Pathway。
1.2.6实时荧光定量聚合酶链式反应(qRT-PCR) 使用RNAzol从各小鼠肺组织中提取总RNA,用NanoDrop One/OneC核酸微量监测仪分析其浓度,用逆转录试剂盒将总RNA的3 μg反转录为互补cDNA,用SYBR Green PCR Master Mix和基因特异性引物(不同引物退火温度见 Tab 1)对其进行q-PCR扩增。q-PCR采用Applied Biosystems 7500 Fast Real-Time PCR系统。q-PCR完成后,通过ABI 7500 fast v2.0.1软件获得Ct值。采用2-△△Ct法表征mRNA的相对表达水平。

Tab 1 Primers involved in Real-Time PCR
1.2.7蛋白质免疫印迹(Western blot) 使用RIPA高效组织裂解液对小鼠肺组织样本进行提取。蛋白质通过聚丙烯酰胺凝胶电泳分离,并转移到硝酸纤维素膜上。用5%脱脂牛奶进行封闭,然后与目的蛋白对应的一抗在4 ℃下孵育过夜。然后将膜与相应的二抗在室温下孵育1 h。膜用增强化学发光检测试剂处理后显影,发光,使用Image Lab软件进行蛋白密度测定。

2 结果
2.1 罗汉果皂苷V对OVA诱导的哮喘模型小鼠肺部的影响肺组织形态学观察(Fig 1A)显示,与空白组相比,模型组表现出明显的充血和肺容积增加,但给药组的这些情况较模型组明显改善。肺组织病理学观察(Fig 1B)表明,与空白组比较,模型组肺泡间质增宽,有大量炎性细胞浸润,有明显的肺纤维化,与模型组比较,给药组炎性细胞浸润明显减少,肺泡间质变薄,表明我们造模成功,且罗汉果皂苷V能够改善OVA诱导的小鼠肺部炎症反应。

Fig 1 Lung histopathological observation and pathological observation
2.2 罗汉果皂苷V对OVA诱导的哮喘模型小鼠转录水平上的影响我们的转录组分析结果显示,在空白、模型和给药组小鼠中,分别平均有6 885、7 062和6 882万个高质量的clean reads。在所有的clean reads中,每组分别有2 020 810.67(空白组)、2 528 500.67(模型组)和2 154 898个mapped reads(给药组)平均以97.06%的映射比率映射到小鼠基因组。这些结果表明,我们的RNA-seq数据有足够的深度来检测大多数表达基因和转录本,用于后续的定量分析。计算每两个样品之间的皮尔斯(pearson)相关系数,以热图(Fig 2A)形式展示任意两个样品之间的相关性。RNA-seq检测后,实验分析阈值为log2(Fold Change)≥ 0.58,且Pvalue<0.05的条件下共筛选出1 122个差异表达基因,分析其趋势发现,在空白与模型组比较上调且模型与给药组比较下调的基因有454(profile 5)个,反之,有111个(profile 2)(Fig 2B),对所有的趋势进行KEGG分析,排在前十的通路如图所示(Fig 2C)。
2.3 罗汉果皂苷V对OVA诱导的哮喘模型小鼠蛋白水平上的影响我们的蛋白质组分析结果显示,共鉴定出86 399个肽段,67 914个独特肽段,最终鉴定出12 367个蛋白,所有蛋白定量热图如下所示(Fig 3A)。根据蛋白定量的结果,以| log2FC | > 1.5,校正P值得到的Qvalue < 0.05的条件筛选得到了497个差异表达蛋白,对其趋势分析发现,在空白与模型组比较上调且模型与给药组比较下调的基因有238个(profile 5),反之,有91个(profile 2)(Fig 3B),对所有的趋势进行KEGG分析,排在前十的通路如图所示(Fig 3C)。
2.4 罗汉果皂苷V通过调节PI3K/Akt信号通路改善OVA诱导肺部炎症的验证比较转录组和蛋白质组趋势分析的KEGG结果发现,这些关键信号通路聚焦到吞噬体(phagosome)、EB病毒感染(Epstein-Barr virus infection)、肺结核(tuberculosis)以及内磷脂酰肌醇3-激酶/丝氨酸激酶信号通路(phosphatidylinositide 3-OH kinases/Akt singaling pathway, PI3K/Akt singaling pathway)4类信号通路。对转录组与蛋质白组的KEGG结果进行比较分析发现他们的通路上都共同富集到以下差异表达基因——Ighg1,Igha,Ighm,Ighv2-5(Tab 2),且这4个基因位于趋势图的模块5中,即为给药后下调造模所致上调的基因,基于此并联合通路上的关键因子PI3K,Akt进行分子水平上的验证。qRT-PCR结果表明,与空白组相比,模型组Igha、Igh1、p85、Akt水平明显上升,与模型组相比,给药组其水平明显降低(Fig 4A),表明罗汉果皂苷V确实通过调节通路上关键因子调节小鼠哮喘,且提示罗汉果皂苷V可能通过抑制PI3K/Akt通路缓解小鼠哮喘。Western blot结果显示,与空白组相比,模型组p-PI3K和p-Akt水平明显上升,给药后其水平明显降低(Fig 4B),进一步从蛋白水平上验证罗汉果皂苷V通过抑制PI3K/Akt通路的激活改善OVA诱导的小鼠哮喘。

Fig 2 Effects of mogroside V on transcriptional level in OVA-induced asthmatic mice

Tab 2 Comparative analysis of differentially expressed genes/proteins in PI3K/Akt pathway based on transcriptome and proteome
3 讨论
转录组学、蛋白质组学和代谢组学相结合的方法在研究中药治疗作用机制方面变得越来越重要,这很可能会改变我们研究复杂疾病发展的方式,也可能会成为中药药理学与药效学研究的重要方法。罗汉果是我国著名的治疗咳嗽、咽喉痛、哮喘、胃炎和便秘的传统中药[13]。然而,其活性成分罗汉果皂苷V在OVA诱导的肺部炎症中的作用及内在机制研究少之又少,因此,本研究采用药效学和转录组学、蛋白质组学数据联合分析相结合的方法,探索罗汉果皂苷V改善OVA诱导的小鼠肺部炎症的作用机制。
我们首选建立了OVA诱导的哮喘小鼠模型,并进一步用罗汉果皂苷V干预哮喘模型小鼠并观察其肺部炎症的改善情况。在我们的实验中,HE染色发现OVA诱发的小鼠哮喘模型肺组织发生了明显的病理学变化,肺组织有渗出及出血,部分肺组织实变,而罗汉果皂苷V的干预可以明显减轻这种症状。PI3K/Akt信号通路在多种癌症中发挥促癌作用[14],在多种慢性疾病中发挥促炎作用[15]。研究显示,miR-4485通过PI3K/Akt/mTOR途径改善了H1N1诱发的肺部损伤[16],另外Psg-1的缺乏会导致PI3K/Akt信号通路激活诱发小鼠肺炎[17]。我们两组学联合分析的结果提示,OVA诱发的肺部炎症与PI3K/Akt通路有关,通过mRNA及蛋白水平验证PI3K/Akt通路的活化确实参与了OVA诱发的肺部炎症。有研究表明,欧前胡素通过PI3K/Akt信号通路对OVA的哮喘小鼠气道重塑起到抑制作用,PI3K/Akt的酶活性在OVA诱导的小鼠哮喘模型中明显增加,在PI3K缺失的小鼠哮喘气道重塑模型中发现气道重塑明显减少[18],此外,麦门冬汤抑制PI3K/Akt/mTOR信号通路,增强肺组织细胞自噬活性,对小鼠间质性肺炎和肺水清除有改善作用,这些研究都提示,PI3K/Akt信号通路可能是诱发肺部炎症的重要途径,抑制其激活可以缓解肺部炎症的发生。多组学联合分析发现OVA导致的PI3K/Akt通路活性的活化确实能被罗汉果皂苷V所抑制。本实验结果表明,PI3K/Akt信号通路的确参与了OVA导致的小鼠肺部炎症反应,同时与罗汉果的“润肺”作用有一定的关系。
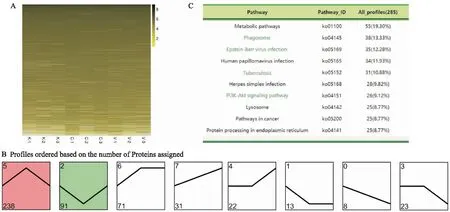
Fig 3 Effects of mogroside V on protein levels in OVA-induced asthmatic mice

Fig 4 Expression levels of Igha, Ighg1, PI3K and Akt by qRT-PCR and Western
本研究仅在动物水平、组学水平及分子水平进行初步和系统的探索,PI3K/Akt通路下游mTOR涉及免疫细胞炎症相关因子的表达,其产生的免疫调控及免疫抑制作用与炎症的关系,及其更详细的机制尚需深入研究。
