木犀草素治疗阿尔茨海默病的作用机制研究进展
2022-12-16孙会艳周立燕任丽雪王洪权
孙会艳,周立燕,任丽雪,李 强,王洪权
(1. 赤峰学院医学部,2. 内蒙古人类遗传病研究重点实验室,内蒙古 赤峰 024000;3.内蒙古民族大学神经内科,内蒙古 通辽 028000;4.赤峰学院附属医院神经内科,内蒙古 赤峰 024005;5.航天中心医院、北京大学航天临床医学院神经内科,北京 100049)
阿尔茨海默病(Alzheimer’s disease, AD)是最常见的一种神经变性病,表现为记忆、认知、语言和行为障碍以及人格改变等[1]。AD的典型病理特征为由β-淀粉样蛋白(β-amyloid, Aβ)细胞外沉积形成的老年斑(senile plaques,SPs)和细胞内由tau蛋白过度磷酸化引起的神经原纤维缠结(neurofibrillary tangles,NFTs)[2]。神经炎症和脑葡萄糖代谢异常参与AD发病机制,使其成为治疗AD的潜在靶标。近年研究表明,黄酮(flavone)类化合物木犀草素(luteolin)表现出抗AD作用,其通过抗炎、调控葡萄糖代谢等多种机制在多靶点抑制AD发生,引起研究者关注。但目前关于木犀草素抗AD的综述尚缺乏,因此,本文目的在于总结综述近年来木犀草素抗AD的药理作用及其机制。
1 木犀草素的结构、理化特性及药代动力学特征
木犀草素即3′,4′,5,7-四羟基黄酮,是一种重要的黄酮类化合物,天然存在于多种植物中,尤其在黄木犀草(reseda luteola)中含量丰富[3]。因最初是从木犀草科(resedaceae)木犀草属草本植物木犀草(resedaodorata L.)的叶、茎、枝中分离出而得名。膳食木犀草素存在于常见的植物性食物中,如芹菜、花椰菜、青椒、欧芹、百里香、胡萝卜、橄榄油、薄荷、迷迭香、脐橙和牛至等。木犀草素也存在于传统医药的药用植物之中。木犀草素具有C6-C3-C6结构,包含2个苯环和1个带有C2-C3碳双键的含氧环结构。木犀草素的5、7、3′和4′碳位上的羟基部分以及2,3位双键的存在是木犀草素具有多种药理作用的原因。木犀草素分子结构见Fig 1所示。
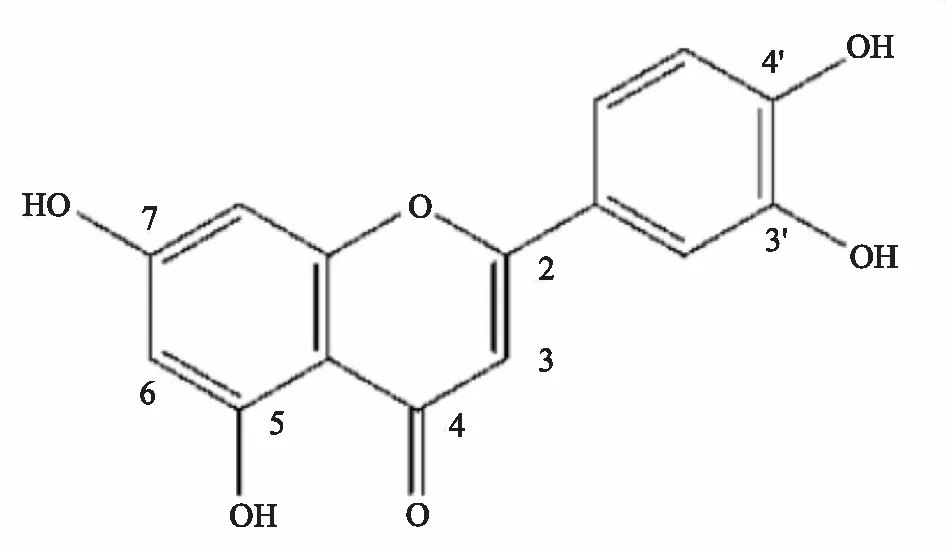
Fig 1 Structure of luteolin
木犀草素以苷元(aglycone)或糖苷(glycosides)的形式存在。木犀草素苷元(luteolin aglycone, LA)具有亲脂性,被肠细胞吸收。木犀草素糖苷(luteolin glycosides,LG)在肠道中通过刷状缘肠膜中的乳糖酶根皮苷水解酶(lactase phlorizin hydrolase)水解糖苷类转化为LA。木犀草素单葡萄糖醛酸盐通过钠依赖性葡萄糖转运蛋白-1,被β-葡萄糖苷酶水解为LA[4]。LG也被某些肠道微生物群水解成LA,因此,木犀草素的生物利用度因肠道微生物群的分布而不同。大多数LG会转变为LA,但一些木犀草素单葡萄糖醛酸苷会被肠道吸收,并可在血液中检测到。木犀草素口服后,很容易在血液中检测到木犀草素。单次给药(50 mg·kg-1体质量)后,其在血液中的浓度在10 min时达到最高水平,从0到最大曲线下面积为0.87(h×mg·L-1)。木犀草素的生物利用度约为4.1%~26%[5-6]。木犀草素可以透过血脑屏障(BBB),外周注射木犀草素后,在血液和脑组织中检测到游离木犀草素[7]。
2 木犀草素在AD中的神经保护作用机制
2.1 抑制Aβ产生和聚集木犀草素具有抑制Aβ生成的作用。木犀草素可减少与家族性β-淀粉样前体蛋白(APP)突变诱导的Aβ产生,以及创伤性脑损导致的Aβ产生增加[7-8]。木犀草素(20 μmol·L-1)可显著降低转染人瑞典突变型APP的小鼠N2a细胞系中Aβ的生成,同时显著降低瑞典突变型APP转基因(Tg2576)小鼠原代神经元中Aβ的生成[8]。 腹腔注射木犀草素(20 mg·kg-1)可能通过抑制糖原合成酶激酶3α(GSK-3α)激活,进而减少Tg2576模型小鼠脑内Aβ的聚集[8]。木犀草素能够降低Aβ诱导的AD大鼠APP和BACE1表达增加,从而减少Aβ1-42产生[9]。 木犀草素同时具有抑制Aβ聚集的作用。硫黄素T(Th-T)是一种与淀粉样纤维特异性结合而荧光显著增强的染料,在发射波长482 nm处,用ThT的方法检测荧光强度,该荧光强度的强弱反映了Aβ的聚集程度,荧光越强,聚集越明显。2008年,Akaishi等[10]通过实验证明,100 μmol·L-1木犀草素与Aβ共孵育,能够将Th-T荧光强度降低到非常低的值。进一步研究显示,木犀草素(40 μmol·L-1)能够抑制Aβ1-42纤维化程度,而透射电镜研究显示,木犀草素能够促进纤维状Aβ的降解[11]。最近研究显示,作为玫瑰葱(Allium roseum)提取物主要组分的LG能够抑制Aβ1-42聚集,并干扰纤维状Aβ的形成[12]。
2.2 抑制tau蛋白过度磷酸化AD中tau蛋白异常磷酸化形成NFTs并在神经元内聚积,tau蛋白异常在AD患者神经变性和学习记忆障碍的发生发展中起重要作用[13]。因此,抑制tau蛋白的过度磷酸化成为治疗AD的手段之一。在高浓度锌处理的SH-SY5Y细胞中的研究发现,高浓度锌可促进诱导tau蛋白在Ser262/356位点异常磷酸化,而木犀草素能够降低锌诱导的tau过度磷酸化[14]。而在Tg2576小鼠中,创伤性脑损伤能够促进Aβ沉积、糖原合成酶-3(GSK-3)激活、磷酸化tau和促炎细胞因子显著增加,而木犀草素治疗可以显著消除这些病理变化[7]。木犀草素口服(10~20 mg·kg-1)能够通过抑制GSK-3β磷酸化从而明显增加胰岛素敏感性,进而降低tau蛋白磷酸化和Aβ沉积[7]。综上所述,木犀草素具有抑制tau蛋白过度磷酸化的功能。
2.3 调控葡萄糖代谢脑胰岛素抵抗降低了大脑葡萄糖利用率,导致脑胰岛素信号紊乱,降低脑内葡萄糖转运体功能,促进Aβ沉积,导致tau过度磷酸化和NFT形成[15]。cAMP反应元件结合蛋白(CREB)是一种可促进大脑中胰岛素受体底物-2(IRS2)基因的表达的转录因子,参与增强胰岛素信号通路,CREB磷酸化增加IRS2表达,从而促进胰岛素/胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)信号传导。研究显示,木犀草素具有刺激大脑胰岛素/IGF-1信号通路和CREB磷酸化的作用,从而增强突触可塑性,抑制β-分泌酶和γ-分泌酶活性,进而减少Aβ的产生[16-18]。
2.4 抑制神经炎症肥大细胞(mast cells)、小胶质细胞和星形胶质细胞是脑内3种主要参与神经炎症的细胞,在AD发病进程中发挥重要作用,参与AD发病机制和病理进程[19]。 神经炎症可导致AD病理发生,而后者又会导致神经炎症发生,从而形成恶性循环。抑制神经炎症发生成为治疗AD的靶点之一。
高脂饮食和肥胖导致的慢性炎症与人类和动物AD的病理变化相似。木犀草素在高脂饮食或衰老诱导的认知缺陷动物模型中具有抗遗忘作用,这种抗遗忘作用与其具有抗炎的药理学作用相关[6,20]。膳食木犀草素(10 mg·kg-1)可显著改善高脂肪饮食小鼠的认知能力,木犀草素抑制高脂肪饮食导致的海马和皮质中炎症分子肿瘤坏死因子-α(TNF-α)、白细胞介素6(IL-6)和NF-κB的表达水平的增加[20]。膳食木犀草素(0.6%)通过减少海马炎症改善了老年小鼠(22~24个月)的空间工作记忆[6]。木犀草素喂食可将老年小鼠的白细胞介素-1β (IL-1β) mRNA水平降低到与年轻小鼠(3~6月龄)相似的水平[6]。此外,膳食木犀草素(0.6%)降低了衰老小鼠(22~24月龄)大脑中因衰老诱导的小胶质细胞激活[21]。木犀草素(10和20 mg·kg-1)给药也改善了通过侧脑室注射链脲佐菌素(3 mg·kg-1)诱导的AD大鼠的空间学习和记忆障碍[22]。这些研究表明,膳食木犀草素可以有效改善认知功能,这种作用主要与其抑制小胶质细胞活化和炎症有关。
Aβ聚集激活小胶质细胞,促进炎症发生和促炎症介质的释放。木犀草素对纤维状Aβ(fAβ)诱导炎症的影响已经通过体外BBB模型进行了研究验证,显示在fAβ处理的人脑微血管内皮细胞和人星形胶质细胞,fAβ促进炎症发生、破坏BBB,木犀草素(3~30 μmol·L-1)能够抑制炎症反应来保护BBB功能的完整性[23]。木犀草素可有效降低由fAβ诱导的炎症介质和细胞因子(如COX-2、IL-1β和IL-6)的释放[23],机制研究显示,木犀草素的抗炎作用是因为其抑制p38丝裂原活化蛋白激酶(p38MAPK)和NF-κB的激活[23]。综上,木犀草素能够通过抑制炎症发生进而减轻Aβ诱导的损伤,对AD具有潜在的治疗作用。
NF-κB介导的炎症级联反应可促进BACE1的转录和激活,Aβ生成增加,而Aβ反过来促进BACE1表达和激活,进而形成恶性循环促进AD发生。最近研究显示,长期服用木犀草素可降低大鼠体内NF-κB和BACE1的表达,进而抑制Aβ沉积[24]。Zheng等[9]证实木犀草素调节多种炎症介质,在AD大鼠模型中,木犀草素下调诱导型一氧化氮合酶(iNOS)、TNF-α、IL-6、环氧合酶-2(COX-2)和IL-1β促炎细胞因子,而上调抗炎细胞因子IL-10,同时也证实了木犀草素下调NF-κB和BACE1的表达[25]。最近研究显示,在Aβ诱导的大鼠AD模型中,木犀草素能够降低大鼠海马和皮层神经元内pJNK、p38MAPK的激活,以及GFAP和Iba-1的表达增加,同时降低脑内p-NF-κB p65水平,抑制TNF-α和IL-1β生成,进一步证实了木犀草素具有抗炎作用。木犀草素(20~40 mg·kg-1)腹腔注射治疗3周,能够改善3×Tg-AD小鼠空间学习能力和记忆缺陷,抑制星形胶质细胞过度激活和神经炎症(即降低TNF-α、IL-1β、IL-6、NO、COX-2和iNOS蛋白),并降低内质网应激(ERS)标记物GRP78和GRP78的表达,这表明木犀草素能够通过抑制ERS依赖的神经炎症发生,对AD具有治疗作用[26]。
2.5 抗氧化和抗凋亡作用木犀草素的神经保护作用与其抗氧化作用有关。在链脲佐菌素诱导的糖尿病模型中,木犀草素改善认知功能与其抗氧化作用有关[27]。在链脲佐菌素诱导的糖尿病中发现神经元损伤和认知功能障碍,而木犀草素(50和100 mg·kg-1,持续8周)可以减少神经元损伤并改善认知功能,木犀草素的这种作用与其增强抗氧化活性的能力有关[27]。
木犀草素在AD中具有抗氧化作用。在Aβ诱导的大鼠AD模型中,木犀草素能够改善Aβ诱导的学习记忆障碍, 增加海马组织中胆碱乙酰基转移酶(ChAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px),逆转乙酰胆碱酯酶(AchE)活性的增加,同时海马匀浆中乙酰胆碱(ACh)含量增加,丙二醛(MDA)含量减少,并能提高Bcl-2/Bax比值,这表明木犀草素通过调节胆碱能系统和抑制Aβ诱导的认知功能障碍和氧化损伤[18]。在高浓度葡萄糖联合Aβ1-42(GLU+Aβ1-42)处理的原代培养大鼠海马神经元中,GLU+Aβ1-42处理显著降低细胞凋亡、活性氧形成增加,SOD、过氧化氢酶、GSH-Px和谷胱甘肽还原酶(glutathione reductase,GR)活性降低,晚期糖基化终产物(advanced glycation end products)和4-羟基壬烯醛加合物(4-HNE)生成增加、3-硝基酪氨酸和炎症产物(如iNOS、IL-1β和TNF-α)增加,线粒体膜电位降低,并促进Aβ聚集, 而木犀草素处理后可逆转上述改变,表明木犀草素在AD中具有抗氧化药理学作用,以减少氧化应激损伤和神经炎症[28]。
木犀草素在AD中同时具有抗凋亡作用。在Aβ诱导AD大鼠模型中,木犀草素能够降低脑内Bax和Caspase-3,上调Bcl-2表达,表明木犀草素在体内具有抑制Aβ诱导的神经元凋亡作用[9]。木犀草素能够抑制Aβ25-35诱导的PC12细胞中Bcl-2/Bax降低和Caspase-3增加,同时激活ERK1/2,进而抑制PC12细胞凋亡发生[29]。在铜处理的稳定过度表达瑞典突变APP的SH-SY5Y细胞(APPsw-SH-SY5Y)中,木犀草素增强细胞活力、减少细胞内ROS的生成、增强SOD活性,逆转线粒体膜电位的降低、抑制Caspase-3相关凋亡。此外,它还下调APP表达,降低Aβ1-42的生成和分泌。综上所述,木犀草素通过降低APP表达、降低Aβ分泌、调节氧化还原失衡、保护线粒体功能和抑制Caspase家族相关凋亡等机制在AD中发挥神经保护作用[30]。
3 结语
综上所述,木犀草素具有多靶点抗AD作用,通过抑制Aβ产生和聚集、抑制tau蛋白过度磷酸化、调控葡萄糖代谢、抑制神经炎症以及抗氧化和抗凋亡(Fig 2)。木犀草素具有抗癌、抗菌、抗炎、祛痰、解痉、抗过敏和免疫增强等作用。木犀草素的天然提取物已用于临床止咳、祛痰、消炎,有较好的疗效。然而,目前木犀草素针对AD的药物临床试验研究尚缺乏,目前尚缺乏对AD病人的干预研究,这严重阻碍了木犀草素作为治疗或预防AD的干预手段的临床进一步应用,值得进一步探索。目前临床研究注册网站(clinicaltrials.gov)有5项关于木犀草素的临床注册研究,分别是对舌鳞状细胞癌、代谢综合征、额颞叶痴呆、自闭症和健康受试者(对记忆的改善作用)的研究。而中国临床试验注册中心(https://www.chictr.org.cn/index.aspx)目前还没有关于木犀草素的临床注册研究。未来针对抗AD的药物临床试验研究尚缺乏,值得期待。

Fig 2 Schematic representation of luteolin-mediated neuroprotection in AD