锦菊素对银屑病模型小鼠的药效学作用及其机制探究
2022-12-16杨婧雯王钰凯张梦莹王广基许正新
张 悦,陆 奕,杨婧雯,王钰凯,张梦莹,周 芳,王广基,许正新,3
(1.扬州大学医学院药理学教研室,江苏 扬州 225000;2.中国药科大学,江苏省药物代谢动力学重点实验室,中国医学科学院“中药复杂组分PK-PD结合研究”创新单元,江苏 南京 210009;3.江苏省非编码RNA基础与临床转化重点实验室,江苏 扬州 225000)
银屑病是一种慢性自身免疫性疾病,目前其发病机制尚未完全阐明,其中遗传因素和环境因素在该病的发生发展中起到关键作用[1]。银屑病也会诱发多种并发症,如银屑病关节炎、2型糖尿病、血脂异常及其他心血管疾病[2]。多数研究认为易感人群表皮中的角质形成细胞受到创伤、感染、药物或UV等刺激后会释放炎症信号激活树突状细胞,而被树突状细胞活化的Th17细胞会进一步释放IL-17A、IL-17F和IL-22等细胞因子,后者可作用于角质形成细胞,诱导表皮快速增生[1]。对于银屑病的上述病理生理变化,目前临床上常用JAK激酶抑制剂和针对IL-17、IL-23和TNF-α等炎症因子的单抗药物进行治疗,但这些疗法治标不治本,停药后极易复发[3]。因此,寻找治疗银屑病的潜在有效药物成为该领域研究的热点之一。
旋覆花属菊科植物约有100多种,主要分布在欧洲、非洲和亚洲等地区[4]。在中国传统医学中常用于止咳、平喘、消痰[5]。旋覆花中存在含量丰富的倍半萜类、黄酮类及甾体类化合物,具有抗肿瘤、抗炎、抗氧化等多种生物活性[4]。锦菊素是源自旋覆花的一种天然化合物,结构上属于倍半萜内酯类。体外研究表明,锦菊素能够调节NF-κB信号通路从而抑制免疫细胞黏附在内皮细胞上[6]。然而,有关该化合物对自身免疫性疾病是否有效或者其效应怎样尚未可知。本研究旨在阐明锦菊素对咪喹莫特诱导的银屑病模型小鼠的症状、体征的影响及其相关的作用机制,从而为临床治疗银屑病提供新的候选药物。
1 材料与方法
1.1 动物与细胞C57BL/6小鼠,8~10周龄,雌性,体质量(18~20)g,购自浙江维通利华实验动物技术有限公司,生产许可证号:SCXK(浙)2019-0001。饲养条件:温度20~25 ℃、环境相对湿度45%~65%,12 h明暗交替。所开展的实验均经扬州大学动物实验伦理审查委员会批准。实验依据动物实验相关指南和法规进行,伦理批准号:YXYLL-2021-147。HaCaT细胞来自中国药科大学单云龙实验室的馈赠。含双抗和10%的胎牛血清的MEM培养基置于37 ℃,CO2体积分数为5%的培养箱中常规培养。
1.2 药物与试剂锦菊素,纯度≥98%(来自中国药科大学单云龙实验室的馈赠);咪喹莫特乳膏(5%)(Aldara,iNova Pharmaceuticals公司);TRIzol(TaKaRa公司);CCK-8试剂盒(碧云天公司,C0037);p-P65抗体(3033)、P65抗体(8242)、Ki67抗体(9449)、Actin抗体(3700)和HRP偶联二抗(7074和7076)均购自Cell Signaling Technology公司;荧光二抗Alexa Fluor 488(Thermo Fisher Scientific公司,R37114);CBA试剂盒(BD公司,552364和560283);C18色谱分离柱(Phenomenex公司);胎牛血清(Gibco公司,10091-148);不完全MEM培养基(凯基生物,KGM41500-500);青霉素-链霉素(碧云天,C0222);小鼠FoxP3流式抗体(Thermo Fisher Scientific公司,15-5773-80);小鼠IL-17A流式抗体(BD公司,560184);FcX封闭抗体(101319)、流式细胞死活染料(423102)、小鼠CD4流式抗体(100547)和小鼠CD25流式抗体(102008)均购自Biolegend公司;GTVisionTMIII抗鼠/兔通用型免疫组化检测试剂盒(GeneTech公司,GK500705);丙酮(南京试剂)。
1.3 仪器Eppendorf 5810R 型高速离心机(Hamburge,德国);Sorvall Biofuge Stratos低温高速离心机(德国);Olympus FV 3000激光共聚焦显微镜(日本);BioTek Lionheart FX全自动显微镜(美国);超高效液相色谱系统(日本岛津);API 4000三重四极杆质谱联用(美国);CytoFLEX S多色流式细胞仪(美国)。
1.4 动物处理20只C57BL/6小鼠随机分为如下组(每组5只):空白对照组、模型对照组、实验组锦菊素低剂量组(16.45 μmol·kg-1)、高剂量组(65.80 μmol·kg-1)。造模前1 d在小鼠背部剃毛,面积约2 cm×3 cm,观察小鼠背部脱毛情况。造模当天,除空白对照组外的小鼠均于背部涂抹约62.5 mg咪喹莫特乳膏(5%),连续造模5 d。自造模d 1起开始给药(将溶解有不同剂量锦菊素的丙酮溶液分别均匀滴至对应组小鼠裸露的皮肤上,待溶剂挥干),模型对照组则给与等体积的溶剂(丙酮溶液),连续给药5 d。于d 5小鼠眼球取血,同时取皮损处皮肤样本测量皮肤厚度,肝、脾称质量,将部分皮肤保存于4%多聚甲醛溶液,剩余皮肤保存于-80 ℃ 冰箱。
1.5 皮损面积和严重程度评分每天同一时段使用数码相机给小鼠背部拍照,采用PASI评分法以红斑、鳞屑、皮肤厚度3个指标对小鼠皮损严重程度进行评分。PASI评分标准:0~4分,按严重程度分为无、轻度、中度、重度、极重度,总分为3个指标分数之和(0~12分)。
1.6 小鼠皮损组织病理学改变取下小鼠背部皮损组织放入4%多聚甲醛溶液中固定,石蜡包埋,切片,苏木精-伊红染色。显微镜下观察小鼠皮损组织病理学改变并拍照。使用ImageJ统计表皮厚度。
1.7 免疫组织化学法检测小鼠皮损组织中Ki67的表达石蜡包埋,切片,脱蜡水化,加入抗原修复液冷修复,PBS清洗,室温封闭,滴加一抗Anti-Ki67于4 °C孵育过夜,隔日滴加二抗孵育,DAB显色与苏木素复染,封片。显微镜下观察Ki67的阳性细胞数量,并使用ImageJ计算阳性表达率。
1.8 HaCaT细胞的CCK-8检测将锦菊素溶解于DMSO得到母液。取对数生长期的HaCaT细胞,胰酶消化后计数。调整细胞密度为5×106个·L-1,每孔100 μL接种于96孔板。每组设置5个复孔,边缘孔用PBS填充,种板完成后置于培养箱培养。用完全培养基将锦菊素母液分别配制成浓度为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0 mmol·L-1的锦菊素工作液;待细胞贴壁后,加入相应浓度的稀释液,终浓度为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5 mmol·L-1;继续放入培养箱培养24 h。24 h后取出吸弃原培养基,每孔加入100 μL含CCK-8的培养基。37 ℃,300 r·min-1离心30 min,酶联免疫检测仪在450 nm波长处测定各孔光吸收值(OD)。并选择对细胞活力无影响的锦菊素剂量进行后续实验。每个实验进行3次生物学重复。
1.9 PCR检测炎症基因表达采用实时荧光定量PCR法检测炎症基因表达,引物由生工生物公司合成。将皮肤组织置于玻璃匀浆器中研碎,随后加入TRIzol提取总RNA,按试剂盒说明书逆转录后进行PCR扩增得到cDNA。各炎症因子基因检测引物设计如下:IL-1β:F:CTTCAGGCAGGCAGTATCACTC,R:TGCAGTTGTCTAATGGGAACGT。IL-6:F:ACAAC CACGGCCTTCCCTAC,R:TCTCATTTCCACGATTTCC CA。IL-17A:F:CTGGAGGATAACACTGTGAGAGT,R:TGCTGAATGGCGACGGAGTTC。S100a8:F:AAA TCACCATGCCCTCTACAAG,R:CCCACTTTTATCAC CATCGCAA。S100a9:F:ATACTCTAGGAAGGAAGG ACACC,R:TCCATGATGTCATTTATGAGGGC。用2-ΔΔCT法计算基因的相对表达量。
1.10 Western blot检测将细胞裂解后进行定量和变性。经SDS-PAGE凝胶电泳后转至PVDF膜,加入5%脱脂牛奶室温封闭2 h,加入相对应一抗4 ℃孵育过夜,洗去未结合一抗,加入偶联辣根过氧化物酶的相应种属的二抗,室温摇床上孵育2 h。结束后取出条带,加入化学发光显色液,曝光显影。
1.11 流式细胞术取小鼠淋巴结进行研磨。重悬取单细胞悬液加入流式细胞死活染料,冰上孵育15 min,洗去染料后加入FcX封闭抗体封闭15 min;再加入膜表面流式抗体冰上孵育30 min;将细胞打孔后,加入预混完的胞内流式抗体孵育液,冰上孵育30 min;弃去抗体,洗2次后上机检测。
1.12 细胞因子微球检测技术将冻干的细胞因子标准品转移至离心管,用2 mL检测稀释液稀释成最高浓度标准品,室温平衡15 min。按照每样品管10 μL的量分别取300 μL捕获微球,将所有微球混合于一只流式管中,涡旋混匀。取10只流式管,在除最高浓度标准品管外的9只管中先加入300 μL检测稀释液,再从最高浓度的管中取300 μL,依次按照1 ∶2、1 ∶4、1 ∶8、1 ∶16、1 ∶32、1 ∶64、1 ∶128和1 ∶256的比例连续稀释,再取一管浓度设置为0 ng·L-1作为阴性对照。涡旋混合微球管。9个浓度的标准品及每份样品分别取50 μL与混合微球50 μL混合,混合完成向上述管中加入50 μL PE检测抗体,室温避光孵育2 h。孵育结束每个管中加入1 mL洗液清洗。离心200×g,5 min。弃上清,每管加入300 μL洗液重悬。准备仪器调试试剂,上机进行检测[7]。
1.13 质谱检测用纯水与乙腈提取血清、皮肤组织中的锦菊素,然后通过超高效液相色谱系统与配备涡轮离子喷雾电离源的三重四极杆质谱联用进行定量分析。色谱分离柱[C18(2) 100 Å,LC 250 mm 4.6 mm,5 μm]。二元溶剂体系为5 mmol·L-1乙酸铵+ 0.1%的水(A)+甲醇(B),二元溶剂的梯度为:1%相B维持1 min, 5 min时上升至70%,保持3 min, 9.5 min时下降至1%,以0.2 mL·min-1的速率2.5 min达到平衡。数据由Analyst 1.5.2处理。
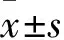
2 结果
2.1 锦菊素改善咪喹莫特诱导的小鼠银屑病皮肤炎症基于每日同一时间观察并记录小鼠背部皮肤状态,发现咪喹莫特造模后小鼠背部皮肤持续损伤,出现鳞屑和皮肤红肿现象;给予锦菊素处理后显著改善小鼠上述皮肤损伤现象,其中锦菊素经皮给药高剂量组效应更显著(Fig 1A)。结合皮肤厚度评分(Fig 1B)、红肿评分(Fig 1C)、鳞屑评分(Fig 1D)以及综合的PASI评分(Fig 1E)发现咪喹莫特持续加重小鼠银屑病皮损症状,而锦菊素可连续减轻其症状,且结果具有统计学意义。d 5小鼠背部皮肤测量结果显示,与空白对照组相比,模型组的皮肤厚度明显增加;经锦菊素治疗后,皮肤厚度减小,表明锦菊素可以显著缓解咪喹莫特诱导的皮肤增厚(Fig 1F)。以上结果说明,锦菊素可以显著改善咪喹莫特诱导的小鼠银屑病样皮肤症状。
2.2 锦菊素抑制银屑病小鼠皮损组织中角质形成细胞的过度增殖及炎症反应Fig 2 HE染色结果显示,与空白对照组相比,模型组表皮厚度增加;与模型组相比,锦菊素给药组表皮厚度减小,说明锦菊素能够明显降低咪喹莫特诱导的小鼠表皮增厚。采用免疫组织化学法检测各组小鼠皮损组织处Ki67阳性表达情况,我们观察到模型组Ki67阳性细胞百分率明显高于空白对照组,而锦菊素给药组的Ki67阳性细胞百分率低于模型组,说明咪喹莫特会显著增加小鼠表皮基底部位细胞的增殖,而锦菊素可以显著改善该现象(Fig 2C、D)。同时,通过PCR检测各组小鼠皮肤中炎症因子的mRNA表达情况。检测结果显示,模型组小鼠皮肤组织中S100a8、S100a9、IL-17A、IL-6及IL-1β表达增加,锦菊素给药后表达明显降低,其中IL-17A及IL-6表现出明显的剂量依赖性,说明给予锦菊素后可以显著降低皮肤中各类炎症因子的mRNA水平(Fig 2E-I)。上述结果表明,锦菊素能够抑制银屑病小鼠皮肤角质形成细胞的过度增殖及其炎症反应。
2.3 锦菊素能够降低银屑病小鼠体内的炎症水平鉴于Th17细胞的活化是正反馈诱导角质细胞过度增殖的关键因素[8],采用流式细胞术进一步分析小鼠淋巴结中Th17细胞和抑制性Treg细胞的比例。流式细胞术的结果显示,与空白对照组相比,模型组小鼠淋巴结中Th17细胞比例增加,具有免疫抑制作用的Treg细胞比例降低。与模型组相比,锦菊素能明显降低小鼠淋巴结中Th17细胞比例,同时升高Treg细胞比例(Fig 3A和B)。此外,采用流式微球分析法检测血清中IL-2、IL-4、TNF-α、IFN-γ及IL-17A的表达水平,结果显示与空白对照组相比,模型组血清中上述细胞因子表达水平均明显增高;与模型组相比,锦菊素给药组能够剂量依赖性地降低小鼠血清中上述细胞因子的水平(Fig 3C-G)。由此可知,锦菊素能够降低咪喹莫特诱导的小鼠体内炎症水平。

Fig 1 Effect of bigelovin on IMQ-induced psoriasis in mice
2.4 锦菊素蓄积在皮肤发挥作用为了观察锦菊素发挥抗炎作用的靶器官,我们分别将小鼠背部皮肤与血清进行了质谱检测。结果显示,锦菊素在皮肤组织中的浓度较高,且呈现剂量依赖性。但血清中的锦菊素含量均低于检测下限(Fig 4A)。说明涂抹给药的锦菊素会蓄积在皮肤组织中发挥药效,其靶细胞可能是皮肤中的角质细胞。进一步观察脾脏指数、肝脏指数与体质量变化,结果显示,相较于空白对照组,模型组肝脏指数与脾脏指数明显升高;锦菊素给药组相较于模型组肝脏指数与脾脏指数降低;与空白对照组相比较,模型组与锦菊素给药组的体质量均明显下降。结果表明咪喹莫特造模毒性较大,会引起小鼠体质量显著下降与脏器异常增大,而锦菊素经皮给药对于银屑病小鼠不产生毒副作用(Fig 4B、C和D)。上述结果表明经皮给药的锦菊素可能在皮肤组织发挥抗炎作用。
2.5 锦菊素可抑制咪喹莫特诱导的P65活化为选取不影响人角质细胞HaCaT细胞正常生长的药物浓度进行后续实验,采用CCK-8法检测不同浓度的锦菊素对HaCaT细胞增殖的影响,其中给药浓度在3 mmol·L-1时与对照组相比较,锦菊素对HaCaT细胞的增殖有明显的抑制作用(Fig 5A)。进一步通过PCR检测发现,咪喹莫特诱导HaCaT细胞中的IL-1β和IL-6的mRNA表达;与咪喹莫特组相比,锦菊素能够明显降低上述两个炎症因子的mRNA水平(Fig 5B和C)。
鉴于咪喹莫特为Toll样受体7激动剂,能够激活NF-κB信号通路,从而启动下游IL-1β和IL-6的转录[9]。此外,有研究表明银屑病患者的样本中NF-κB活化,磷酸化P65水平升高[10]。我们进一步通过蛋白印迹实验发现,经咪喹莫特刺激后,HaCaT细胞中P65磷酸化增加,NF-κB信号通路激活,锦菊素处理后HaCaT细胞中P65磷酸化水平显著降低;未经咪喹莫特刺激仅给予锦菊素并不能引起P65磷酸化(Fig 5D)。同时,核蛋白分离和细胞免疫荧光检测的结果显示咪喹莫特能促进P65入核,锦菊素处理后可以显著抑制P65入核(Fig 5E和F)。综上所述,锦菊素在HaCaT细胞中可以显著抑制咪喹莫特诱导的P65活化。
3 讨论
本研究发现了旋覆花主要成分锦菊素可以缓解小鼠的银屑病症状,并揭示了锦菊素靶向角质细胞抑制炎症因子的释放作用。结果显示,锦菊素经皮给药后会蓄积在皮肤组织中,而在血液中难以被检测到,说明锦菊素经皮给药发挥作用的靶器官可能是皮肤组织。

Fig 2 Epidermal proliferation and inflammatory cytokine profile in lesion skin affected by bigelovin

Fig 3 Inflammatory ecosystem in mice influenced by

Fig 4 Accumulation of bigelovin in lesion

Fig 5 Activation of P65 inhibited by bigelovin
损伤皮肤中异常的炎症细胞因子表达已被证明是银屑病发病机制的重要诱因。由S100a8和S100a9组成的钙卫蛋白复合物已被确定为炎症性疾病的生物标志物,包括类风湿性关节炎和银屑病关节炎[11]。我们的研究显示,锦菊素对皮损中炎症相关基因S100a8和S100a9的表达有明显的抑制作用,这表明锦菊素对银屑病炎症发挥了初步的改善作用。此外,我们也发现锦菊素对IL-17、IL-1β、IL-6和IFN-γ等多种炎症因子的产生和释放均有抑制作用,上述炎症因子揭示了Th17细胞的活化水平[8]。综上所述,我们推测锦菊素的靶细胞位于正反馈反应的上游。
银屑病患者真皮和表皮内T淋巴细胞、巨噬细胞和中性粒细胞数量会显著增加[12]。上述浸润的炎性细胞中,Th17细胞可以迅速募集到损伤部位以产生促炎细胞因子[8]。我们观察了锦菊素对Th17细胞和免疫抑制细胞Treg细胞的作用,发现锦菊素可以下调淋巴结中Th17细胞的比例,增加Treg细胞的比例。我们推测该现象可能与锦菊素抑制表皮细胞释放促炎信号相关。
NF-κB信号传导是细胞释放促炎信号的重要通路之一,阻断NF-κB信号活化已被证明可有效缓解银屑病[13]。我们发现锦菊素能够抑制P65活化和入核,从而降低角质细胞炎症水平,其具体机制可能与IκBα的磷酸化相关[6]。但仍需要进一步阐明锦菊素的具体作用靶点及其通过何种方式介导NF-κB信号失活。目前,多种抗体药物已被开发和批准用于治疗各种疾病,如克罗恩病、类风湿性关节炎、强直性脊柱炎和银屑病[14]。然而,抗体药物在体内的续存时间较长,难以被机体快速代谢和排泄。长期使用抗体药物,如TNF-α抗体,会导致严重的副作用,包括对细菌感染的易感性增加或潜伏性结核病的再激活[15]。与上述抗体药物不同,经皮给药的锦菊素可以避免这些副作用。
综上所述,锦菊素在体内和体外均可以抑制角质细胞中促炎因子的表达及其P65的活化,从而改善咪喹莫特诱导的小鼠银屑病,为治疗银屑病提供了一种有效的候选药物。