腰果过敏原Ana o 3蛋白的分离纯化及热稳定性研究
2022-12-15肖志文金雪玲陈红兵
肖志文, 胡 帅, 金雪玲, 陈红兵, 武 涌
(1.南昌大学 食品科学与技术国家重点实验室, 江西 南昌 330047;2.南昌大学 食品学院, 江西 南昌 330047;3.南昌大学 中德联合研究院, 江西 南昌 330047;4.江西省农业科学院 农产品加工研究所, 江西 南昌 330200;5.南昌大学 第一附属医院 耳鼻咽喉头颈外科, 江西 南昌 330006)
腰果(AnacardiumoccidentaleLinn.)是被子植物门(Angiospermae)木兰纲(Magnoliopsida)无患子目(Sapindales)漆树科(Anacardiaceae)腰果属(Anacardium)植物的果实,又称槚如果。原产于西印度群岛和巴西东北部,全球热带地区已广泛引种栽培。腰果过敏是一种仅次于核桃过敏的常见坚果过敏,其全球发生率呈上升趋势[1]。腰果在我国也是较为常见的致敏食物之一,研究表明腰果处于我国食入性过敏原的前3位[2-4]。腰果过敏临床症状涉及多个器官或系统,根据国内早期的病例报道,腰果过敏患者多表现为过敏性休克、体温下降、全身瘙痒、腹部疼痛及呼吸困难等,甚至有因腰果过敏死亡的案例[5]。
腰果中过敏原蛋白主要分为3类:7S豌豆球蛋白(Ana o 1)、11S豆球蛋白(Ana o 2)和2S白蛋白(Ana o 3)。这3种蛋白被归类为种子贮藏蛋白[6],且都属于I类食物过敏原[7]。其中,腰果过敏原Ana o 3蛋白是分子质量为16.3 kDa的2S白蛋白,由5个α-螺旋组成,包含2个由半胱氨酸二硫键连接的亚基。国内外已围绕腰果过敏原Ana o 3蛋白的纯化进行了相关的研究。迄今为止,Reitsma等[8]通过多步硫酸铵沉淀结合超滤法分离出腰果过敏原Ana o 3蛋白,Mattison等[9]采用硫酸铵分级沉淀结合羟基磷灰石低压色谱系统纯化出腰果过敏原Ana o 3蛋白。然而,目前腰果过敏原Ana o 3蛋白分离纯化的效果较低,且分离过程复杂,而仅通过阴离子交换层析高效纯化出高纯度的腰果过敏原Ana o 3蛋白尚未见报道。此外,通过腰果过敏原Ana o 3蛋白的氨基酸序列预测其理论等电点为5.68,与另外两种过敏原的预测等电点相差较大,故采用弱阴离子交换层析纯化腰果过敏原Ana o 3蛋白。
热加工会使蛋白质发生变性,空间结构展开、内部疏水基团暴露,从而促进与其他物质的相互作用,生成各种高聚物和交联产物[10],最终导致构象型表位[11]、IgE结合表位和T细胞反应[12]发生变化。如烘焙处理会使花生过敏原Ara h 2蛋白的分子结构和核心表位发生改变[13]。目前的研究主要关注烘焙加工对腰果致敏性的影响,而对腰果主要过敏原Ana o 3蛋白的结构变化及热稳定性的研究相对较少。食品工业中腰果常用加工方法主要是先经150 ℃加热25~35 min以去除外壳,而后120 ℃或160 ℃烘焙20 min,或93 ℃逐渐增加至135 ℃缓慢油炸35~40 min[14]。因此研究腰果过敏原Ana o 3蛋白在160 ℃热处理过程中的结构变化及稳定性对研究腰果过敏具有重要意义。
本研究拟采用阴离子交换层析法开发一种腰果过敏原Ana o 3蛋白的高效分离纯化的方法,并利用小分子蛋白电泳(Tricine-SDS- PAGE)、液相色谱- 串联质谱(liquid chromatography-tandem mass spectrometry,LC- MS/MS)和免疫印迹(Western Blotting)技术对分离纯化的腰果过敏原Ana o 3蛋白进行鉴定,同时探究在腰果常用加工160 ℃条件下对腰果过敏原Ana o 3蛋白结构的影响,旨在为腰果过敏原Ana o 3蛋白的分离纯化及结构稳定性、致敏性研究提供理论及技术支持。
1 材料与方法
1.1 材料与试剂
生腰果(已高压蒸煮脱壳),市售;人抗腰果过敏原Ana o 3蛋白的IgE单克隆抗体E- 2F5,美国INDOOR公司;低分子质量蛋白质Maker,美国Thermo公司;DEAE- Sepharose Fast Flow,美国GE公司;生物素标记的羊抗人IgE,美国Sigma公司;HRP标记的链霉亲和素,欣博盛生物科技有限公司;三羟甲基氨基甲烷(2-amino-2-(hgdroxymethyl)-1,3-propanediol,Tris)、pH=7.2的磷酸盐缓冲液、甘氨酸、三(羟甲基)甲基甘氨酸(Tricine)、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵(ammonium persulphate,AP)、吐温- 20(Tween-20),北京索莱宝科技有限公司;四甲基乙二胺(tetramethylethylenediamine,TEMED)、增强型化学发光试剂(enhanced chemiluminescence,ECL)显色液、40%储液(丙烯酰胺和甲叉双丙烯酰胺总质量分数为40%的水溶液),上海生工科技公司;考马斯亮蓝R250,上海蓝季科技发展有限公司;硝酸纤维素(nitrocellulose,NC)膜,美国PALL公司;氯化钠、十二水合磷酸氢二钠、二水合磷酸二氢钠,西陇科学科技公司;封阻液,上海翌圣生物科技股份有限公司;3 kDa超滤管,德国Sigma公司。
1.2 仪器与设备
PHS- 3C型pH计,上海仪电科学仪器公司;1658004型迷你蛋白电泳仪、GS- 800型光密度扫描仪,美国Bio- Rad公司;Chemi XRQ型凝胶成像系统,美国Syngene公司;EPS- 601型电转仪,美国GE公司;5804R型高速冷冻离心机,德国Eppendorf公司;SCIENTZ- 10N型冷冻干燥机,宁波新芝生物科技股份有限公司;蛋白纯化系统,上海青浦沪西仪器厂;MOS- 450/AF- CD型色谱仪,法国Biologic公司;UV WinLab型紫外分光光度计,美国Perkin Elmer公司。
1.3 实验方法
1.3.1腰果粉的制备
取新鲜生腰果用高速粉碎机于液氮环境中粉碎至糊状,称取一定质量的腰果糊于烧杯中,以m(腰果糊)∶V(提取溶剂)=1 g∶10 mL的比例加入沸程为30~60 ℃石油醚脱脂6 h;然后于4 ℃,8 000 r/min条件下离心15 min去除上清液,沉淀物再次脱脂,离心后于通风橱中自然干燥后即得脱脂腰果粉。脱脂腰果粉末于-20 ℃冰箱中保存备用。
1.3.2腰果粗蛋白的提取
称取脱脂腰果粉,以m(脱脂腰果粉)∶V(提取溶剂)=1 g∶10 mL的比例加入pH=7.2的磷酸盐缓冲液,在4 ℃条件下磁力搅拌12 h后,于4 ℃,8 000 r/min条件下离心15 min,取上清液;取沉淀重复上述操作,合并两次上清液。上清液于蒸馏水中透析(透析袋截留分子质量为6~8 kDa),4 ℃磁力搅拌48 h,换液5次,透析完后经冷冻干燥得到粗蛋白冻干粉。利用Bradford法测定蛋白浓度并于-80 ℃保存备用。
1.3.3蛋白质分子质量的测定
称取36.3 g Tris和0.3 g SDS溶于85 mL超纯水中,用盐酸调至pH=8.45后定容为100 mL制成凝胶缓冲液;称取1.0 g AP粉末溶解于10 mL超纯水中配制成质量浓度为0.1 mg/mL的AP溶液;将3 000 μL凝胶缓冲液,3 750 μL 40%储液,2 250 μL超纯水,30 μL AP溶液,3 μL TEMED混匀后配制成质量分数为16.5%致密胶;将990 μL凝胶缓冲液,780 μL 40%储液,960 μL超纯水,99 μL AP溶液,1.5 μL TEMED混匀后配制成质量分数为10%夹层胶;将1 125 μL凝胶缓冲液,450 μL 40%储液,2 745 μL超纯水,30 μL AP溶液,3 μL TEMED混匀后配制成质量分数为16.5%浓缩胶;将50 mL甲醇、75 mL乙酸和875 mL超纯水混匀配制成脱色液。
研究采用Tricine- SDS- PAGE电泳法测定蛋白质的分子质量。采用质量分数为16.5%致密胶,质量分数为10%夹层胶和质量分数为4%浓缩胶进行腰果过敏原Tricine- SDS- PAGE电泳分析,上样量为10 μL,电泳条件为浓缩胶恒压30 V,60 min;夹层胶和分离胶恒压100 V,120 min。电泳结束后,胶块用蒸馏水清洗5 min,固定液固定15 min,考马斯亮蓝染色15 min,而后用脱色液进行脱色过夜。次日以GS- 800型光密度扫描仪进行成像,并利用Quantity One软件分析蛋白纯度。
1.3.4腰果过敏原Ana o 3蛋白的分离纯化
采用DEAE- Sepharose Fast Flow柱材进行弱阴离子交换层析以分离纯化蛋白,层析柱内径为1.6 cm,长度为30 cm。利用腰果过敏原Ana o 3蛋白的氨基酸序列预测其等电点约为5.68,为使蛋白质与树脂的结合力强弱适中,缓冲体系pH值应与蛋白质的等电点相差一个单位,故选用pH值为6.8。用磷酸盐缓冲液(将3.51 g十二水合磷酸氢二钠和1.59 g二水合磷酸二氢钠溶于2 000 mL蒸馏水配制成磷酸根浓度为0.02 mol/L,pH=6.8的磷酸盐缓冲液)平衡离子交换柱后,将腰果粗蛋白100 mg溶于5 mL平衡缓冲液后进行上样,并用磷酸盐缓冲液(磷酸根浓度为0.02 mol/L,pH=6.8)洗脱未结合蛋白,待基线平衡后,用含0.1~0.3 mol/L NaCl的磷酸盐缓冲液(磷酸根浓度为0.02 mol/L,pH=6.8)连续梯度洗脱,洗脱速度为2 mL/min,280 nm处检测紫外吸收峰,收集各洗脱峰。利用Bradford法测定蛋白含量并计算腰果过敏原Ana o 3蛋白的得率。
1.3.5腰果过敏原Ana o 3蛋白的质谱鉴定
将经Tricine- SDS- PAGE电泳脱色后电泳胶上的目标条带裁切下来,保存于超纯水中送至上海中科新生命有限公司进行质谱鉴定。
1.3.6腰果过敏原Ana o 3蛋白的免疫印迹鉴定
称取4.84 g Tris和58.48 g NaCl溶于850 mL超纯水中,用盐酸调至pH=7.5后定容为1 000 mL,而后向其中加入1 mL Tween 20,经混匀后配制成洗涤缓冲液(tris-buffered saline and Tween 20,TBST)。
将Tricine- SDS- PAGE电泳未经染色的电泳胶置于3层滤纸和NC膜中间,转印程序设置如下:电压为100 V,电流为400 mA,时间为1 h。转印完成后将带有蛋白的NC膜蛋白面朝上置于50 mL离心管中,加入10 mL封阻液于室温封阻10 min,弃去封阻液后用35 mL TBST洗膜3次,每次5 min;倾去TBST,将体积分数为0.01%的人抗腰果过敏原Ana o 3 蛋白的IgE单克隆抗体E- 2F5的TBST溶液(一抗)5 mL加入至离心管中,于4 ℃孵育12 h,孵育结束后弃去一抗,用35 mL TBST洗膜3次,每次5 min;倾去TBST,将体积分数为0.02%的生物素标记羊抗人IgE的TBST溶液(二抗)12.5 mL加入至离心管中,于室温孵育1 h,孵育结束后弃去二抗,用35 mL TBST洗膜3次,每次5 min;用TBST按体积比为1∶60的比例稀释HRP标记的链霉亲和素稀释液,倾去TBST,加入链霉亲和素稀释液10 mL于室温孵育1 h,孵育结束后弃去链霉亲和素稀释液,用35 mL TBST洗膜3次,每次5 min。洗涤结束后,转移NC膜至化学发光成像仪,加入ECL显色液,成像并保存结果。
1.3.7腰果过敏原Ana o 3蛋白的热稳定性测定
将分离纯化所得的腰果过敏原Ana o 3蛋白溶液用3 kDa超滤管浓缩并除盐,用Braford法测定蛋白浓度,然后用磷酸盐缓冲液(磷酸根浓度为0.02 mol/L,pH=6.8)配制成质量浓度为0.2 mg/mL的蛋白溶液。取2 mL溶液装在密封的耐高温玻璃管中,置于160 ℃油浴中恒温加热10、15、20、25、30 min,加热完成后置于冰水中冷却备用。
采用圆二色光谱仪测定热处理前后腰果过敏原Ana o 3蛋白的二级结构变化。样品质量浓度为0.2 mg/mL,比色皿为1 mm厚,波长范围为190~250 nm,速度为100 nm/min。
采用紫外分光光度计分析热处理前后腰果过敏原Ana o 3蛋白空间结构变化。将样品蛋白溶液稀释成质量浓度为0.1 mg/mL,波长扫描范围为210~350 nm,扫描速率中等。
1.4 数据处理
每组实验进行3次平行实验并取平均值,圆二光谱数据用Dichroweb网站进行分析,紫外和圆二光谱结果由Origin 2019软件绘图,并采用IBM SPSS Statistics 25.0软件的单因素方差分析法对数据进行显著性分析(P<0.05),表格用Excel软件绘制。
2 结果与分析
2.1 腰果粗蛋白电泳分析结果
生腰果经低温粉碎、脱脂、浸提、冷冻干燥等操作后获得的腰果粗蛋白冻干粉,而后进行蛋白粗提物的Tricine- SDS- PAGE电泳分析,结果见图1。研究表明2S白蛋白是低盐浓度下的水溶性蛋白家族[7],为减少其他蛋白的浸出,故采用0.01 mol/L磷酸盐缓冲液进行蛋白浸提。由图1可知,腰果粗蛋白成分较为复杂,至少含11种蛋白成分,且大部分蛋白组分主要分布在10~80 kDa,粗蛋白中含量较高的蛋白条带在10~15 kDa。此外,采用二次浸提方法可使原料利用率提高,且整个粗提过程始终处于低温环境,可较大程度保留蛋白的天然活性。
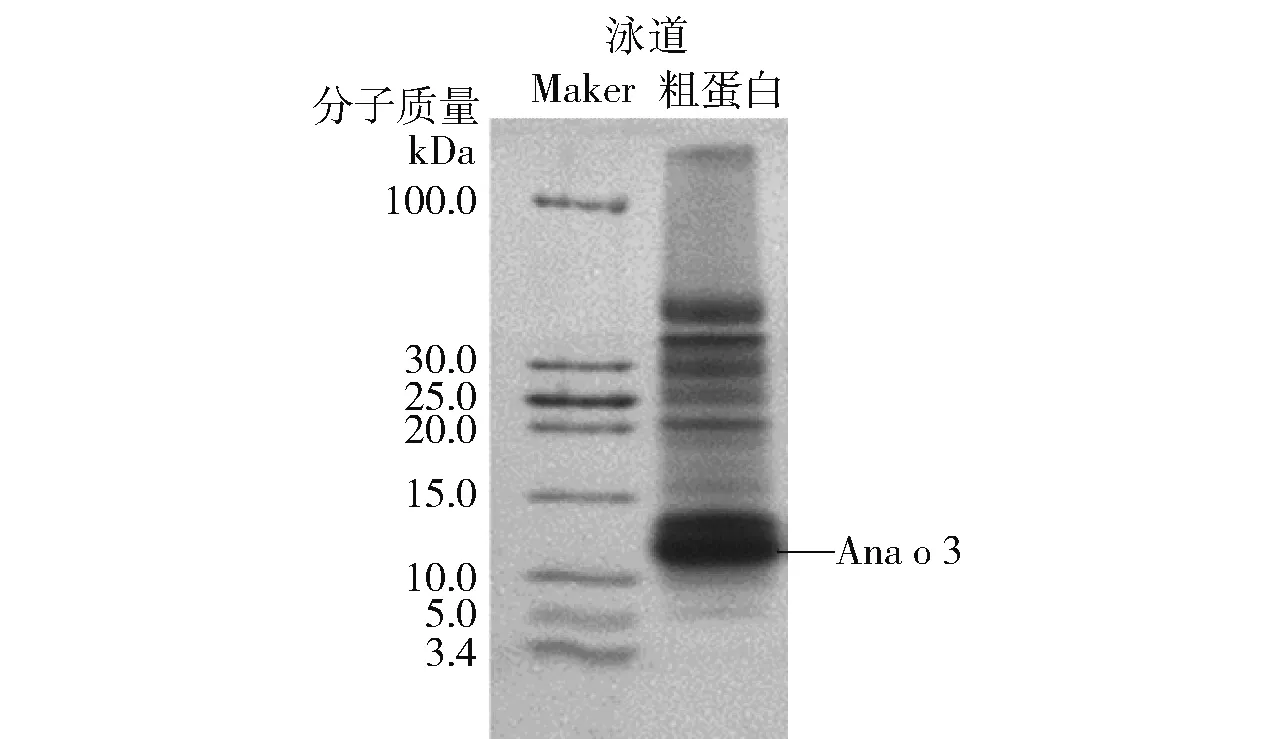
图1 腰果粗蛋白Tricine- SDS- PAGE电泳
2.2 腰果过敏原Ana o 3蛋白的分离纯化结果
采用弱阴离子交换层析分离腰果过敏原Ana o 3蛋白纯化峰型及电泳分析见图2。腰果粗蛋白复溶后上样,待未结合蛋白流出后,用0.1~0.3 mol/L NaCl洗脱液进行连续的线性梯度洗脱,流速为2 mL/min。结果表明:根据图2(a)和图2(b),峰2为NaCl洗脱后的第一个峰,其在NaCl浓度为0.12 mol/L时被洗脱下来,该峰收集组分经Tricine- SDS- PAGE电泳和飞行时间质谱(见图3)检测为腰果过敏原Ana o 3蛋白,其分子质量约为12.6 kDa,与Reitsma等[8]纯化的腰果过敏原Ana o 3蛋白分子质量相同。用Quantity One软件对比图2(c)条带灰度值,发现该条带的纯度在98%以上。此外,通过图2(a)可知,2号峰为洗脱后的第一个峰,且整个2号峰的洗脱过程约为15 min,说明该纯化方法简单高效。
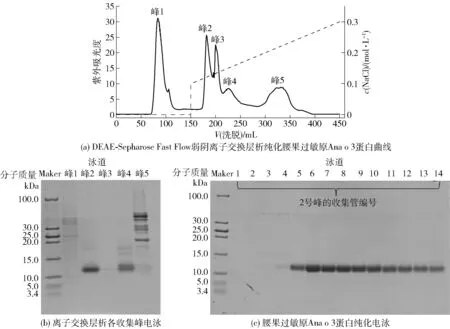
图2 纯化腰果过敏原Ana o 3蛋白Tricine- SDS- PAGE电泳分析结果
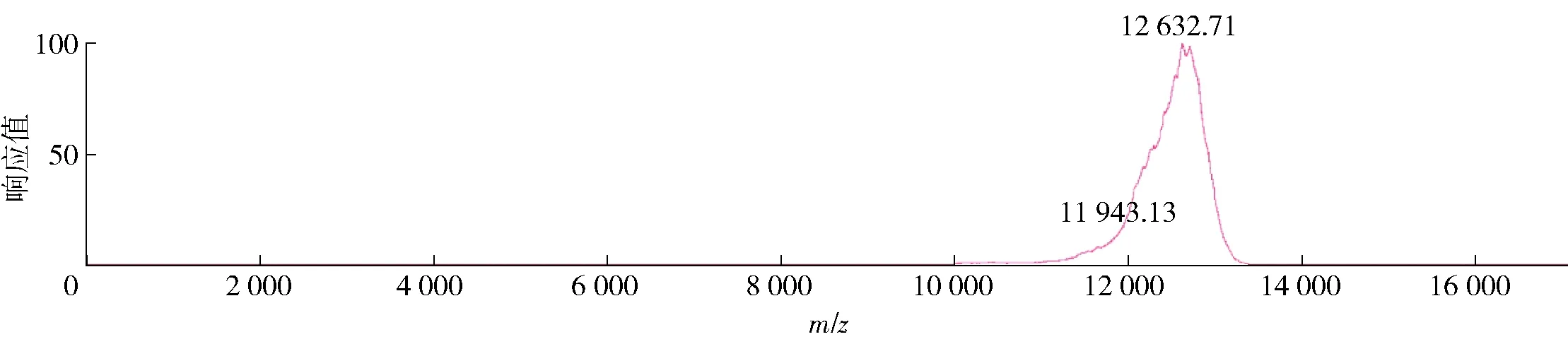
图3 腰果过敏原Ana o 3蛋白飞行时间质谱
纯化出的腰果过敏原Ana o 3蛋白的分子质量为12.6 kDa,与Uniprot上的16.3 kDa存在一定质量差异,主要原因是2S白蛋白是植物细胞液泡中经蛋白水解后的小型球状蛋白,其全长前体蛋白通常被裂解成由2个二硫键连接的大亚基和小亚基,并经翻译后加工,信号肽、短连接子和侧翼序列被切除,产生较小的成熟产物[15]。此类现象在巴西坚果、芝麻、蓖麻等植物中也有同样的体现,如巴西坚果的前体蛋白为15 kDa,但从其浸提物得到的成熟2S白蛋白仅有13 kDa[16]。
2.3 腰果过敏原Ana o 3蛋白的得率分析
参考Reitsma等[8]的纯化计算公式,对分离纯化的得率进行分析。生腰果中蛋白质含量约为19%~21%[17-18],腰果过敏原Ana o 3蛋白占腰果蛋白的5%[19]。由于粗蛋白浸提时无法完全浸提生腰果中的蛋白,且采用低盐提取粗蛋白后各组分的比重发生改变,故以1 g生腰果所含腰果过敏原Ana o 3蛋白为基准来计算腰果过敏原Ana o 3蛋白的得率,阴离子法分离得到腰果过敏原Ana o 3蛋白的含量及得率见表1。该阴离子交换法分离所得的腰果过敏原Ana o 3蛋白得率为25.36%,相比于Reitsma等[8]纯化得率的3%具有大幅度提升。这是由于2次提取和低盐浸提法可尽量收集腰果过敏原Ana o 3蛋白,而Reitsma的方法中大部分的腰果过敏原Ana o 3蛋白在样品硫酸铵沉淀步骤中损失,从而导致较低的产率,由此可见在纯化前的样品处理中应尽量提高目的蛋白的含量。

表1 阴离子法分离得到的腰果过敏原Ana o 3蛋白的得率
2.4 腰果过敏原Ana o 3蛋白的质谱鉴定结果
研究采用胰蛋白酶对蛋白质样品进行酶解,然后使用LC- MS/MS对酶解后的样品进行鉴定,利用MASCOT等质谱匹配软件对质谱数据进行分析,质谱鉴定的总离子流图见图4,肽段序列比对结果见表2,主要特征肽段的二级质谱图及肽段序列展示见图5。
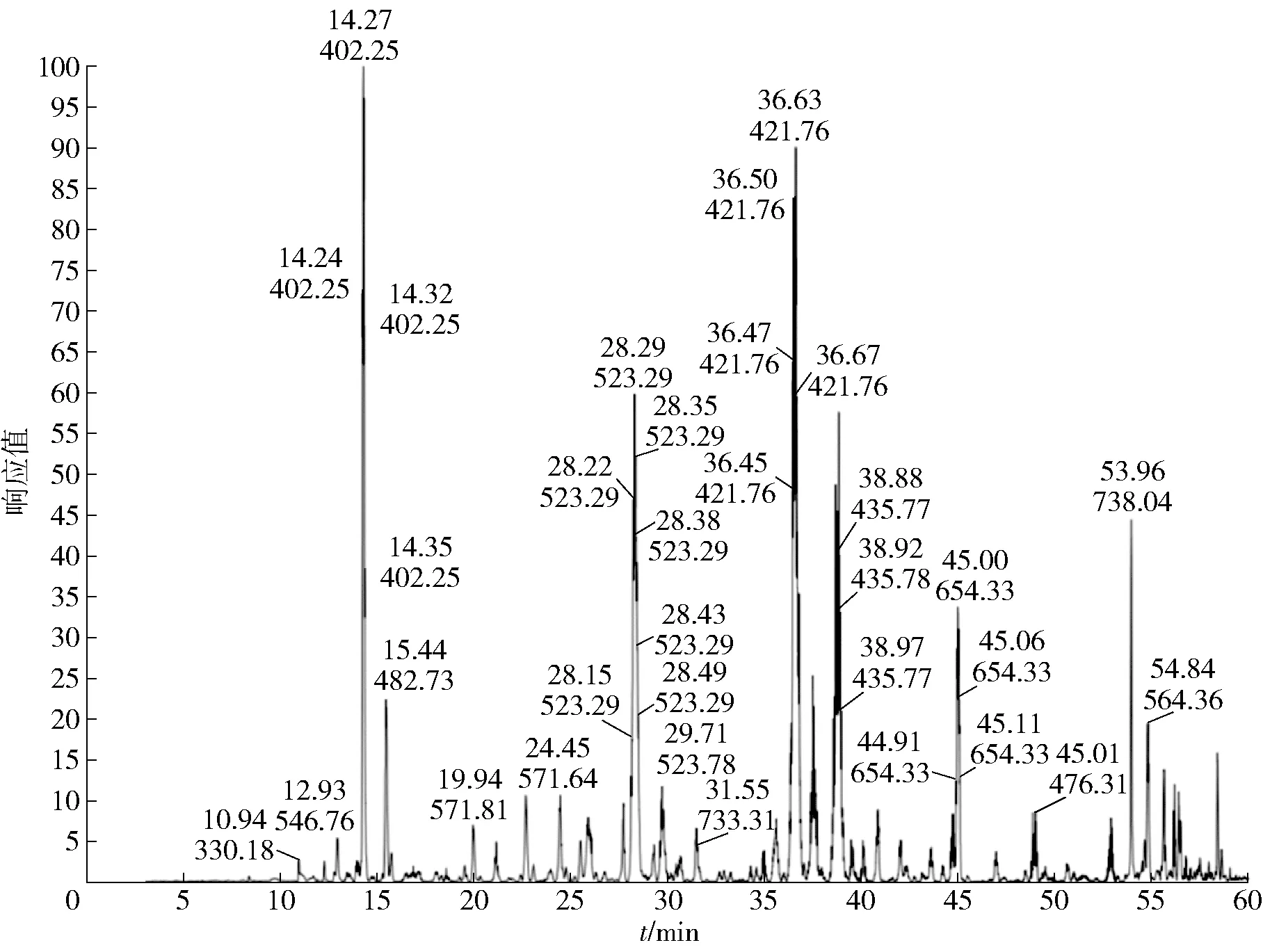
峰标数值分别为出峰时间和分子离子峰质荷比

表2 腰果过敏原Ana o 3蛋白质谱鉴定肽段序列鉴定
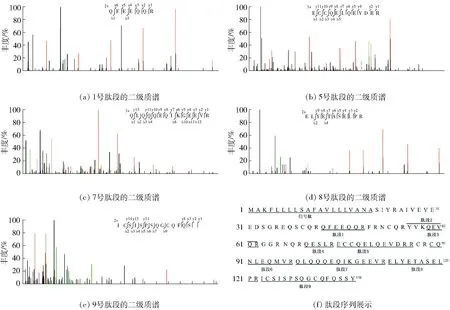
图5 腰果过敏原Ana o 3蛋白主要特征肽段的二级质谱及肽段序列
结果表明:本研究纯化所得蛋白与腰果过敏原Ana o 3蛋白相匹配,匹配度为60%。该蛋白在UniProtKB数据库中的序列号是Q8H2B8,分子质量为16.3 kDa,匹配度为60%的原因也是腰果过敏原Ana o 3蛋白在成熟过程中会丢失信号肽、短连接子和侧翼序列导致较小的成熟产物。结合Tricine- SDS- PAGE电泳鉴定目标蛋白的结果,LC- MS/MS鉴定进一步证实了阴离子法纯化蛋白为腰果过敏原Ana o 3蛋白。
2.5 腰果过敏原Ana o 3蛋白的免疫印迹鉴定结果
对阴离子法纯化所得的目标蛋白进行免疫印迹鉴定,结果见图6。结果表明,与Tricine- SDS- PAGE电泳相对应的腰果过敏原Ana o 3蛋白组分的泳道在分子质量约12.6 kDa处出现单一的条带,说明人抗腰果过敏原Ana o 3蛋白的IgE单克隆抗体能够特异性识别腰果过敏原Ana o 3蛋白,并且在其他分子质量处无明显的条带,进一步证明本研究纯化出的腰果过敏原Ana o 3蛋白纯度较高。
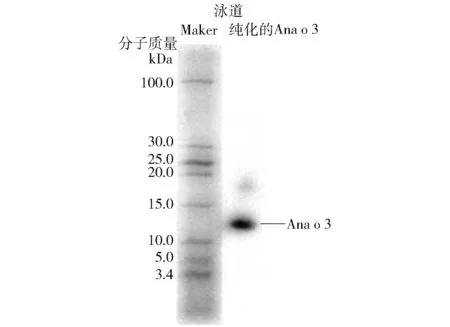
图6 腰果过敏原Ana o 3蛋白的Western Blotting分析
2.6 腰果过敏原Ana o 3蛋白的热稳定性分析
2.6.1热处理对Ana o 3蛋白二级结构的影响
利用圆二光谱分析热处理前后腰果过敏原Ana o 3蛋白的二级结构变化,结果见图7和表3。由 图7 可知,未经热处理的腰果过敏原Ana o 3蛋白光谱曲线在220 nm、209 nm处呈负峰,在193 nm附近有一正峰,说明未加热腰果过敏原Ana o 3蛋白具有典型的α-螺旋结构[20]。随着腰果过敏原Ana o 3蛋白处理时间的升高,双负峰的峰值发生了稍许的红移,峰值明显减小,α-螺旋有解旋趋势。表明α-螺旋构象比例下降,β-折叠构象比例增加。
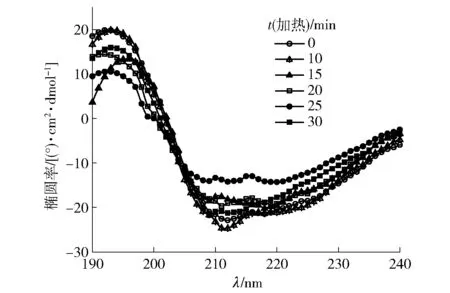
图7 热处理不同时间腰果过敏原Ana o 3蛋白的 圆二色谱
从表3的数据可知,与未经加热的腰果过敏原Ana o 3蛋白相比,160 ℃条件下不同时间的加热会使腰果过敏原Ana o 3蛋白的α-螺旋向其他二级结构转化。此外,随着时间的延长,α-螺旋含量降低,β-转角含量变化较小,β-折叠和无规则卷曲含量稍有增加。与未加热腰果过敏原Ana o 3蛋白相比,在加热25 min时无规则卷曲含量下降,分子结构更为有序,这可能是适当热处理可使天然腰果过敏原Ana o 3蛋白向更稳定的形态转化。160 ℃加热可使腰果过敏原Ana o 3蛋白的二级结构发生改变,但破坏程度较小,表明腰果过敏原Ana o 3蛋白的二级结构较为稳定。

表3 热处理不同时间腰果过敏原Ana o 3蛋白二级结构的含量
2.6.2热处理对Ana o 3蛋白空间结构的影响
利用紫外光谱分析不同时间热处理后腰果过敏原Ana o 3蛋白的空间结构变化,结果见图8。天然腰果过敏原Ana o 3蛋白的紫外光谱图在280 nm附近有特征吸收峰,主要是由蛋白肽链上色氨酸和酪氨酸残基的芳香杂环π→π*跃迁引起的[21]。所有样品的特征吸收峰均在280 nm附近,未发生蓝移或红移,说明腰果过敏原Ana o 3蛋白的色氨酸和酪氨酸残基的侧链基团分布并未发生显著变化。与未加热样品相比,加热后特征吸收峰的吸光度升高,表明:加热会使其变性,结构展开,将更多的色氨酸和酪氨酸残基暴露,空间结构变得松散。随着加热时间的延长,特征吸收峰的吸光度整体趋势逐渐升高,但加热15 min的吸光度较未处理时有所下降,这可能是蛋白质分子发生自聚集,芳香族氨基酸残基的包埋所致[22]。总体而言,加热可使腰果过敏原Ana o 3蛋白分子展开,空间结构变得松散,芳香族氨基酸残基暴露在分子表面,最终导致蛋白空间结构发生破坏。
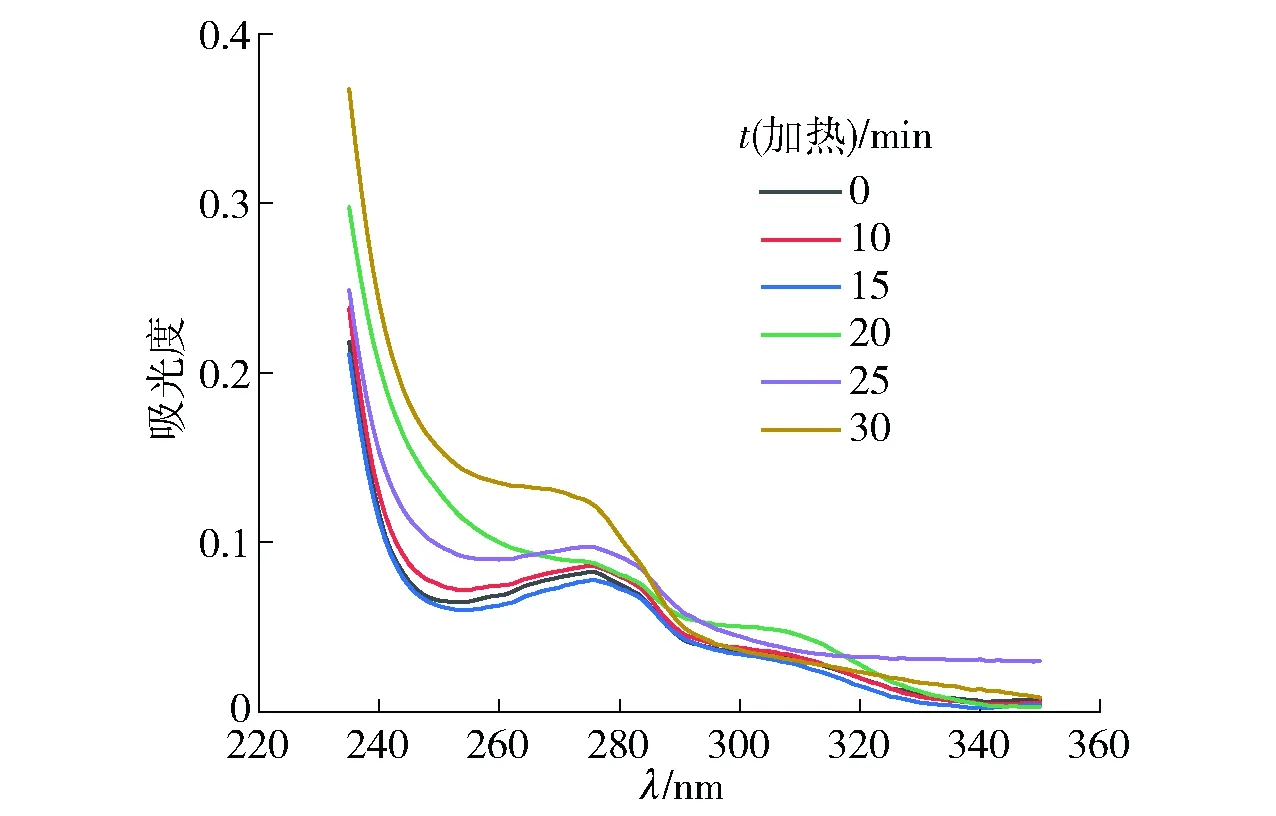
图8 热处理不同时间腰果过敏原Ana o 3蛋白的紫外光谱
2.6.3热处理对Ana o 3蛋白致敏性的影响
为明确不同时间热处理后腰果过敏原Ana o 3蛋白的致敏性变化,对热处理前后的样品进行了电泳和免疫印迹分析,结果见图9。从电泳图可知,160 ℃加热可导致腰果过敏原Ana o 3蛋白发生降解,并且随着加热时间的延长,降解程度也越高,这也印证了紫外结果中加热会导致腰果过敏原Ana o 3蛋白的空间结构发生破坏。通过免疫印迹发现160 ℃加热后,腰果过敏原Ana o 3蛋白与商业化人抗腰果过敏原Ana o 3蛋白的IgE单克隆抗体的免疫活性丧失,表明:热处理后空间结构的改变会导致构象型表位发生变化,且与商业化单抗结合的表位已被破坏[23],但腰果过敏原Ana o 3蛋白降解的部分是否仍具有致敏性,需要结合腰果过敏原患者血清进行进一步的研究。结合电泳和免疫印迹结果表明:160 ℃的高温加热是降低腰果过敏原Ana o 3蛋白致敏性的潜在方法。
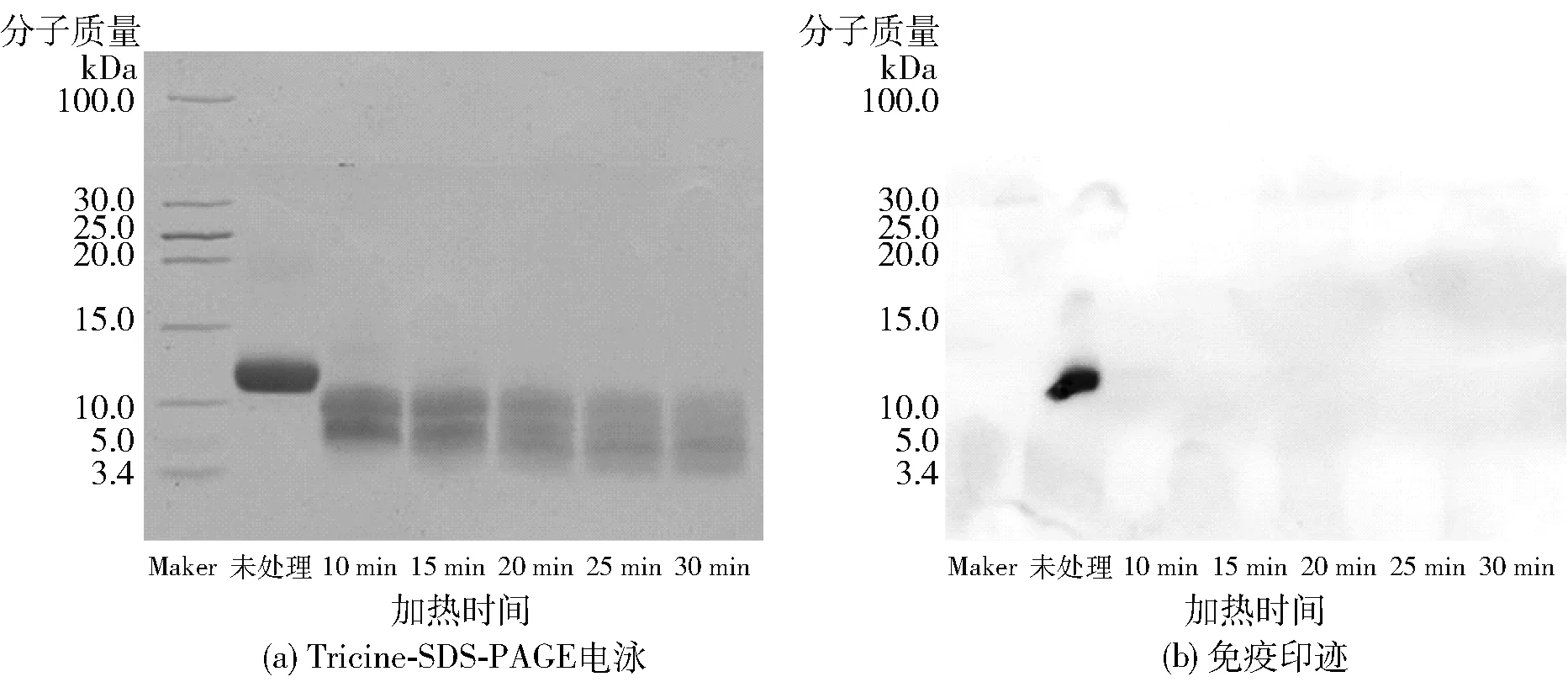
图9 热处理不同时间腰果过敏原Ana o 3蛋白的致敏性变化
3 结 论
本研究得到了一种以新鲜生腰果为原料的腰果过敏原Ana o 3蛋白的纯化方法,得到的腰果过敏原Ana o 3蛋白的纯度大于95%。腰果过敏原Ana o 3蛋白经160 ℃加热后,二级结构较为稳定,但空间结构会发生较大破坏;此外热处理后的腰果过敏原Ana o 3蛋白会发生降解,并且降解程度随着加热时间延长而增高,部分表位被破坏。160 ℃ 热处理可作为降低腰果过敏原Ana o 3蛋白致敏性的潜在方式,但在致敏性评价中使用的是单克隆抗体,后续研究中可使用腰果过敏患者血清进行致敏性评价和进一步表征过敏原表位。希望本研究可为腰果过敏研究提供原材料和相关低致敏性腰果蛋白产品的开发提供理论与技术参考。
