超声改性蛋白对玉米淀粉凝胶结构及消化特性的影响
2022-12-15吴天昊许志凌云许秀颖侯景瑶齐佳伟吴玉柱赵城彬刘景圣
吴天昊, 韩 蕊, 许志凌云, 许秀颖, 侯景瑶, 齐佳伟, 吴玉柱,赵城彬, 刘景圣
(吉林农业大学 食品科学与工程学院/小麦和玉米深加工国家工程实验室, 吉林 长春 130118)
玉米中含有丰富的维生素和植物纤维素,有促进胃肠蠕动、抑制餐后血糖及降血脂等营养功效。玉米中约含70%淀粉,玉米淀粉(corn starch,CS)作为一种廉价、易得的食品原料,常在食品加工中作为稳定剂和食品增稠剂等[1-2];但由于CS本身存在易老化、热稳定性差、快速消化淀粉含量较高等缺陷,限制了其在食品工业中的应用范围[3]。
目前较多研究表明,蛋白质的添加可改善淀粉凝胶的结构及消化特性。Yang等[4]发现,乳清分离蛋白与玉米淀粉在蒸煮过程中主要通过氢键作用,并且随着乳清分离蛋白的增加,加热过程中淀粉颗粒的凝胶化过程被延缓,并降低了淀粉的消化率。肖瑜[5]研究发现,在消化过程中,蛋白质覆盖于淀粉颗粒表面,可阻碍消化酶对淀粉颗粒的可及性,从而降低淀粉的消化性。Lu等[6]研究表明,马铃薯分离蛋白和马铃薯淀粉之间通过静电作用和氢键作用结合,随着蛋白质混合比例的增加,降低了加工过程中共混物的淀粉消化率。陈旭[7]研究了外源脂质和蛋白质对淀粉形貌特征及消化特性的影响,结果发现玉米油和大豆蛋白均可降低淀粉的消化速率。已有研究均表明,原蛋白质的添加能够改善淀粉凝胶的结构及消化特性,然而关于改性蛋白与淀粉复配体系的相关研究却鲜见报道。超声波是一种成本低、效率高的改性方式,超声处理产生的空穴效应可改变蛋白质构象、展开柔性结构,使蛋白平均粒径减小,表面疏水性和溶解度增加,二级、三级结构发生改变,使更多的巯基和疏水基团暴露于蛋白质分子的表面,降低蛋白质溶液的表面张力和刚性,从而导致聚合物的结构更稳定。超声对蛋白质的这种改变,可能会促进其与淀粉相互作用,从而改变淀粉凝胶的特性。本研究拟将不同超声时间处理的大豆分离蛋白与CS复配,研究其对CS凝胶的结构和消化特性的影响,以期改善CS凝胶的功能特性,扩大其应用范围,为改性蛋白在淀粉基食品中的应用提供基础数据和理论参考。
1 材料与方法
1.1 材料与试剂
CS(水分质量分数12%、直链淀粉质量分数24%),上海瑞永生物科技有限公司;大豆分离蛋白(soybean protein isolate,SPI)(蛋白质量分数为90.2%),北京奥博星生物技术有限责任公司;NaCl、尿素(urea)、十二烷基硫酸钠(K12)等化学试剂均为分析纯,国药集团化学试剂有限公司;P7545猪胰α-淀粉酶(8 U/mg)、A7095淀粉葡萄糖苷酶(260 U/mL),美国Sigma-Aldrich公司;D-葡萄糖检测试剂盒(GOPOD 法),爱尔兰Megazyme公司。
1.2 仪器与设备
JY92- 2D型超声波细胞粉碎机,宁波Scientz生物科技股份有限公司;ALPHA1- 4LD plus型冷冻干燥机,德国Christ公司;PC- 620D型磁力搅拌器,美国Corning公司;VERTEX 70型傅里叶红外光谱仪(FTIR),德国Bruker公司;Q- 2000型差示扫描量热仪,美国TA公司;D/MAX2500 MCR- 302型X-射线衍射仪,日本理学公司;MCR- 302 型流变仪,奥地利Anton Paar公司;Alpha1- 4Ldplus型全波长酶标仪,德国Christ公司;RF- 5301PC型荧光分光光度计,日本岛津公司。
1.3 实验方法
1.3.1改性蛋白的制备
超声处理SPI分散液参照胡昊[8]的方法,略作改动。准确称取3 g的SPI置于100 mL三角瓶中,加入蒸馏水配置成质量浓度为0.06 g/mL的SPI分散液,在室温下磁力搅拌2 h至充分溶解,并放置于4 ℃冰箱中备用。用直径为0.636 cm的超声波探头伸入SPI溶液表面下方1~2 cm处理SPI分散液。整个超声过程中,对三角瓶进行冰浴,以避免蛋白过热。以未经超声处理的SPI分散液作为对照组,在20 kHz的超声频率和300 W输出功率下对蛋白溶液进行超声。每超声4 s,停止超声2 s,总作用时间为(含每4 s工作后休息2 s的时间)10、20、30 min。超声结束后,将蛋白冷冻干燥,然后放入干燥器中保存,即获得超声改性SPI(U-SPI)。
1.3.2复配样品的制备
根据Zhang等[9]的方法稍作修改。在前期预实验以及肖瑜等[5]的研究基础上,样品中蛋白添加量为总样品质量的10.0%。准确称量3 g样品放入快速黏度分析仪(RVA)专用铝盒中,加入去离子水,配成质量分数为10%的悬浮液,将样品搅拌至完全溶解,避免样品结块及挂壁。RVA糊化程序:在50 ℃ 下保持1 min,以12 ℃/min 在3.75 min内升温到95 ℃,在95 ℃下保持2.5 min,然后在3.75 min内下降到50 ℃,继续保温2 min。前10 s内搅拌速率为960 r/min,而后以160 r/min搅拌速率进行测定。将糊化后的样品冻干、粉碎过100目筛,储存于干燥器中备用。以糊化后的玉米淀粉作为对照样品,蛋白超声0、10、20、30 min后与玉米淀粉复配的样品分别用SPI-CS、U10-SPI-CS、U20-SPI-CS、U30-SPI-CS表示。
1.3.3U-SPI二级结构的测定
参考Zhao等[10]的方法测定复配样品的FTIR光谱。测定温度为25 ℃,波数扫描范围为 500~4 000 cm-1,分辨率为4 cm-1,波数精度为0.01 cm-1,扫描次数为64次。
1.3.4U-SPI三级结构的测定
参考Peng等[11]的方法,将样品溶液用磷酸盐缓冲溶液(0.01 mol/L、pH值 7.0)稀释至蛋白质质量浓度为0.5 mg/mL,于激发波长280 nm、发射波长范围300~500 nm扫描,激发狭缝宽为3 nm,发射狭缝宽为5 nm,扫描3次。
1.3.5复配样品FTIR的测定
参考Cai等[12]的方法,稍作改动。在400~4 000 cm-1下扫描64次,分辨率为4 cm-1。采用 OMNIC 8.0对图片进行处理,得到红外去卷积光谱图。
1.3.6复配样品热特性的测定
参考常晓红[13]的方法并稍作修改。称取5.0 mg样品置于铝质坩埚内,其中蛋白添加量占总样品质量的10.0%,加入10 μL去离子水,密封压盖。密封后在4 ℃条件下平衡24 h,以10 ℃/min 的速度从40 ℃升至120 ℃进行扫描。空铝质坩埚为对照,记录凝胶化的起始温度(to)、峰值温度(tp)、终止温度(tc)和热焓值(ΔH)。
1.3.7复配样品晶体结构的观察
根据Qiao等[14]的方法,略有修改。测定CS和蛋白- 淀粉复配体系的结晶特性。采用铜靶Cu Kα,管压40 kV,管流30 mA,扫描角度(2θ)范围为5 °~50 °,扫描速率为5 °/min,步长0.02 °。
1.3.8复配样品相互作用力的测定
采用Wang等[15]的方法测定了蛋白- 淀粉糊在热处理后的分子相互作用力。将2.0 g样品放入含有25 mL蒸馏水的铝盒中,其中蛋白添加量为总样品质量的10.0%,将获得的蛋白- 淀粉混合物搅拌10 min。将悬浮液与NaCl溶液(0.1、0.2、0.3 mol/L)、urea溶液(0.1、0.2、0.3 mol/L)和K12(1%、2%、3%)混合,以不含这3种化学物质的蛋白混合物作为对照。将悬浮的混合物置于试管中,用95 ℃水浴加热15 min,冷却至37 ℃,在0.1~10.0 Hz,1%的应变条件下进行流变学测试。
1.3.9复配样品消化特性的测定
样品消化率根据Englyst等[16]的方法测定,并稍作修改。称取600 mg制备好的样品,加入乙酸钠缓冲溶液(15 mL、0.1 mol/L、pH值5.2)以及6枚玻璃珠于100 mL锥形瓶中,在37 ℃下间歇混合平衡5 min。将5 mL混合酶溶液(猪胰α-淀粉酶和淀粉葡萄糖苷酶)添加到每个锥形瓶中。将样品放入37 ℃恒温水浴摇床中进行酶解。在0、10、20、30、40、60、80、100、120 min各取出0.5 mL,并与4 mL的无水乙醇(质量分数为70%)混合以终止反应,在4 500 r/min下离心10 min,取离心后的上清液,采用D-葡萄糖检测试剂盒来测定水解产物。将0、20、120 min水解后的葡萄糖含量分别标记为m0、m20和m120。根据式(1)、(2)、(3)计算快消化淀粉(RDS),慢消化淀粉(SDS)和抗性淀粉(RS)的含量。
(1)
(2)
w(RS)=[1-w(RSD)-w(SDS)]×100%。
(3)
式(1)(2)(3)中,m0是上清液中样品的游离葡萄糖质量,mg;m20是20 min时释放的葡萄糖质量,mg;m120是120 min时释放的葡萄糖质量,mg;mTS是总淀粉质量,mg。
1.4 数据处理
所有实验重复测试3次取平均值。通过SPSS 25.0软件对实验数据进行差异显著性分析,P<0.05为差异显著,同时使用Origin 2018软件绘图。
2 结果与分析
2.1 U-SPI结构特性分析
2.1.1U-SPI二级结构分析
SPI在波数为400~4 000 cm-1的红外光谱见 图1。 利用PeakFit 4.0软件进行处理,通过去卷积计算可以得到蛋白质二级结构含量变化[17]。
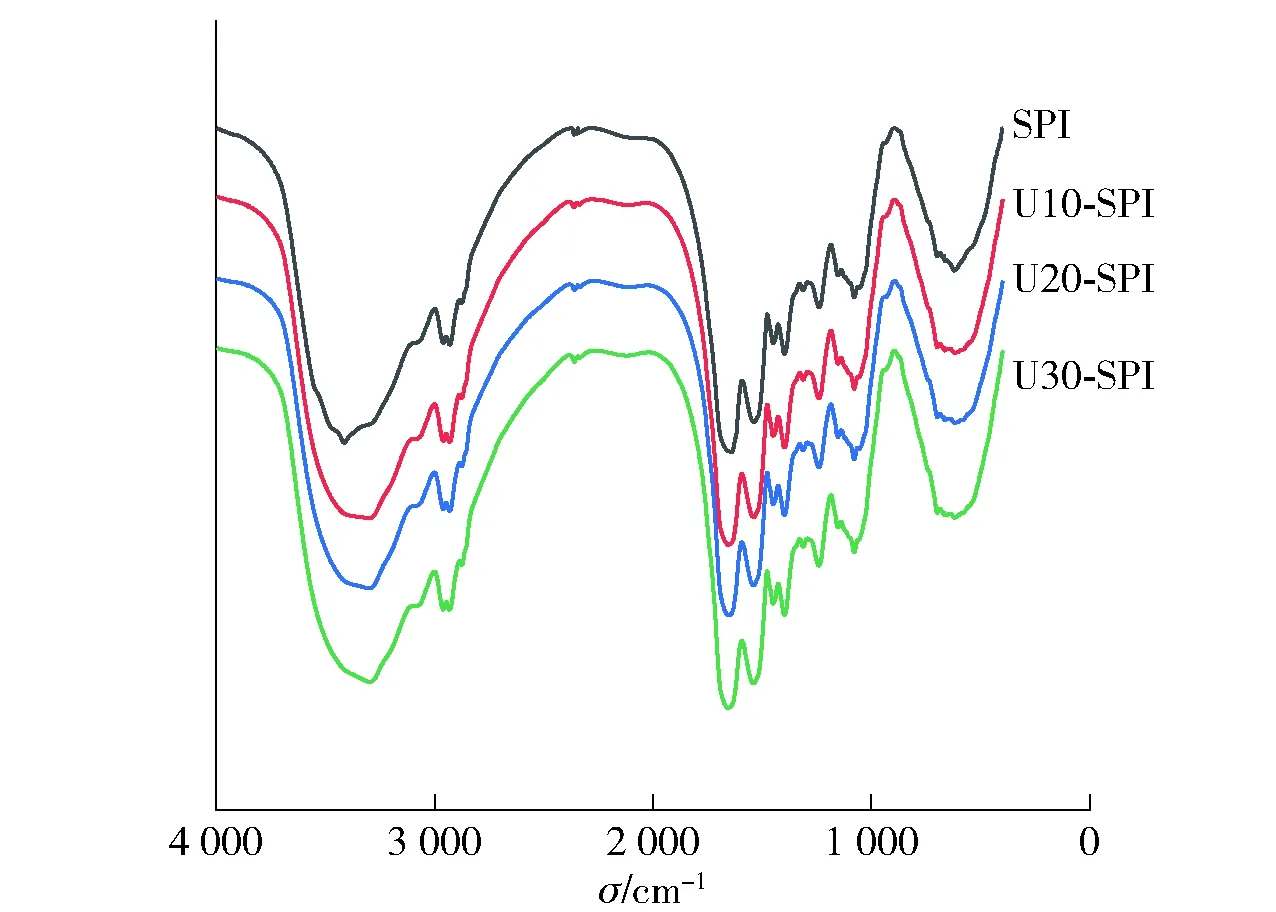
图1 不同超声时间处理SPI的红外光谱
不同超声时间处理下SPI的二级结构相对含量分析结果见表1。由表1可知,与原蛋白相比,随着超声时间的延长,U-SPI的二级结构发生显著变化,其α-螺旋结构相对含量减少,β-转角和无规卷曲结构相对含量增加,表明蛋白结构由有序向无序趋势转变。这可能由于超声处理破坏了蛋白质结构,增加蛋白质分子柔韧性,夏轩泽等[18]也得出类似结论。β-折叠相对含量能够反映蛋白质疏水作用力,β-折叠相对含量降低表明蛋白表面疏水基团暴露,疏水性增强[19]。实验结果表明,随超声时间的延长,蛋白的表面疏水性的增加,二级结构发生改变,并且打开蛋白分子或者聚合体,使巯基和疏水基团暴露,可能会改变蛋白三级结构,本实验结果与Hu等[20]和Zhao等[21]的研究结果相类似。这些性质的变化可能会对蛋白- 淀粉凝胶的形成及特性产生一定影响。

表1 不同超声时间处理下SPI的二级结构相对含量
2.1.2 U-SPI三级结构分析
在激发波长为280 nm处可反映蛋白质内部色氨酸的荧光强度变化,大量色氨酸存在于SPI的内部疏水区域,因此可从荧光的波动确定蛋白质三级结构的变化[22]。不同超声时间处理SPI荧光强度的变化结果见图2。由图2可知,随着超声时间延长,SPI内源荧光强度升高,说明蛋白内部暴露的色氨酸基团增多。Sui等[23]在研究过程中也得出类似结论。超声后的SPI荧光强度增加,可能是由于超声处理改变了蛋白质分子内部的极性微环境,使蛋白结构变得疏松,促进蛋白内部疏水区域的打开,使埋藏于蛋白分子内部的疏水基团暴露出来导致荧光强度增加。本实验结果与Li等[24]的研究结果一致。
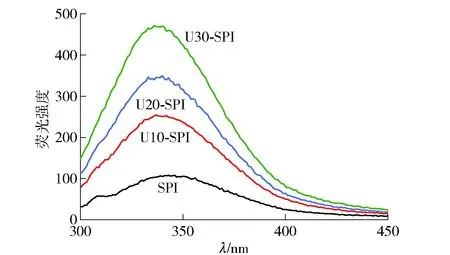
图2 不同超声时间处理SPI荧光强度的变化
2.2 复配样品结构特性分析
2.2.1复配样品傅里叶红外光谱分析

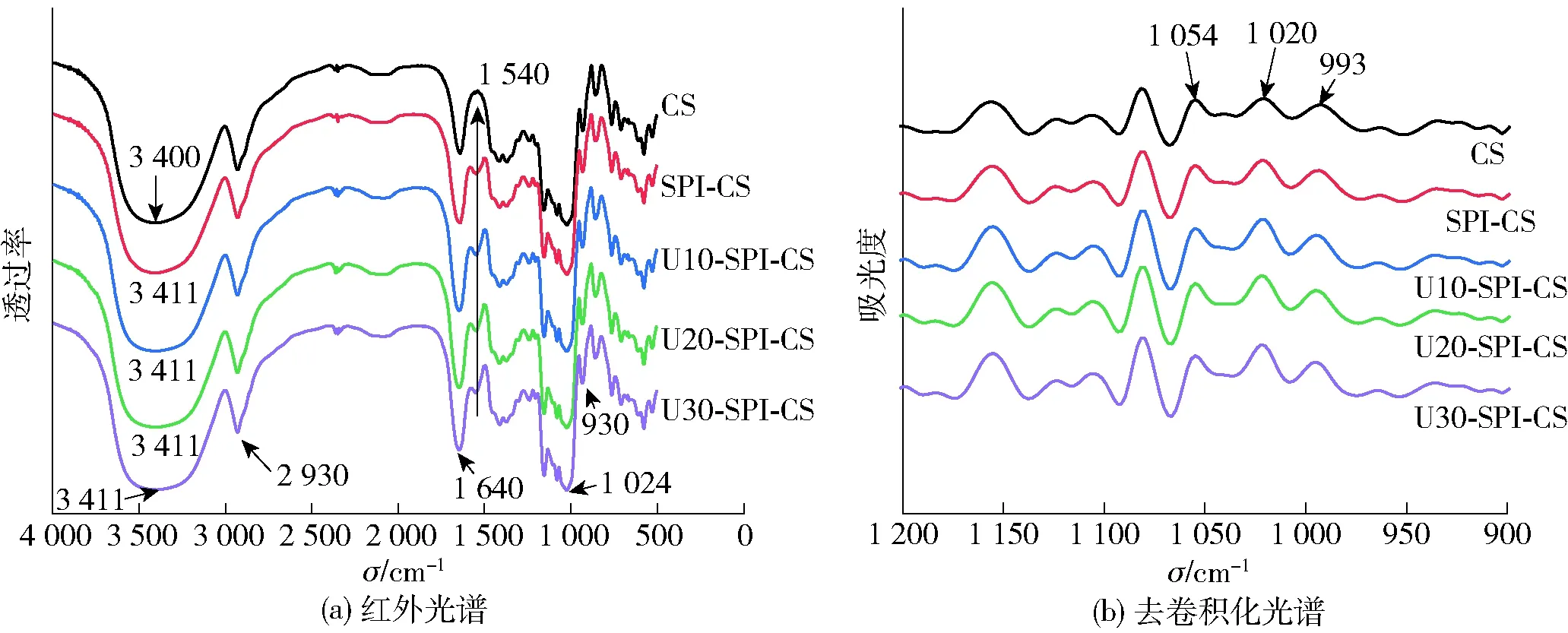
图3 不同超声条件改性SPI-CS复配体系的红外光谱和去卷积化光谱
对900~1 200 cm-1段特征峰进行去卷积处理,分析蛋白质对淀粉短程有序结构的影响。1 054 cm-1和1 020 cm-1分别表征淀粉结晶区结构和非结晶区结构,993 cm-1表征淀粉分子羟基间形成的氢键结构[27]。波数为1 054 cm-1与1 020 cm-1、1 020 cm-1与993 cm-1处的吸收峰强度比值,可反映淀粉有序结构和氢键强度。不同超声条件改性SPI-CS复配体系的短程有序结构参数计算结果见表2。由表2可知,与CS相比,当添加U-SPI后,U-SPI-CS体系在波数为1 054 cm-1与1 020 cm-1的吸收峰强度比值随超声时间的延长呈逐渐下降趋势,而1 020 cm-1与993 cm-1的吸收峰强度比值逐渐升高。这表明淀粉颗粒短程有序性被破坏,淀粉颗粒的结晶区结构特征逐渐减弱,无定形区结构特征增强,淀粉分子链间原有的氢键被破坏,打破了分子间缔合状态。这可能是在超声波的空穴效应及高压和剪切力的作用下,随着超声时间的延长,SPI较大颗粒的聚集体解聚成更小的蛋白颗粒[28],而小颗粒蛋白分子的加入抑制了淀粉分子间的相互作用,从而抑制淀粉分子内和分子间氢键的形成。
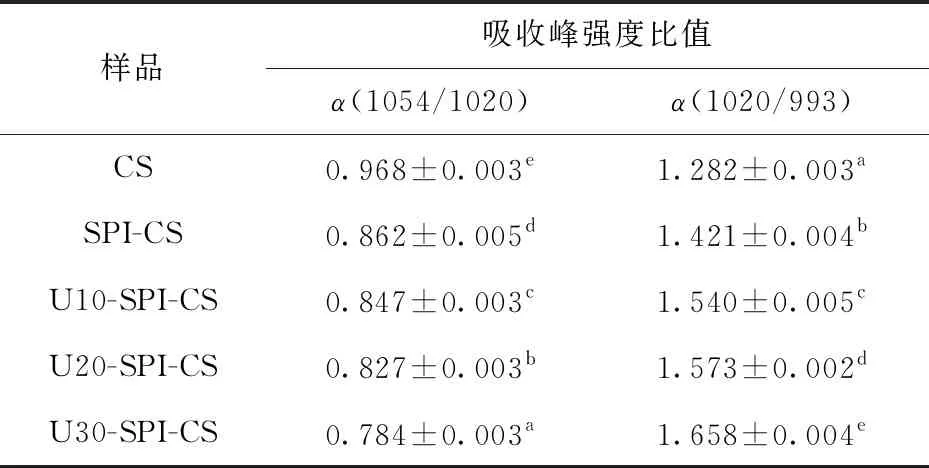
表2 不同超声条件改性SPI-CS复配体系的短程有序结构参数
2.2.2 复配样品的热特性分析
不同超声条件改性SPI-CS复配体系的热力学参数测定结果见表3。由表3可知,热处理后,SPI和U-SPI的加入使复配体系的热特性产生明显变化。ΔH可用来表示淀粉相变过程中双螺旋解聚及熔融所需要的能量,淀粉的有序结构被破坏使得体系焓值降低[29]。与CS相比,热处理后的SPI-CS体系和U-SPI-CS体系的ΔH均显著降低(P<0.05),当超声时间为0、10、20、30 min时,SPI和U-SPI的加入使复配体系ΔH分别降低了10.02%、20.25%、23.14%、27.27%。由此可见,SPI和U-SPI的加入,可降低淀粉熔融所需要的能量。与SPI-CS体系相比,U-SPI-CS体系作用的程度更大;且随着超声时间的延长,ΔH降低的程度越大。这表明超声对于蛋白质结构的伸展和构象的改变,影响了其与玉米淀粉复合凝胶体系的形成。超声空穴效应使蛋白质大分子物质分解为小分子颗粒,导致体系中蛋白颗粒的大小和数目均发生了变化[30],使超声改性蛋白能更大程度包裹在淀粉颗粒表面。随着超声时间的延长,改性的蛋白质颗粒粒径变小[31],包裹的程度更大,阻碍了水分子与淀粉颗粒的接触,使淀粉分子间氢键的结合受到抑制,导致淀粉颗粒中结晶区域的不完全熔化,从而使糊化受到抑制,降低了ΔH。

表3 不同超声条件改性SPI-CS复配体系的热力学参数
2.2.3复配样品的晶体结构分析
淀粉是一种天然多晶聚合物,常用X-射线衍射的方法来分析淀粉的晶体结构特征[32]。不同超声条件改性SPI-CS复配体系的X射线衍射图见图4。由图4可知,未糊化的玉米淀粉在2θ为15°和23°处显示强衍射峰,在17°和18°处有未分解的双峰,这是典型的A型结构[32]。糊化后,CS、SPI-CS和U-SPI-CS体系的XRD图均表现出分散的模式,原淀粉的结晶峰消失,表明糊化使淀粉凝胶样品中A型结构受损[33]。所有样品均在2θ约20°时出现宽峰,呈现典型Ⅴ型结构[34]。这是因为淀粉在糊化过程中由于湿热效应破坏了淀粉的晶体结构有序性,而在冷却过程中只有一小部分有缺陷的晶体形成。随着SPI和不同超声时间SPI的加入,复配体系峰的位置未发生明显变化,也没有出现与淀粉和蛋白质晶体相关的新峰。这表明不同超声时间处理SPI的添加对CS的晶体类型没有影响。Wang等[15]在研究籼稻淀粉与蛋白热加工相互作用时也得到类似研究结果,但区别于Wang等研究的是本实验采用了改性的SPI。
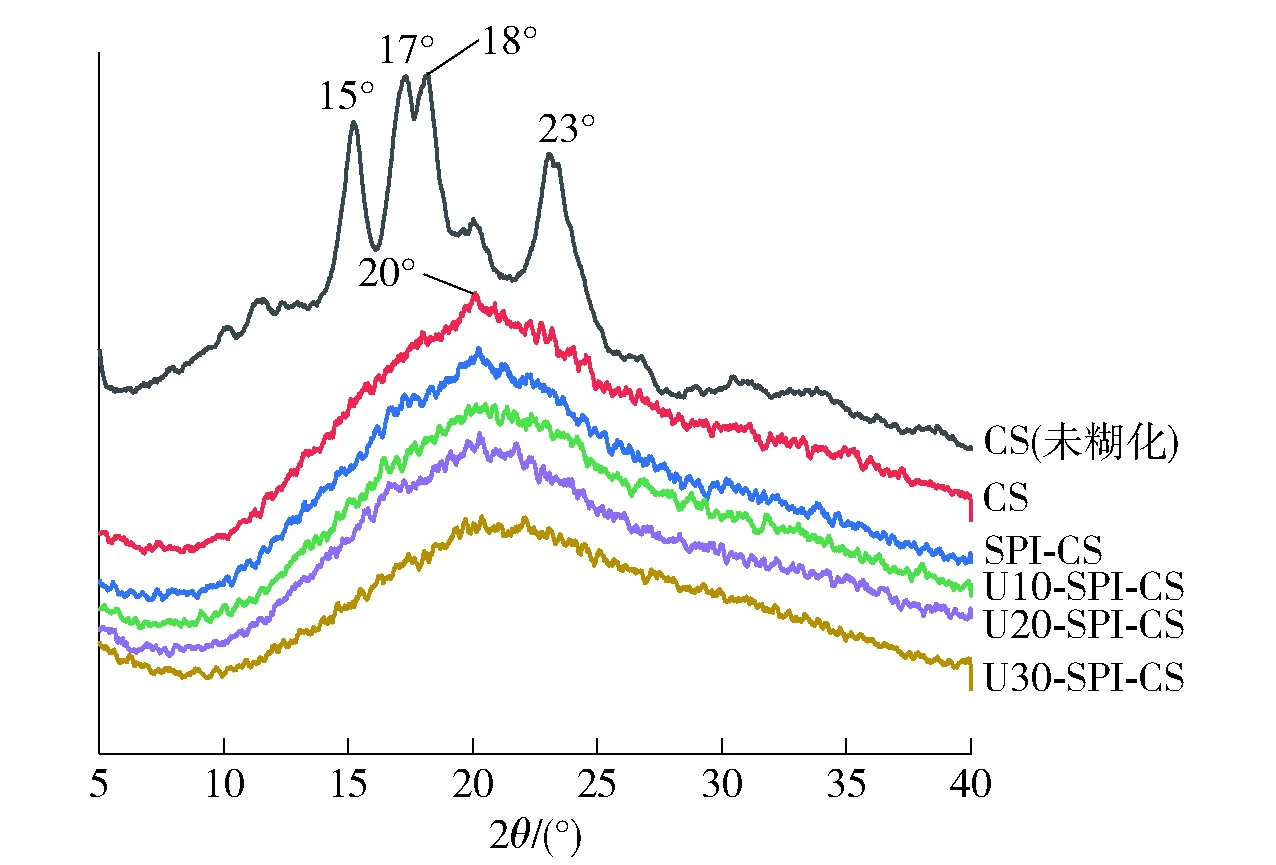
图4 不同超声条件改性SPI-CS复配体系的 X射线衍射图
2.2.4复配样品的相互作用力分析
本研究通过在样品中添加特定化学物质(NaCl、urea和K12)来研究非共价结合相互作用对淀粉- 蛋白质混合物的流变学或黏度特性的影响。NaCl影响静电相互作用,urea破坏氢键,K12影响疏水力[35]。受添加特定化学物质影响的SPI-CS和U30-SPI-CS体系储能模量图谱见图5。由图5可知,当体系中加入K12后,SPI-CS和U30-SPI-CS体系的弹性模量G′位移明显向高值移动,且随着K12浓度的升高弹性模量G′移动越明显,而加入NaCl和urea则波动较小,说明相比静电相互作用和氢键,SPI-CS和U30-SPI-CS中主要以疏水相互作用为主。
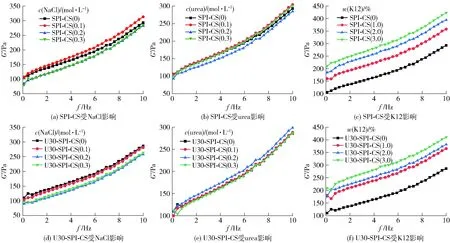
图5 添加NaCl、urea和K12对淀粉- 蛋白糊的储能模量的影响
在超声及加热过程中,蛋白质发生部分变性,可能会暴露蛋氨酸、半胱氨酸等疏水氨基酸[36],这些疏水残基与淀粉的疏水区域(如C-H)发生疏水相互作用[37]。改性蛋白在静电相互作用力和疏水作用力的共同作用下可能吸附在淀粉颗粒的表面,与淀粉分子链缠结,形成凝胶,从而改变淀粉的糊化、回生和流变学性质[38]。Xu 等[39]利用色谱法和分子模拟也证实大米蛋白和直链淀粉间可自发地结合,且主要驱动力为疏水相互作用力。
2.3 复配样品的消化特性分析
SPI-CS和U-SPI-CS复配体系体外消化拟合曲线见图6。由图6可知,与SPI-CS体系相比,U-SPI-CS体系的水解率下降程度更显著,且随着超声时间的延长,U-SPI-CS体系的水解率下降程度越大。RDS、SDS、RS质量分数分析结果见表4。由表4可知,SPI和U-SPI的加入使体系的水解率和RDS质量分数显著降低(P<0.05),SDS和RS质量分数显著升高(P<0.05)。与CS相比,添加超声时间0、10、20、30 min的SPI时,复配体系的RDS质量分数分别降低了2.42%、7.11%、9.43%、10.42%,SDS含量分别升高了1.60%、5.31%、6.60%、7.01%,RS含量分别升高了0.82%、1.80%、2.83%、3.41%。RDS、SDS和RS质量分数分析结果表明,U-SPI比SPI改变淀粉消化率的效果更明显。这可能是由于超声改性后暴露出的疏水残基可显著增强蛋白质- 淀粉的相互作用,促使蛋白包裹在淀粉颗粒表面,阻碍淀粉和淀粉酶相互作用。且随超声时间的延长,更多通过超声改性后小颗粒蛋白附着在淀粉颗粒表面,从而起到包裹作用,降低了淀粉酶与淀粉接触的面积,促进了淀粉之间的相互聚集,导致了SDS和RS质量分数升高。相关研究表明,淀粉的Ⅴ型晶体结构更有助于形成抗性淀粉,并在抑制淀粉消化中起重要作用[40],体外消化特性分析也证实了2.2.3中图4的这一结论。与CS相比,U30-SPI-CS复配体系对淀粉消化的抑制作用最为显著,表现出对人体的潜在健康益处。López-Barón等[41]在研究天然、变性和经酶水解的几种蛋白对小麦淀粉消化性的影响时发现,天然蛋白和淀粉的结合力较弱,对混合物的RDS质量分数无显著影响,而酶水解和热变性后暴露出的疏水残基可显著增强蛋白质- 淀粉的相互作用,促使蛋白在淀粉颗粒表面形成一层包衣,阻碍酶的可及性,显著降低了混合物的RDS质量分数。
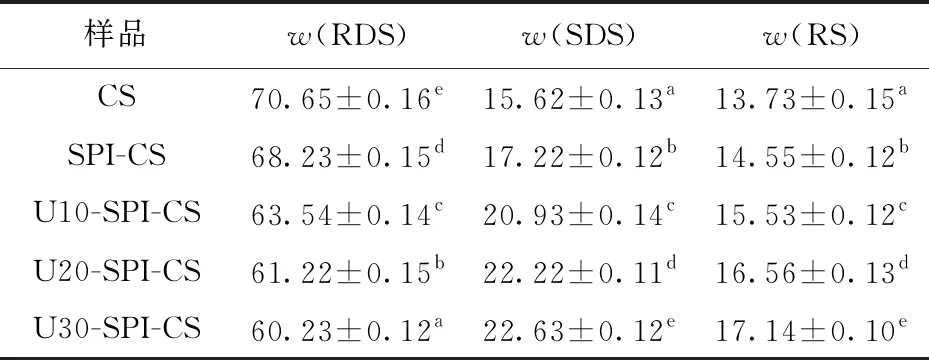
表4 超声改性蛋白对玉米淀粉体外消化结果的影响
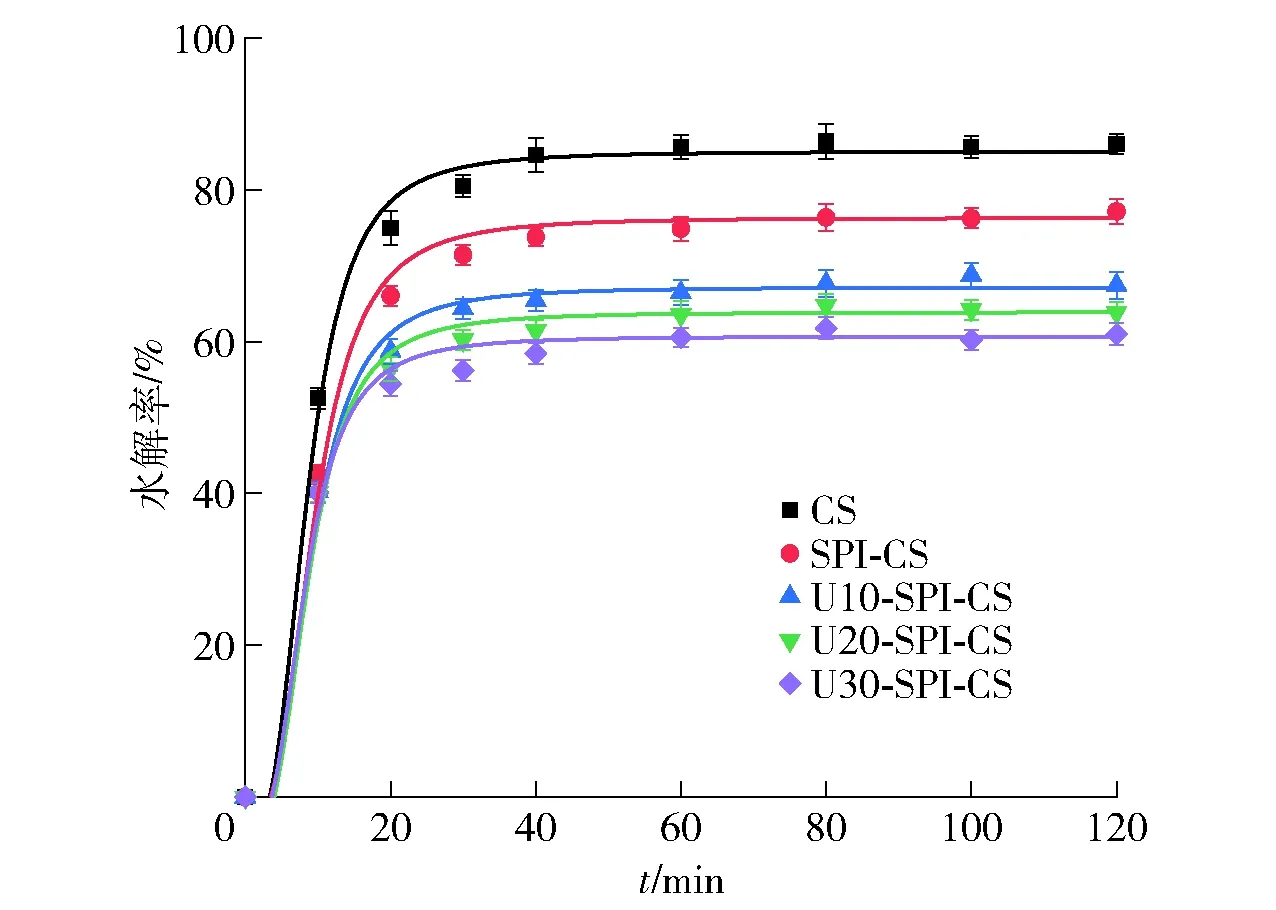
图6 不同超声条件改性SPI-CS复配体系的 水解率变化
3 结 论
本研究对超声改性SPI-CS凝胶的结构以及消化特性影响进行了分析。与CS相比,在CS中添加不同超声时间处理的SPI,U-SPI-CS凝胶体系的有序程度降低,分子间及分子内氢键强度减弱,ΔH降低;与SPI-CS复配体系相比,U-SPI-CS体系的作用效果更为显著(P<0.05)。随着超声处理时间的延长,U-SPI的加入使CS的短程有序性、体系氢键强度和ΔH均逐渐降低;SDS和RS质量分数逐渐升高。相互作用力的分析结果表明,超声改性蛋白与淀粉间主要结合方式为疏水相互作用。X-射线衍射分析表明复配体系在2θ约20°出现宽峰,形成了典型的Ⅴ型晶体结构。改性蛋白加入改变了淀粉消化特性。与CS相比,超声30 min U-SPI-CS复配体系变化最明显,SDS和RS质量分数分别提升了7.01%和3.41%。此外,为进一步明确超声改性SPI对CS消化特性的影响,有待于在体内进行再验证,如细胞实验、动物实验;体内血糖变化规律、胰岛素抵抗情况等还有待进一步研究。希望本研究可为超声改性蛋白对CS凝胶结构及消化特性的影响规律提供一定的理论指导。
