环状RNA hsa_circ_0009735 对胃癌细胞上皮间质转化、细胞周期和自噬的影响
2022-12-15朱琳琦邵世和
刘 云, 朱琳琦, 邵世和
(江苏大学医学院检验医学研究所微生物学及检验教研室, 江苏 镇江 212013)
胃癌是一种起源于胃黏膜细胞的恶性肿瘤, 是世界上位列第四的常见恶性肿瘤和位列第三的癌症死亡原因, 2018 年, 全球约有1 033 701 例胃癌新发病例和782 685 例胃癌相关死亡病例[1-3]。早期胃癌患者缺乏明显的症状, 大多数胃癌患者一经诊断即为胃癌晚期, 尽管近年来胃癌的诊断方法和手术方式方面取得了较多进展, 但胃癌患者的总体生存率仍较低。研究[4-6]显示:幽门螺杆菌感染、环境因素、饮食生活习惯和基因因素均是胃部疾病发生发展的重要因素, 可能导致胃癌的发生。环状RNA 是一类新发现的非编码RNA, 具有环状结构, 能够抵抗RNase R 酶作用, 稳定存在于患者组织或血液中, 可以通过多种方式调控胃癌细胞迁移、增殖、凋亡和自噬等过程, 影响胃癌进展[7-9], 但hsa_circ_0009735 在胃癌中的作用及其机制目前尚无相关报道。本研究分析hsa_circ_0009735 在胃癌组织和细胞中的表达情况, 通过转染小干扰RNA 和过表达质粒探讨hsa_circ_0009735 异常表达对胃癌细胞上皮间质转化进程(epithelialmesenchymal transition, EMT)、迁移、细胞周期和自噬的作用。本文作者探讨胃癌的发病机制, 为寻找有价值的胃癌分子标志物提供依据。
1 材料与方法
1.1 组织标本来源选取10 例江苏大学附属人民医院2020 年10 月—2021 年4 月诊治的胃癌患者的胃癌组织及相应的癌旁组织(距离肿瘤边缘≥5 cm)标本。研究对象纳入标准:术前未接受放化疗等任何形式的抗肿瘤治疗, 且经过病理诊断确诊为胃癌的患者;排除标准:有胃癌家族史和经过放化疗等治疗的患者。本研究获得江苏大学医学伦理委员会批准, 所有参与者均签署知情同意书。
1.2 细胞、主要试剂和仪器人正常胃黏膜GES-1细胞(丰晖生物科技有限公司), 人胃癌MGC-803、MKN-45 和HGC-27 细胞(北京北纳创联生物技术研究院)。RPMI 1640 培养基(美国Gibco公司), 胎牛血清(美国Hycone 公司), 1%青霉素-链霉素(北京Solarbio 公司), 雷帕霉素、hsa_circ_0009735 过 表 达 质 粒 (OE-hsa_circ_0009735) 及对照质粒(vector plasmid) 和细胞自噬质粒pcDNA-eGFP-LC3(上海生工生物科技有限公司), hsa_circ_0009735 小干扰RNA 和阴性对照(negative control)(苏州吉玛生物科技公司), Lipofectamine 3000 (美国Thermo Fisher 公司), TRIzol 试剂和逆转录试剂、 实时荧光定量PCR(real-time fluorescence quantitative PCR, RTqPCR)试剂和ECL 曝光液(南京诺唯赞生物科技有限公司), 兔抗GAPDH 抗体(美国Cell Signaling Technology 公司), 兔抗微管相关蛋白轻链 (microtuble-associated protein light chain 3, LC3) 抗体和Hoechst 33258 染色剂(武汉万类生物科技有限公司), 兔抗E-钙黏蛋白抗体、兔抗N-钙黏蛋白抗体、兔抗Vimentin 抗体和兔抗Cyclin D1 抗体(美国Proteintech 公司), 辣根过氧化物酶标记山羊抗兔IgG HRP(上海优宁维公司), 结晶紫(安徽省巢湖市弘慈医疗器械有限公司)。Transwell 小室(美国康宁公司), 移液枪、CO2培养箱和低温高速离心机(德国Eppendorf 公司), 超净工作台(上海启前电子科技有限公司), 倒置显微镜(日本Olympus 公司), 细胞爬片和抗荧光猝灭封片剂(上海碧云天生物科技有限公司), Western blotting 装 置 和4×Loading Buffer (美 股Bio-Rad 公司), SynergyH1 型BioTek 酶标仪(美国BioTek 公司), QYC-200 型恒温摇床(上海新苗医疗器械制造有限公司), DW-86L386 型立式超低温保存箱(青岛海尔特种电器有限公司)。
1.3 细胞培养和转染将正常胃黏膜GES-1 细胞、胃癌MGC-803 细胞、MKN-45 细胞和HGC-27细胞置于含10%胎牛血清和1%青霉素-链霉素的RPMI 1640 培养基中, 在37 ℃、含5% CO2的培养箱中培养。取对数生长期的胃癌MGC-803 细胞接种于细胞培养板6 孔板中, 待细胞融合度达50% ~70% 时, 采 用 Lipofectamine 3000 将 hsa_circ_0009735 小干扰RNA (上游引物:5'-CAUCAGACGAGAAGCUGUCTT-3', 下游引物:5'-GACAGCUUCUCGUCUGAUGTT-3') 和 阴 性 对 照 转染入MGC-803 细胞; 将对照质粒和hsa_circ_0009735 过表达质粒转染入HGC-27 细胞, 转染48 h 后采用RT-qPCR 法检测细胞转染效率, 收集细胞进行后续实验。
根据实验目的和转染质粒不同, 将胃癌MGC-803 细胞分为si-hsa_circ_0009735 组和阴性对照组;将胃癌HGC-27 细胞分为OE-hsa_circ_0009735 组和对照质粒组;MGC-803 细胞转染细胞自噬质粒pcDNA-eGFP-LC3 后分为空白组和不同浓度(0.25、0.50、1.00 和2.00 mg·L-1)雷帕霉素组。
1.4 RT-qPCR 法检测胃癌组织和细胞中hsa_circ_0009735 表达水平按照TRIzol 试剂说明书提取细胞总RNA 后, 逆转录为cDNA, 实验重复3 次, 引物序列: Hsa_circ_0009735 上游引物5'-ACATCAGACTGAGAGAAGCTGT-3', 下 游 引 物5'-GCGTAGAGTGCCTTCCGAAT-3'; GAPDH上游引物5'-CAGGAGGCATTGCTGA-TGAT-3', 下 游 引 物5'-GAAGGCTGGGG-CATTT-3', 以GAPDH 为内参。采用2-ΔΔCt法计算胃癌组织和细胞中hsa_circ_0009735 表达水平。
1.5 激光共聚焦显微镜观察各组MGC-803 细胞形态表现和细胞中自噬小体数将细胞自噬质粒(pcDNA-eGFP-LC3 质粒) 转染入MGC-803 细胞进行hsa_circ_0009735 敲减, 采用不同浓度(0.25、0.50、1.00 和2.00 mg·L-1)雷帕霉素处理18 h 后作为不同浓度雷帕霉素组, 并设空白组, 分别消化计数, 并将10 000 个细胞接种于细胞爬片上。次日, 采用4%多聚甲醛室温下固定30 min 后, 室温下PBS 洗涤5 次, 每次5 min, 采用Hoechst 33258室温下染色8 min, PBS 缓 冲 液 洗 涤5 次, 每次5 min, 取出爬片, 采用抗荧光猝灭封片剂封片后, 激光共聚焦显微镜拍照观察MGC-803 细胞形态表现和细胞中自噬小体数。
1.6 Western blotting 法检测各组细胞中LC3Ⅰ和LC3Ⅱ蛋白表达水平将待提取蛋白的细胞采用PBS 轻洗后, 将蛋白裂解液RIPA、蛋白酶抑制剂和磷酸酶抑制剂按照100∶1∶1 比例加入细胞中, 冰上裂解45 min~1 h, 充分裂解细胞, 13 000 r·min-1离心30 min, 吸取上清, 加入Loading Buffer, 96 ℃煮沸5 min 后获得细胞总蛋白。随后在SDSPAGE 凝胶(10%)上分离200 μg 细胞蛋白, 然后将蛋白转移至PVDF 膜上。室温下采用5%脱脂奶封闭PVDF 膜1~2 h, 在4 ℃摇床上抗体孵育过夜。次日, 洗膜后室温下HRP 标记的二抗孵育1 h, 洗膜后采用ECL 发光试剂拍照, 以GAPDH 作为内参, 采用Image J 软件分析各目的蛋白条带的灰度值, 计算目的蛋白表达水平, 目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值, 并计算LC3Ⅱ/LC3Ⅰ比值。
1.7 Transwell 小室实验检测各组细胞迁移细胞数 取各组MGC-803 和HGC-27 细胞, 采用无血清培养基重悬后调整细胞密度(200~300 μL, 含2×104个细胞), 接种于Transwell 小室的上室中, 24 孔细胞培养板中加入600 μL 完全培养基, 在37 ℃、5% CO2条件下培养24 h 后, 室温下采用4%多聚甲醛固定30 min, 结晶紫染色15 min 后, PBS 缓冲液清洗干净后采用无菌棉签擦拭小室中上室的细胞。显微镜下随机选取5 个视野, 采集图像观察迁移细胞数。实验重复3 次, 采用Image Pro Plus 软件计算迁移细胞数。
1.8 流式细胞术检测不同细胞周期各组细胞百分率收集转染48 h 后各组细胞, PBS 缓冲液洗涤后70%乙醇重悬细胞, -20 ℃过夜固定。次日, 细胞经冷PBS 缓冲液冲洗后, 采用PI/RNase 染色缓冲液重悬。在室温条件下孵育15 min。采用流式细胞术分析不同细胞周期各组细胞百分率。
1.9 Western blotting 法检测各组细胞中目的蛋白表达水平将待提取蛋白细胞采用PBS 清洗后, 将蛋白裂解液RIPA、蛋白酶抑制剂和磷酸酶抑制剂按照100∶1∶1 比例加入细胞中, 冰上裂解45 min~1 h 充 分 裂 解 细 胞, 13 000 r·min-1离 心30 min, 吸取上清, 加入Loading Buffer, 96 ℃煮沸5 min 后获得细胞总蛋白。随后在SDS-PAGE 凝胶(10%)上分离200 μg 细胞蛋白, 然后将蛋白转移至PVDF 膜上。室温下采用5% 脱脂奶封闭PVDF 膜1~2 h, 在4 ℃摇床上抗体孵育过夜。次日, 洗膜后室温下HRP 标记的二抗孵育1 h, 洗膜后采用ECL 发光试剂拍照留图, 以GAPDH 作为内参, 采用Image J 软件分析各目的蛋白条带的灰度值。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.10 统计学分析采用GraphPad Prism 8.0.2 统计软件进行统计学分析。各组组织和细胞中hsa_circ_0009735 mRNA 表达水平, 各组细胞迁移细胞数, 不同细胞周期细胞百分率、各组细胞中E-钙黏蛋白、Cyclin D1、Vimentin 和N-钙黏蛋白表达水平和LC3Ⅱ/LC3Ⅰ蛋白比值均符合正态分布, 以±s表示, 多组间样本均数比较采用单因素方差分析, 组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 胃癌组织和细胞中hsa_circ_0009735 表达水平PCR 产物经测序发现存在环化位点, 与环状RNA hsa_circ_0009735 序列匹配, 见图1。RTqPCR 检测结果显示:与癌旁组织(2.682±2.117)比较, 胃癌组织中hsa_circ_0009735 表达水平(5.777±2.719)升高(P<0.05);与GES-1 细胞比较, HGC-27 细胞和MKN-45 细胞中hsa_circ_0009735 表达水平差异无统计学意义(P>0.05), MGC-803 细胞中hsa_circ_0009735 表达水平升高(P<0.05)。见图2。
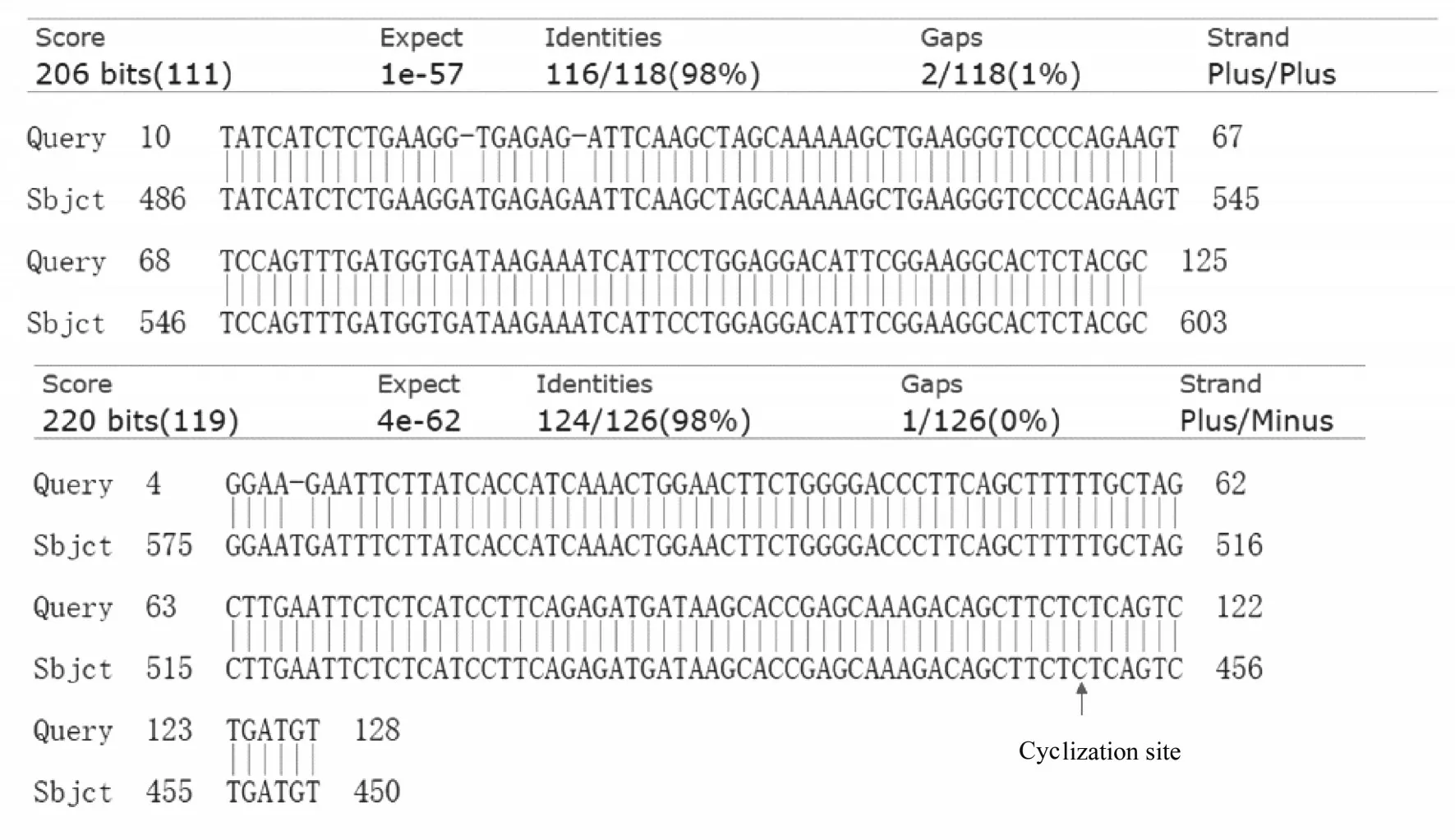
图1 PCR 产物测序结果和环化位点Fig.1 Sequencing results of PCR products and cyclization sites
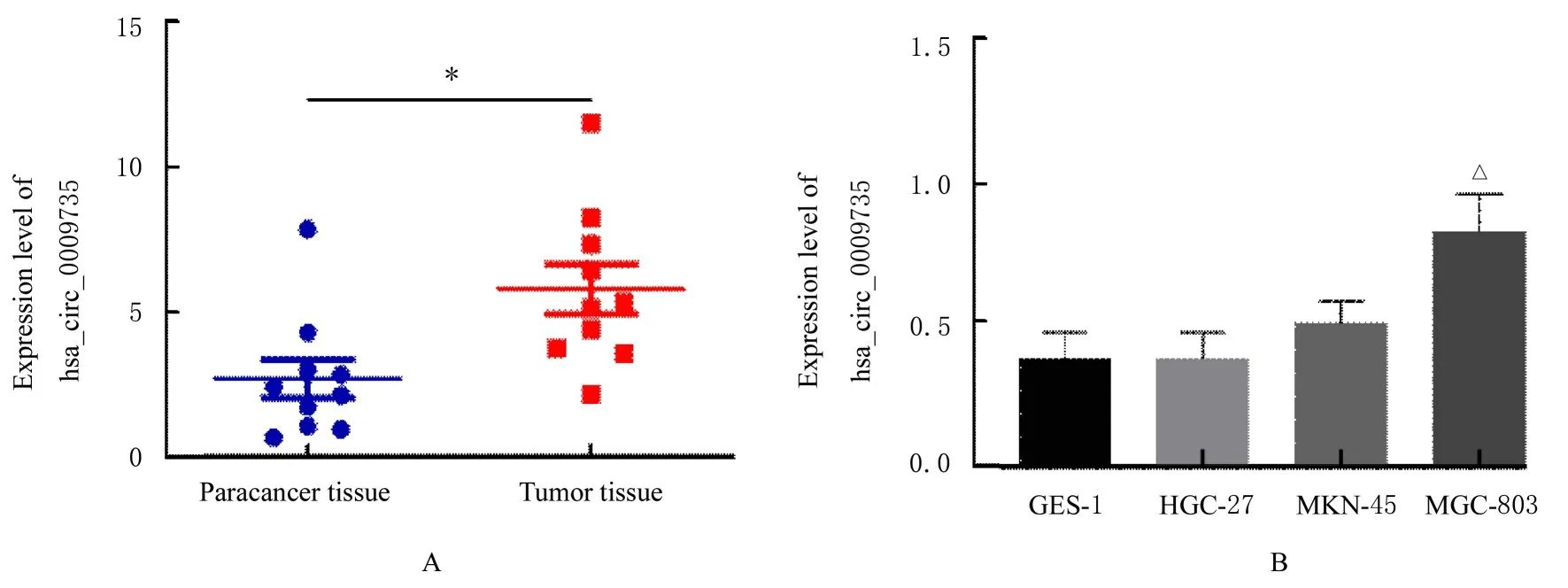
图2 胃癌组织(A)和胃癌细胞(B)中hsa_circ_0009735 表达水平Fig.2 Expression levels of hsa_circ_0009735 in gastric cancer tissue (A)and gastric cancer cells (B)
2.2 不同浓度雷帕霉素作用后MGC-803 细胞形态表现和细胞中自噬小体数与空白组比较, 0.25 和0.50 mg·L-1雷帕霉素组MGC-803 细胞形态无明显改 变, 1.00 mg·L-1雷帕霉 素 组MGC-803 细 胞 中颗粒明显增多, 边界不清, 2.00 mg·L-1雷帕霉素组MGC-803 细胞中有明显的毒性作用表现, 死亡细胞较多, 见图3。MGC-803 细胞转染pcDNAeGFP-LC3 质粒后, 给予不同浓度雷帕霉素处理, 激光共聚焦显微镜检测发现随着雷帕霉素浓度升高, 自噬小体数目逐渐增多, 1.00 mg·L-1雷帕霉素组MGC-803 细胞中自噬小体数明显增多, 但与2.00 mg·L-1雷帕霉素组比较无明显差异, 见图4。故后续选择1.00 mg·L-1雷帕霉素进行相关实验。

图3 各组MGC-803 细胞形态表现(×200)Fig.3 Morphology of MGC-803 cells in various groups(×200)
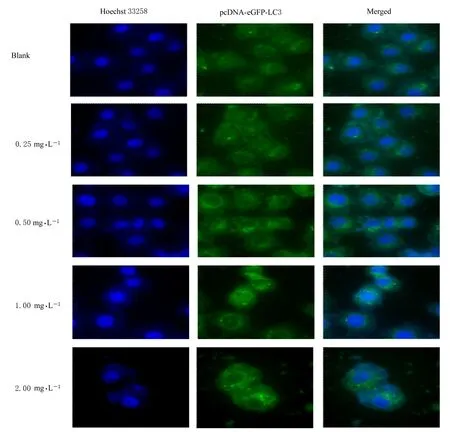
图4 各组MGC-803 细胞中自噬小体数(×600)Fig.4 Numbers of autophagosomes in MGC-803 cells in various groups(×600)
2.3 各组MGC-803 细胞中LC3Ⅱ/LC3Ⅰ比值和细胞中hsa_circ_0009735 表达水平与空白组比较, 不同浓度雷帕霉素组MGC-803 细胞中LC3Ⅱ/LC3Ⅰ比值升高(P<0.05), 且具有浓度依赖性, 见图5 和表2。与空白组比较, 不同浓度雷帕霉素组MGC-803 细胞中hsa_circ_0009735 表达水平降低(P<0.01), 且具有浓度依赖性, 见表2。
表2 各组MGC-803 细胞中 LC3 Ⅱ/LC3Ⅰ比值和hsa_circ_0009735 表达水平Tab. 2 Ratios of LC3 Ⅱ/LC3 Ⅰand expression levels of hsa_circ_0009735 in MGC-803 cells in various groups(n=3, ±s)
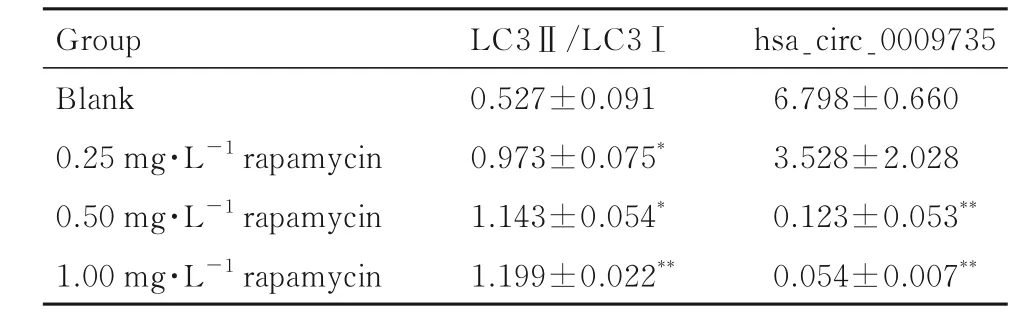
表2 各组MGC-803 细胞中 LC3 Ⅱ/LC3Ⅰ比值和hsa_circ_0009735 表达水平Tab. 2 Ratios of LC3 Ⅱ/LC3 Ⅰand expression levels of hsa_circ_0009735 in MGC-803 cells in various groups(n=3, ±s)
*P<0.05, **P<0.01 vs blank group.
Group Blank 0.25 mg·L-1 rapamycin 0.50 mg·L-1 rapamycin 1.00 mg·L-1 rapamycin hsa_circ_0009735 6.798±0.660 3.528±2.028 0.123±0.053**0.054±0.007**LC3Ⅱ/LC3Ⅰ0.527±0.091 0.973±0.075*1.143±0.054*1.199±0.022**
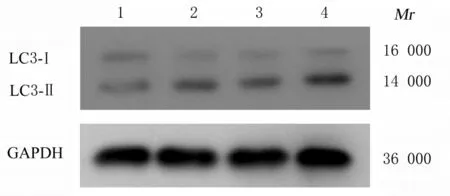
图5 各组MGC-803 细胞中LC3Ⅰ和LC3Ⅱ蛋白表达电泳图Fig. 5 Electrophoregram of expressions of LC3 Ⅰand LC3 Ⅱ proteins in MGC-803 cells in various groups
2.4 各组细胞中hsa_circ_0009735 表达水平与阴性对照组(2.467±0.209) 比较, si-hsa_circ_0009735 组MGC-803 细胞中hsa_circ_0009735 表达水平(1.384±0.075) 降低(P<0.01);HGC-27细胞中转染对照质粒和hsa_circ_0009735 过表达质粒48 h 后, 倒置荧光显微镜下观察转染效率为75%~85%, 见 图6。 与 对 照 质 粒 组(0.343±0.148) 比 较, OE-hsa_circ-0009735 组 细 胞 中hsa_circ_0009735 表达水平(1.295±0.204) 明显升高(P<0.01)。

图6 HGC-27 细胞转染效率(×100)Fig.6 Transfection efficiencies of HGC-27 cells (×100)
2.5 各组细胞迁移细胞数Transwell 小室实验表明:与 阴 性 对 照 组(931.0 个±19.8 个) 比较, si-hsa_circ_0009735 组MGC-803 细胞中迁移细胞数(261.5 个±84.2 个)明显减少(P<0.01);与 对 照 质 粒 组 (725.0 个±75.0 个) 比较, OE-hsa_circ-0009735 组HGC-27 细胞中迁移细胞数(1 771.0 个±47.4 个) 明显增加(P<0.01)。见图7。
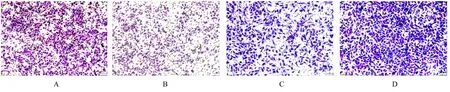
图7 Transwell 小室实验检测各组胃癌细胞迁移情况Fig.7 Migration of gastric cancer cells in various groups detected by Transwell chamber assay
2.6 各组不同细胞周期细胞百分率流式细胞术检测结果显示:与阴性对照组比较, si-hsa_circ_0009735组MGC-803 细胞中G1期细胞百分率升高(P<0.05), S 期细胞百分率降低(P<0.01), G2期细胞百分率降低(P<0.05);与对照质粒组比较, OE-hsa_circ_0009735 组HGC-27 细胞中G1期细胞百分率降低(P<0.01), S 期细胞百分率升高(P<0.05), G2期 细 胞 百 分 率升高(P<0.05)。 见图8 和表3。
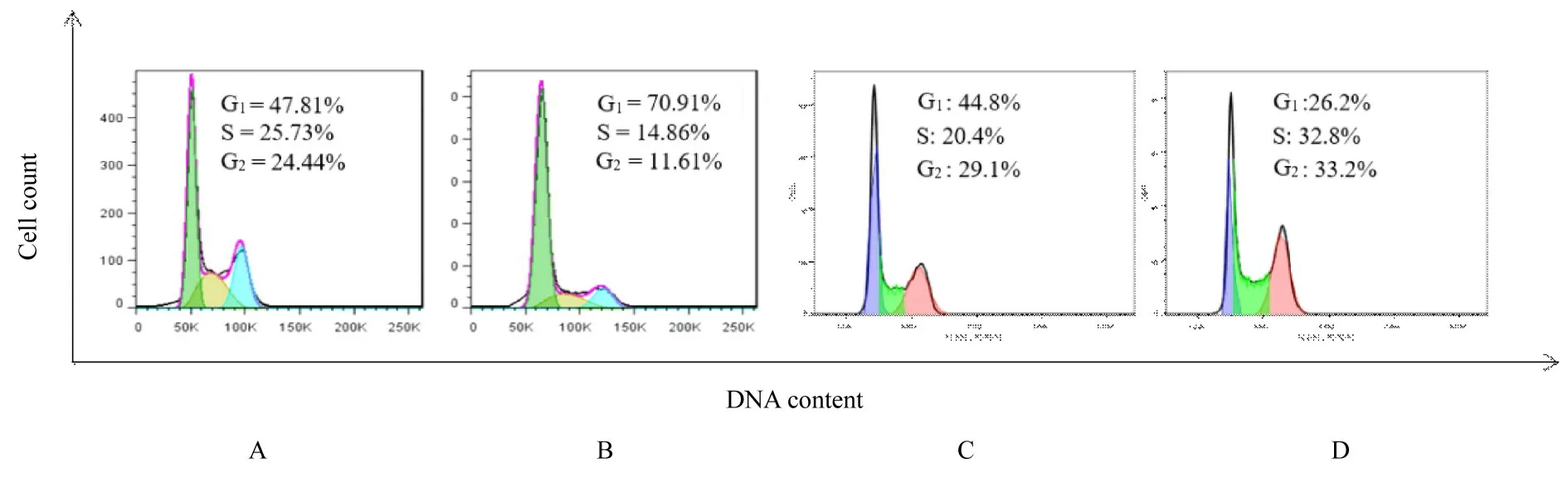
图8 流式细胞术检测各组不同细胞周期细胞百分率Fig.8 Percentages of cells at different cell cycles in various groups detected by flow cytometry
表3 各组不同细胞周期细胞百分率Tab.3 Percentages of cells at different cell cycles in various groups (n=3,±s, η/%)
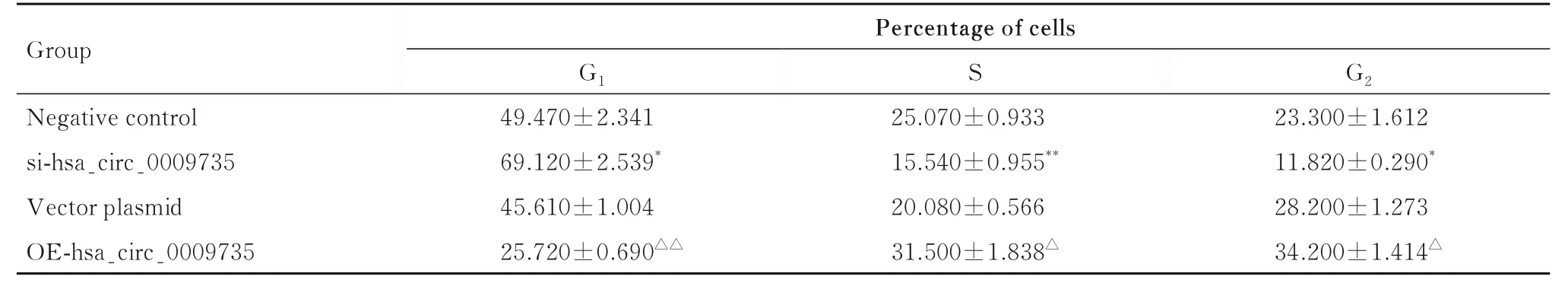
表3 各组不同细胞周期细胞百分率Tab.3 Percentages of cells at different cell cycles in various groups (n=3,±s, η/%)
*P<0.05, **P<0.01 vs negative control group;△P<0.05, △△P<0.01 vs vector plasmid group.
Group Percentage of cells S G2 Negative control si-hsa_circ_0009735 Vector plasmid OE-hsa_circ_0009735 G1 49.470±2.341 69.120±2.539*45.610±1.004 25.720±0.690△△23.300±1.612 11.820±0.290*28.200±1.273 34.200±1.414△25.070±0.933 15.540±0.955**20.080±0.566 31.500±1.838△
2.7 敲减hsa_circ_0009735 后MGC-803 细胞中自噬小体数和LC3Ⅱ/LC3Ⅰ比值MGC-803 细胞转染细胞自噬质粒(pcDNA-eGFP-LC3) 后, 分为阴性对照组和si-hsa_circ_0009735 组。与阴性对照组比较, si-hsa_circ_0009735 组MGC-803 细胞中自噬小体数增多, 见图9。与阴性对照组比较, si-hsa_circ_0009735 组MGC-803 细 胞 中LC3 Ⅱ/LC3Ⅰ比值升高(P<0.01);与对照质粒组比较, OE-hsa_circ_0009735 组HGC-27 细 胞 中LC3 Ⅱ/LC3Ⅰ比值降低(P<0.01)。见图10 和表4。
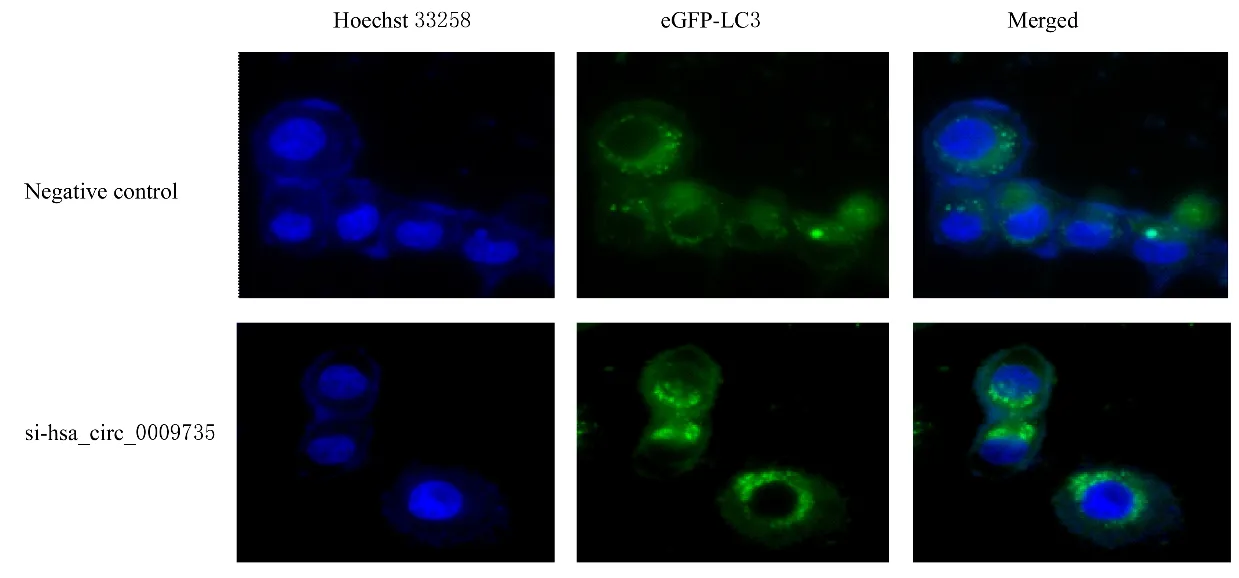
图9 敲减has_circ_0009735 后2 组MGC-803 细胞中自噬小体形态表现(×600)Fig.9 Morphology of autophagy in MGC-803 cells in two groups after hsa_circ_0009735 knockdown(×600)

图10 各组细胞中LC3Ⅰ和LC3Ⅱ蛋白表达电泳图Fig. 10 Electrophoregram of expressions of LC3 Ⅰand LC3Ⅱproteins in cells in various groups
2.8 各组胃癌细胞中E-钙黏蛋白、Cyclin D1、Vimentin 和N- 钙黏蛋白表达水平Western blotting 检测结果显示:与阴性对照组比较, si-hsa_circ_0009735 组MGC-803 细胞中E-钙黏蛋白表达水平无明显变化, Cyclin D1、Vimentin 和N-钙黏蛋白表达水平均降低(P<0.05 或P<0.01);与对照质粒组比较, OE-hsa_circ_0009735组HGC-27 细胞中E-钙黏蛋白表达水平降低(P<0.05), Cyclin D1、Vimentin 和N-钙黏蛋白表达水平均升高(P<0.05)。见表4 和图11。
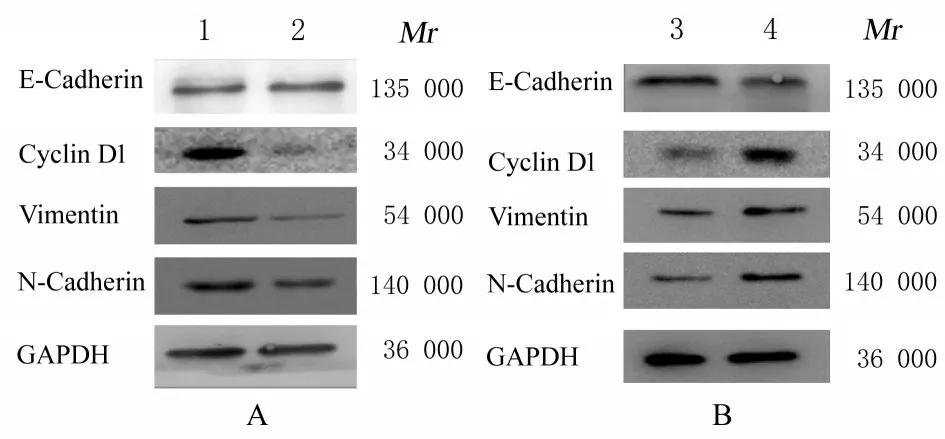
图11 各组胃癌细胞中E-钙黏蛋白、Cyclin D1、Vimentin和N-钙黏蛋白表达电泳图Fig. 11 Electrophoregrams of expressions of E-Cadherin,Cyclin D1,Vimentin,and N-Cadherin proteins in gastric cancer cells in various groups
表4 各组细胞中LC3Ⅱ/LC3Ⅰ比值和E-钙黏蛋白、Cyclin D1、Vimentin 及N-钙黏蛋白表达水平Tab. 4 Ratios of LC3Ⅱ/LC3Ⅰand expression levels of E-Cadherin, Cyclin D1, Vimentin ,and N-Cadherin proteins in cells in various groups (n=3, ±s)
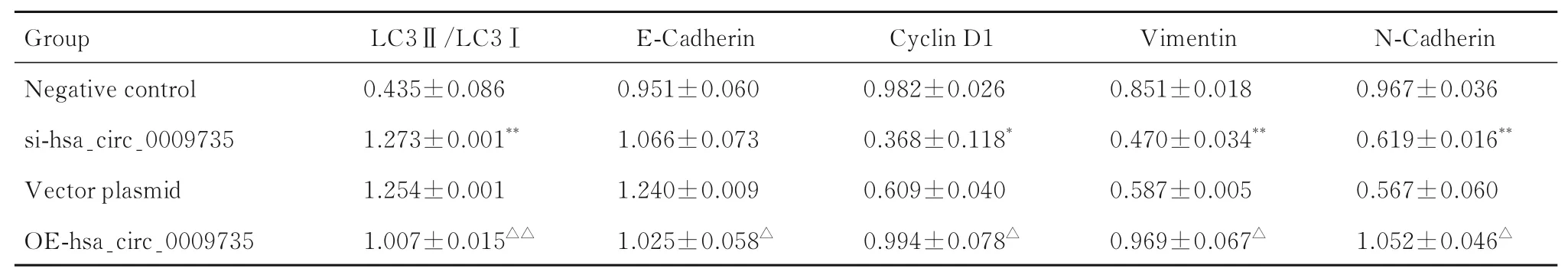
表4 各组细胞中LC3Ⅱ/LC3Ⅰ比值和E-钙黏蛋白、Cyclin D1、Vimentin 及N-钙黏蛋白表达水平Tab. 4 Ratios of LC3Ⅱ/LC3Ⅰand expression levels of E-Cadherin, Cyclin D1, Vimentin ,and N-Cadherin proteins in cells in various groups (n=3, ±s)
*P<0.05, **P<0.01 compared with negative control group;△P<0.05, △△P<0.01 compared with vector plasmid group.
Group Negative control si-hsa_circ_0009735 Vector plasmid OE-hsa_circ_0009735 N-Cadherin 0.967±0.036 0.619±0.016**0.567±0.060 1.052±0.046△LC3Ⅱ/LC3Ⅰ0.435±0.086 1.273±0.001**1.254±0.001 1.007±0.015△△E-Cadherin 0.951±0.060 1.066±0.073 1.240±0.009 1.025±0.058△Cyclin D1 0.982±0.026 0.368±0.118*0.609±0.040 0.994±0.078△Vimentin 0.851±0.018 0.470±0.034**0.587±0.005 0.969±0.067△
3 讨 论
环状RNAs 是一类具有共价闭合环状结构的新型RNA, 是近年来非编码RNA 研究领域的新热点。早在20 世纪70 年代, 人们首次在病毒中发现了环状RNA[10]。随着RNA 测序技术和生物学信息的发展, 发现哺乳动物细胞中大量存在环状RNAs, 在胃癌的生长、转移、复发和肿瘤耐药中发 挥 重 要 作 用[11]。 研 究[12]显 示: 环 状RNA FBXO11(circFBXO11)在胃癌组织中高表达, 可通过miR-376a-3p/SNRPB 靶轴调控胃癌细胞增殖和细胞凋亡。张辉等[13]研究显示:环状RNA circFOXO3 在胃癌组织中高表达, 与胃癌患者的组织分化、浸润深度和TNM 分期呈正相关关系, 可以促进胃癌细胞的增殖、侵袭和迁移过程。还有研究[14]显示:circ-ABCB10 在胃癌组织和细胞中高表达并预示着胃癌患者的不良预后, 能够通过miR1915-3p/Rac1 轴促进胃癌进展。本研究结果显示:PCR 扩增产物测序分析发现产物序列中存在hsa_circ_0009735 环化位点, 与hsa_circ_0009735 序列相匹配, 表明hsa_circ_0009735 为环状RNA;与癌旁组织比较, 胃癌组织中hsa_circ_0009735 高表达;与GES-1 细胞比较, 胃癌MGC-803 细胞中hsa_circ_0009735 表达水平较高。在胃癌MGC-803细胞中敲减hsa_circ_0009735 后, 迁移细胞数减少, G1期细胞百分率增加, S 期和G2期细胞百分率降低, 表明MGC-803 细胞中敲减hsa_circ_0009735 能够抑制胃癌细胞迁移和阻滞细胞周期。在HGC-27细胞中过表达hsa_circ_0009735 后迁移细胞数明显增多, G1细胞百分率明显降低, S 期和G2期细胞百分率升高, 表明过表达hsa_circ_0009735 能够促进细胞迁移及诱导细胞周期百分率发生改变。
研究[15]显示:环状RNA 还可以调控胃癌细胞自噬过程, circCUL2 可能作为肿瘤抑制因子和顺铂敏感性调节因子, 通过miR-142-3p/ROCK-2 激活自噬影响胃癌的生物学行为。体内体外实验[16]结果显示:在胃癌细胞中敲减circRACGAP1, 可能通过抑制自噬调控胃癌细胞对阿帕替尼的敏感性。本研究结果显示:1.00 mg·L-1雷帕霉素可引起MGC-803 细胞颗粒增多, 细胞中自噬小体数明显增多;随着雷帕霉素浓度升高, MGC-803 细胞中LC3Ⅱ/LC3Ⅰ比值逐渐升高, hsa_circ_0009735表达水平逐渐降低。敲减hsa_circ_0009735 后, MGC-803 细胞中自噬小体数增多, LC3Ⅱ/LC3Ⅰ比值升高, 表明敲减hsa_circ_0009735 促进细胞自噬过程发生。同时, 过表达hsa_circ_0009735 后, HGC-27 细胞中LC3Ⅱ/LC3Ⅰ比值降低, 抑制细胞自噬过程发生, 表明hsa_circ_0009735 可能通过调控LC3 蛋白表达变化影响胃癌细胞自噬过程。
EMT 进程是包括胃癌在内的恶性肿瘤侵袭迁移的重要机制之一[17-19]。研究[20]显示:circRNA_0023642 在胃癌组织和细胞中高表达, 可通过调控EMT 相 关 蛋 白N-钙 黏 蛋 白、Vimentin、snail 和E-钙黏蛋白影响胃癌进展。WU 等[21]研究显示:circRNA_0005075 在胃癌患者组织和细胞中高表达, 能够通过miR-431/p53 调控EMT 进程, 从而调节胃癌细胞的生长和迁移。还有研究[22]显示:Circ-OXCT1 在胃癌组织和细胞中表达水平降低, 其表达水平与胃癌患者的淋巴结迁移、临床分期和总体生存率有关。Circ-OXCT1 可下调SMAD4 表达, 通过miR-136/SMAD4 轴的转化生长因子β(transforming growth factor-β, TGF-β)/SMAD信号通路调控E-钙黏蛋白、 N-钙黏蛋白和Vimentin 表达, 导致EMT 进程增强, 促进细胞迁移和侵袭, 促进裸鼠肺迁移。
本研究结果显示:敲减hsa_circ_0009735 后, MGC-803 细胞中E-钙黏蛋白表达无明显变化, Vimentin 和N-钙黏蛋白表达水平均降低;过表达hsa_circ_0009735 后, HGC-27 细胞中E-钙黏蛋白表达水平降低, Vimentin 和N-钙黏蛋白表达水平均升高, 表明环状RNA hsa_circ_0009735 可能通过调控胃癌细胞EMT 进程, 但其调控EMT 进程的分子机制目前尚未阐明。除此之外, Cyclin D1 是一种重要的细胞周期调节蛋白, 在癌症的发病机制中起关键作用, 导致细胞不受控制的增殖过程[23-25]。相 关 研 究[26-27]显 示:在 胃 癌 早 期Cyclin D1 表达水平明显升高, 且其表达与患者不同临床参数有关。 本研究结果显示: 敲减hsa_circ_0009735后, MGC-803细胞中Cyclin D1表达水平降低;过表达hsa_circ_0009735 后, HGC-27 细胞中Cyclin D1 表达水平升高, 表明环状RNA hsa_circ_0009735 可能调控Cyclin D1, 进而影响胃癌细胞周期, 但其具体调控机制目前尚未清楚。因此, 本课题组将进一步探讨环状RNA hsa_circ_0009735 调控胃癌细胞EMT 进程和细胞周期的作用机制。
综上所述, hsa_circ_0009735 在胃癌组织和细胞中表达上调, 可以促进胃癌细胞EMT 进程、影响细胞迁移和细胞周期, 抑制胃癌细胞自噬过程。本研究对胃癌进展的分子机制有了新的认识, 这可能为胃癌提供了一种新的诊断标志物和治疗靶点。
