lncRNA-MIAT 对肿瘤相关巨噬细胞M2 型极化的作用及其机制
2022-12-15蒲兴魏李大星
许 静, 郭 健, 蒲兴魏, 李大星
(1. 贵州省骨科医院骨内科, 贵州 贵阳 550000;2. 贵州省骨科医院脊柱科, 贵州 贵阳 550000)
骨肉瘤(osteosarcoma, OS)是一种临床常见的骨恶性肿瘤, 约占所有原发性骨肿瘤的20%, 且好发于儿童与青少年时期。近年来, 随着综合化疗、手术切除和放疗等治疗手段的进步, 局限型OS 患者的5 年生存率可达60%。然而, OS 患者的总体预后仍然很差, 这与80%接受手术治疗的OS患者可发生肿瘤复发或转移有关[1-2]。因此, 深入探讨OS 进展的分子机制, 积极寻找肿瘤治疗的潜在靶点起重要意义。肿瘤相关巨噬细胞(tumorassociated macrophage, TAM)在肿瘤微环境的调节中起重要作用[3]。根据功能和表型的不同, 巨噬细胞可分为M1 型(经典活化巨噬细胞)和M2 型巨噬细胞(交替活化的巨噬细胞)。巨噬细胞极化是一个巨噬细胞对应微环境讯号所表现不同程式功能的过程。肿瘤微环境可促进M1 向M2 转化, 而M2 型巨噬细胞与肿瘤的侵袭和转移有密切关联[3-5]。
长链非编码RNA (long non-coding RNA, lncRNA) 是一类长度超过200 个核苷酸的非编码RNA。研究[6-7]显示:lncRNAs 参与调控肿瘤细胞的多个过程, 如细胞增殖、转移、凋亡、自噬和上皮-间充质转化等, 从而可作为癌基因或肿瘤抑制因子发挥作用。新近的研究[5]显示:TAM 中非编码RNA 可参与调节M2 型巨噬细胞的极化。lncRNA MIAT 具有增加心肌梗死的风险, 但近年来的研究[8]显示:lncRNA MIAT 还参与多种癌症的发生发展。在OS 组织中, lncRNA MIAT 表达呈异常升高, 且高表达的lncRNA MIAT 与OS 患者的肿瘤大小、临床分期和淋巴结转移呈正相关关系[9-10]。而在类风湿关节炎中, 有研究[11]显示:上调lncRNA MIAT 表达可诱导M2 型巨噬细胞极化以抵抗脂多糖诱导的炎症反应。但在OS 中, 异常高表达的lncRNA MIAT 是否参与调控TAM 中M2 型巨噬细胞的极化尚不清楚。本研究采用体内外实验探讨lncRNA MIAT 对M2 型巨噬细胞极化的影响及在肿瘤进展中的相关作用及其机制, 以期为OS 的免疫治疗提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人单核THP-1 细胞、OS MG63 细胞和人脐静脉内皮血管细胞(human umbilical vein endothelial vascular cell, HUVEC)均购自美国ATCC 细胞库。36 只4 周龄的雌性BALB/c 裸鼠(体质量为18~22 g)购自贵州医科大学实验动物中心, 动物生产许可证号:SCXK(黔) 2018-0001。靶向沉默和过表达lncRNAMIAT 的慢病毒颗粒(LV-shMIAT 和LV-MIAT)由上海汉恒生物科技有限公司设计并合成, DMEM 培养基和胎牛血清(fetal bovine serum, FBS) 购 自 美 国Gibco 公 司、 佛 波 酯(phorbol myristate acetate, PMA) 和1%青霉素-链霉素混合液购自杭州天航生物科技股份有限公司, 苏木精-伊红(hematoxylin-eosin, HE) 染色试剂盒、免疫组织化学EnVison 二步法试剂盒和二氮基联苯胺(3, 3'-diaminobenzidine, DAB)显色试剂盒购自北京索莱宝科技公司, SYBR Green Real-time PCR 试剂购自上海康成生物有限公司, 辣根过氧化物酶(horseradish peroxidase, HRP) 标记的山羊抗兔IgG 二抗购自江苏碧云天生物技术公司, PCR 引物合成由生工生物工程(上海)有限公司完成, TRIzol 试剂和反转录试剂盒购自美国Thermo 公司、 CD163 多克隆抗体购自美国Bioworld 公司, 磷酸化信号传导及转录激活蛋白6(phosphorylated signal transducer and activator of transcription 6, p-STAT6)、血管内皮细胞生长因子 受 体 2 (vascular endothelial growth factor receptor 2, VEGFR2)、Janus 激酶1(Janus kinase 1, JAK1) 和磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase gene, GAPDH) 单 克 隆抗体购自美国Abcam 公司, STAT6、δ 样蛋白4(delta like protein 4, DLL4)、Notch1 和CD31 多克隆抗体购自美国Cell Signaling Technology 公司, 白细胞介素4(interleukin-4, IL-4)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、白细胞介素10 (interleukin-10, IL-10) 和转化生长因子β1(transforming growth factor-β1, TGF-β 1)ELISA 检测试剂盒购自武汉博士德生物技术公司, 异硫氰酸荧光素酯(fluorescein 5-isothiocyanate, FITC)标记的CD163 和藻红蛋白(phycoerythrin, PE) 标 记 的F4/80 抗 体 购 自 美 国Biolegend 公 司, Transwell 小室(0.4 μm 孔径) 购自美国Millipore公司。光学倒置显微镜(B Ⅹ型) 购自日本Olympus 公 司, 实 时 荧 光 定 量PCR (real-time fluorescence quantitative PCR, RT-qPCR) 仪(iQ5 型) 购自美国Bio-Rad 公司, 流式细胞仪(FACSCalibur 型) 购自美国BD Bioscience 公司, 恒温细胞培养箱(371 型)购自美国Thermo 公司。
1.2 细胞培养和慢病毒感染THP-1、MG63 和HUVEC 均培养于含10%FBS、1%青霉素-链霉素混合液的DMEM 完全培养基中, 置于37 ℃、5%CO2恒温恒湿培养箱中培养。取生长状态良好的THP-1 细胞计数后, 按每孔5×105个接种至6 孔细胞培养板中, 待细胞生长融合至50%~70%时, 加入含LV-shMIAT、LV-MIAT 或空载体LV-Vector的慢病毒颗粒转染液, 按感染指数(multiplicity of infection, MOI)为50 将慢病毒颗粒与细胞缓慢充分混匀后, 置于37 ℃、5%CO2恒温恒湿培养箱中进行感染, 8 h 后更换为含10% DMEM 培养液, 感染48 h 后, 收集细胞, 采用RT-qPCR 法检测THP-1 细胞中lncRNA-MIAT 表达水平。继续培养72 h 后, 采 用 含10% FBS 和2 mg·L-1嘌 呤 霉 素 的DMEM 培养液进行筛选以建立稳定感染LVshMIAT、LV-MIAT 或LV-Vector 的细胞系。
1.3 细胞处理和分组取生长状态良好的稳定感染LV-shMIAT、LV-MIAT 或LV-Vector 的细胞, 参考文献[12]方法采用50 μg·L-1丙二醇甲醚醋酸酯。刺激THP-1 细胞48 h 使其活化为贴壁巨噬细胞, 采用20 μg·L-1IL-4 处理上述细胞48 h 后进行诱导分化。采用Transwell 共培养体系将经PMA活化后的TPH-1 细胞与MG63 细胞进行共培养, 并将细胞分为MG63 与感染LV-Vector 细胞的共培养组(MG63+LV-Vector 组), MG63 与感染LVshMIAT 细胞的共培养(MG63+LV-shMIAT 组), MG63 与感染 LV-MIAT 细胞的共培养组(MG63+LV-MIAT 组) 和IL-4 处理的感染LVVector 细 胞 组 (IL-4+LV-Vector 组)。 其 中Transwell 上室为经PMA 活化后的感染不同慢病毒颗粒的TPH-1 细胞, 下室为MG63 细胞或IL-4 诱导液。各组细胞置于37 ℃、5% CO2恒温恒湿培养箱中培养诱导48 h 后用于后续实验。
1.4 RT-qPCR 法检测各组细胞中lncRNA-MIAT表达水平TRIzol 法提取待测细胞中总RNA, 分光光度计检测浓度和纯度后, 采用逆转录试剂将其逆转录为cDNA, 再按照SYBR Green Real-time PCR试剂盒说明书确定的反应时间和温度进行PCR扩增。RT-qPCR 引 物 序 列: lncRNA MIAT-F 5'-GGACGTTCACAACCACACTG-3', lncRNA MIAT-R 5'-TCCCACTTTGGCATTCTAGG-3';GAPDH-F 5'-AGAAGGCTGGGGCTCATTTG-3', GAPDH-R 5'-AGGGGCCATCCACAGTCTTC-3'。以GAPDH 为内参, 采用2-ΔΔCt法计算细胞中lncRNA-MIAT 表达水平。实验单独重复3 次。
1.5 流式细胞术检测各组细胞中M2 型巨噬细胞(CD163+F4/80+)百分率取“1.3”步骤中各组中上室THP-1 细胞, PBS 缓冲液洗涤细胞3 次, 调整细胞密度后取约1×106个细胞至流式管中, 加入FITC 标 记 的CD163 与PE 标 记 的F4/80 抗 体 各10 μL, 避光孵育20 min 后, PBS 缓冲液再次洗涤细胞, 1 mL 流式缓冲液重悬细胞并采用200 目滤网过滤后, 上机分析M2 型巨噬细胞百分率。实验单独重复3 次。
1.6 ELISA 法检测各组细胞中细胞因子水平取“1.3”步骤中各组中上室THP-1 细胞的培养上清液, 3 000 r·min-1离心20 min 后, 取上清液, 并按照VEGF、IL-10 和TGF-β1 ELISA 试 剂 盒 说 明 书检测各组巨噬细胞中上述细胞因子水平。实验单独重复3 次。
1.7 EdU 染色检测各组HUVEC 增殖活力取“1.3”步骤中各组中的上室THP-1 细胞, 将其与HUVEC 在Transwell 共培养室中进行共培养, 上室为HUVEC, 下室为各组THP-1 细胞, 培养24 h后检测HUVEC 的增殖活力。EdU 染色法步骤:取各组HUVEC, 加入EdU 试剂孵育4 h 后, 采用4%多聚甲醛固定30 min, 然后加入2 g·L-1甘氨酸5 min, PBS 缓冲液洗涤后, 采用1×Apollo 染色液孵育30 min, 丢弃染色液, 采用含0.5%Triton X-100 透化10 min。再次以PBS 缓冲液洗涤后, 添加1×Hoechst33342 在室温下培养30 min。采用PBS 缓冲液洗涤后, 置于荧光显微镜下观察, EdU 标记的阳性细胞为红色。随机选取5 个阳性视野计数, 细胞增殖活力以EdU 阳性率表示。EdU 阳性率=EdU 阳性细胞数/总细胞数×100%。实验单独重复3 次。
1.8 成管实验检测各组HUVEC 的血管形成能力按“1.7”步骤中方法将HUVEC 与各组THP-1细胞共培养于Transwell 体系, 其中上室预先铺备Matrigel 基质胶后将接种HUVEC, 下室为“1.3”步骤中处理后的各组THP-1 细胞。置于培养箱中培养24 h 后, 随机选取5 个观察视野, 倒置显微镜下拍照, Image J 软件检测各组HUVEC 的血管形成数, 即代表各组HUVEC 的血管形成能力。
1.9 Western blotting 法检测各组细胞中STAT6/JAK1 途径相关蛋白和血管形成关键蛋白的表达水平取“1.7”步骤中共培养体系中的THP-1 细胞和HUVEC, 4 ℃预冷的PBS 缓冲液洗涤后, 加入RIPA 细胞裂解液和蛋白酶抑制剂提取细胞总蛋白。BCA 法进行蛋白定量后, 取约35 μg 蛋白进行聚丙烯酰胺凝胶电泳分离蛋白, 采用湿转法将分离的蛋白转至PVDF 膜上, 以5%脱脂奶粉于室温下封闭2 h 后, THP-1 细胞中加入p-STAT6 (1∶500), STAT6(1∶800)、JAK1(1∶500), HUVEC 中加 入 Notch1 (1∶500)、 DLL4 (1∶500) 和GAPDH(1∶1 000)一抗, 4 ℃摇床孵育过夜, 加入辣根过氧化物酶标记的二抗(1∶5 000)室温孵育1 h, TBST 溶液充分清洗后, 均匀滴加加强型化学发光液ECL 于凝胶成像仪进行曝光拍照。Image J 软件检测目的蛋白条带灰度值, 以目的蛋白条带灰度值与内参GAPDH 条带灰度值的比值作为目的蛋白表达水平, 并计算p-STAT6/STAT6比值。以上实验重复3 次。
1.10 OS 荷瘤小鼠模型的建立将36 只雌性BALB/c 裸鼠饲养在SPF 级环境中。参照参考文献[13]方法取生长状态良好的MG63 细胞, 将其密度调整为5×106mL-1, 取200 μL 细胞悬液经皮注射于裸鼠右侧前肢腋下。观察裸鼠的生长和实体瘤的形成, 以接种部位出现可触及或肉眼可见肿瘤小结时(接种约10 d 时可出现)将各组荷瘤小鼠随机分为3 组, 每组12 只, 分别为LV-Vector 组、LVshMIAT 组和LV-MIAT 组。其中各组小鼠经尾静脉每天注射对应的100 μL 慢病毒液, 连续2 周。每3 d 测量肿瘤的长度与宽度, 并按肿瘤体积=(长度×宽度2)/2, 监测肿瘤体积生长情况, 30 d 后处死各组小鼠。剥离肿瘤组织块, 拍照后, 以4%多聚甲醛固定, 石蜡包埋, 制成厚度为4 μm 的连续切片, 进行HE 染色与CD163 和CD31 的免疫组织化学染色, 其中细胞核为蓝色, CD163 和CD31的阳性表达为棕黄色或黄褐色, CD163 或CD31 的阳性表达率=CD163 或CD31 的阳性细胞数/细胞总数×100%。
1.11 统计学分析采用SPSS 19.0 统计软件进行统计学分析。各组THP-1 细胞中lncRNA-MIAT 表达水平, M2 型巨噬细胞百分率, 各组THP-1 细胞上 清 液 中VEGF、IL-10 和TGF-β1 水 平, 各 组THP-1 细胞中STAT6、p-STAT6 和JAK1 蛋白表达水平, 各组EdU 阳性率, 各组HUVEC 的血管生成数, 各组HUVEC 中血管生成关键蛋白VEGFR2、Notch1 和DLL4 的表达水平, 各组荷瘤小鼠的皮下移植瘤体积、质量和CD163 及CD31 阳性表达率均符合正态分布, 以±s表示。多组间样本均数比较采用单因素方差分析, 组间两两比较采用SNK-q检验。各组裸鼠肿瘤组织中CD163 和CD31 阳性表达率以百分率表示, 组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 感染慢病毒后各组THP-1 细胞中lncRNAMIAT 表达水平RT-qPCR 法检测结果显示:与LV-Vector 组 比 较, LV-shMIAT 组THP-1 细 胞 中lncRNA-MIAT 表 达 水 平 明 显 降 低(P<0.05), LV-MIAT 组THP-1 细胞中lncRNA-MIAT 表达水平明显升高(P<0.05)。见图1。
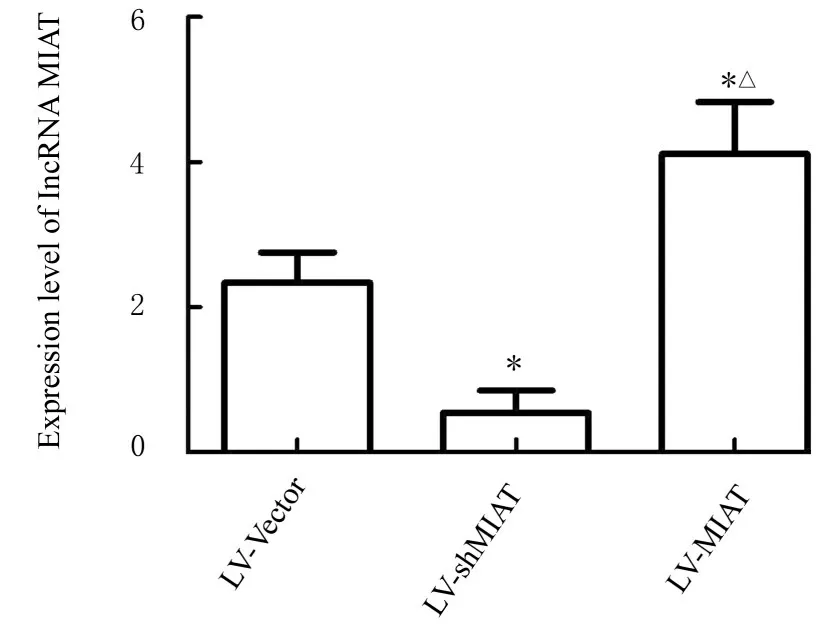
图1 RT-qPCR 法检测各组THP-1 细胞中lncRNAMIAT 表达水平Fig. 1 Expression levels of lncRNA-MIAT in THP-1 cells in various groups detected by RT-qPCR method
2.2 各组THP-1 细胞中M2 型巨噬细胞百分率
流式细胞术检测各组THP-1 细胞中M2 型巨噬细胞百分率, 结果显示:与MG63+LV-Vector 组比较, MG63+LV-shMIAT 组THP-1 细胞中M2型巨噬细胞百分率明显降低(P<0.05), MG63+LV-MIAT 组和IL-4+LV-Vector 组THP-1 细胞中M2 型巨噬细胞百分率均明显升高(P<0.05 或P<0.01);与MG63+LV-MIAT 组比较, MG63+LV-shMIAT 组THP-1 细胞中M2 型巨噬细胞百分率 明 显 降 低 (P<0.05), IL-4+LV-Vector 组THP-1 细胞中M2 型巨噬细胞百分率明显升高(P<0.05)。见图2 和图3。
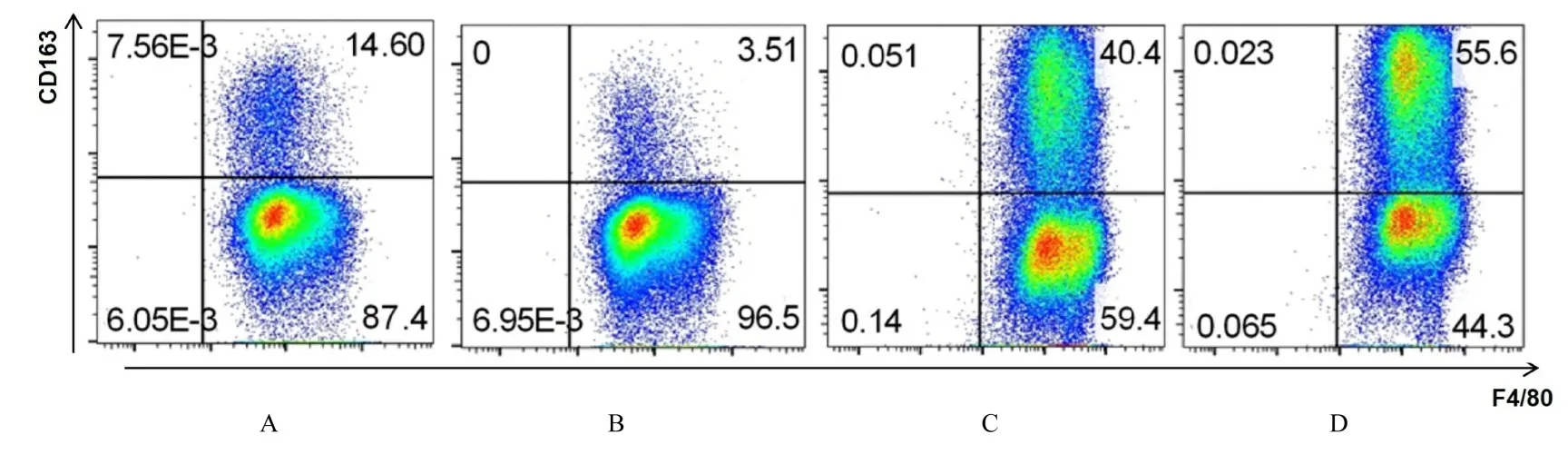
图2 流式细胞术检测各组THP-1 细胞中M2 型巨噬细胞百分率Fig.2 Percentages of M2-type macrophages in THP-1 cells in various groups detected by flow cytometry method
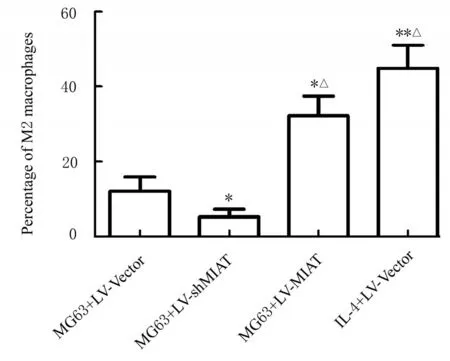
图3 各组THP-1 细胞中极化M2 型巨噬细胞百分率Fig. 3 Percentages of polarized M2 macrophages in THP-1 cells in various groups
2.3 各组THP-1 细胞中M2 型细胞因子水平与MG63+LV-Vector 组比较, MG63+LV-shMIAT组THP-1 细 胞 中VEGF、IL-10 和TGF-β1 水 平 明显降低(P<0.05), MG63+LV-MIAT 组和IL-4+LV-Vector 组THP-1 细胞中EGF、IL-10 和TGF-β1水 平 均 明 显 升 高(P<0.05 或P<0.01); 与MG63+shMIAT 组 比 较, MG63+LV-MIAT 组 和IL-4+LV-Vector 组THP-1 细 胞 中VEGF 水 平 明 显降低(P<0.05), 但THP-1 细胞中IL-10 和TGF-β1水平明显升高(P<0.05)。见表1。
表1 各组THP-1 细胞上清液中VEGF、IL-10 和TGF-β1 水平Tab. 1 Levels of VEGF, IL-10,and TGF-β1 in supernatant of THP-1 cells in various groups[n=5,±s,ρB/(ng·L-1)]
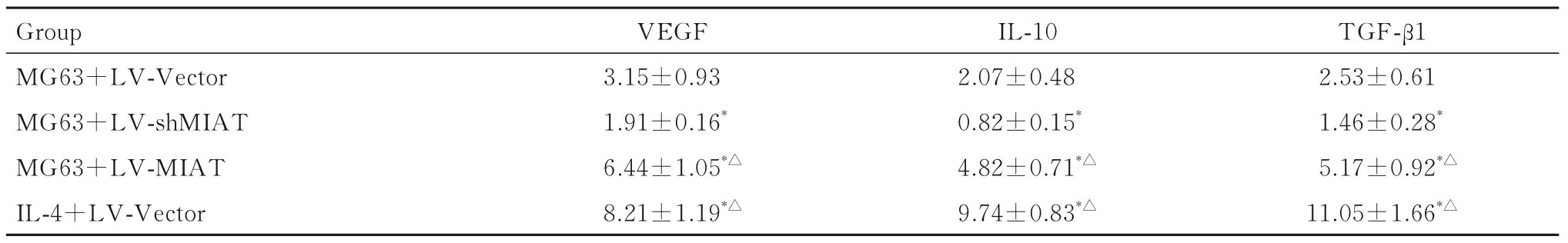
表1 各组THP-1 细胞上清液中VEGF、IL-10 和TGF-β1 水平Tab. 1 Levels of VEGF, IL-10,and TGF-β1 in supernatant of THP-1 cells in various groups[n=5,±s,ρB/(ng·L-1)]
*P<0.05, **P<0.01 compared with MG63+LV-Vector group;△P<0.05 compared with MG63+ LV-shMIAT group.
Group MG63+LV-Vector MG63+LV-shMIAT MG63+LV-MIAT IL-4+LV-Vector TGF-β1 2.53±0.61 1.46±0.28*5.17±0.92*△11.05±1.66*△VEGF 3.15±0.93 1.91±0.16*6.44±1.05*△8.21±1.19*△IL-10 2.07±0.48 0.82±0.15*4.82±0.71*△9.74±0.83*△
2.4 各组HUVEC 中EdU 阳性率EdU 染色法结果显示:与MG63+LV-Vector 组比较, MG63+LV-shMIAT 组HUVEC 中EDU 阳性率明显降低(P<0.05), MG63+LV-MIAT 组 和IL-4+LVVector 组HUVEC 中EdU 阳性率均明显升高(P<0.05);与MG63+LV-MIAT 组 比 较, MG63+LV-shMIAT 组HUVEC 中EdU 阳 性 率 明 显 降 低(P<0.05), IL-4+LV-Vector 组HUVEC 中EdU阳性率明显升高(P<0.05)。各组增殖的细胞呈现EdU 标志的红色状态。各组HUVEC 增殖形态表现见图4, 各组HUVEC 中EdU 阳性率见图5。
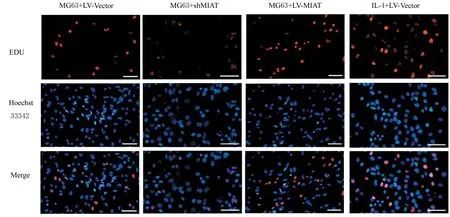
图4 EdU 染色法检测各组HUVEC 增殖形态表现(Bar=100 μm)Fig.4 Morphology of proliferation of HUVEC in various groups detected by EdU staining method (Bar=100 μm)
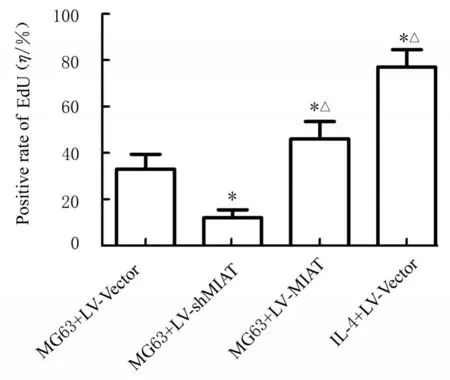
图5 各组HUVEC 中EdU 阳性率Fig. 5 Positive rates of EdU in HUVEC in various groups
2.5 各组HUVEC 的血管形成数成管实验检测结果显示:与MG63+LV-Vector 组比较, MG63+LV-shMIAT 组HUVEC 的血管形成数明显降低(P<0.05), MG63+LV-MIAT 组 和IL-4+LVVector 组HUVEC 的血管形成数明显升高(P<0.05); 与MG63+LV-MIAT 组 比 较, MG63+LV-shMIAT 组中HUVEC 的血管形成数明显降低(P<0.05), 但IL-4+LV-Vector 组HUVEC 的 血管形成数明显升高(P<0.05)。见图6 和7。
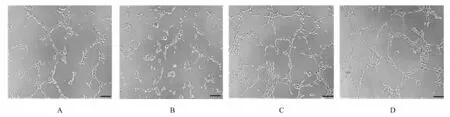
图6 成管实验检测各组HUVEC 的血管形成情况(Bar=100 μm)Fig.6 Angiogenesis of HUVEC in various groups detected by tube formation method (Bar=100 μm)
2.6 各 组THP-1 细 胞 中STAT6、p-STAT6 和JAK1 蛋白表达水平Western blotting 法检测结果显示:与MG63+LV-Vector 组比较, MG63+LVshMIAT 组THP-1 细 胞 中p-STAT6/STAT6 比 值和JAK1 蛋白表达水平均明显降低(P<0.05), MG63+LV-MIAT 组 和IL-4+LV-Vector 组THP-1细胞中p-STAT6/STAT6 比值和JAK1 蛋白表达水平均明显升高(P<0.05);与MG63+shMIAT 组比较, MG63+LV-shMIAT 组 THP-1 细 胞 中p-STAT6/STAT6 比值和JAK1 蛋白表达水平明显降低(P<0.05), IL-4+LV-Vector 组THP-1 细胞中p-STAT6/STAT6 比值和JAK1 蛋白表达水平明显升高(P<0.05)。见图8。
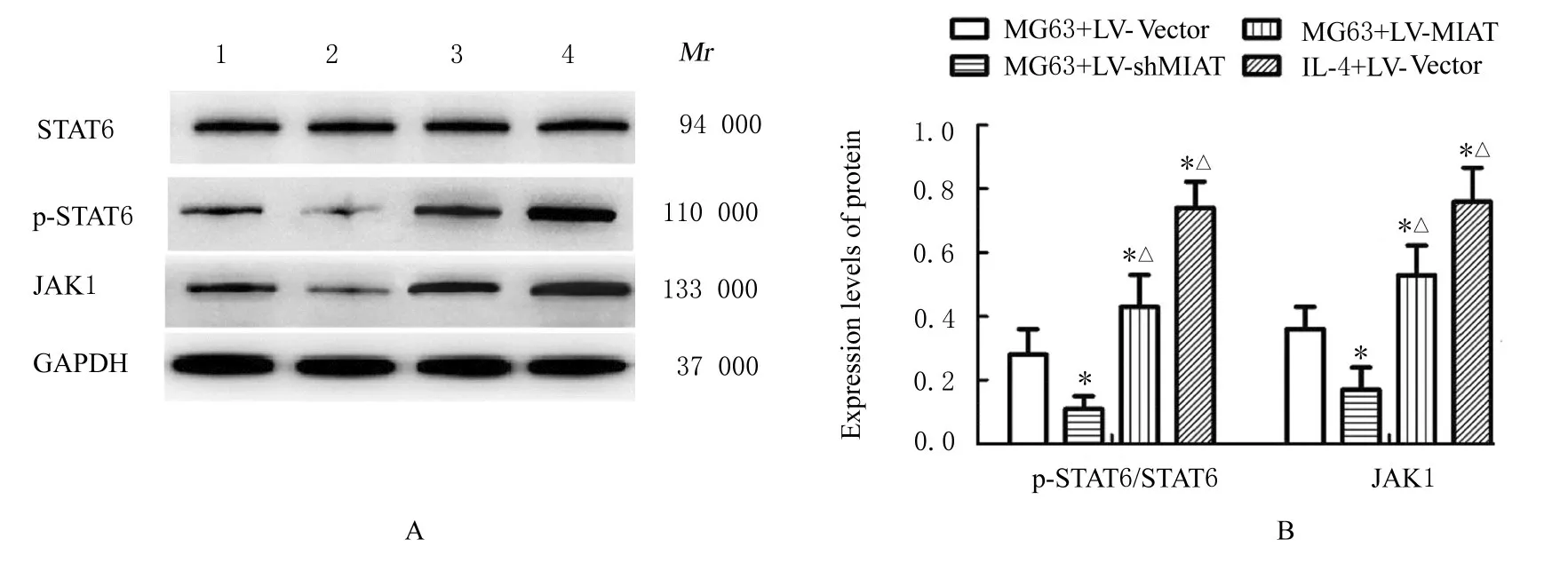
图8 Western blotting 法检测各组THP-1 细胞中STAT6、p-STAT6 和JAK1 蛋白表达电泳图(A)和直条图(B)Fig. 8 Electrophoregram(A)and histogram (B) of expressions levels of STAT6, p-STAT6,and JAK1 proteins in THP-1 cells in various groups detected by Western blotting method
2.7 各组 HUVEC 中血管生成关键蛋白VEGFR2、Notch1 和DLL4 表 达 水 平Western blotting 法检测结果显示:与MG63+LV-Vector 组比较, MG63+LV-shMIAT组HUVEC中VEGFR2、Notch1 和DLL4 蛋白表达水平均明显降低(P<0.05), MG63+LV-MIAT组和IL-4+LV-Vector 组HUVEC 中VEGFR2、Notch1 和DLL4 蛋白表达水平明显升高(P<0.05);与MG63+LV-MIAT 组比 较, MG63+LV-shMIAT 组 HUVEC 中VEGFR2、Notch1 和DLL4 蛋白表达水平均明显降低(P<0.05), 但IL-4+LV-Vector 组HUVEC 中VEGFR2、Notch1 和DLL4 蛋白表达水平明显升高(P<0.05)。见图9。
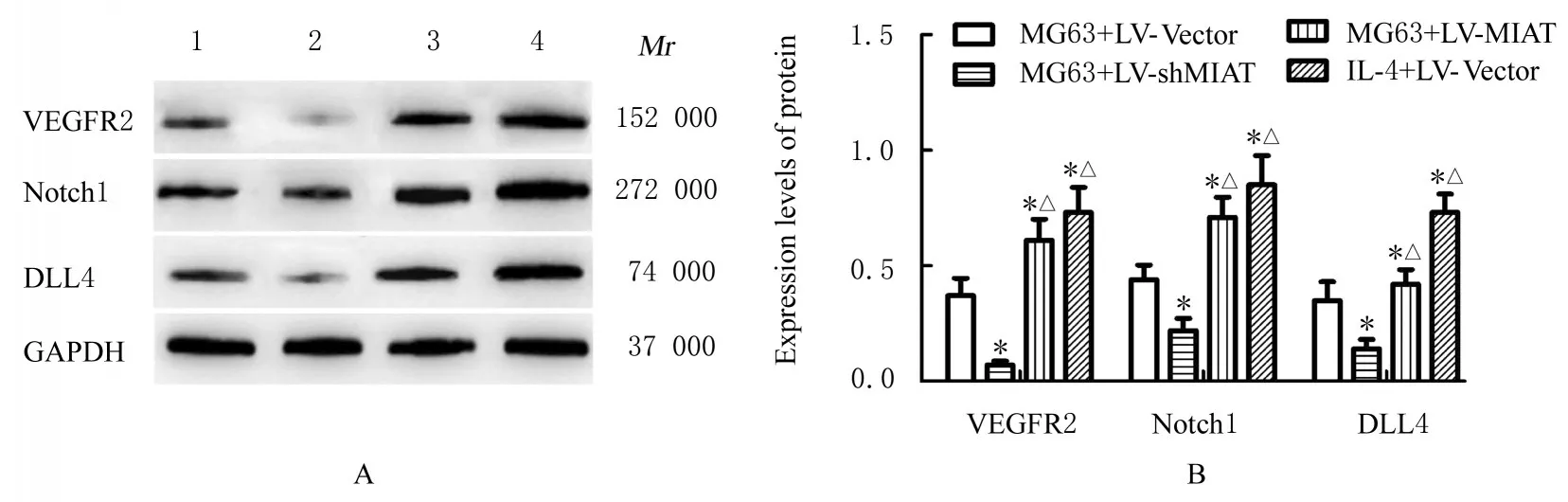
图9 Western blotting 法检测各组HUVEC 中VEGFR2、Notch1 和DLL4 蛋白表达电泳图(A)和直条图(B)Fig. 9 Electrophoregram( A)and histogram (B) of expressions of VEGFR2,Notch1,and DLL4 proteins in HUVEC in various groups detected by Western blotting method
2.8 各组荷瘤小鼠的移植瘤体积和质量及各组小鼠肿瘤组织中CD163 和CD31 阳性表达率与LVVector 组比较, LV-shMIAT 组荷瘤小鼠的移植瘤体积和质量均降低(P<0.05), 而LV-MIAT 组荷瘤小鼠的移植瘤体积和质量明显增加(P<0.05);与LV-shMIAT 组比较, LV-MIAT 组荷瘤小鼠的移 植 瘤 体 积 和 质 量 明 显 增 加 (P<0.05)。见图10~12。肿瘤组织中M2 型巨噬细胞标记物CD163 与肿瘤血管标记物CD31 的免疫染色结果显示:与LV-Vector 组比较, LV-shMIAT 组小鼠肿瘤组织中CD163 和CD31 阳性表达率明显降低(P<0.05), LV-MIAT 组小鼠肿瘤组织中CD163和CD31阳性表达率明显升高(P<0.05)LV-MIAT组较LV-shMIAT 组的肿瘤组织中CD163 与CD31的阳性表达率明显升高(P<0.05)。见图13。
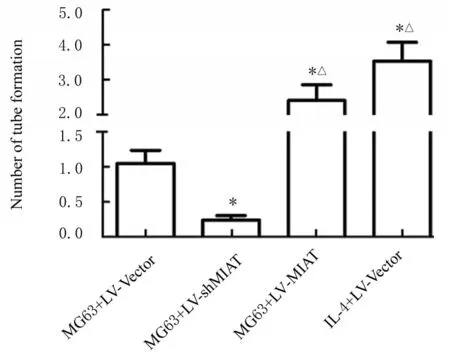
图7 各组HUVEC 的血管形成数Fig. 7 Number of tube formation of HUVEC in various groups
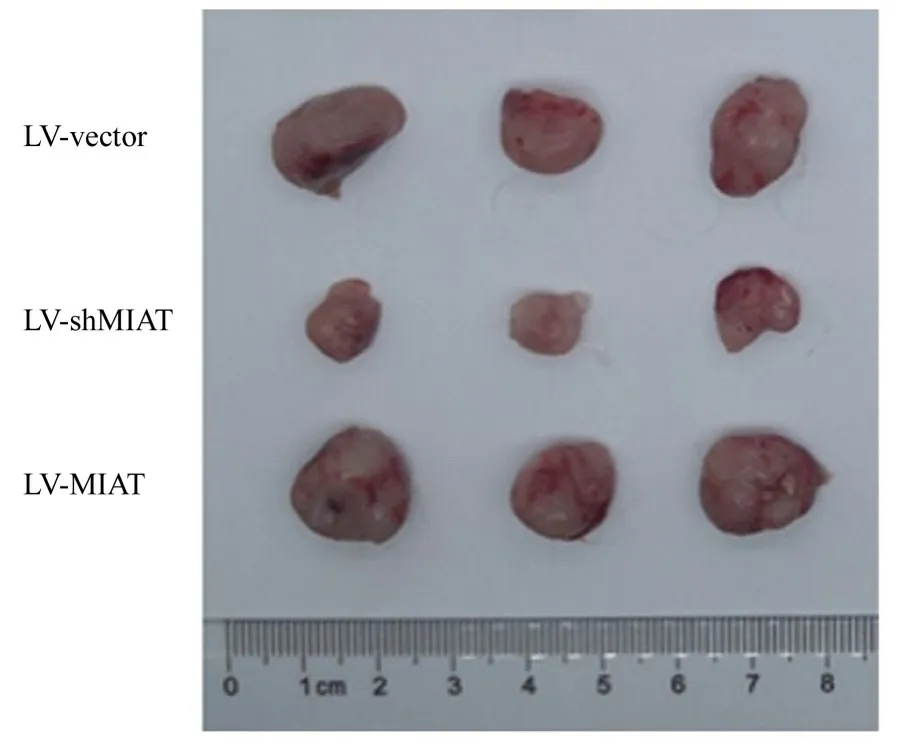
图10 各组裸鼠移植瘤大体形态Fig. 10 Gross morphology of transplanted tumor of nude mice in various groups
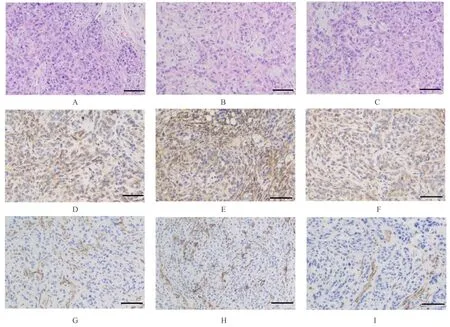
图13 各组裸鼠移植瘤组织中CD163 和CD31 表达(Bar=100 μm)Fig.13 Expressions of CD163 and CD31 in transplanted tumor tissue of nude mice in various groups (Bar=100 μm)
3 讨 论
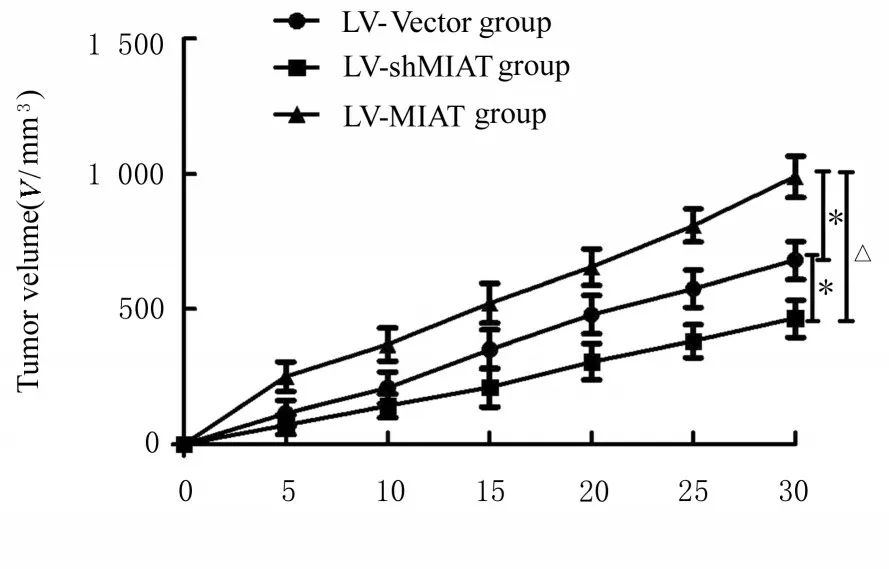
图11 各组裸鼠移植瘤体积Fig. 11 Volumes of transplanted tumor of nude mice in various groups
近年来, 越来越多的研究强调了lncRNAs 在多种人类肿瘤发生中的重要作用[6-7]。其中, MIAT作为一种新的lncRNA, 被发现在多种肿瘤组织中表达失调, 并参与肿瘤的恶性进展。如在卵巢癌组织中lncRNA MIAT 表达异常升高, 且其高水平表达现象与卵巢癌患者预后不良有关[14]。在喉鳞癌组织中, lncRNA MIAT 表达水平明显上调, 并能通过促进肿瘤细胞的增殖、迁移和侵袭作用加速肿瘤 的 进 展[15]。在OS 组 织 中, lncRNA MIAT 同 样呈高水平表达, 且与肿瘤大小、临床分期和淋巴结转移呈正相关关系[10]。同时, lncRNA MIAT 可在体外通过miR-128-3p 血管内皮生长因子C 调控机制促进OS 细胞的增殖、侵袭和迁移[9]。本研究结果显示:lncRNA MIAT 可通过诱导M2 型巨噬细胞的极化促进血管内皮细胞的血管生成功能, 从而参与OS 的进展。
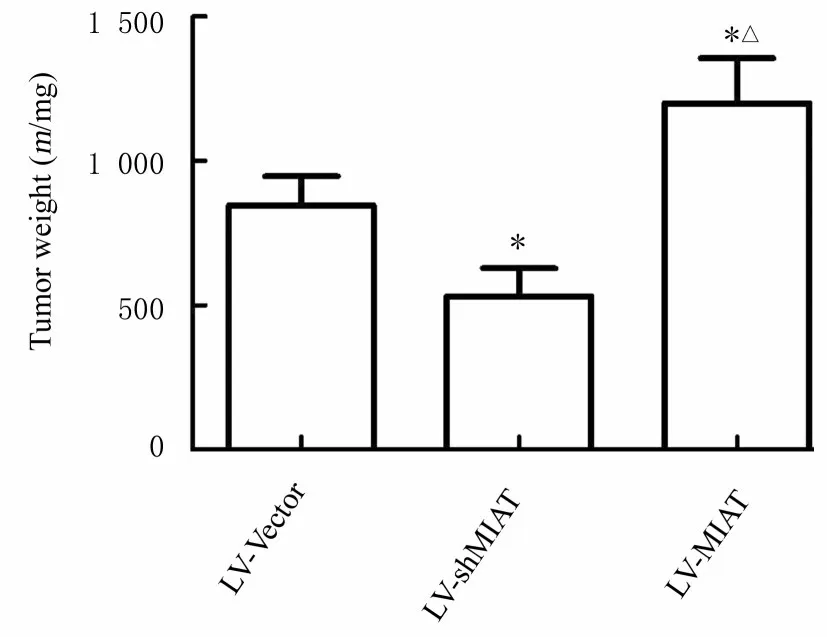
图12 各组裸鼠移植瘤质量Fig. 12 Weights of transplanted tumor of nude mice in various groups
可根据巨噬细胞的表型和分泌的细胞因子, 将巨噬细胞分为M1 型(经典激活)和M2 型(交替激活)。巨噬细胞的极化分类现象广泛存在于肿瘤和脂肪等组织及器官中, 并与疾病的转归密切相关[3, 16]。TAM 中 的M2 型 巨 噬 细 胞 能 明 显 促 进 肿瘤的侵袭和转移。这与其一方面能够促进肿瘤血管生成, 为肿瘤生长提供营养, 另一方面可通过降解细胞外基质促进肿瘤细胞的侵袭和迁移有关。M2型巨噬细胞还可以分泌TGF-β1 和IL-10 等细胞因子 抑 制 肿 瘤 免 疫[4]。F4/80 是M1 和M2 巨 噬 细 胞的共同标志物。而M1 型巨噬细胞的表面标志包括HLA-DR 和CD197 等, 其可分泌TNF-α、诱导型一氧化氮合酶及活性氧等, 发挥抵抗微生物的炎症反应和宿主免疫等功能, 同时, M1 巨噬细胞也可能对正常组织造成炎症损伤。M2 巨噬细胞的共同标志物包括CD163 和CD301 等, 其主要分泌IL-10、VEGF 和TGF-β1 等促进创伤修复及组织纤维化[3-4, 17]。在肿瘤的多个发展阶段, 巨噬细胞可以表现出不同的表型, 如M1 巨噬细胞在早期肿瘤组织中占优势, 可抑制血管生成, 激活机体的抗肿瘤免疫机制。而在肿瘤进展后期, M2 巨噬细胞成为TAM 浸润的主要类型, 其主要发挥促进肿瘤生长和肿瘤血管生成的作用[18]。
本研究采用干扰THP-1 细胞中lncRNA MIAT的表达, 并采用IL-4 协同干预作为诱导M2 型巨噬细胞极化的阳性对照组探讨lncRNA MIAT 对巨噬细胞M2 极化的影响, 结果显示:下调lncRNA MIAT 表达可抑制OS 细胞诱导的M2 巨噬细胞极化 并 抑 制 后 者 对VEGF、IL-10 和TGF-β1 分 泌, 而上调lncRNA MIAT 表达则能通过促进M2 型极化, 进而上调上述细胞因子表达。本研究结果显示:lncRNA MIAT 的促进M2 型极化作用可能通过STAT6/JAK1 途径发挥作用。肿瘤免疫研究[19]显示:JNK 信号已被报道在M2 极化中起重要作用。当使用JNK1 抑制剂时, M2 巨噬细胞百分率明显下调, 其分子标志物Arg-1 和MRC1 的表达水平也明显降低[20]。STAT6 作为JAK 通路的直接底物, 其可被JAK 磷酸化发生核转位, 从而促进M2 型巨噬细胞表达极化的基因转录, 因此在M2 型巨噬细胞中, JAK1/STAT6 信号通路的活化水平远高于M1 型巨噬细胞[21]。
M2 巨噬细胞主要与肿瘤血管生成有关。本课题组将不同条件下诱导后的M2 巨噬细胞与HUVEC 进行共培养, 结果表明:IL-4 诱导的M2巨噬细胞可明显促进HUVEC 血管生成, lncRNA MIAT 过表达可进一步促进血管形成。OS 诱导的M2 巨噬细胞也能促进HUVEC 的形成, 其作用与IL-4 诱导后相似, 提示lncRNA MIAT 通过诱导巨噬细胞M2 极化, 进一步促进肿瘤血管的形成;裸鼠体内实验结果显示:抑制lncRNA MIAT 可降低CD163 和CD31 的表达。CD31 是肿瘤血管生成的标志物, CD31 表达下调反映血管增殖的抑制[22]。因此在荷瘤小鼠模型中, lncRNA MIAT 还与巨噬细胞M2 极化和血管形成有关。
综上所述, 本研究结果显示:lncRNA MIAT可通过促进巨噬细胞的M2 极化上调肿瘤血管生成, 这可能是其参与调控肝癌进展的机制之一, 表明lncRNA MIAT 可能是治疗OS 的一个新的潜在作用靶点。
