基于LC-MS代谢组学技术探究铅胁迫大麦苗粉代谢产物及通路分析
2022-12-14崔航曹冬梅王冀菲娄雨豪杨建张东杰
崔航,曹冬梅,3,4*,王冀菲,娄雨豪,杨建,张东杰,4,5
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)(2.国家杂粮工程技术研究中心,黑龙江大庆 163319)(3.黑龙江省农产品加工与质量安全重点实验室,黑龙江大庆 163319)(4.黑龙江省杂粮加工及质量安全工程技术研究中心,黑龙江大庆 163319)(5.北大荒现代农业产业技术省级培育协同创新中心,黑龙江大庆 163319)
大麦不仅营养成分丰富,也是制作啤酒的主要原料[1]。有研究表明,大麦营养含量最高的阶段是成长到幼苗期的大麦。将大麦幼苗加工成麦苗粉后进行冲服,其中含有的矿物质、蛋白质以及人体所需各种微量元素较为丰富,长期饮用大麦幼苗粉(青汁)可以改善酸性体质,提高机体抵抗力、免疫力和新陈代谢力[2];同时具有抗菌,镇痛和抗氧化的作用。大麦还具有“三高两低”的特点[3],制作成大麦苗饮后,具有良好的保健功效。现在研究发现大麦苗还具有抗癌的作用。我国作为发展中大国,人类活动向大气释放的有害气体导致大气沉降、工业活动产生的工业废水和日常生活中生污排放,在进行农业活动中使用的一些农用物资,诸如农药、化肥里含有的重金属成分以及农业地膜的长期不合理使用,均会导致土壤铅等重金属含量超标[4]。
代谢组学(Metabolomics)是考察生物细胞、组织、器官或者生物体在不同状态下代谢物种类、数量及其小分子物质变化规律的科学[5]。植物代谢组学指当植物受到外界干扰或刺激后,通过代谢组学技术对其产生的代谢物进行非靶定性或靶向定性定量分析,以此探究植物代谢网络以及相关基因功能的科学技术[6]。目前,广泛应用于代谢组学分析的技术有1H,13C-NMR 技术、GC-MS 技术、LC-MS 技术、CE-MS 技术以及DIMS技术等,其中由于LC-MS 具有较高的灵敏度和分辨率,较宽的动态范围,适合通过非靶向技术手段对标本中未知代谢物进行探索研究,被广泛应用于代谢组学研究中[7,8]。近年来代谢组学在植物研究中也获得了极大地进展,在农作物营养成分及质量评价等几个方面的均有着极大的研究进展[9]。本研究预通过分析Pb 胁迫下大麦苗粉中代谢物的变化,并找出其中的标志性代谢物,从而推导Pb 胁迫的代谢机理,并从食品安全的角度出发,对大麦产地的Pb 污染防治有重要指导性意义。本研究将对大麦食品安全及大麦农业产量提供一定的理论依据和数据基础。
1 材料与方法
1.1 试剂与设备
色谱级甲醇、乙腈、乙酸铵、氨水,CNM Technologies 试剂有限公司;硝酸铅,郑州中天泓达化工科技有限公司;超纯水;Vanquish 超高效液相、Q Exactive HFX 高分辨率质谱、Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)液相色谱柱、Heraeus Frescol17 离心机,Thermo Fisher Scientific 公司;FOSS-KN295 组织研磨仪,丹麦福斯仪器公司。
1.2 LC-MS 检测
本实验使用Vanquish(Thermo Fisher Scientific)超高效液相色谱仪,通过Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱A 相为水相,含5 mmol/L 乙酸铵和5 mmol/L 乙酸,B 相为乙腈。样品盘温度:4 ℃,进样体积:3 μL。
Thermo Q Exactive HFX 质谱仪能够在控制软件(Xcalibur,版本:4.0.27,Thermo)控制下进行一级、二级质谱数据采集。详细参数如下:鞘气流速:30 Arb,辅助气流速:10 Arb,毛细管温度:350 ℃,Full MS分辨率:60 000,MS/MS 分辨率:7 500,碰撞能量:10/30/60(在NCE 模式下),喷涂电压:4.0 kV(正)或-3.8 kV(负)。
1.3 大麦标准萌发实验
选取一定量籽粒饱满的优质CK15 大麦,购自黑龙江省佳木斯农科院;使用去离子水将种子漂洗4~6 次,再经体积分数30%过氧化氢溶液消毒10 min 后用去离子水反复冲洗4~6 遍,充分晾干后备用。使用从前期萌发实验中确定的Pb 浓度(1 600 mg/kg,以土壤质量计)进行土壤拌种,将硝酸铅与土壤混合均匀后开始种植大麦。先取出适量均匀拌铅的土壤,根据盆内土量用适量去离子水将土充分湿润,再把种子撒在湿润土壤表面,种子之间保留1~3 cm 间隙,最后将事先取出的土壤均匀覆盖在种子表面,完成种植。每4 盆为1个处理,每个处理重复3 次,盆栽置于室温中明暗交替培养至10~15 d,大麦幼苗高度生长至10~20 cm 时取样备用。同时做无铅胁迫对照组。
1.4 大麦苗粉制备
将取样后的大麦幼苗使用去离子水清洗干净,放在室温中通风干燥24 h 后放入超低温冰箱中冷冻12 h,用冻干机冷冻干燥48 h,经高速粉碎机粉碎后备用。
1.5 样品处理
取样后将样品使用去离子水反复冲洗至无土壤残留,经液氮研磨后称取20 mg 样品,加入1 000 µL 提取液[甲醇:水=3:1(V/V)];于50 Hz 声波下研磨5 min,冰浴超声6~7 min(以上操作步骤重复进行三次);于-40℃下静置1 h;将样品4 ℃,12 000 r/min 离心15 min;使用移液枪吸取静置后上清液于进样瓶中上机检测,剩余样品分别吸取等量上清液混合成质控样品(QC)上机检测。LC-MS 上机A 相为水相,B 相为乙腈(纯度99.99%)。进样温度4 ℃,样品体积3 μL。在Thermo Q Exactive HFX 质谱仪控制下进行多级数据采集。
1.6 数据处理
原始数据使用R 软件包进行峰识别、峰提取、峰对齐等处理[10],先通过PCA 对所有样本点数据分布情况进行概况预览,然后采用OPLS-DA 对数据进行建模分析,根据t检验的p值<0.05,同时VIP 值>1,进行差异性代谢物的筛选。筛选出的代谢物通过Biotree DB(V2.1)自建二级质谱数据库和HMDB 人类代谢组数据库联合筛选匹配后定性,Cutoff 值设为0.3;再将筛选出的差异代谢物进行KEGG 注释和通路分析,通过富集分析和拓扑分析检索出差异代谢物映射的关键代谢通路[11]。
2 结果与分析
2.1 代谢物定性结果
由表1可知,成苗期大麦共定性出脂质和类脂质代谢物、多酚类代谢物、多胺类代谢物、有机杂环代谢物、有机酸及其衍生物、有机氧代谢物、苯丙烷和聚酮化合物、苯甲酸酯类代谢物、核苷及核苷酸类似物及少量有机氮代谢物、生物碱及其衍生物等共84 个代谢物;其中脂质和类脂质、多酚类、多胺类、有机酸及其衍生物的含量发生了明显的变化。由于大麦在生长的过程中由于不断地长出新的叶片,所需能量增加、酶活增强[12,13],从而导致脂类物质,有机酸、蛋白质的含量发生变化[14,15]。有研究表明,多酚类代谢物、有机酸等是植物生长过程中主要发生变化的物质[14],而多酚类代谢物的变化会导致大麦幼苗抗氧化能力也发生改变,机体食用后会影响其自由基清除能力;大麦中存在的多胺类代谢物是农作物中普遍存在的,多胺类代谢物作为植物细胞分裂和生长发育必需的物质[16],在大麦受到非生物胁迫时能发挥重要作用[17]。
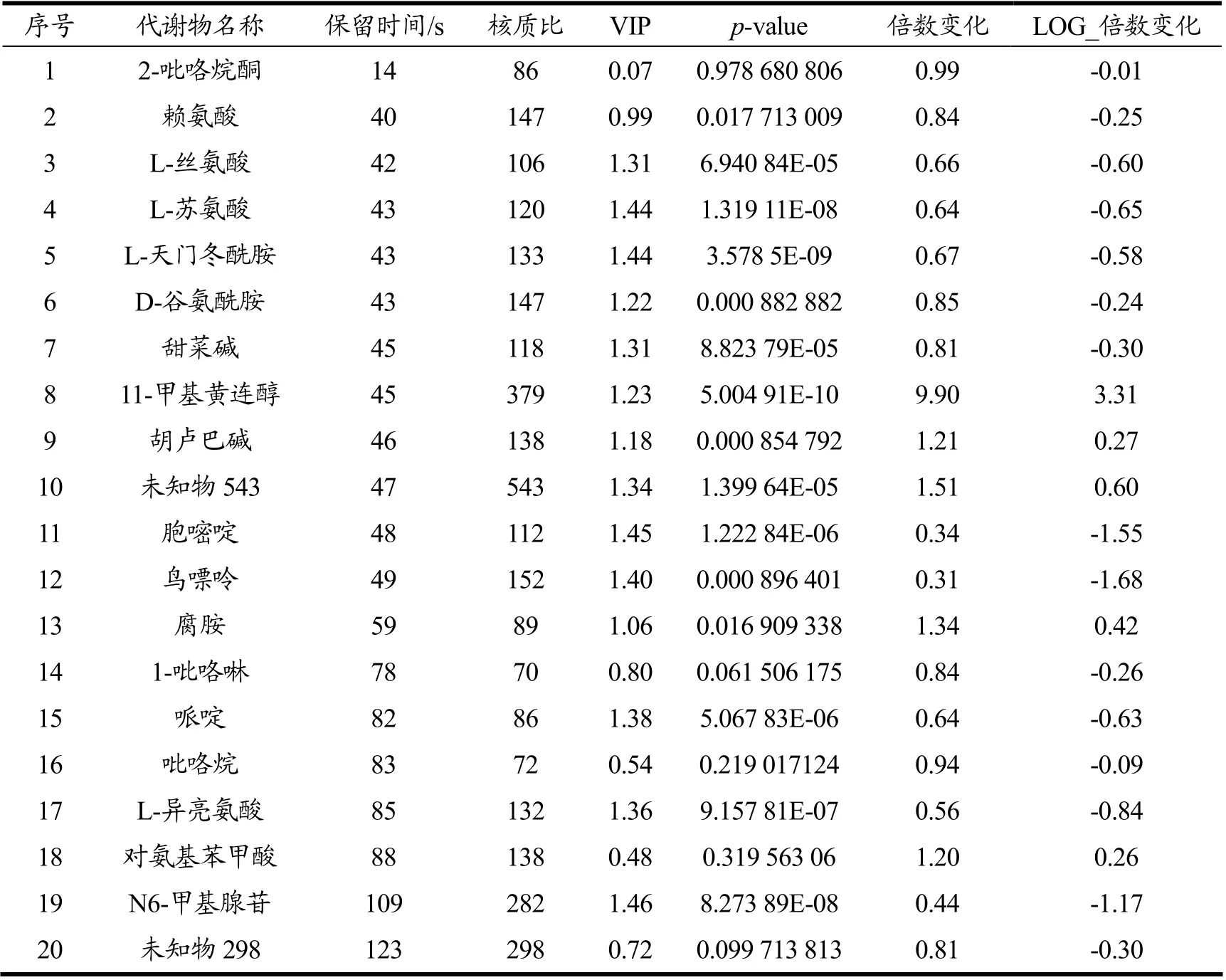
表1 代谢物定性结果Table 1 Qualitative results of metabolites

续表1

续表1
2.2 主成分分析(PCA)
图1为CMQ-CMQPb 组主成分分析得分图,拟合后方程R2X=0.662>0.5,说明此方程拟合后稳定性较好。由图可知,样本点均处于95%置信区间内,经Pb胁迫后与对照组相比,两组样本组间区分效果十分显著,无任何重叠现象。同组样本内存在部分重叠的现象,推断是由于品种相同的大麦内部代谢物具有相似性造成的[18]。

图1 CMQ-CMQPb 组PCA 得分图Fig.1 PCA score chart of CMQ-CMQPb group
2.3 正交偏最小二乘-判别检验(OPLS-DA)
PCA(主成分分析),多用于考察样本之间相关性,而对数据进行进一步精准分析还需要应用OPLS-DA(正交偏最小二乘法),这种数据分析方法可以通过正交化筛选数据信息中与类别信息无关的数据,排除与分类无关的自变量,从而更加精准的筛选出各类样本的特征变量[19]。VIP 值也叫变量投影重要度,是变量信息筛选过程中的一个重要评价指标,能较好反映出OPLS-DA 模型对各个化合物的评分。一般认为,当VIP>1 时,则表明该变量对于模型中类别的分类有着较为重要的意义[20]。
由图2可知,通过本次OPLS-DA 判别分析共得到两个主成分,R2X=0.526,R2Y=1,Q2=0.982;R2Y、Q2两者均大于0.5 说明模型可靠性较好。由图2可知,两组样本分列于置信区间的两侧且样本间区分明显,两组样本全部处于95%置信区间内,稍有部分重叠;从分布形态上看,CMQ 组样本点离散程度要大于CMQPb 组样本点。两组样本点区分显著,但也各自存在组内聚集区,因使用同一品种大麦,所以内部成分相差不大;组间不存在聚集区,可以看出Pb 胁迫对大麦内部成分影响较大。
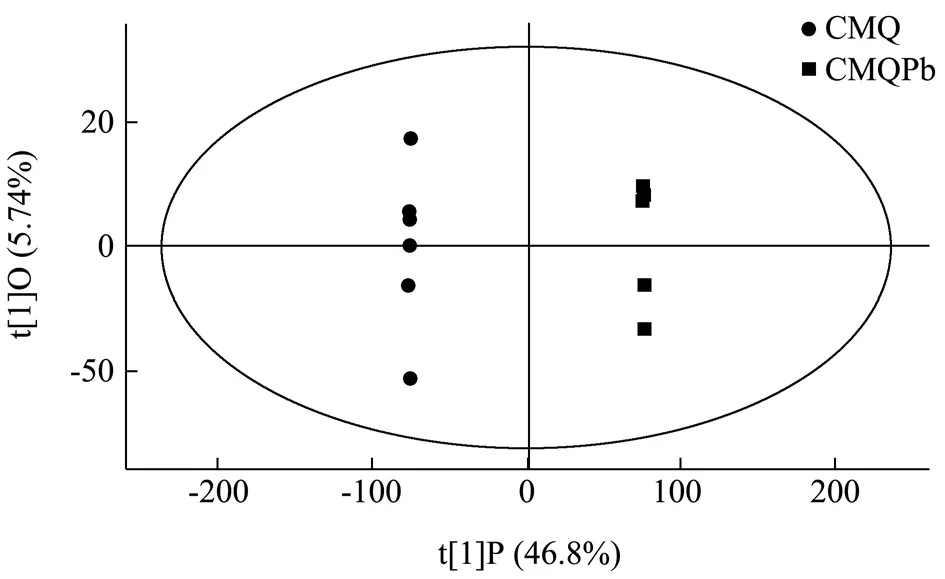
图2 CMQ-CMQPb 组OPLS-DA 判别得分图Fig.2 OPLS-DA discriminant score chart of CMQ-CMQPb group
2.4 正交偏最小二乘-判别置换检验
置换检验通过随机改变分类变量Y 的排列顺序,多次(次数n=200)建立对应的OPLS-DA 模型以获取随机模型的R2和Q2值[21]。
图3为CMQ 对CMQPb 组OPLS-DA 置换检验,原模型R2Y=1,Q2=0.982 大于0.5 且接近于1,证明原模型可以较好解释两组样本之间的差异[22]。置换检验随机模型的Q2值均小于原模型的Q2值;同时随着置换Y 变量比例增大,随机模型的Q2逐渐下降。同时采用200 次响应的置换检验,建立对应的OPLS-DA 模型以随机获取模型的R2和Q2值,从而有效避免检验模型存在过拟合现象。说明原模型具有良好的稳健性,不存在过拟合现象[23]。

图3 CMQ-CMQPb 组OPLS-DA 置换检验Fig.3 OPLS-DA permutation test in CMQ-CMQPb group
2.5 差异代谢物筛选
将差异代谢物以火山图的形式进行可视化处理,筛选标准为正交偏最小二乘(OPLS-DA)模型VIP>1且t检验的p值<0.05,结合保留时间等条件在Biotree DB(V2.1)自建二级质谱数据库中进行差异代谢物匹配,两组样本间差异代谢物定性结果如表2所示。
图4为差异代谢物筛选火山图,红色为含量上调的代谢物,蓝色为含量下调的代谢物,灰色为变化不显著差异代谢物。根据匹配度和VIP(p-value)值共筛选出高度匹配差异代谢物60 个,如表2。

表2 差异代谢物定性结果Table 2 Differential metabolite qualitative results
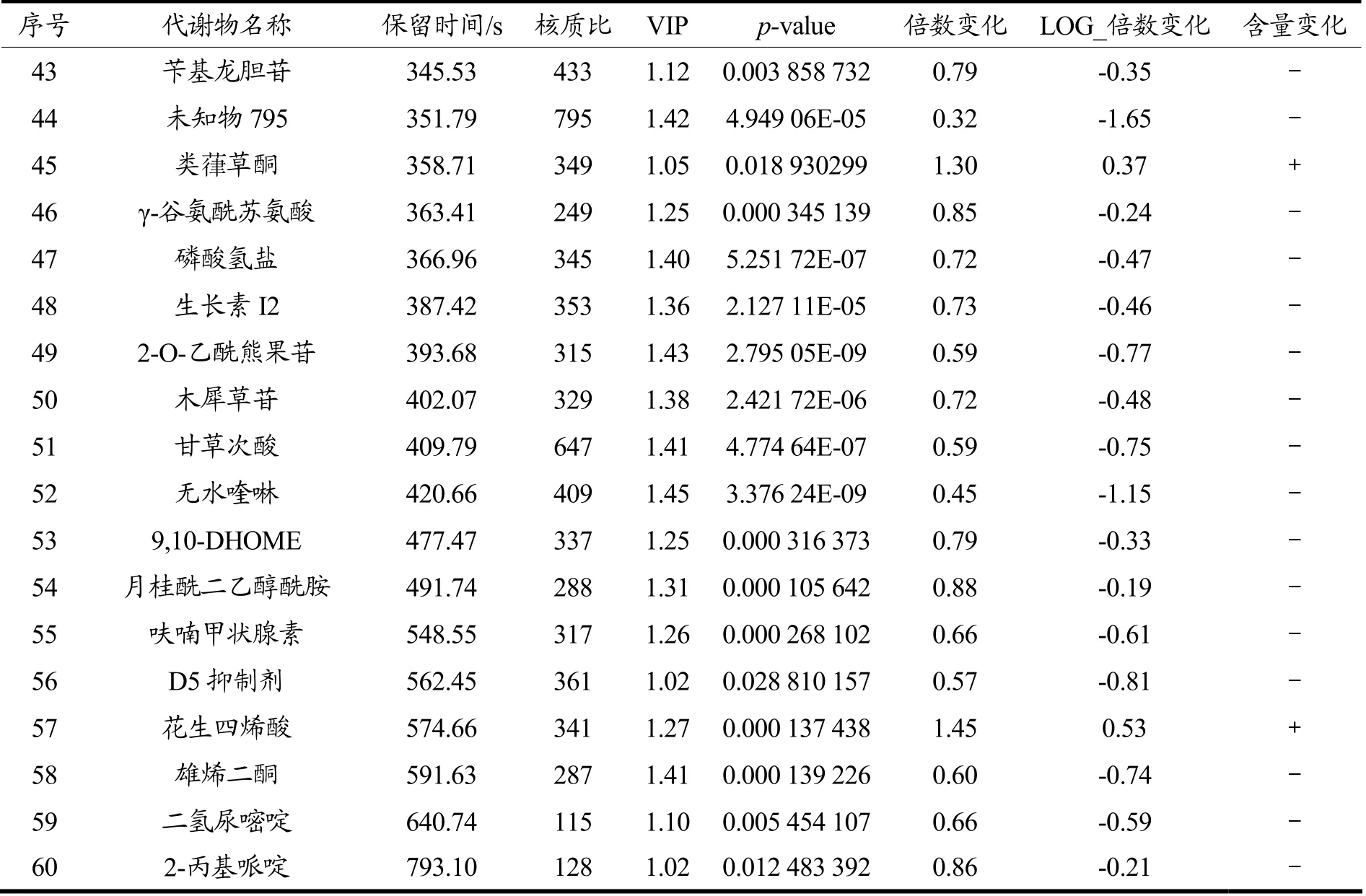
续表2

图4 CMQ-CMQPb 组差异代谢物筛选火山图Fig.4 CMQ-CMQPb group differential metabolite screening volcano map
CMQ-CMQPb 组共筛选出了60 个差异代谢物,多数为有机酸及其衍生物、多酚类代谢物、多胺类代谢物、脂质和类脂质分子以及少量的氧化物、有机化合物、生物碱和核苷酸等;其中CMQ 组对比CMQPb 组中相对含量上升的代谢物11 个,多数为多酚类物质和多胺类物质;CMQ 组对比CMQPb 组中相对含量下调的代谢物49 个,多数为有机酸及其衍生物、脂质和类脂质分子、有机氧化合物等。
多酚类物质是大麦中一种重要的次级代谢产物,存在其各个部位中,随着大麦的生长,多酚类物质会发生一定的动态变化;已有研究表明,大麦幼苗中多酚类的变化,食用后可直接影响其对机体的抗氧化能力。多胺类物质的上升或下降,已通过转基因研究证明,其含量的动态变化可能作为植物提高耐胁迫能力的一种策略[24],可以通过调节植物体内的HMs 进行螯合或者间接的刺激增强植物抗氧化系统的防御能力、诱导胁迫相关基因的特异性表达、影响植物内源生长调节物质的含量和离子的吸收和平衡[25]。同时外源施用腐胺和亚精胺类物质也可以显著诱导植物遭受胁迫后响应基因的表达。当Pb 不断对植物造成胁迫时,植物根系就会分泌有机酸来与重金属螯合,形成并分泌一种新的螯合物来保护植物根系,从而对抗重金属的胁迫,从而导致有机酸含量发生动态变化;脂类物质含量变化的原因可能是由于大麦受到Pb 胁迫后在成苗期需要能量增加,呼吸作用增强,故会分解消耗更多的脂类物质来为大麦的生长提供能量。
2.6 差异代谢物层次聚类分析
上述分析得到的差异代谢物,由于不同的代谢物可能会具有相似的生物特性或者受到同一个代谢通路的调控,最终导致差异代谢物之间特征区分不明显。层次聚类是将未明显区分的差异代谢物进行聚类,将具有相似生物特性的代谢物归到一类,以此来分析同类差异代谢物在样本间的明显变化特征。对差异代谢物的定量值进行计算欧式距离矩阵(Euclidean Distance Matrix),以完全连锁方法对差异代谢物进行聚类,并以热力图进行展示[26]。结果如图5所示。
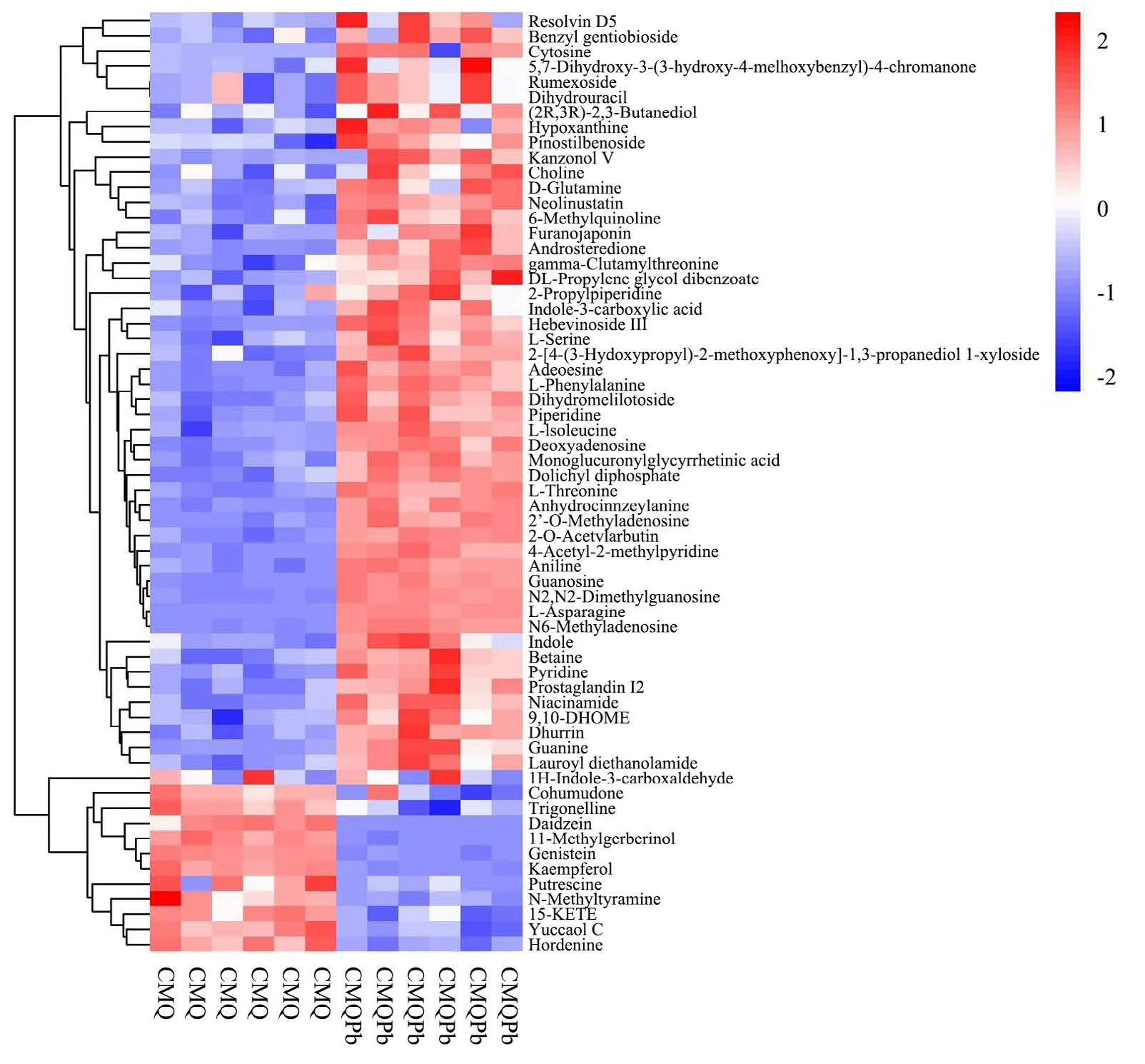
图5 CMQ-CMQPb 组差异代谢物层次聚类热力图Fig.5 CMQ-CMQPb group differential metabolite hierarchical clustering heat map
图5为CMQ-CMQPb 组层次聚类热力图,热力图的颜色代表代谢物的丰值高低,红色为高表达区,蓝色为底表达区。红蓝区分度明显,说明聚类效果显著。图左侧CMQ 组前49 个差异代谢物的表达量明显低于CMQPb 组,多数为有机酸及其衍生物、脂质和类脂质代谢物、有机氧等代谢物;其中含有3 个数据库中检索不到的未知物,根据其核质比暂命名为未知物377、未知物446、未知物795;暂对以上未知物进行定性推断,由于其在通路中的表达量于其余已知代谢物具有相似的高表达,故推断该未知物的结构也属于有机酸类代谢物、脂质类等代谢物。
从热图中可以看出经Pb 胁迫后的大麦幼苗(CMQPb 组)中高表达代谢物明显高于未经Pb 胁迫的大麦幼苗(CMQ 组),证明Pb 胁迫可以增加大麦幼苗中差异代谢物的活跃度。图右侧下半部CMQ 组后11 个差异代谢物的表达量明显高于CMQPb 组,多数为多酚类化合物、多胺类化合物等物质;其中含有1个数据库中检索不到的未知物,根据其核质比暂命名为未知物543,由于其在代谢通路中表达量和其余已知代谢物具有一定的高表达相似性,故推断该未知物的结构也属于多酚类、多胺类等代谢物。研究发现,大麦生长过程中根系分泌的有机酸能有效降低土壤对Pb的吸附并加强于土壤Pb 的螯合,这一结论与徐卫红等[27]的研究结果相符;通过有机酸与Pb 螯合以此对抗Pb 胁迫从而减轻外界非生物胁迫对大麦的毒害,并促使Pb 从根部向地上部转移。而多酚类物质主要在于调控大麦幼苗的新陈代谢,促进其生长发育,经Pb 胁迫后,大麦幼苗生长受到抑制,新陈代谢减慢,从而刺激多酚类物质的合成来维持大麦幼苗的正常生理活动。通过层次聚类热力图分析可以看出,Pb 胁迫会对大麦幼苗内部的不同种类代谢物具有一定的影响,而两组间筛选出的差异代谢物是大麦苗内部众多代谢物中因遭受非生物胁迫而导致含量变化显著的物质,对于探究大麦幼苗在Pb 胁迫下的代谢物动态变化和代谢途径鉴别具有一定的参考意义,并从食品安全角度找出大麦种植区Pb 污染防治办法。
2.7 关键代谢通路分析
KEGG 注释分析仅能匹配到差异代谢物参与的通路,并不能筛选出与本实验高度相关的关键代谢通路[28]。因此,想要筛选出高度匹配的关键代谢通路,还需利用Pathway 数据库对上述筛选出的差异代谢物其进行富集分析和拓扑分析[29],再通过KEGG、PubChem 等权威代谢物数据库对差异代谢物进行映射。本实验共映射出7 个高度匹配的差异代谢物,分别为:β-丙氨酸、二氢尿嘧啶、泛酸、尿嘧啶、酪氨酸、山奈酚、L-苯丙氨酸,且均为精确匹配。最后根据-log(p)值和Impact 值综合分析,筛选出最为显著的5 条代谢通路[30],如表3所示。

表3 关键代谢通路分析表Table 3 Analysis of key metabolic pathways
对差异代谢物参与的代谢通路进行分析,分别为β-丙氨酸代谢、泛酸和CoA 生物合成、异喹啉生物碱的生物合成、黄酮和黄酮生物合成、苯丙氨酸代谢。说明Pb 胁迫大麦幼苗后,其内部代谢通路多数与氨基酸代谢有关,氨基酸是蛋白质的基本组成单位,也是人体重要营养素之一,在大麦幼苗受到Pb 胁迫后,氨基酸代谢可以参与调节离子转运、气孔关闭、氮代谢等解毒过程[31]。这5 条代谢通路共映射7 个代谢物,其中β-丙氨酸、二氢尿嘧啶、泛酸和尿嘧啶都分别参与了两条代谢通路,说明这4 个差异代谢物对关键代谢通路的影响较大。从关键代谢通路映射出的差异代谢物可以看出,氨基酸类代谢物的变化可作为研究Pb 胁迫后大麦幼苗内部响应的重要信号,则说明大麦幼苗在受到Pb胁迫后会对其中的氨基酸代谢产生一定影响。
图6中圆形气泡代表不同的代谢通路,气泡大小表示该条通路影响因子的大小;气泡所在纵坐标和气泡颜色表示富集分析的p值[取负自然对数,即-ln(p)],气泡颜色由蓝到红,颜色越深富集程度越显著。
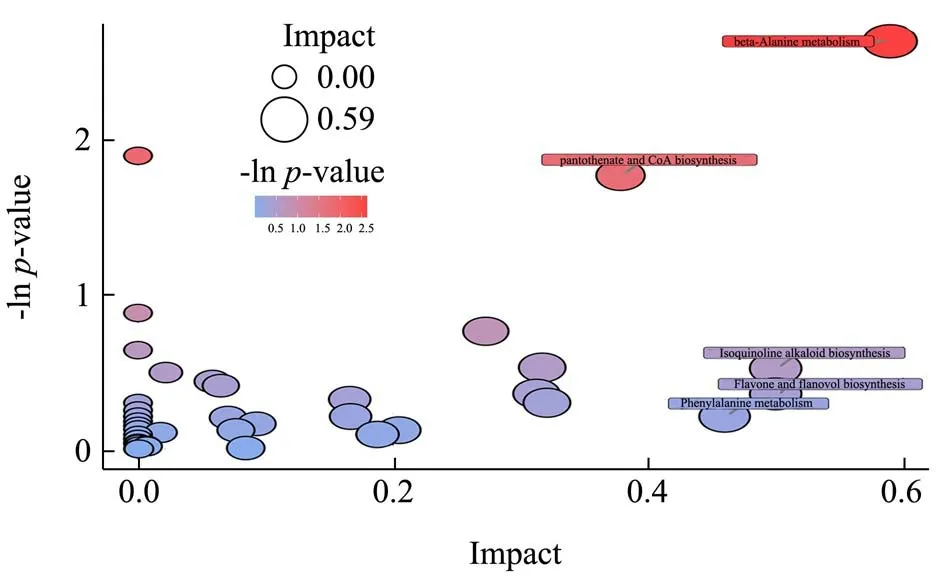
图6 CMQ-CMQPb 组代谢通路分析气泡图Fig.6 CMQ-CMQPb group Metabolic pathway analysis bubble chart
由图6可知,β-丙氨酸代谢处的气泡颜色为深红色、气泡相对较大。丙氨酸代谢的应激反应主要体现在对细胞内环境pH 的调节,植物在生长过程中遭受到重金属胁迫后,蛋白质合成速率降低和丙氨酸转氨酶反应减缓引起的。说明Pb 胁迫对大麦幼苗中的丙氨酸代谢影响较大。泛酸和CoA 生物合成的颜色较浅,气泡稍小、说明此途径对Pb 在大麦幼苗中的代谢影响也较大。CoA 在大麦萌发过程中提供90%的能量。主要参与糖基代谢、蛋白质代谢以及能量代谢,这与杨延辉等[32]的研究结果相符。其次是异喹啉生物碱的生物合成,异喹啉类生物碱具有多种生物活性,存在于动植物细胞中可以抵抗生物或非生物胁迫;异喹啉类生物碱的生物合成途径是从2 种酪氨酸衍生物的缩合开始[33],紧接着是一系列的反应形成反式心果碱[34](是大部分喹啉生物碱的中间或前体物质),生物碱和其它次生代谢物是通过ABC 转运蛋白来转运和聚集的[35],其在转运蛋白上体现了重要的运输功能。最后是黄酮和黄酮生物合成和苯丙氨酸代谢;黄酮化合物是植物的次生代谢物,它能使植物适应环境压力,包括生物压力和非生物压力[36],其在植物的根、茎、叶中都有分布。植物所处温度、光照、水分和外源胁迫都可以调控植物中的黄酮生物合成。而苯丙氨酸解氨酶是本代谢途径中重要的酶基因启动因子,其只存在于植物和微生物中,能够应答生物和非生物胁迫。由此可见,苯丙氨酸代谢途径可以增强大麦遭受Pb 胁迫时的耐受力。
3 结论
本文应用大麦为实验材料进行模拟大麦种植区铅污染盆栽实验,经Pb 胁迫生长到成苗期(三叶幼苗)后将其制成大麦苗粉,应用LC-MS 代谢组学技术来探究大麦幼苗遭受Pb 胁迫后的代谢机理。本实验对大麦幼苗(CMQ)和Pb 胁迫大麦幼苗(CMQPb)样本进行检测,通过主成分分析、正交偏最小二乘法判别分析等多元统计学方法,共筛选出60 个差异代谢物,主要为有机酸及其衍生物、多酚类和多胺类代谢物、脂质和类脂质分子和少量的氧化物、有机化合物、生物碱和核苷酸等;层次聚类热力图结果表明,CMQPb 组有49 个差异代谢物表达量明显高于CMQ 组,多数为有机酸及其衍生物、脂质和类脂质分子;CMQPb 组有11 个差异代谢物表达量明显低于CMQ 组,多数为多酚类物质和多胺类物质。证明Pb 胁迫会导致大麦幼苗中多酚类物质、多胺类物质、有机酸及其衍生物和脂质和类脂质分子的含量发生显著变化。通过KEGG 通路分析发现,Pb 胁迫会对大麦幼苗中氨基酸代谢有显著影响,β-丙氨酸、二氢尿嘧啶、泛酸和尿嘧啶是影响代谢通路的关键差异代谢物。本研究使用LC-MS 代谢组学技术探究Pb 胁迫对大麦苗粉代谢产物的影响切实可行,从食品安全的角度对大麦种植和Pb 污染防治具有一定指导性意义。
