嗜酸乳杆菌发酵红甜菜汁对血管紧张素转化酶和乙酰胆碱酯酶的抑制作用
2022-12-14闫明哲王萍
闫明哲,王萍,2*
(1.东北林业大学林学院,黑龙江哈尔滨 150040)(2.黑龙江省森林食品资源利用重点实验室,黑龙江哈尔滨 150040)
阿尔兹海默症(Alzheimer’s Disease,AD)又称原发性老年痴呆症,是一种具有遗传性和散发性且与衰老相关的神经退行性疾病[1]。其典型表现为遗忘性认知障碍,具有不可逆性和致死性[2,3]。研究显示,到2050年全球AD 患者将超1 亿,亚洲地区AD 患者将达6 280 万[4]。因此,寻找有效防治AD 的方法是人们亟待解决的问题。
乙酰胆碱酯酶(Acetylcholinesterase,AChE)是生物神经信号传导过程的关键酶,可将神经递质乙酰胆碱水解为胆碱和乙酸[5]。AChE 活性过度增加会降低乙酰胆碱水平,引发或加重AD 等神经系统疾病[6]。血管紧张素转化酶(Angiotensin Converting Enzyme,ACE)抑制剂可阻断Ang I 转变为Ang II,同时阻断Ang II作用于Ang II-1 型受体[7,8],从而减少因神经元凋亡引起的不良反应,可有效延缓神经退行性病变。此外,氧化应激产生过多的活性氧会使神经元发生不可逆损伤,减轻氧化应激对防治神经退行性疾病举足轻重[9]。因此,在标准疗法AChE 抑制剂的基础上结合ACE 抑制剂和自由基清除剂可有效防治AD。但AChE 和ACE抑制剂类药物存在副作用且价格高昂,人们开始关注通过摄入食物防治AD。此外,食物所含活性物质易被人体代谢和耐受,减少副作用发生[10],这对开发具有缓解AD 的功能性食品具有重要意义。
红甜菜(Beta vulgarisL.)别名火焰菜、紫菜头,属于石竹目(Caryophyllales)藜科(Chenopodiaceae)甜菜属(Genus beta)[11],富含甜菜色素、酚类、黄酮类、皂苷等活性物质[12]。红甜菜在维持健康和预防疾病方面具备一定潜能,具有抗炎、抗氧化、降血压等药理作用[13]。红甜菜被认为具有神经保护作用,治疗中枢神经系统相关疾病,如AD[14]。目前关于红甜菜防治AD 研究较少,且鲜有学者研究乳酸菌发酵红甜菜汁对ACE 和AChE 的抑制作用。
乳酸菌是功能性益生菌的代表,在发酵代谢过程中会产生乳酸菌素、生物活性肽等活性物质,上述化合物具有抗氧化、抗炎、抑菌、免疫增强和调节肠道菌群平衡等作用,可缓解和防治多种疾病[14]。孙百虎[15]选用植物乳杆菌发酵桑葚汁,试验表明经乳酸菌发酵可使总酚、总黄酮含量、DPPH·清除率和FRAP 显著提升,且乳酸菌发酵促进了花青素类物质的转化。Szutowska 等[16]研究表明乳酸菌发酵果蔬汁能够降低血清胆固醇水平,改善肠胃功能并增强免疫系统。王惠等[17]使用乳酸菌发酵树莓汁,试验发现通过乳酸菌发酵的树莓汁其抑制肿瘤细胞活性能力、促进乳酸酸脱氢酶释放能力、促进细胞凋亡能力均显著提高。Seelam 等[18]使用球形芽孢杆菌发酵胡萝卜汁,经乳酸菌发酵后胡萝卜汁的抗氧化活性和感官品质都得到提升。Ming 等[19]研究表明,红甜菜中甜菜色素可减少β-淀粉样蛋白沉积,延缓AD 患者病情发展。以上研究均表明以乳酸菌发酵为技术手段可以显著提升植物基质的功能特性,并对相关产品的感官品质起到一定的改善作用。
本研究以红甜菜为原料,旨在利用乳酸菌发酵改善红甜菜汁口感风味、丰富其营养价值并提升对AD的防治能力。主要研究了经嗜酸乳杆菌发酵的红甜菜汁在发酵过程中pH 值、活菌数、总酸、还原糖、甜菜色素、总酚和黄酮含量及其自由基(ABTS+·、·O2-、·OH)清除能力、酶(AChE 和ACE)抑制能力。旨在探究抗氧化、酶抑制能力变化规律及其与生物活性物质的关系,为探寻食源性AChE、ACE 抑制剂来源、推进红甜菜精深加工并针对AD 功能性食品开发提供数据支撑和理论参考。
1 材料和方法
1.1 材料与试剂
红甜菜(品种为沃丹),吉林省长春市;双碳白砂糖,南京甘汁园糖业有限公司;嗜酸乳杆菌(Lactobacillus acidophilus,LA-5),丹麦科汉森公司。福林酚、ABTS,北京博奥拓达科技有限公司;没食子酸、芦丁、无水葡萄糖标准品、氯化硝基四氮唑蓝、还原辅酶I、N-甲基吩嗪甲基硫酸盐、乙酰胆碱酯酶(苍蝇头部,0.2 UN)、5,5-二巯基-2,2-二硝基苯甲酸、碘代硫代乙酰胆碱、4-羟乙基哌嗪乙磺酸、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸,上海源叶生物科技有限公司;血管紧张素转化酶(兔肺,0.1 UN)、亚硝酸钠标准品,西格玛奥德里奇公司;MRS 肉汤、琼脂粉,北京奥博星生物科技有限公司;甲酸、乙腈(色谱纯),德国Meker 公司;其余试剂、药品均为国产分析纯。
1.2 仪器与设备
Triple TOF 5600 Plus 四级杆飞行时间串联质谱检测器联用仪、ExionLC™ AD UHPLC 超高压液相色谱系统(配备Analyst 1.6 和Peakview 2.0 分析软件及数据库),美国AB SCIEX 公司;SW-CJ-2D 无菌操作台,上海尚道仪器制造有限公司;PHS-3E pH 计,上海仪电科学仪器股份有限公司;SPX-50B 生化培养箱,北京市恒诺利兴科技有限公司;721 可见分光光度计,上海佑科仪器仪表有限公司;TG16G 离心机,常州金坛仪器制造有限公司;EPO CH2 全波长酶标仪,美国伯腾仪器有限公司;5030-PVL 高压灭菌锅,长春百奥生物仪器有限公司;L18-YZ05 真空保鲜破壁调理机,九阳家电有限公司。
1.3 试验方法
1.3.1 嗜酸乳杆菌菌悬液的制备
取适量培养至24 h 经活化、驯化的培养液,5 000 r/min 离心10 min,弃上清液并取底部沉淀转移至无菌水中。根据先前已确定的基于稀释涂布平板计数-分光光度法确定活菌数,在600 nm 下调整其吸光度值为1.42~1.45,此时活菌数约为6.00 lg CFU/mL,菌悬液现用现配。
1.3.2 样品制备
选用新鲜红甜菜,洗净、去皮并切块,将红甜菜与无菌水按照料液比为1:4 使用破壁调理机在低气压(30 kPa)、40 000 r/min 条件下打浆4.5 min,4 层纱布过滤,自然pH 值,滤汁4 ℃条件下备用;白砂糖添加量7.5wt%,搅匀后将其置于紫外照射20 min;按10%(体积比)接种量向100 mL 红甜菜汁中接入菌悬液并密封,30 ℃恒温发酵54 h。
1.3.3 红甜菜接种发酵过程评价指标及测定方法
每间隔6 h 取样,立即测定pH 值和乳酸菌活菌数;对样品进行5 000 r/min 离心15 min 取上清液,经适当稀释后测定还原糖和总酸、总酚、黄酮、甜菜色素含量及抗氧化能力和酶抑制能力。
1.4 评价指标测定方法
1.4.1 理化指标
(1)pH 值测定:pH 计直接测定。
(2)乳酸菌活菌数测定:采用稀释涂布平板计数法在MRS 培养基中培养48 h 后计数[20]。
(3)总酸含量测定:参照《GB/T 12456-2008 食品中总酸测定》[21]并结合文献[22],采用电位滴定法。
(4)还原糖含量测定:参照王俊丽等[23]的方法,采用3,5-二硝基水杨酸法。
1.4.2 活性成分
(1)总酚含量测定:参照李祎等[24]的方法,采用Folin-Ciocalteu 法。
(2)黄酮含量测定:参照Li 等[25]的方法,采用NaNO2-Al(NO3)3分光光度法。
(3)甜菜色素含量测定:参照李垚等[26]的方法,采用分光光度法。
1.4.3 自由基清除能力
(1)ABTS+·清除率测定:参照Garzón 等[27]的方法,采用分光光度法。
(2)·O2-清除率测定:参照Li 等[28]的方法,采用NADH-PMS-NBT 经典法。
(3)·OH 清除率测定:参照冯隽野等[29]的方法,采用硫代巴比妥酸法。
1.4.4 酶活抑制
(1)ACE 抑制活性测定:参照郝心悦等[30]的方法,采用FAPGG 底物法。
(2)AChE 抑制活性测定:参照王微[31]的方法,采用改良的Ellman 法。
1.4.5 甜菜色素UHPLC-Q-TOF-MS/MS分析条件
1.4.5.1 色谱条件
ACQUITY UPLC BEH C18 色谱柱(100 mm×2.1 mm,1.7 μm);柱温40 ℃;进样量5 μL;流量0.4 mL/min;检测时间15 min,流动相A 为含0.1%甲酸的水溶液,流动相B 为纯乙腈;洗脱程序为0 min~5 min,5%~95% B;5 min~11 min,95% B;11 min~12 min,95%~5% B;12 min~15 min,5% B。
1.4.5.2 质谱条件
电喷雾离子源(ESI),采用正离子和负离子模式采集数据,一级质谱和二级质谱扫描范围分别为100~1 200m/z、50~1 200m/z;扫描类型为TOF;一级质谱和二级质谱的离子化电压均为5 500 V;各气路均使用氮气(喷雾气、辅助加热气和气帘气分别为50 psi、50 psi 和35 psi);锥孔电压均为90 V;碰撞能量分别为10 V 和35 V(正负离子不同模式下碰撞能量有+/-不同);二级质谱碰撞能量为15 V。
1.5 数据处理与统计
各试验独立重复3 次,数据表示为均值±标准差。采用OriginPro 9.8.5 软件进行绘图,Excel 2020 软件进行数据处理,SPSS 26.0 软件进行相关性分析(相关类型为Pearson)、主成分分析、聚类分析(聚类方法为类间平均连接法、距离类型为Euclidean 平方)和基于单因素方差分析(ANOVA)的统计学差异检验。显著性差异分析结果在图和表中以各数据点处小写字母表示,字母相同则表示差异不显著(p>0.05),字母不同则表示差异显著(p<0.05)。
2 结果与讨论
2.1 红甜菜汁发酵过程中乳酸菌活菌数、pH值、总酸及还原糖含量变化
红甜菜汁发酵过程中乳酸菌活菌数、pH 值、总酸及还原糖含量变化如图1所示。

图1 红甜菜汁发酵过程中活菌数、pH、总酸及还原糖含量变化Fig.1 Changes of viable bacteria,pH,total acid and reducing sugar content in red beetroot juice during fermentation
由图1可知,发酵过程中pH 值、乳酸菌活菌数、总酸及还原糖含量显著变化(p<0.05)。0 h~18 h 发酵液乳酸菌活菌数及总酸含量均快速上升,分别由1.03×106CFU/mL(0 h)升至3.39×109CFU/mL(18 h)、4.53 g/kg(0 h)升至14.37 g/kg(18 h),同时活菌数在18 h 达到最大值。嗜酸乳杆菌的大量繁殖表明该菌种在发酵时具有较强的生长能力,Yoon 等[32]对红甜菜作为嗜酸乳杆菌的潜在生长基质进行评估时,发现该菌种可快速利用红甜菜汁进行生长代谢和产生乳酸,在30 ℃发酵48 h 后发酵液中活菌数为6.70×108CFU/mL,pH 值由6.3 降至4.5,说明红甜菜可作为该菌种生长的适宜基质。0 h~18 h 发酵液pH 值及还原糖含量均呈断崖式下降,分别由5.99(0 h)降至3.85(18 h)、113.48 mg/L(0 h)降至48.98 mg/L(18 h),下降了55.58%和56.84%。这是由于发酵液中嗜酸乳杆菌消耗大量碳源进行生长代谢致使还原糖含量减少[33],同时伴随着发酵基质中有机酸溶出及菌种产生大量有机酸使pH 迅速下降[34]。
18 h~54 h发酵液中乳酸菌活菌数先缓慢下降后逐渐平稳,由3.39×109CFU/mL(18 h)降至6.29×108CFU/mL(54 h)。主要原因是发酵过程中菌种产酸量增加使得发酵液pH 值较低,与嗜酸乳杆菌最适生长pH 值5.5~6.5 相差较大,在偏酸性环境下其生长繁殖受到限制导致活菌数有所下降[35]。随后,该菌种逐渐对环境产生耐受使得发酵后期活菌数略有上升且逐渐平稳。此阶段内总酸含量增加、还原糖含量减少,分别由14.37 g/kg(18 h)升至18.22 g/kg(54 h)、45.34 mg/L(18 h)降至41.00 mg/L(54 h),分别增加了26.79%、减少了9.57%;pH 值持续降低,由3.85(18 h)降至3.35(54 h),降低了12.99%。与未发酵时相比,活菌数和总酸含量分别增加了6.27×108CFU/mL和302.21%,pH值和还原糖含量分别降低了44.07%和63.87%。李垚等[26]在乳酸菌发酵红甜菜的过程中同样观察到相似结果,至发酵结束时pH 值呈显著下降趋势至3.94,乳酸菌活菌数呈增加趋势至1.49×107CFU/mL,总酸含量呈上升趋势至16.78 g/kg。
2.2 红甜菜汁发酵过程中活性成分含量变化
2.2.1 红甜菜汁发酵过程中总酚和黄酮质量浓度变化
红甜菜汁发酵过程中总酚和黄酮含量变化如图2所示。

图2 红甜菜汁发酵过程中总酚和黄酮质量浓度变化Fig.2 Changes of total phenols and flavonoids in red beetroot juice during fermentation
由图2可知,发酵过程中总酚和黄酮质量浓度显著变化(p<0.05),均呈先上升再下降的趋势。0 h~6 h黄酮质量浓度由8.34 mg/L(0 h)降至7.84 mg/L(6 h),下降了6.00%。其原因是发酵初期体系中O2含量和多酚氧化酶含量较高使得酚类物质被氧化[36],致使黄酮类物质部分损失。此外,还与黄酮类物质发生不同程度的水解和聚合作用有关[37]。6 h~24 h 黄酮质量浓度由7.84 mg/L(0 h)升至9.56 mg/L(24 h),增加了21.94%。原因是在酸性环境中酸水解反应将黄酮类聚合物转化为单一的黄酮类物质[38];此外,微生物产生的酶类(如葡糖苷酶)可分解植物细胞壁,促进黄酮类物质的释放或合成[39],使黄酮质量浓度增加。0 h~18 h 总酚质量浓度由1 153.29 mg/L(0 h)升至1 179.03 mg/L(18 h),增加了2.23%,这得益于微生物产生的酶类(如酚酸酯酶)利于结合酚水解释放小分子游离酚[40,41],使总酚质量浓度增加。
18 h~54 h 总酚质量浓度由1 179.03 mg/L(18 h)降至1 144.71 mg/L(54 h),减少了2.91%。原因是活菌数降低而减少酶类(如酚酸酯酶)的产生而难以将酚类物质转化为代谢产物并释放新的酚类物质[42],且多酚类物质与蛋白质、多糖等大分子物质结合或吸附,使其质量浓度下降[43]。24 h~54 h 黄酮质量浓度由9.56 mg/L(24 h)降至8.30 mg/L(54 h),减少了13.18%,这与引起总酚质量浓度减少的原因相同。
2.2.2 红甜菜汁发酵过程中甜菜色素含量变化
红甜菜汁发酵过程中甜菜红素、甜菜黄素及总甜菜色素含量变化如图3所示。

图3 红甜菜汁发酵过程中甜菜红素、甜菜黄素及总甜菜色素含量变化Fig.3 Changes of betacyanin,betaxanthin and total betalain content in red beetroot juice during fermentation
由图3可知,发酵过程中色素含量显著变化(p<0.05)。0 h~54 h 甜菜黄素含量先下降后趋于稳定,由1.23 mg/100 mL(0 h)降至0.70 mg/100 mL(54 h),下降了43.09%。0 h~6 h 其含量由1.23 mg/100 mL(0 h)升至1.33 mg/100 mL(6 h),增加了8.13%。原因是榨汁时红甜菜组织纤维被机械力破坏,与液体接触面积增大利于色素释放;且在低酸环境中甜菜苷发生醛亚胺键断裂生成甜菜醛氨酸,该物质与氨基酸(或胺)进行分子缩合生成甜菜黄素[44],使甜菜黄素含量增加。6 h~54 h 观察到甜菜黄素含量呈下降趋势,由1.33 mg/100 mL(6 h)降至0.70 mg/100 mL(54 h),减少了47.37%。其原因是受温度影响,与甜菜红素相比甜菜黄素对温度更敏感,同温度下易降解[45]。
甜菜红素和总甜菜色素含量在0 h~54 h 均先上升后下降,分别由4.33 mg/100 mL(0 h)升至4.92 mg/100 mL(54 h)、5.56 mg/100 mL(0 h)升至5.61 mg/100 mL(54 h),增加了13.63%和0.90%。0 h~24 h 甜菜红素和总甜菜色素含量整体呈上升趋势,分别由4.33 mg/100 mL(0 h)升至5.29 mg/100 mL(24 h)、5.56 mg/100 mL(0 h)升至6.30 mg/100 mL(24 h),增加了22.17%和13.30%。因甜菜色素是一种水溶性色素,发酵过程中借助水的浸泡作用使色素溶出;且甜菜苷在酸性环境中会代谢产生不同结构的甜菜红素,使甜菜红素含量上升[46]。
24 h~54 h 观察到甜菜红素及总甜菜色素含量均为下降趋势,分别由5.29 mg/100 mL(24 h)降至4.92 mg/100 mL(54 h)和6.30 mg/100 mL(24 h)降至5.61 mg/100 mL(54 h),减少了7.00%和10.95%。原因是在30 ℃的发酵温度下受发酵容器中O2含量和降解酶[47](如β-葡萄糖苷酶)的影响,甜菜苷在易发生化学变化位置发生脱糖基化、脱羧、脱氢作用等化学变化[46]加速代谢使其含量减少。此外,乳酸菌可将红甜菜汁中的β-葡萄糖苷作为碳源进行生长代谢从而减少甜菜苷含量[48]。值得注意的是,甜菜红素与总甜菜色素含量变化趋势相似,原因是红甜菜中甜菜红素含量要远多于甜菜黄素含量,使得以甜菜红素发生的化学变化占主导地位。Swaicki 等[49]在红甜菜发酵过程中也观察到甜菜红素含量与未发酵时相比下降了30%~50%,其下降原因与上述原因相同。
2.3 基于UHPLC-Q-TOF-MS/MS 对发酵液中甜菜色素组成及相对含量分析
2.3.1 红甜菜汁发酵液中甜菜色素组成定性分析及代谢途径分析
根据质谱数据库和文献[50-52]对发酵0 h~54 h 共10个样品中的甜菜色素组成进行定性分析,在[M+H]+条件下所有样品共鉴定出12 种甜菜色素,详见表1。
如表1所示,12 种甜菜色素分别为2 种甜菜色素前体(Betalamic Acid、Cyclo-DOPA)、6 种甜菜红素( Betanin、Betanidin、17-Decarboxy-Betanidin、2-Decarboxy-Neobetanin、2-Decarboxy-2,3-Dehydro-Neobetanin、6ˊ-O-Feruloyl-Betanin)、4 种甜菜黄素(Indicaxanthin、Vulgaxanthin I、Miraxanthin V、Vulgaxanthin IV)。

表1 甜菜色素组成分析Table 1 Analysis of constituents of betalain
红甜菜汁所含甜菜色素在发酵过程中受发酵温度、光照、氧气、pH 值、酶等综合因素影响产生以甜菜苷为主的代谢作用[53,54],具体的代谢途径和颜色变化见图4。
由图4可知甜菜苷(Betanin)的代谢途径及其产物,鉴定出的12 种甜菜色素有7 种是由甜菜苷(Betanin)在代谢过程中产生,分别为Betanidin、17-Decarboxy-Betanidin、2-Decarboxy-Neobetanin、2-Decarboxy-2,3-Dehydro-Neobetanin、6ˊ-O-Feruloyl-Betanin 和Betalamic Acid、Cyclo-DOPA。
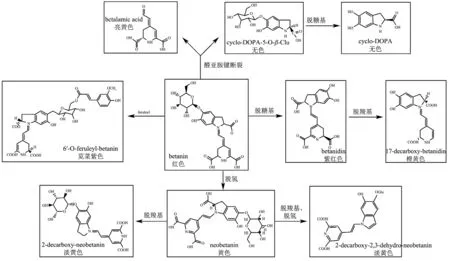
图4 甜菜苷的代谢途径及其代谢产物颜色变化Fig.4 Metabolic pathway of beet glycoside and color change of its metabolites
2.3.2 红甜菜汁发酵液中甜菜色素组成相对定量分析
根据甜菜色素各成分质谱峰进行峰面积积分并进行积分校正,计算甜菜色素各成分其相对含量,详见表2。
由表2可知,与未发酵时相比,在发酵第6 小时和 24 小时共生成3 种新的甜菜红素,分别为17-Decarboxy-Betanidin(6 h)、2-Decarboxy-Neobetanin(6 h)和6ˊ-O-Feruloyl-Betanin(24 h)。发酵过程中12 种甜菜色素成分按照上调和下调被分为2 类。第1类中共有7 种甜菜色素成分上调,即相对含量增加,分别为 5 种甜菜红素(Betanin、Betanidin、17-Decarboxy-Betanidin、2-Decarboxy-Neobetanin、6ˊ-O-Feruloyl-Betanin)、甜菜黄素(Vulgaxanthin I)和甜菜色素前体物质(Betalamic Acid),增加的甜菜色素成分占12 种甜菜色素成分的58.33%;第2 类中共有5种成分下调,即相对含量降低,分别为甜菜红素(2-Decarboxy-2,3-Dehydro-Neobetanin)、3 种甜菜黄素(Indicaxanthin、Miraxanthin V、Vulgaxanthin Ⅳ)和甜菜色素前体物质(Cyclo-DOPA),降低的甜菜色素成分占12 种甜菜色素成分的41.67%。由此可见,在发酵过程中甜菜色素各成分相对含量变化以甜菜红素上调为主。

表2 发酵过程中甜菜色素各成分相对含量Table 2 Relative content of betalain components in fermentation process
2.4 红甜菜汁发酵过程中抗氧化能力变化
红甜菜汁发酵液抗氧化能力如图5所示。由图5可知,发酵的红甜菜汁与未发酵样品相比,抗氧化能力显著提升(p<0.05),随着发酵进行抗氧化能力整体呈上升趋势。·O2-清除率在发酵过程中显著上升(p<0.05),由42.90%(0 h)增至55.40%(54 h),增加了29.13%;在18 h 达到了最高点60.10%,与0 h 相比增加了40.09%。·OH 清除率在发酵过程中显著提升(p<0.05),由38.50%(0 h)增至75.60%(54 h),增加了96.36%,且在54 h 达到了清除率最高点。ABTS+·清除率在发酵过程中显著提升(p<0.05),由43.10%(0 h)增至76.50%(54 h),增加了77.49%,且在54 h 达到了清除率最高点。相似的是,Sawicki 等[44]在发酵红甜菜48 h 时发现ABTS+·清除率和DPPH·清除率与发酵初期相比分别提升0.16 和0.15 μmol Trolox/mL;Değirmencioğlu 等[55]对比了红甜菜鲜汁与红甜菜汁乳酸菌发酵液的抗氧化能力后得出同样结论,经发酵的红甜菜汁ABTS+·清除率相比红甜菜鲜汁显著(p<0.05)提升9.00%,具有更强的自由基清除能力。以上分析均表明经发酵的红甜菜汁具有较高的抗氧化能力并明显高于未发酵样品,且以发酵为技术手段可显著提升并维持红甜菜的抗氧化能力。

图5 红甜菜汁发酵液自由基清除能力Fig.5 Free radical scavenging ability of red beetroot juice fermentation broth
2.5 红甜菜汁发酵过程中酶抑制能力变化
红甜菜汁发酵液对ACE 和AChE 抑制能力如图6所示。如图6可知,与未发酵样品相比,发酵液酶抑制能力显著提升(p<0.05)。随着发酵的进行酶抑制能力呈先上升后逐渐下降、最后趋于稳定的趋势。AChE抑制率在发酵过程中显著增加(p<0.05),由38.60%(0 h)增至61.43%(54 h),增加了59.15%;在24 h达到了抑制率最高点77.18%,与0 h 相比增加了99.95%。ACE 抑制率在发酵过程中显著提升(p<0.05),由46.03%(0 h)增加至62.31%(54 h)增加了35.37%;在24 h 达到了清除率最高点70.38%,与0 h 相比增加了52.90%。虽然24~54 h 酶抑制能力有所下降,但仍高于未发酵样品。Sawicki 等[56]经试验发现以发酵红甜菜汁为主的处理方式其ACE 抑制率显著优于未发酵、真空切片和煮沸等加工方式,经发酵后其ACE 抑制率显著(p<0.05)增加了31.00%。以上分析表明,红甜菜汁发酵液不仅具有较强的AChE 抑制能力,还是一种具有中枢作用的ACE 抑制剂,即可通过增强AChE和ACE抑制能力延缓AD所引起的神经退行性变[57,58]。

图6 红甜菜汁发酵液血管紧张素转化酶和乙酰胆碱酯酶抑制能力Fig.6 Inhibition of angiotensin converting enzyme and acetylcholinesterase in red beetroot juice fermentation broth
2.6 活性物质与抗氧化能力、酶抑制能力相关性分析
2.6.1 甜菜色素、总酚、黄酮与抗氧化能力、酶抑制能力相关性分析
为探究发酵液抗氧化能力、酶抑制能力与活性物质含量的关系,将上述功能指标与甜菜红素、甜菜黄素和总酚、黄酮含量进行Pearson 相关性分析,分析结果见表3。
由表3可知,甜菜红素和甜菜黄素含量分别与上述功能指标呈极显著正相关(p<0.01)和不同程度的负相关。虽然总酚、黄酮含量与上述功能指标均呈极低负相关或呈正相关(p>0.05),但酚类物质同样具有抗氧化能力[59],这表明上述功能应是由所有物质共同发挥作用。上述抗氧化能力与甜菜红素呈极显著正相关(p<0.01),与另外3 种活性物质呈负相关或正相关不显著,说明甜菜红素是主要的抗氧化活性成分。同样的,肖默艳等[60]研究了红心火龙果果肉中甜红色素、总酚、黄酮类物质与其抗氧化能力的相关性,经试验发现甜菜红素在总抗氧化、清除DPPH·、NO2-·、ABTS+·和·OH 自由基能力时发挥了主要作用,与上述自由基清除能力呈极显著正相关(r=0.936~0.955)。其原因是甜菜红素主要以糖苷形式存在,经诱导之后能产生泛醌还原酶,其酚基和环胺基均为电子供体,可参与生物体的氧化还原反应和自由基的清除过程[61]。

表3 甜菜黄素、甜菜红素和总酚、黄酮含量与抗氧化能力、酶抑制能力相关性Table 3 Correlation between the contents of betaxanthins,betacyanins,total phenols,flavonoids and antioxidant capacity and enzyme inhibition capacity
2.6.2 甜菜色素各成分与抗氧化能力、酶抑制能力相关性分析
为深入探究甜菜色素与抗氧化能力、酶抑制能力的关系,对发酵液中甜菜色素各成分相对含量与功能指标进行相关性分析,分析结果见表4。
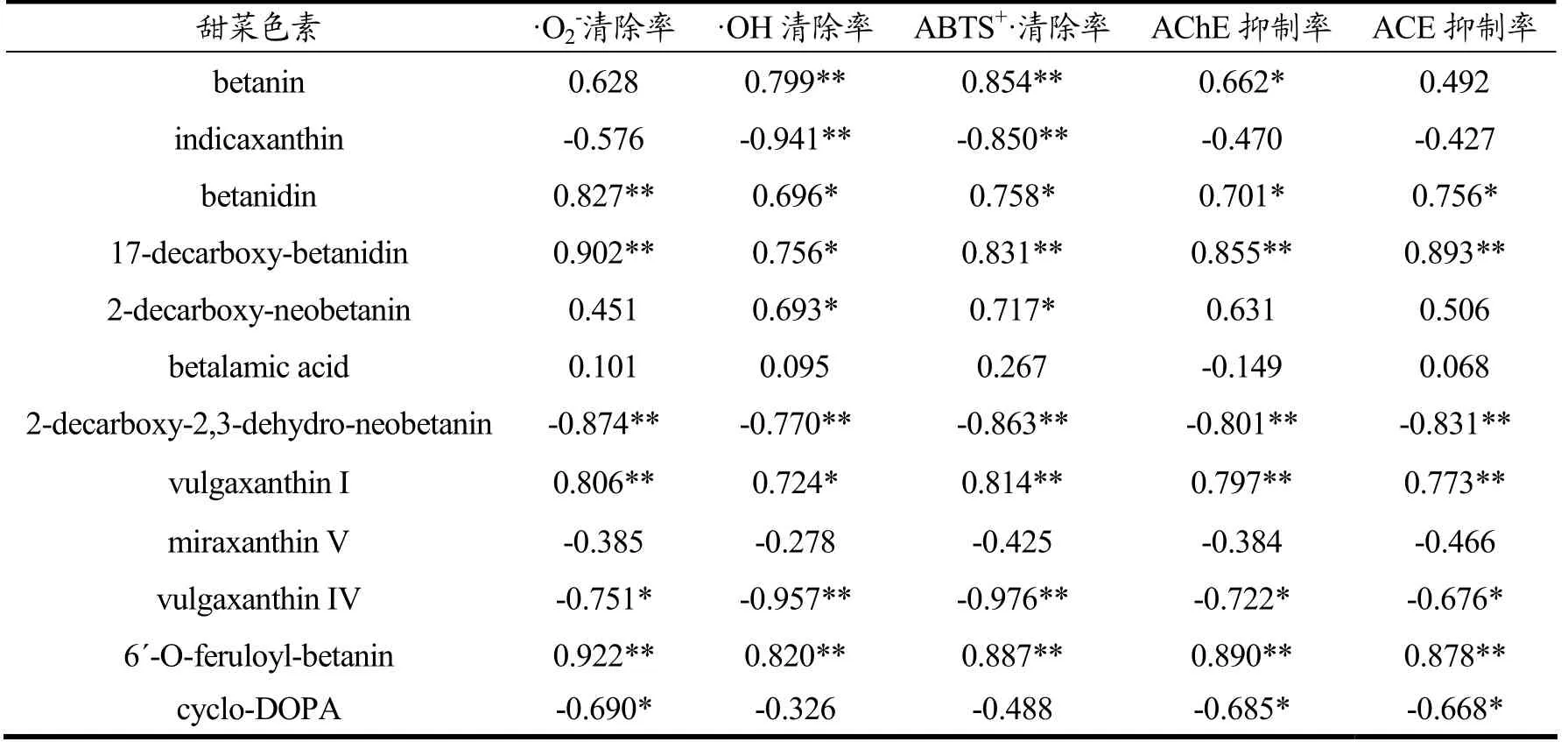
表4 甜菜色素各成分相对含量与抗氧化能力、酶抑制能力相关性分析Table 4 Correlation analysis of betalain with antioxidant capacity and enzyme inhibition capacity
由表4可知,抗氧化能力和酶抑制能力与甜菜红素(Betanin、Betanidin、17-Decarboxy-Betanidin、2-Decarboxy-Neobetanin、6ˊ-O-Feruloyl-Betanin)、甜菜黄素(Vulgaxanthin I)和甜菜色素前体物质(Betalamic Acid)均呈现不同程度的正向相关性。其中,甜菜红素是以Betanin 和Betanidin 为清除自由基的主要基团,其功能性基团同时作为电子供体和电子受体,是氧化还原的中间体[62]。相似的是,肖默艳等[60]在研究红心火龙果果肉中甜红色素与其抗氧化能力关系的试验中,经液质鉴定出果肉中甜菜红素组分有Betanin、Isobetanin、Phyllocactin 和Isophyllocactin,其中Betanin是清除自由基的主要成分。此外,Sawicki 等[56]研究了红甜菜汁发酵液中甜菜色素与ACE 抑制能力的关系,经液质分析鉴定后发现 Betanin、Betanidin、6ˊ-O-Feruloyl-Betanin、2-Decarboxy-Neobetanin 是提升ACE 抑制能力的主要物质,与本试验分析结果相同。
2.7 甜菜色素各成分与抗氧化能力、酶抑制能力的主成分分析
为消除指标间的信息重叠和多重共线性,并对相关性分析结果进行补充和解释,将甜菜色素12 个成分、3 种抗氧化能力和2 种酶抑制能力共17 个指标经数值标准化后进行主成分分析,选取特征值>1 且各主成分总方差总贡献率≥85%[63]的原则选择主成分,分析结果如表5和图7所示。

表5 主成分的特征值、贡献率和累计贡献率Table 5 The eigenvalue,contribution rate and the cumulative contribution rate of principal components
由图7a 可知,前3 个主成分的特征值大于1,由表5可知前3 个主成分(分别用PC1、PC2、PC3 表示)的方差贡献率累积达到90.63%,可保留90.63%的原始信息。由表5和图7b 可知,第一主成分方差贡献率为68.11%,主要包含3 种抗氧化能力、2 种酶抑制能力和甜菜色素(Betanin、Betanidin、17-Decarboxy-Betanidin、2-Decarboxy-Neobetanin、Betalamic Acid、Vulgaxanthin I、6ˊ-O-Feruloyl-Betanin)且12 个指标且呈正相关;第二主成分的方差贡献率为13.77%,主要包含·OH 清除率、ABTS+· 清除率和甜菜色素( Betanin、2-Decarboxy-Neobetanin)且4 个指标且呈正相关,还包含·O2-清除率、2 种酶抑制能力和甜菜色素(Miraxanthin V、cyclo-DOPA)且呈负相关;第三主成分的方差贡献率为8.75%,主要包含·O2-清除率、2种酶抑制能力和甜菜色素Vulgaxanthin I 且呈正相关,还包含·OH 清除率、ABTS+·清除率和甜菜色素(Indicaxanthin、Miraxanthin V、Vulgaxanthin IV)且5个指标且呈负相关。由主成分分析可知,主要的活性物质为Betanin、Betanidin、17-Decarboxy-Betanidin、2-Decarboxy-Neobetanin、Betalamic Acid、Vulgaxanthin I、6ˊ-O-Feruloyl-Betanin,且主成分分析结果与相关性分析结果基本一致。

图7 碎石图(a)和主成分分析图(b)Fig.7 Scree plot (a) and Principal component analysis diagram(b)
2.8 甜菜色素各成分与抗氧化能力、酶抑制能力的聚类分析
红甜菜汁发酵过程中其抗氧化和酶抑制能力呈动态变化,为掌握发酵过程中功能性指标变化、补充相关性分析和主成分分析结果,遂进行聚类分析。数据经标准化后采用聚类方法为类间平均连接法、距离类型为Euclidean 平方,对10 个发酵时间节点样品的聚类采用Q 型聚类、对17 个指标的聚类采用R 型聚类,结果如图8所示。
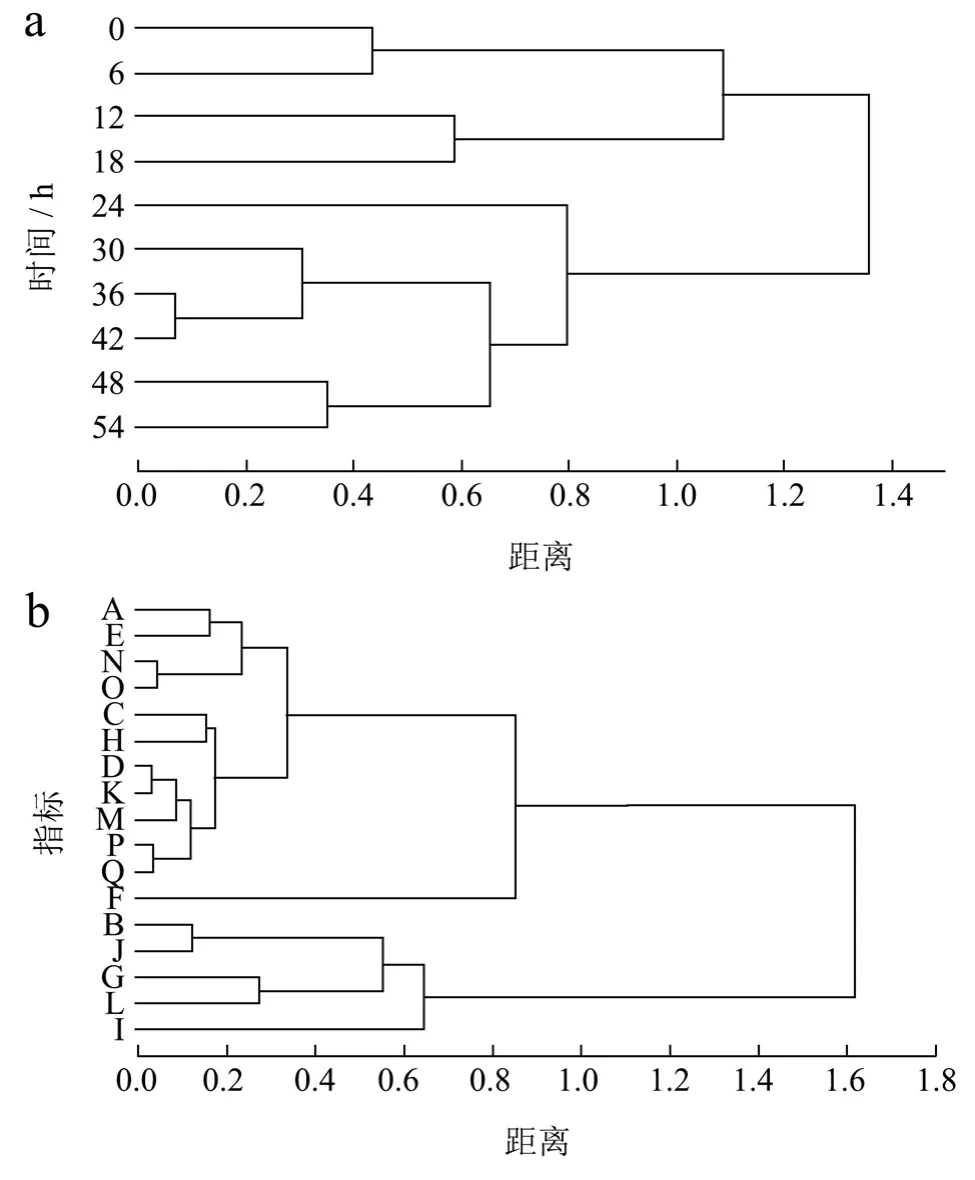
图8 不同发酵时间节点的Q 型聚类分析(a)和各指标间的R 型聚类分析(b)谱系图Fig.8 Q-type cluster analysis (a) of different fermentation time and R-type cluster analysis among indicators (b) pedigree
由图8a 所示Q 型聚类分析可知,10 个发酵时间节点可聚为3 类,代表发酵过程中抗氧化能力和酶抑制能力的变化趋势。第1 类聚集了0 h~18 h 4 个时间点,聚集了发酵过程初期(缓慢增长期)。与未发酵时相比,此时发酵液抗氧化能力和酶抑制能力得到提升。从发酵全过程来看,此阶段内发酵液抗氧化能力和酶抑制能力相对较低,处于缓慢上升阶段。第2 类聚集了24 h~42 h 4 个时间点,聚集了发酵过程中期(显著变化期),与未发酵时相比和发酵全过程来看,此阶段内发酵液抗氧化能力处于上升期,而酶抑制能力处于先上升后下降的动态变化趋势。第3 类聚集了48 h~54 h 2 个时间点,聚集了发酵过程末期(平缓期)。与未发酵时相比和发酵全过程来看,此阶段内发酵液抗氧化能力处于整体处于上升期,而酶抑制能力处于先下降后稳定的平缓趋势。经Q 型聚类分析可知,各阶段内发酵液抗氧化能力和酶抑制能力均有不同程度的提升。
由图8b 所示R 型聚类分析可知,17 个指标可聚为3 类,代表发酵过程中甜菜色素各成分与抗氧化能力、酶抑制能力的相关程度。第1 类聚集了甜菜色素(Betain、2-Decarboxy-Neobetanin)和·OH 清除率、ABTS+·清除率,且呈正相关。第2 类聚集了甜菜色素(Betanidin、17-Decarboxy-Betanidin、Vulgaxanthin I、6ˊ-O-Feruloyl-Betanin、Betalamic Acid)和·O2-清除率、2 种酶抑制能力,且呈正相关。第3 类聚集了剩余部分的甜菜色素成分,且与抗氧化能力和酶抑制能力呈负相关。经R 型聚类分析可知,在聚为3 类的情况下,分析结果与相关性分析和主成分分析结果一致。
3 结论
本研究选用的嗜酸乳杆菌LA-5在发酵末期活菌数在108CFU/mL 并保持稳定,这有利于发挥其健康益处。发酵过程中pH 值和还原糖含量均显著降低(p<0.05),活菌数、甜菜红素含量均显著增加(p<0.05),甜菜黄素和黄酮含量显著下降(p<0.05),总甜菜色素和总酚含量无显著差异(p>0.05)。各时间段发酵液中共鉴定出12 种甜菜色素,包括6 种甜菜红素、4 种甜菜黄素和2 种甜菜色素前体;其中有3 种甜菜红素是在发酵过程中新产生的,这表明益生菌发酵使甜菜色素成分更多样。发酵后自由基(·O2-、·OH、ABTS+·)清除能力和酶(AChE、ACE)抑制能力显著提升(p<0.05),说明以发酵为技术手段发酵红甜菜可减少氧化应激和增强上述酶抑制能力从而对AD 病情起到缓解作用。
相关性分析表明,自由基(·O2-、·OH、ABTS+·)清除能力和酶(AChE、ACE)抑制能力的增强是由甜菜色素、总酚和黄酮共同作用的结果,且上述指标与5种甜菜红素( Betanin、Betanidin、17-Decarboxy-Betanidin、2-Decarboxy-Neobetanin、6ˊ-O-Feruloyl-Betanin)、甜菜黄素(Vulgaxanthin I)和甜菜色素前体物质(Betalamic Acid)含量呈正相关,说明甜菜红素是主要的功能性成分。主成分分析表明,活性成分和功能指标可转化为3 个主成分,可保留全部信息的90.63%。Q 型聚类分析表明可将发酵过程聚为3 类,分别为缓慢增长期、显著变化期和平缓期;R 型聚类分析表明活性成分和功能指标可聚为3类,各个分类所涵盖信息与相关性分析结果一致。
实验表明经嗜酸乳杆菌LA-5发酵的红甜菜汁是一种优质的自由基(·O2-、·OH、ABTS+·)清除剂和酶(AChE、ACE)抑制剂,对AD 具有一定的防治作用,具有一定的开发空间和研究价值。未来的研究内容包括乳酸菌发酵红甜菜汁饮品制备和小胶质细胞试验,此系列研究旨在为乳酸菌发酵红甜菜及防治AD 提供数据支撑和理论依据。
